不同地区麦冬遗传多样性的ISSR分析
胡仲义,吴 帆,徐兵兵,张 晶,戴智慧,倪 穗*
(1.宁波城市职业技术学院,浙江 宁波 315502;2.宁波大学 应用海洋生物技术教育部重点实验室,浙江 宁波 315211)
不同地区麦冬遗传多样性的ISSR分析
胡仲义1,吴帆2,徐兵兵2,张晶2,戴智慧2,倪穗2*
(1.宁波城市职业技术学院,浙江 宁波 315502;2.宁波大学 应用海洋生物技术教育部重点实验室,浙江 宁波 315211)
利用ISSR分子标记技术对5个地区6个麦冬居群进行遗传多样性分析。选用10条扩增带型清晰且重复性好的引物进行扩增,共获得115条带,其中89条具有多态性,多态性比例为77.39%。当遗传相似系数(GS)为0.61时,可将6个麦冬居群分为2大类群。居群的GS平均值为0.643,表明供试居群之间存在较近的亲缘关系,且地域越近的其亲缘关系关系越近。研究表明ISSR分子标记技术能够很好地用于不同地域同种物种的亲缘关系分析。
麦冬; ISSR-PCR; 亲缘关系; 遗传多样性
麦冬(Ophiopogonjaponicus)为百合科沿阶草属多年生草本植物。中医学上以麦冬地下块根入药。临床证明,麦冬块根对肺燥干咳、虚劳咳嗽、津伤口渴、心烦失眠、肠燥便秘等症具有很好的疗效[1]。根据麦冬产地不同,可将麦冬分为四川麦冬、湖北麦冬、浙麦冬等品系。近年来,对这三种麦冬的研究大多数都着眼于其内部的化学成分、药理毒理、数量遗传性状等方面[2-4],对三者种质资源鉴定和其遗传多样性的研究较少。
ISSR(inter-simple sequence repeats,简单序列重复区间扩增多态性)技术是1994年发展起来的一项基于微卫星技术的新型的分子标记技术。相对于RAPD和SSR分子标记而言,ISSR引物具有更高的退火温度,从而保证了更高的稳定性和重复性。此外,由于ISSR所使用的引物为非特异性引物,故不需要预先知晓序列信息,既可以节约人力物力成本。由于ISSR的简便快捷,近年来其已经应用于植物亲缘关系、指纹图谱及种质资源遗传多样性等领域的研究。本实验以四川麦冬、浙麦冬和湖北麦冬为研究对象,利用ISSR分子标记方法研究三种麦冬品系的遗传多样性。以期为各地麦冬的种植、资源保护和优良品种选育提供理论依据。
1 材料与方法
1.1实验材料
实验材料来源于湖北武汉、湖北襄阳、浙江慈溪、四川成都、贵州遵义等地,采其新鲜幼嫩叶片并对不同居群标号(表1),用无菌水洗净后晾干,装入灭菌离心管内,封口胶封口,保存于-80 ℃超低温冰箱中。

表1 实验材料产地及类型
1.2主要试剂与仪器
试剂:十六烷基三甲基溴化铵(CTAB)、Tris-HCl、乙二胺四乙酸(EDTA)、氯化钠、聚乙烯吡咯烷酮(PVP),氯仿、异戊醇等均为分析纯;2×Easy Taq PCR Supermix (+dye);ISSR引物(华大基因合成);超纯水。
仪器:冷冻离心机(Sigma)、电泳仪(北京六一仪器厂)、超净工作台、水浴锅、PCR仪、UVP凝胶成像系统。
1.3实验方法及步骤
1.3.1麦冬总DNA提取
由于麦冬叶片中含有大量的多糖、酚等物质,若采用传统CTAB法进行实验则会因为杂质太多而降低DNA的纯度。故参考王冠明[5]等的方法,经过多次实验摸索出适合麦冬的改进CTAB法。
具体操作步骤如下:取新鲜幼嫩的麦冬叶片于预冷的研钵中,加入少量PVP粉末和石英砂,加入液氮迅速研磨至样品彻底成为粉末,后迅速转移至2 mL预冷离心管中,加入1.5 mL预冷的核分离液 (250 mmol/L NaCl,200 mmol/L Tris-HCl (pH 8.0),50 mmol/L EDTA (pH 8.0),2% PVP (w/v),1%巯基乙醇(v/v)),混合均匀后冰上静置20 min。4 ℃下3000 r/min离心5 min,弃上清液和胶状粘稠物质及壁上残留。若上清液颜色较深则重复抽提一次。在沉淀中加入700 μL 65 ℃预热的CTAB缓冲液、14 μL β-巯基乙醇,65 ℃水浴40 min。期间轻摇离心管数次,后4 ℃10 000 r/min离心10 min。将上清液转移至新的2 mL预冷灭菌离心管内,加入等体积的氯仿-异戊醇,轻轻上下颠倒2 min,静置5 min后4 ℃10 000 r/min离心10 min。后重复此步骤一次。取上清液于新的2 mL预冷灭菌离心管内,加入2.5倍体积的-20 ℃预冷的无水乙醇。上下轻轻颠倒至完全混合均匀后-20 ℃冷冻过夜。后4 ℃10 000 r/min离心10 min,1 mL -20 ℃预冷的无水乙醇洗涤沉淀一次,再4 ℃ 10 000 r/min离心10 min。加入200 μL灭菌超纯水将固体溶解,-40 ℃冷冻备用。
1.3.2引物筛选
根据加拿大哥伦比亚大学公布的ISSR引物序列以及总DNA电泳结果,选取两组条带清晰、含量较高的麦冬DNA对20条ISSR引物进行筛选,从中筛选出扩增条带清晰、重复性好的10条引物,随后用这些引物对所有个体进行PCR扩增。PCR体系如下:
Primer0.4μL
2×Supermix10μL
DNA0.4μL
ddH2O补至20μL
PCR反应程序如下:94 ℃预变性5 min,94 ℃变性30 s,在适当退火温度下退火30 s,72 ℃链延长2 min,35次循环后充分延长7 min,最后在12 ℃下保存。将扩增后的样品点样于1.5%琼脂糖凝胶上加Gel Red染色剂,120V电泳1-1.5h,并将成像条带拍摄、储存,供分析时使用。

表2 ISSR引物及退火温度
1.4数据处理与分析
采用人工计数法进行电泳结果记录。根据电泳结果记录清晰可重复的电泳条带,对同一引物的扩增产物,迁移率相同的条带记为一个位点。扩增有带记为1,扩增无带记为0。利用NTSYS2.1软件按基于Nei-Li遗传相似系数的UPGMA法进行计算,GS=m/(m+n)。其中GS为遗传相似系数,m为基因型间共有条带的数目,n为差异条带的数目。遗传距离GD=1-GS,采用UPGMA进行聚类分析,构建树状图。
2 结果与分析
2.1麦冬叶片总DNA的提取
利用经过改良的CTAB法对麦冬叶片进行总DNA提取,结果表明,改良后的CTAB法能够有效地提取麦冬叶片中的DNA。经测定,所有DNA的OD260 nm/OD280 nm均在1.8~2.0之间;同时电泳结果表明,每一组DNA的含量均符合PCR扩增的要求。
2.2ISSR多态性分析
利用筛选出的10条ISSR引物对各地麦冬DNA进行扩增,结果表明,10条ISSR引物一共扩增出115条带,片段长度大约在250 bp至2 000 bp之间。其中多态性条带89条,占总条带数(115条)的77.39%,平均每条引物扩增11.5条带。实验证明麦冬基因组DNA多态性较高。图2为引物UBC857扩增结果。

图1 各地麦冬总DNA电泳图

图2 UBC857对各地麦冬DNA的扩增图谱
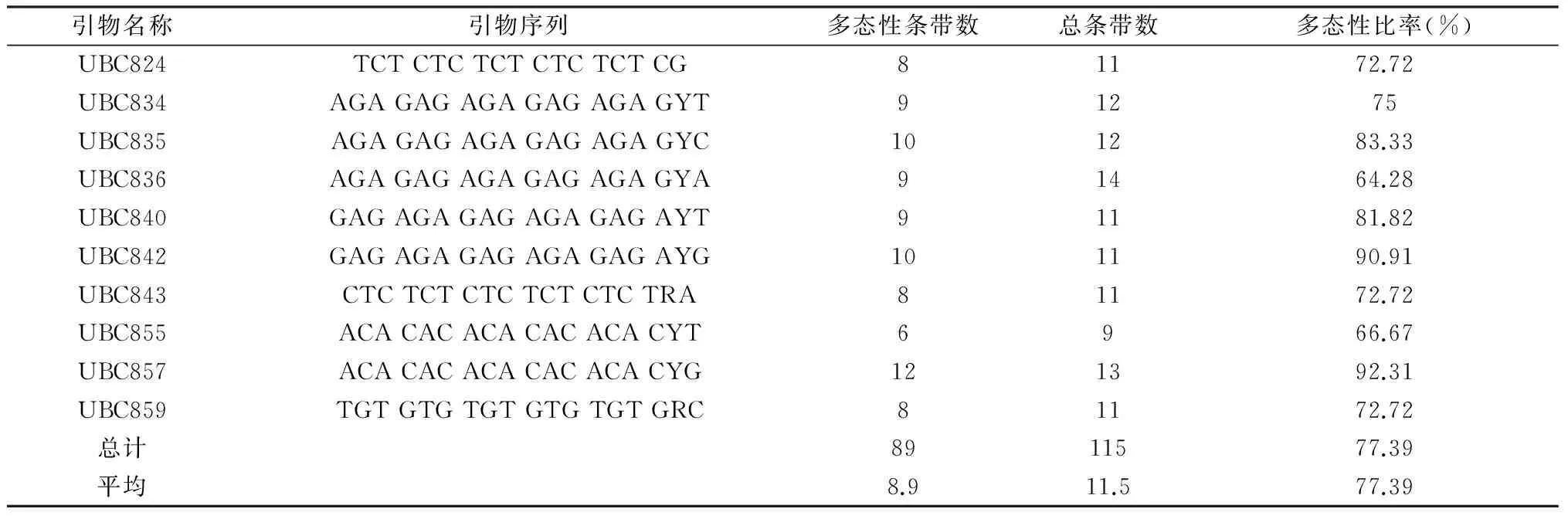
引物名称引物序列多态性条带数总条带数多态性比率(%)UBC824TCTCTCTCTCTCTCTCG81172.72UBC834AGAGAGAGAGAGAGAGYT91275UBC835AGAGAGAGAGAGAGAGYC101283.33UBC836AGAGAGAGAGAGAGAGYA91464.28UBC840GAGAGAGAGAGAGAGAYT91181.82UBC842GAGAGAGAGAGAGAGAYG101190.91UBC843CTCTCTCTCTCTCTCTRA81172.72UBC855ACACACACACACACACYT6966.67UBC857ACACACACACACACACYG121392.31UBC859TGTGTGTGTGTGTGTGRC81172.72总计8911577.39平均8.911.577.39
2.3不同产地麦冬的亲缘关系分析
利用ISSR-PCR扩增得到的115条带在NTSYS2.1软件下计算遗传相似系数并推算遗传相似矩阵。若两种样品遗传相似系数越接近1,则表明两者亲缘关系越大;反之越小。实验结果表明,不同产地的麦冬遗传相似系数在0.531至0.859之间。其中,慈溪八塘地区与慈溪九塘地区样本的遗传相似系数最大,为0.859,即说明这两地的麦冬亲缘关系最近,遗传差异最小;而湖北襄阳和四川成都两地的样品的遗传相似系数最小,为0.531。表明这两地产的麦冬具有较远的亲缘关系,遗传差异最大。

表4 不同产地麦冬的遗传相似矩阵
2.4不同产地麦冬的聚类分析
根据遗传相似矩阵,利用UPGMA法进行聚类分析。实验结果表明,当遗传相似系数在0.61时,6个地域的麦冬分为2类。第一类为四川、遵义2个地区的麦冬品种。这2个品种在形态结构上极为相似,即叶片窄而短,颜色墨绿;第二类为其余两地的4种麦冬品种。相对于之前的2者,在形态结构上可以明显看出,最大的区别在于后4种麦冬叶片较长,且在颜色上更加丰富,呈现出墨绿、翠绿两种颜色。
遗传相似系数在0.86时,慈溪的2个居群,湖北的2个居群及四川和贵州的2个居群各自聚合在一起,充分体现了地理区域和环境对麦冬的影响很大。实验结果表明麦冬种植区域越近的麦冬居群,其亲缘关系越近。从形态学上分析,这两者的形态结构几乎一样,凭肉眼无法分别。实验证明ISSR分子标记对不同地域的麦冬进行亲缘关系分析是可行的。
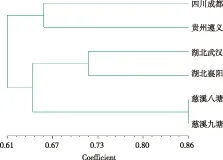
图3 不同地区麦冬的UPGMA聚类图
3 讨 论
由于不同产地的麦冬的形态特征受到外界环境条件的影响,很难从形态结构上将不同产地的麦冬完全区别开来。而利用分子标记技术,从基因水平上对不同产地的麦冬进行遗传差异和它们之间的亲缘关系分析,就能够得到更为可靠和有效的结论。陈瑞凤[6]等利用18条引物对47种短葶山麦冬品种进行遗传多样性分析。实验证明,其多态性比率为63.4%。GS变化值为0.64至0.98之间。其与本实验选择相同的引物为UBC834、UBC835、UBC836、UBC840、UBC843、UBC859;叶桂英[7]等利用ISSR分子标记,对两种常用的麦冬栽培品种进行聚类分析。实验结果表明,2种麦冬的GS值为0.818 2,证明两者具有较高的同源性,与其形态结构相符。其与本实验选择相同的引物为UBC834、UBC835、UBC836、UBC840。此外,何天友[8]、王小刚[9]等也对麦冬ISSR进行过深入研究,指出ISSR分子标记技术能够很好地区分不同产地相同物种之间的亲缘关系。针对麦冬而言,大量实验证明其不同品种基因组中含有较多的UBC857引物序列的保守区,故利用UBC857能更好地对麦冬基因组DNA进行扩增。
麦冬栽培历史悠久,品种丰富。在长期的自然杂交或人工种植的背景下,又存在普遍的种质资源交流,以至于麦冬成为当今国内许多省份都有分布的广布种[10]。参试的慈溪八塘和慈溪九塘地区的麦冬都隶属于浙麦冬,遗传背景较为相似,故两者的亲缘关系也比较近(GS=0.86)。而贵州遵义和四川成都所产的麦冬隶属于川麦冬,从形态特征而言就与浙麦冬存在差异,故这两者之间的遗传相似系数较小(GS=0.61)。此结论与两种麦冬生长省份的地理位置相符。而湖北两地所产的麦冬品种从遗传图谱上分析与慈溪麦冬的亲缘性更高。故可推断湖北麦冬与浙麦冬有可能是同一品种下由于长期生殖隔离而产生的不同亚种。
麦冬叶色鲜绿,根系发达,喜光、耐旱,是全国诸多城市公园、街道和其它各种建筑必不可少的优良建植材料。其地下块根自古即被用作一味中药治疗肺燥、干咳等疾病。不同品系的麦冬在形态结构和地下块根药效程度上存在一定差异。保证品种的纯度是麦冬不同品种进行营养繁殖和人类对其进行利用的首要问题。目前大多数的品种鉴定方法是根据其形态结构进行鉴定。此方法针对地域跨度较大,形态差异较明显的麦冬品种而言较为有效,但是针对本身难以以肉眼区分的品种而言则效果不好。且外部表现型时常受到外界环境的影响,故此方法存在一定的局限性。利用ISSR分子标记法,能够更好地将各地品种进行聚类,从DNA层面对麦冬进行分析,克服了前一方法的缺点[11]。实验证明,利用ISSR分子标记得到的结果与根据形态结构观察获得的结果是一致的,且ISSR可以将肉眼无法分别的慈溪八塘和慈溪九塘地区的麦冬品种区分,说明利用ISSR分子标记技术能更好、更精确的处理不同品系之间的亲缘关系问题。ISSR分子标记的深入研究,也为我国新品种开发和品种保护提供技术支持。
[1]赵训传, 许文东, 陈建刚. 麦冬栽培技术[M]. 北京:中国农业科学技术出版社, 2002.
[2]陈莉华, 李三艳, 张烨, 等. 麦冬叶中总黄酮的抗油脂氧化研究[J]. 中国粮油学报, 2013,28(3): 70-74.
[3]张旻, 刘晓萌, 宋捷, 等. 麦冬水浸提液对大鼠胚胎/胎儿发育毒性研究[J]. 中国中药杂志, 2010,35(17): 2334-2337.
[4]尤海涛, 李松, 陈菁瑛. 短葶山麦冬主要数量性状变异及因子分析[J]. 福建农业学报, 2008, 23(1):53-57.
[5]王冠明, 韩烈保, 马秀杰. 麦冬基因组 DNA 提取方法研究[J]. 生物技术通报, 2010: 100-106.
[6]陈瑞凤, 张君毅. 短葶山麦冬遗传多样性的ISSR标记研究[J]. 福建农业学报, 2010, 25(3):245-250.
[7]叶桂英, 杨美全, 梁国鲁, 等. 两种常用麦冬栽培品种的ISSR分子鉴定[J]. 亚太传统医药, 2007, 3(1) :48-50.
[8]何天友. 短葶山麦冬的遗传多样性分析及ISSR指纹图谱构建[D]. 福州:福建农林大学, 2011.
[9]王小刚. 湖北麦冬种植优化和遗传多样性研究[D]. 武汉:华中科技大学, 2011.
[10]国家药典委员会. 中国药典[M]. 北京: 化学工业出版社, 2005.
[11]肖寒, 杨进. 分子生物学技术在麦冬研究中的应用[J]. 中医药导报, 2010,16(11): 120-122.
Genetic Diversity Analysis ofOphiopogonjaponicusby Using ISSR
Hu Zhongyi1, Wu Fan2, Xu Bingbing2, Zhang Jing2, Dai Zhihui2, Ni Sui2*
(1.Ningbo City College of Vocational Technology, Ningbo 315502,China; 2.Key Laboratory of Applied Marine Biotechnology of Ministry of Education, Ningbo University, Ningbo 315211, China)
This research focused on the genetic diversity analysis ofOphiopogonjaponicusincluding six populations, which come from five areas with the way of ISSR markers. Ten primers with clear bands and perfect repeatability are used to amplify DNA ofOphiopogonjaponicus. One hundred and fifteen bands were amplified, including eighty-nine polymorphic bands. The percentage of the polymorphic bands was 77.39%. Samples from six populations can be classified into two groups when the genetic similarity was 0.61. The average value of genetic similarity was 0.643, and it indicates there are very close genetic relationship between different populations, and the regions closer, the more genetic relationship intimate. The research of ISSR markers technology would be helpful for the genetic relationship analysis of the species from different area.
Ophiopogonjaponicus;ISSR-PCR;genetic relationship;genetic diversity
2014-11-12
浙江宁波农业和社会发展科技计划项目(CN2014015)。
胡仲义(1967—),男,副教授,主要研究方向:植物基础。E-mail:fhhzy@163.com
*通讯作者:倪穗(1965—),女,教授,主要研究方向:植物生物学。E-mail:niusui@nbu.edu.cn
10.3969/j.issn.1006-9690.2015.03.006
TS255.6
A
1006-9690(2015)03-0023-04

