HBV在卵巢组织及卵细胞中复制的实验研究
陕西省人民医院消化内一科(西安710068)
金 燕 邱 婷 吕颐菲 闫春英 王 雪 刘贵生
HBV在卵巢组织及卵细胞中复制的实验研究
陕西省人民医院消化内一科(西安710068)
金 燕 邱 婷 吕颐菲 闫春英 王 雪 刘贵生
目的:寻找寻找卵细胞感染HBV的直接证据及影响因素。方法:检测卵巢及卵细胞中HBcAg、HBV DNA 和HBV mRNA的分布情况。研究血清中HBeAg阳性和HBV DNA水平与HBV感染卵巢及卵细胞的关系。结果: 在卵巢颗粒细胞和卵细胞内发现了HBcAg、HBV DNA、HBV mRNA分布。血清HBeAg与否和HBV DNA水平高低与卵巢及卵细胞中HBcAg、HBV DNA、HBV mRNA阳性率无关。 结论:HBV可以在卵巢和卵细胞内复制,这意味着被感染的卵细胞一旦受精成功就很有可能将HBV带入胚胎发生垂直传播。血清HBeAg与否和HBV DNA水平与卵巢及卵细胞感染HBV无关。
乙型病毒性肝炎(乙型肝炎)是一种严重危害人类健康的世界性疾病,截至目前全球约有20亿人既往或持续感染HBV(乙肝病毒),其中3.5~4亿人为慢性HBV感染者。HBV母婴传播是造成HBV感染慢性化的主要原因。随着孕期和新生儿注射乙肝免疫球蛋白(HBIG)和接种乙肝疫苗(HBVac)明显降低了母婴传播率,但是仍有部分患者不能通过上述方法阻断[1-3]。研究显示,经HBV卵细胞垂直传播可能是主要原因,因此需要研究卵巢和卵细胞中的HBV复制活性以利于HBV母婴传播机制的深入探讨。另一方面,既往的研究认为孕产妇HBV DNA高水平及HBeAg阳性是造成HBV母婴传播感染的主要因素,通过孕前、孕中降低HBV DNA水平和使HBeAg转阴可以减少母婴传播的发生[4-5]。且有研究也发现HBV DNA病毒复制水平和血清HBeAg与肝外组织病变有明确相关性[6-7]。
本研究拟通过检测卵巢及卵细胞中HBcAg、HBV DNA 和HBV mRNA的分布情况,分析HBV在卵巢组织中尤其是卵细胞中的复制情况。并进一步研究血清中HBeAg阳性和HBV DNA水平与HBV感染卵巢及卵细胞的关系,深入探讨HBV经卵细胞垂直传播的机制。
材料和方法
1 研究对象 选择2008年7月至2010年6月在西安交通大学第一附属医院和陕西省妇幼保健院因妇科疾病且患有慢性乙肝需要手术切除的50例患者的卵巢组织。患者平均年龄38岁,妇科疾病分别为:卵巢囊肿18例,异位妊娠2例,卵巢畸胎瘤6例,子宫恶性肿瘤24例。同时选择6例无乙肝病毒感染的卵巢组织作为阴性对照。所有乙肝患者均经临床诊断确诊为慢性乙型肝炎和慢性乙型肝炎携带者,诊断符合以2000年全国病毒性肝炎学术会议(西安)修订的慢性病毒性肝炎的诊断标准,并且所有患者未接受正规抗病毒治疗。
所有患者在手术前于肘静脉处抽取10ml静脉血,分别用于血清HBV DNA定量检测,和HBVM检测。同时检测患者血清中HAV、HCV、HDV和HIV抗体,排除有上述病毒的感染。
2 研究方法
2.1 血清HBV DNA定量检测。
2.2 免疫组化检测卵巢中HBcAg。
2.2.1 制片:新鲜卵巢组织置冰上,用DEPC水处理过的手术刀将标本切成0.5cm×0.5cm×0.5cm大小组织。冲洗-固定-脱水-透明和包埋-连续切片。
2.2.2 免疫组化:先用PBS冲洗;阻断内源性过氧化物酶的活性。与一抗反应,然后PBS洗3次每次各5min。与二抗反应,DAB显色,脱水干燥。二甲苯透明,中性树胶封片。
2.2.3 阳性对照:选择乙肝患者的肝穿标本,并通过病理学检查诊断为慢性活动性肝炎的肝组织。
2.2.4 阴性对照:乙肝阴性的正常对照组的卵巢; PBS代替一抗;不加一抗的空白对照;用PBS代替二抗;不加二抗的空白对照。
2.2.5 结果判断:杂交阳性信号主要位于胞浆中呈棕黄色。
2.3 mRNA原位杂交。
2.3.1 取材和切片标本的制备同前。
2.3.2 原位杂交:脱蜡,用蛋白酶稀释液将胃蛋白酶溶解后滴在切片组织上,脱水; 预杂交;杂交:加杂交液20 μl/每张切片,含10ng探针,42℃过夜;DNA杂交95℃10min变性,使DNA双链解开,迅速置于冰上1min,随后42℃过夜 (16~18 h) ;终止;显色, 复染,脱水、透明、封片。
2.3.3 阳性对照:选择乙肝患者的肝穿标本,并通过病理学检查诊断为慢性活动性肝炎的肝组织。
2.3.4 阴性对照:乙肝阴性的正常对照组的卵巢;杂交时未加入杂交探针;用PBS代替抗-DIG抗体;在杂交前用RNA酶将标本37℃过夜。
2.3.5 结果判断:mRNA杂交阳性信号主要位于胞浆中呈紫兰色,细胞核呈红色。DNA杂交阳性信号位于胞核中呈棕黄色或黄色。
结 果
1 血清中HBV DNA和HBVM结果分析 根据检测血清中HBV DNA定量的结果,将实验组分为低复制组(HBV DNA定量≤104IU/ml)和高复制组(HBV DNA定量>104IU/ml)。同时根据HBeAg分为阳性组和阴性组。
2 卵巢中HBcAg检测结果 以细胞胞浆内出现棕黄色颗粒为阳性细胞。再次在卵巢组织中卵母细胞和卵巢颗粒细胞的胞浆和胞膜中发现棕黄色HBcAg的阳性信号阳性率14%(7/50),且分布位置无变化,见图1。
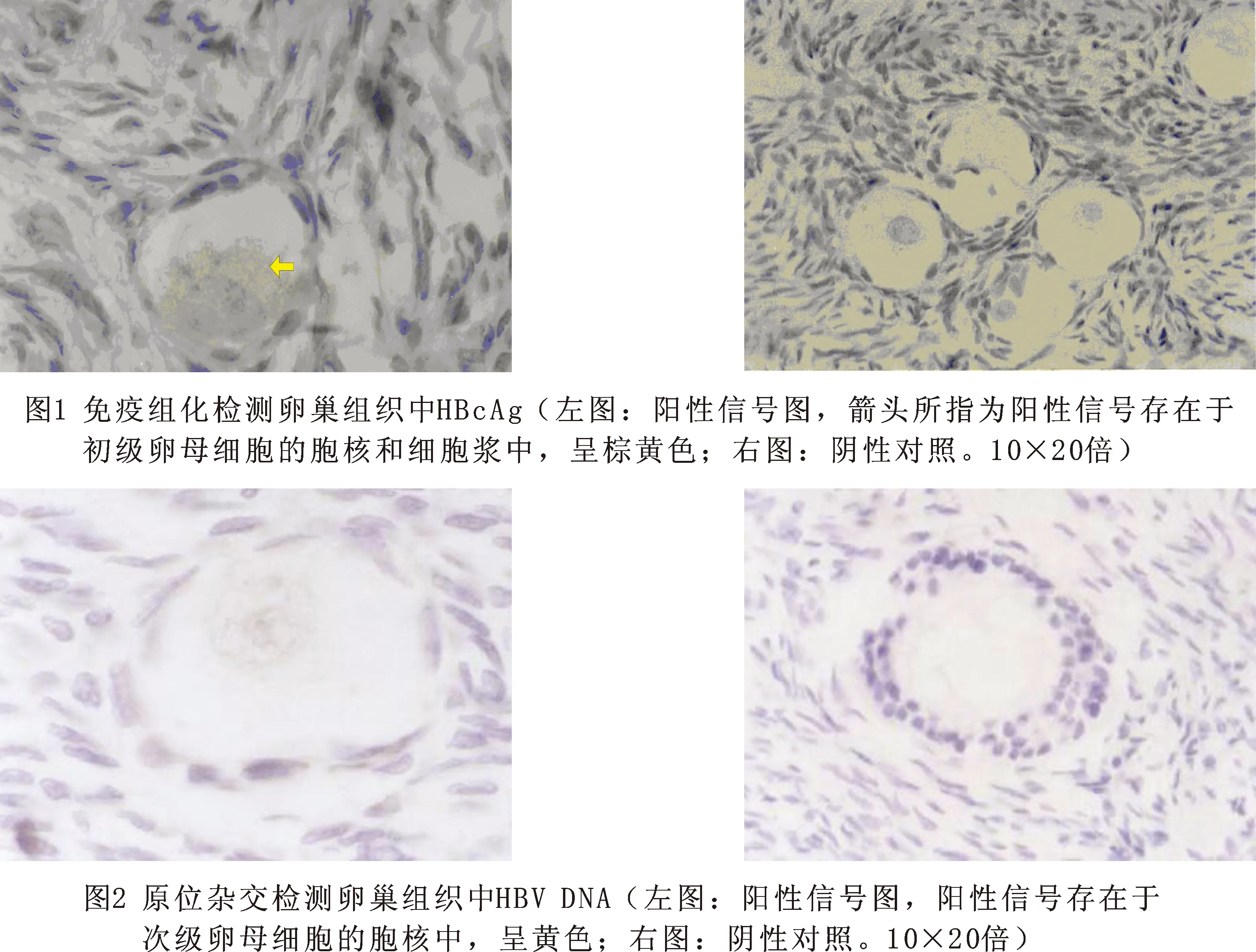
3 卵巢中HBV DNA检测结果 以细胞胞浆内出现棕黄色颗粒为阳性细胞。在实验组中颗粒细胞和不同发育阶段的卵母细胞胞核内发现黄色HBV DNA的阳性信号,阳性率为12%(6/50),见图2。阴性对照、空白对照和替代对照均未显示阳性信号。
4 卵巢组织中mRNA原位杂交结果 镜下阳性表达判断标准以细胞胞浆内出现兰紫色颗粒为阳性细胞。在卵巢颗粒细胞和卵细胞内阳性信号。分布于细胞浆中,见图3、4。阳性率为6%(3/50)。HBV mRNA原位杂交的阴性对照、空白对照和替代对照均未显示阳性信号,见图3。
5 卵巢中HBV标志物检出与血清HBeAg和HBV DNA的关系 卵巢组织中检测出HBcAg、HBV DNA、HBV mRNA检测结果与患者血清中HBeAg关系,见表1。用统计学软件分析HBeAg与卵巢组织中各项乙肝标志物检出率的关系后,结果显示血清中HBeAg阳性组和阴性组之间卵巢中HBcAg、HBV DNA、HBV mRNA阳性率均无明显差异(P= 0.409、0.697、0.602)。
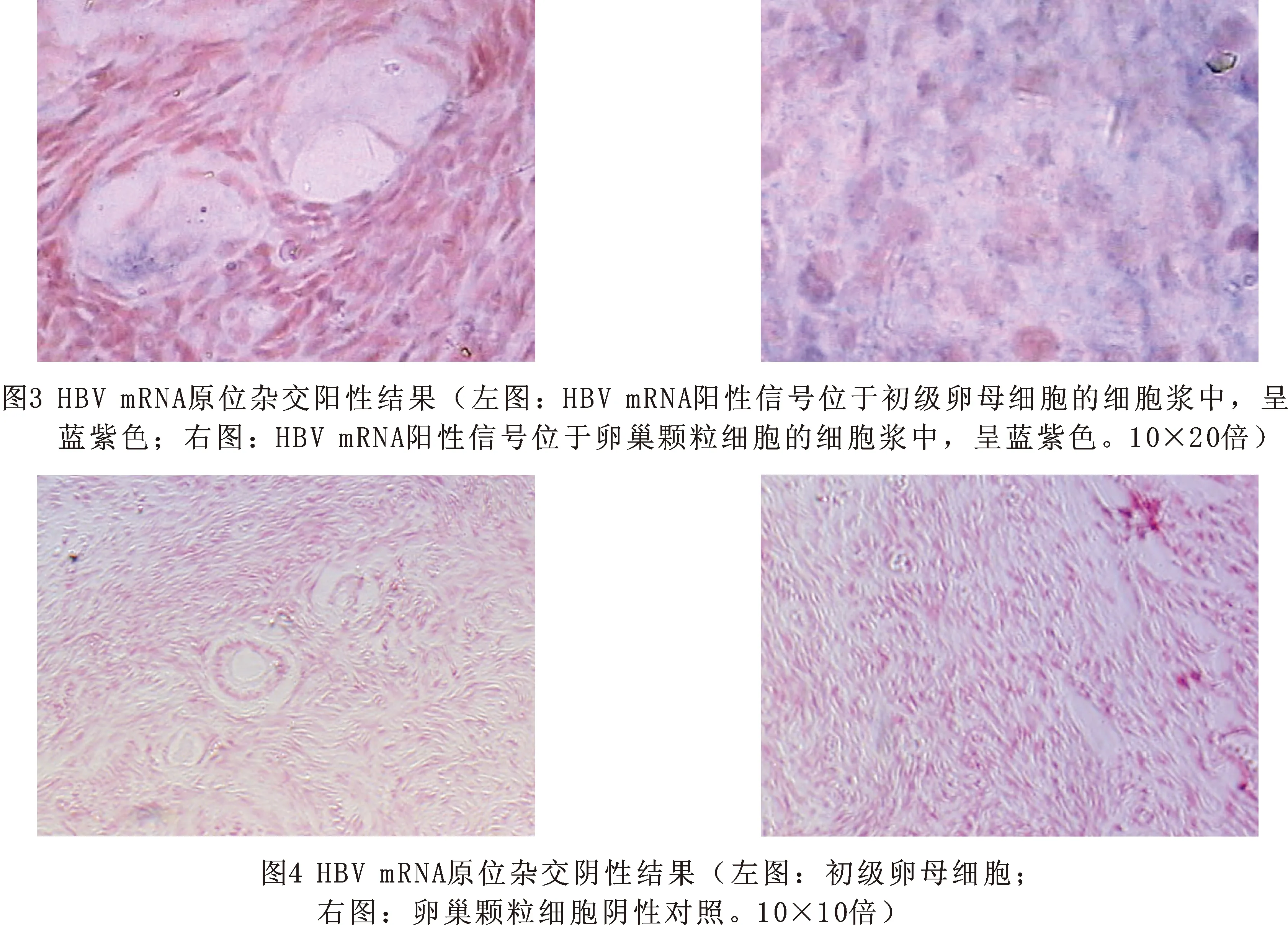
表1 HBcAg、HBVDNA 、HBV mRNA阳性信号的患者与血清中HBeAg关系

卵巢中HBcAg阳性阴性阳性率 卵巢中HBVDNA阳性阴性阳性率 卵巢中HBVmRNA阳性阴性阳性率HBeAg(+) 42014.3%42021.4%22214.3%HBeAg(-)2246.25%32312.5%1254%总数64412%74314%3476%
HBV DNA水平104IU/ml为分界限分为低复制组和高复制组,同样用Fisher精确概率法分析,认为两组间的卵巢中HBcAg、HBV DNA、HBV mRNA阳性率的差异无明显统计学意义(P= 0.674、1、1)。

表2 HBV DNA水平与HBcAg、HBVDNA 、HBV mRNA阳性率的关系
讨 论
HBV虽是一种嗜肝病毒,但是近十年,人们已经陆续在许多肝外组织中发现了乙肝病毒的存在的证据。本研究项目[8]在卵细胞和卵巢颗粒细胞中发现了HBV DNA存在和HBV蛋白表达。证实HBV可以感染卵巢中的卵细胞,但尚未有证据证实这些HBV片段具有复制活性,只有具有生物学活性的HBV DNA片段才能重新组装成共价闭合环状DNA并以此为模板转录mRNA,并与聚合酶一起被核衣壳包裹成核心颗粒并进而与外膜蛋白包装成Dane颗粒并重新感染新的子代。这样才有可能发生真正意义上的HBV经卵细胞的母婴垂直传播。因此,进一步证实卵细胞中的HBV具有复制活性对深入研究HBV经卵细胞垂直传播的机制具有重要意义。
HBcAg在胞浆中合成后转入核内,在HBV DNA高表达时即行装配,与病毒活跃复制密切相关,HBcAg的检出也是HBV在卵细胞中复制和表达的标志。HBV DNA是明确的复制指标。HBV mRNA既是逆转录模板又是翻译模板,因此HBV mRNA是HBV复制和表达的中间环节。本研究在卵巢组织及卵细胞中发现了HBcAg、HBV DNA和HBV RNA,分别从不同的层面证实在卵巢组织中尤其是卵细胞内存在的HBV具有复制活性。我们有理由认为具有复制活性的HBV的卵细胞与正常人精子受精后,极有可能发生经卵细胞母婴传播。
影响HBV母婴传播的因素众多,如胎盘屏障作用、孕母及新生儿的遗传易感性等。大部分研究结果证实孕产妇HBV DNA高水平及HBeAg阳性是造成HBV母婴传播感染的主要因素[9-10]。但在临床中我们观察到一些HBeAg阴性和HBV DNA低水平复制的孕妇即使在孕期接种HBIG也会免疫失败造成母婴传播。本研究分析了血清HBeAg阳性和HBV DNA复制水平与卵巢中HBV阳性检出率的关系,根据统计学得出提示血清HBeAg阳性和HBV DNA水平与卵巢中HBV的感染无明显关系。而上述人群母婴传播的阻断失败发生的极有可能与卵细胞感染了HBV相关,也可以说,目前手段对阻断经卵细胞垂直传播无效,这就要求我们通过深入研究HBV经卵细胞垂直传播机制寻找新的手段来降低HBV的母婴传播率。
总之,HBV不但可以在卵细胞和卵巢颗粒细胞内复制而具有生物学活性。这就意味着一旦这些卵细胞受精成功发育为胚胎将很有可能在其内复制并进一步发生垂直传播。且这种复制与患者血清HBeAg阳性与否和HBV DNA水平高低与卵巢HBV感染率无关,因此,目前所采用阻断措施对该途径无效,需要进一步探索其机制来研究新的方法来控制经卵细胞的HBV母婴传播。
[1] Liang BZ. Study about intrauterine Hepatitis B Virus infection andclinical application of HBIG during pregnant period [J]. Maternal and Child Health Care of China, 2004, 19(2): 81-83.
[2] Yang YJ, Liu CC, Chen TJ,etal. Role of hepatitis B immunoglobulin in infants born to hepatitis B e antigen-negative carrier mothers in Taiwan [J].Pediatric Infectious Disease Journal, 2003, 22(7): 584-588.
[3] Yang YJ, Liu CC, Chen TJ,etal. Role of hepatitis B immunoglobulin in infants born to hepatitis B e antigen-negative carrier mothers in Taiwan [J]. Pediatric Infectious Disease Journal, 2003, 22(7): 584-588.
[4] Wang Z, Zhang J, Yang H,etal. Quantitative analysis of HBV DNA level and HBeAg titer in hepatitis B surface antigen positive mothers and their babies: HBeAg passage through the placenta and the rate of decay in babies [J]. J Med Virol, 2003, 71(3): 360-366.
[5] Song YM, Sung J, Yang S,etal. Factors associated with immunoprophylaxis failure against vertical transmission of hepatitis B virus [J]. Eur J Pediatr, 2007, 166(8): 813-818.
[6] Jiang W, Liu LQ. Effect of content of hepatitis B virus DNA in the serum on the pathologic change in hepatitis B virus associated-glomerulonephritis [J]. Zhong Nan Da Xue Xue Bao Yi Xue Ban, 2008, 33(9): 857-860.
[7] Mansour GF, Rafiei R, Joukar F,etal. Relationship between serum HBV DNA level and liver histology in HBV carriers with normal ALT in Guilan province, Iran [J]. Med Sci Monit, 2010, 16(3): 97-101.
[8] Feng Y, Ya-Fei Yue, Shu-Hong Li,etal. Presence of HBsAg, HBcAg and HBVDNA in Ovary and ovum of the Patients with Chronic Hepatitis B Virus Infection [J]. Am J Obstet Gynecol, 2006, 193(2): 387-392.
[9] Jiang W, Liu LQ. Effect of content of hepatitis B virus DNA in the serum on the pathologic change in hepatitis B virus associated-glomerulonephritis [J]. Zhong Nan Da Xue Xue Bao Yi Xue Ban, 2008, 33(9): 857-860.
[10] Lin TM, Chen CJ, Wu MM,etal. Hepatitis B virus markers in Chinese twins [J]. Anticancer Res, 1989, 9(3): 737-741.
(收稿:2015-02-12)
乙型肝炎病毒 卵子 病毒复制 传染病传染,垂直
R392.3
A
10.3969/j.issn.1000-7377.2015.07.006

