29例非中性粒细胞缺乏患者侵袭性肺曲霉病临床分析
蔡学究,倪文涛,魏传琦,崔俊昌
解放军总医院 呼吸科,北京 100853
29例非中性粒细胞缺乏患者侵袭性肺曲霉病临床分析
蔡学究,倪文涛,魏传琦,崔俊昌
解放军总医院 呼吸科,北京 100853
目的分析非中性粒细胞缺乏患者侵袭性肺曲霉病(invasive pulmonary aspergillosis,IPA)的临床特点。方法对本院2011年1月- 2013年12月呼吸科29例非中性粒细胞缺乏IPA患者的临床特点进行回顾性研究。结果29例IPA患者中,确诊12例,临床诊断17例。基础疾病以慢性肺疾病最常见(11例),其次为糖尿病、无基础疾病(各7例)。从发病到诊断平均16.5 d。临床症状无特异性,胸部CT以渗出影最常见。结论对于咳嗽、咳痰并有呼吸困难,PCT正常,CT表现为渗出影,特别是伴有肺部基础疾病,经广谱抗生素和糖皮质激素治疗无效的非中性粒细胞缺乏患者,应高度怀疑IPA可能。
非中性粒细胞缺乏;侵袭性肺曲霉病;临床分析
侵袭性肺曲霉病(invasive pulmonary aspergillosis,IPA)最常见于血液系统疾病粒细胞缺乏的患者。但近年来研究发现,在免疫功能正常或轻度受损的非中性粒细胞缺乏患者中IPA也不少见。虽然粒细胞缺乏患者IPA的临床特点有较多报道,但非粒细胞缺乏患者IPA的临床及影像学的特点尚少有报道。为提高临床医生对这一疾病的认识,我们回顾分析了我院2011年1月- 2013年12月诊断的29例非中性粒细胞缺乏患者IPA的临床特点。
资料和方法
1 临床资料 2011年1月- 2013年12月在本院呼吸科住院治疗并确诊或临床诊断为IPA的非中性粒细胞缺乏患者共29例。IPA的诊断分为确诊、临床诊断和拟诊,诊断标准和分组主要参照欧洲癌症治疗组织及真菌病研究组(EORTC/MSG)制订的诊断标准[1],确诊符合肺组织标本用组织化学或细胞化学方法检出菌丝或球形体(非酵母菌的丝状真菌),并发现有相应的肺组织损害。肺组织标本、胸腔积液或血液真菌培养阳性(排除标本污染)。临床诊断符合1项宿主因素,1项微生物学标准(合格痰液或支气管肺泡灌洗液直接镜检发现菌丝,连续2次真菌培养阳性)和1项主要临床标准(CT检出晕轮征、新月征和实变区内的空洞)或2项次要标准(肺部感染的症状和体征;影像学出现新的肺部浸润影;持续发热96 h,经积极抗菌治疗无效)。拟诊符合1项宿主因素和1项微生物学标准,而不符合临床标准,或仅符合临床标准而不符合微生物学标准。排除慢性坏死性肺曲霉病及曲霉球患者。既往有血液病及中性粒细胞缺乏症病史不纳入研究。本研究将确诊和临床诊断患者视为IPA患者。
2 方法 对29例IPA病患者的一般情况、临床症状、实验室检查、影像特点进行回顾性分析,并将患者分为有肺基础疾病组及无肺基础疾病组进行比较。
3 统计学处理 采用SPSS19.0软件进行统计分析。定量数据以或中位数表示,资料比较采用t检验或秩和检验。率的比较采用χ2检验或Fisher精确概率检验。检验水平α=0.05。
结 果
1 一般情况 29例IPA患者中,男性16例,女性13例,平均年龄58.9岁。确诊12例,临床诊断17例。基础疾病以慢性肺疾病最常见,为11例,其中8例慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD),8例全部接受激素治疗。其次为糖尿病7例,无基础疾病7例。所有患者诊断IPA前均接受广谱抗生素治疗。从发病到诊断平均时间16.5 d,肺部基础疾病组高于非肺部基础疾病组(19.3 d vs 14.8 d,P=0.036)。住院病死率为20.7%。见表1。
2 临床表现 29例中,咳嗽21例,咳痰69%,呼吸困难15例,发热12例,咯血8例,胸痛3例。见表2。
3 实验室检查 半乳甘露聚糖(galactomannan,GM)和1,3-β-D-葡聚糖(1,3-β-D-glucan,BG)阳性率均为44.8%。痰标本培养曲霉菌阳性率12例,其中烟曲霉11例,黄曲霉1例。白细胞、中性粒细胞均数分别为8.5×109/L、6.3×109/L,肺部基础疾病组高于非肺部基础疾病组(P=0.019,0.020)。C-反应蛋白、PCT中位数分别为1.67 mg/dl、0.05 ng/dl。见表2。
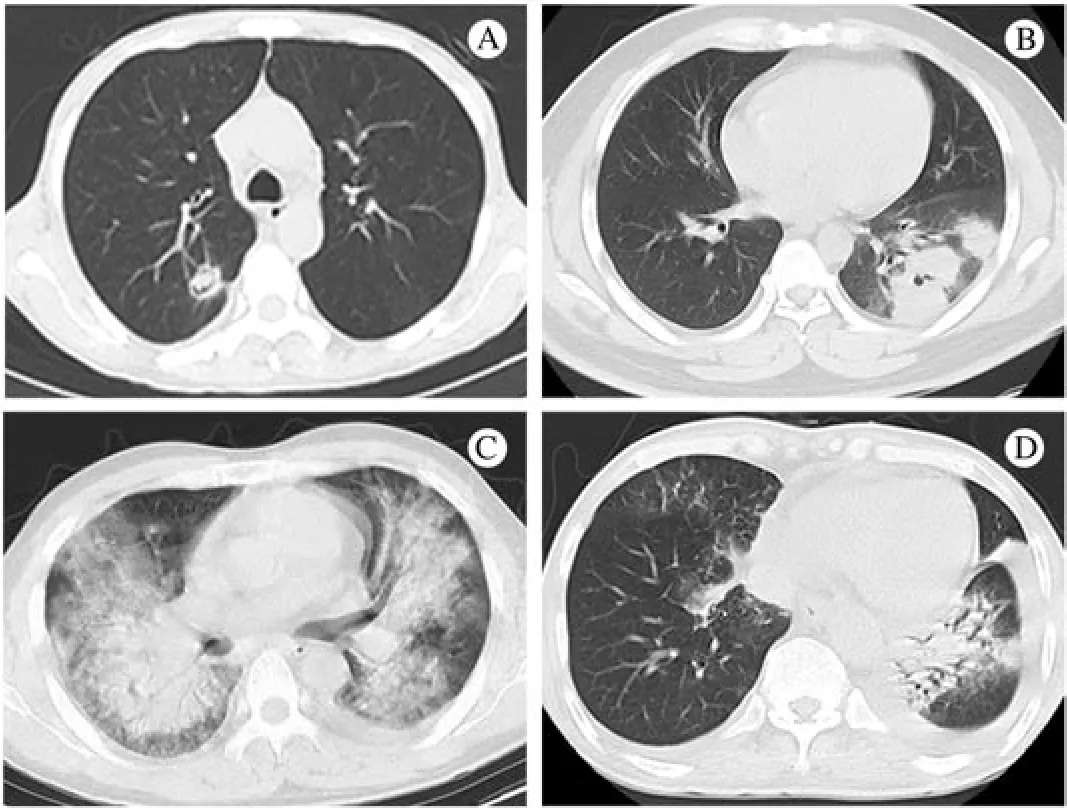
图 1 IPA的肺部CT表现 A:空气新月征;B:肺实变;C:磨玻璃影;D:渗出影Fig. 1 Findings in IPA on chest CT A: Air crescent sign B: Consolidation C: Ground-glass attenuation D: Infiltrates
4 肺部CT表现 渗出影17例,磨玻璃影9例,空洞影8例,团块影7例,结节影6例,胸腔积液4例,空气新月征1例。见表2,图1。
讨 论
IPA常见于血液恶性肿瘤疾病或是严重免疫功能受损的患者,是一种严重的肺疾病并具有高死亡率[2]。但近来研究发现,在免疫功能正常或轻度受损的非中性粒细胞缺乏患者中并不少见,其高危因素包括实体器官移植、实体器官恶性肿瘤放化疗、重度COPD长期糖皮质激素治疗等[3-4]。本研究中,最常见的基础疾病仍是COPD,并全部长期接受了糖皮质激素治疗,其次是糖尿病,这与文献报道一致[5]。多项研究显示[6-7],使用广谱抗生素超过10 d是COPD患者并发IPA的危险因素,本组患者在明确诊断前都接受了广谱抗生素治疗1周以上,但本组中7例无基础病史。
IPA患者的临床症状缺乏特异性,在中性粒细胞缺乏患者中,其临床症状主要包括对抗生素无反应的发热、咳嗽、咳痰、呼吸困难,部分患者可有胸痛与咯血[8]。本文中,以咳嗽、咳痰多见,发热仅为41.4%,这可能与前期抗生素及糖皮激素治疗有关。早期诊断治疗是影响预后最主要的因素,但由于其临床缺乏特异性,症状被原基础疾病掩盖,常导致诊断的延误。特别是对于免疫功能正常患者,更易为临床医师所漏诊。本组从发病至确立诊断最长时间为16.5 d。而肺部基础疾病组确诊需要更长时间,平均为19.3 d,这可能是因肺疾病症状影响了IPA的诊断。
表2 有肺基础疾病组和无肺基础疾病组IPA的各项临床指标比较Tab. 2 Comparison of symptoms, laboratory and CT findings of IPA between non-neutropenic patients with or without respiratory disease ()
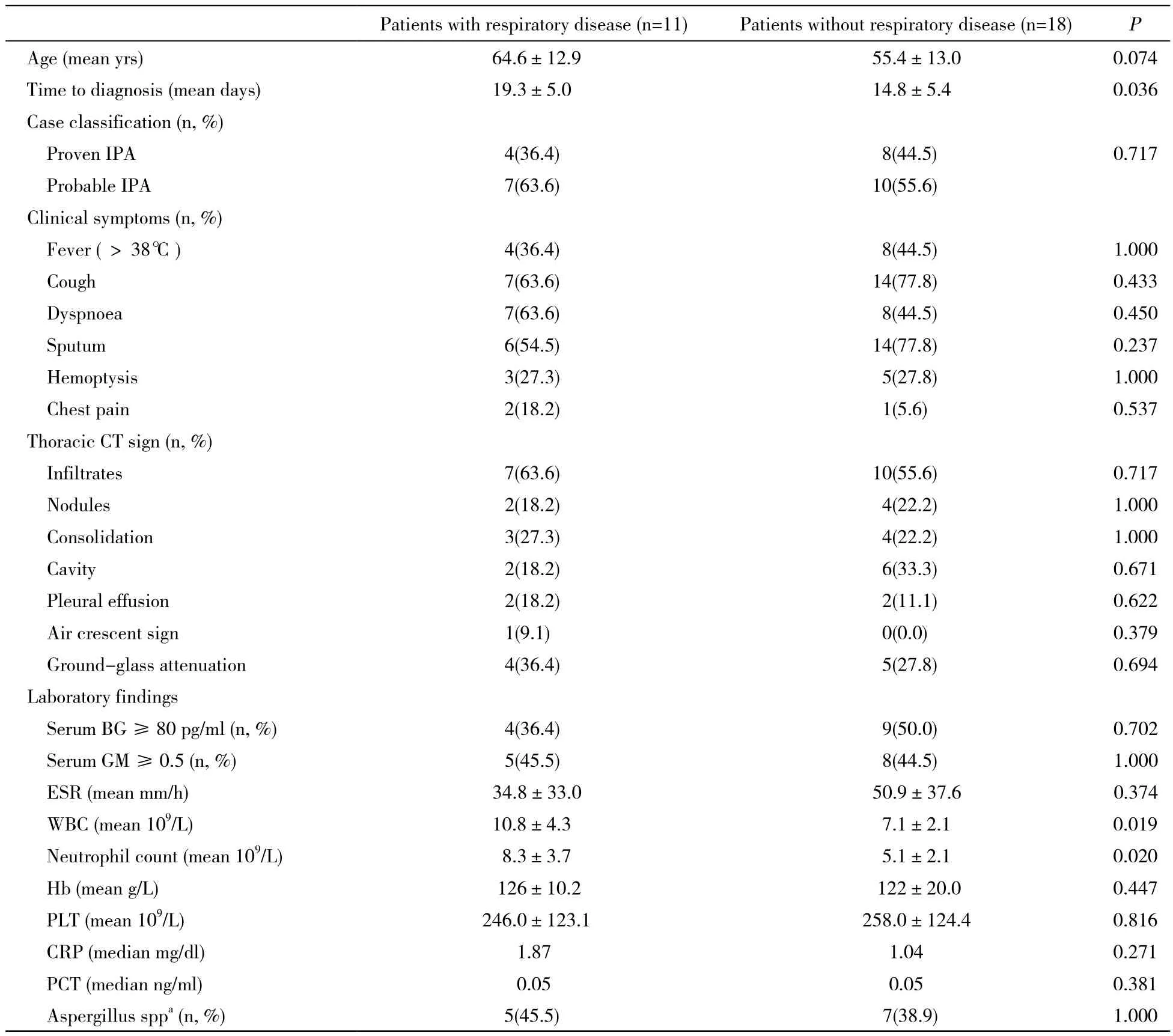
表2 有肺基础疾病组和无肺基础疾病组IPA的各项临床指标比较Tab. 2 Comparison of symptoms, laboratory and CT findings of IPA between non-neutropenic patients with or without respiratory disease ()
aSputum samples; CRP: C-reactive protein; ESR: erythrocyte sedimentation rate; Hb: hemoglobin; PLT: platelet; PCT: procalcitonin; WBC: white blood cell; BG: 1, 3-β-D-glucan; GM: galactomannan
Patients with respiratory disease (n=11)Patients without respiratory disease (n=18)P Age (mean yrs)64.6±12.955.4±13.00.074 Time to diagnosis (mean days)19.3±5.014.8±5.40.036 Case classification (n, %) Proven IPA4(36.4)8(44.5)0.717 Probable IPA7(63.6)10(55.6) Clinical symptoms (n, %) Fever (>38℃)4(36.4)8(44.5)1.000 Cough7(63.6)14(77.8)0.433 Dyspnoea7(63.6)8(44.5)0.450 Sputum 6(54.5)14(77.8)0.237 Hemoptysis3(27.3)5(27.8)1.000 Chest pain2(18.2)1(5.6)0.537 Thoracic CT sign (n, %) Infiltrates7(63.6)10(55.6)0.717 Nodules2(18.2)4(22.2)1.000 Consolidation3(27.3)4(22.2)1.000 Cavity2(18.2)6(33.3)0.671 Pleural effusion2(18.2)2(11.1)0.622 Air crescent sign1(9.1)0(0.0)0.379 Ground-glass attenuation4(36.4)5(27.8)0.694 Laboratory findings Serum BG≥80 pg/ml (n, %)4(36.4)9(50.0)0.702 Serum GM≥0.5 (n, %)5(45.5)8(44.5)1.000 ESR (mean mm/h)34.8±33.050.9±37.60.374 WBC (mean 109/L)10.8±4.37.1±2.10.019 Neutrophil count (mean 109/L)8.3±3.75.1±2.10.020 Hb (mean g/L)126±10.2122±20.00.447 PLT (mean 109/L)246.0±123.1258.0±124.40.816 CRP (median mg/dl)1.871.040.271 PCT (median ng/ml)0.050.050.381 Aspergillus sppa(n, %)5(45.5)7(38.9)1.000
Dai等[5]对52例非中性粒细胞缺乏IPA患者实验室检验的回顾性研究显示,白细胞为9.66× 109/L,中性粒细胞7.51×109/L,血沉45.37 mm/h,说明常规的炎症指标与曲霉菌感染的病情严重程度并不一致。本研究与Dai的报道较为一致,但在肺基础疾病组中,白细胞及中性粒细胞比非肺部基础疾病组更高,这可能与有肺基础疾病组更容易合并其他肺部感染有关。一项关于降钙素原(procaicltonin,PCT)在侵袭性真菌感染价值的研究认为[9],PCT在鉴别真菌感染与细菌感染有一定临床价值,真菌感染的PCT明显低于细菌性感染。我们的研究显示,PCT中位数为0.05ng/ml,说明PCT在鉴别真菌感染与细菌感染应为临床医师所重视。
GM和BG实验被认为在IPA早期诊断中具有较高的价值,但研究多集中在血液病患者或接受造血干细胞移植患者[10-11]。对于非中性粒细胞缺乏患者诊断价值的研究资料比较少,最近一项研究认为,在非中性粒细胞缺乏患者的侵袭性曲霉病患者的GM实验虽然具有较好的特异性,但是敏感度仅为23.1%[12]。另外两项针对IPA在非粒细胞缺乏患者的研究中,GM实验的敏感度为50.0% ~57.9%[13-14],本研究显示,GM的敏感度为44.8%,与文献报告相似。对血液病患者,BG实验的敏感度达到66%[15],在本研究中,对于非中性粒细胞缺乏患者,其敏感度只有44.8%。说明对于非中性粒细胞缺乏患者IPA的诊断,无论GM或BG实验,其诊断价值都不如在血液病患者中。
血液恶性肿瘤、免疫功能严重低下患者,胸部CT,特别是HRCT,对诊断更有价值。常规早期使用HRCT能提高诊断和改善预后,并利于指导进一步检查,比如支气管检查及活检[8]。典型胸部CT影像包括多发肺结节影、新月征、月晕征等,但这些征象既缺乏敏感性,也缺乏特异性[8]。Hauggaard等[16]的研究显示,在中性粒细胞缺乏患者IPA早期,月晕征的阳性率95%,空气新月征和空洞征的阳性率为33%。另一项研究对发热的中性粒细胞缺乏的IPA患者行HRCT,常见的表现包括结节影67%,磨玻璃影56%,团块影44%[17]。而在以COPD为基础疾病的非中性粒细胞缺乏患者中,Tutar等[18]发现,IPA的CT表现以渗出影最为常见,并常表现为急性肺炎,由于缺乏典型影像学改变,IPA常被误诊并导致病情恶化。这与本文中渗出影为常见一致,虽然本文空洞征和空气新月征阳性率为31%,但具有诊断意义的月晕征或空气新月征在本组患者中阳性率低。缺乏典型IPA影像学征象,可能与检查的时机有关。在本文中,对非中性粒细胞缺乏患者,依靠典型月晕征或空气新月征表现易耽误病情。
IPA在非中性粒细胞缺乏患者中的临床症状缺乏特异性,以往常用于中性粒细胞缺乏患者早期诊断IPA的血清学检查在非中性粒细胞缺乏患者中缺乏敏感性,胸部CT影像典型的空气新月征阳性率低,组织病理学检查有很多局限性,而导致临床误诊与漏诊。因此,对于咳嗽、咳痰并有呼吸困难,炎症指标正常,CT表现为渗出影,特别是伴有肺部基础疾病,经广谱抗生素和糖皮质激素治疗无效的非中性粒细胞缺乏患者,应高度怀疑IPA可能。
1 De Pauw B, Walsh TJ, Donnelly JP, et al. Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) C[J]. Clin Infect Dis,2008, 46(12): 1813-1821.
2 Chamilos G, Luna M, Lewis RE, et al. Invasive fungal infections in patients with hematologic malignancies in a tertiary care cancer center: an autopsy study over a 15-year period (1989-2003)[J]. Haematologica, 2006, 91(7): 986-989.
3 Samarakoon P, Soubani A. Invasive pulmonary aspergillosis in patients with COPD: a report of five cases and systematic review of the literature[J]. Chron Respir Dis, 2008, 5(1): 19-27.
4 刘毅,张杰根,张钗,等.49例慢性阻塞性肺疾病合并肺部真菌感染的临床分析[J].军医进修学院学报,2012,33(4):364-366.
5 Dai Z, Zhao H, Cai S, et al. Invasive pulmonary aspergillosis in nonneutropenic patients with and without underlying disease: a singlecentre retrospective analysis of 52 subjects[J]. Respirology, 2013,18(2): 323-331.
6 He H, Ding L, Li F, et al. Clinical features of invasive bronchialpulmonary aspergillosis in critically ill patients with chronic obstructive respiratory diseases: a prospective study[J]. Crit Care, 2011, 15(1): R5.
7 招云春,蔡少华,清怡.肺曲霉菌病21例临床分析[J].军医进修学院学报,2009,30(1):62-64.
8 Kousha M, Tadi R, Soubani AO. Pulmonary aspergillosis: a clinical review[J]. Eur Respir Rev, 2011, 20(121):156-174.
9 Dou YH, Du JK, Liu HL, et al. The role of procalcitonin in the identification of invasive fungal infection-a systemic review and metaanalysis[J]. Diagn Microbiol Infect Dis, 2013, 76(4): 464-469.
10 Pfeiffer CD, Fine JP, Safdar N. Diagnosis of invasive aspergillosis using a galactomannan assay: a meta-analysis[J]. Clin Infect Dis,2006, 42(10): 1417-1427.
11 Persat F, Ranque S, Derouin F, et al. Contribution of the (1-->3)-beta-D-glucan assay for diagnosis of invasive fungal infections[J]. J Clin Microbiol, 2008, 46(3): 1009-1013.
12 Ku NS, Han SH, Choi JY, et al. Diagnostic value of the serum galactomannan assay for invasive aspergillosis: it is less useful in non-haematological patients[J]. Scand J Infect Dis, 2012, 44(8):600-604.
13 Xu PF, Zhou JY, Zhou H, et al. Serum antigens assay combined with chest CT scan in diagnosis of invasive pulmonary aspergillosis[J]. Zhejiang Da Xue Xue Bao Yi Xue Ban, 2012, 41(3): 332-338.
14 He H, Ding L, Chang S, et al. Value of consecutive galactomannan determinations for the diagnosis and prognosis of invasive pulmonary aspergillosis in critically ill chronic obstructive pulmonary disease[J]. Med Mycol, 2011, 49(4): 345-351.
15 Metan G, Koç AN, Atalay A, et al. What should be the optimal cut-off of serum 1,3-β-D-glucan for the detection of invasive pulmonary aspergillosis in patients with haematological malignancies?[J]. Scand J Infect Dis, 2012, 44(5): 330-336.
16 Hauggaard A, Ellis M, Ekelund L. Early chest radiography and CT in the diagnosis, management and outcome of invasive pulmonary aspergillosis[J]. Acta Radiol, 2002, 43(3): 292-298.
17 Heussel CP, Kauczor HU, Heussel GE, et al. Pneumonia in febrile neutropenic patients and in bone marrow and blood stem-cell transplant recipients: use of high-resolution computed tomography[J]. J Clin Oncol, 1999, 17(3): 796-805.
18 Tutar N, Metan G, Koç AN, et al. Invasive pulmonary aspergillosis in patients with chronic obstructive pulmonary disease[J]. Multidiscip Respir Med, 2013, 8(1): 59.
Invasive pulmonary aspergillosis in non-neutropenic patients: A clinical analysis of 29 cases
CAI Xuejiu, NI Wentao, WEI Chuanqi, CUI Junchang
Department of Respiratory Diseases, Chinese PLA General Hospital, Beijing 100853, China
CUI Junchang. Email: guoguoyoumeng@163.com
ObjectiveTo investigate the clinical characteristics of invasive pulmonary aspergillosis (IPA) in non-neutropenic patients.MethodsClinical and imaging characteristics about 29 patients with proven and probable IPA admitted to department of respiratory diseases from January 2011 to December 2013 were retrospectively analyzed.ResultsPatients were classified into proven IPA group (n=12) and probable IPA group (n=17). The most common underlying disease of patients with IPA was chronic respiratory disease (n=11), diabetes mellitus and no basic diseases, each occurred in 7 cases. The average time from onset to diagnosis was 16.5 days. Clinical symptoms were nonspecific in non-neutropenic patients with IPA. The most common chest CT scan findings of patients with IPA were infiltrates.ConclusionIPA should be taken into account in the differential diagnosis particularly in non-neutropenic patients with dyspnea, cough, sputum, PCT normal values and a new pulmonary in filtrate that are irresponsive to broad-spectrum antibiotics and steroids.
non-neutropenic; invasive pulmonary aspergillosis; clinical analysis
R 563.1
A
2095-5227(2015)06-0532-04
10.3969/j.issn.2095-5227.2015.06.003
时间:2015-03-24 10:07
http://www.cnki.net/kcms/detail/11.3275.R.20150324.1007.001.html
2014-08-14
国家自然科学基金项目(81371855)
Supported by the National Natural Science Foundation of China(81371855)作者简介:蔡学究,男,在读硕士。研究方向:细菌耐药的预防及抗感染药物合理应用。Email: 10891432@qq.com
崔俊昌,男,博士,副主任医师,副教授,硕士生导师。Email: guoguoyoumeng@163.com

