Tagalsin对小鼠皮下移植肝癌微血管生成抑制作用
王萌,宋修岐,徐飞
(青岛大学医学院第二附属医院普外科,山东 青岛 266042)
Tagalsin对小鼠皮下移植肝癌微血管生成抑制作用
王萌,宋修岐,徐飞
(青岛大学医学院第二附属医院普外科,山东 青岛 266042)
目的 探讨Tagalsin(角果木提取物)在小鼠皮下移植性肝癌组织中抗微血管生成活性和对肿瘤生长的抑制作用。方法 利用鼠源性H22肝癌细胞建立小鼠皮下移植性肝癌模型,模型成功后随机将小鼠分为空白对照组和高、中、低浓度Tagalsin组4组,比较小鼠实验前后体质量变化,计算抑瘤率,检测瘤组织中促血管生成素-1(Ang-1)、促血管生成素-2(Ang-2)表达水平及两者比值,计数微血管密度(MVD)。结果 与空白对照组比较,Tagalsin各剂量组肿瘤生长均较缓慢,瘤质量减小(F=1 588.76,t=36.42~75.11,P<0.05),其高、中、低剂量组抑瘤率分别为37.03%、33.90%、29.92%。免疫组化结果显示,Tagalsin各剂量组、空白对照组间Ang-1、Ang-2阳性表达率及Ang-2/Ang-1比值比较差异均有显著性(F=135.81~355.39,t=2.29~47.15,P<0.05)。Tagalsin各剂量组、空白对照组间MVD随Tagalsin剂量的增加而递减,差异均有显著性(F=169.27,t=20.39~45.78,P<0.05)。结论 Tagalsin有抑制肿瘤生长的作用,其机制可能是通过调节Ang-1、Ang-2蛋白的表达,从而影响肿瘤组织中微血管的生成。
肝肿瘤;Tagalsin;促血管生成素-1;促血管生成素-2;新生血管化,病理性
原发性肝癌是消化系统肿瘤中最常见的恶性肿瘤之一,每年我国约有22万人死于肝癌[1]。肿瘤的生成、生长与转移与肿瘤性血管的生成有密切关系,而肿瘤性血管的生成依赖于肿瘤性的血管生长因子[2]。从肿瘤的生物学特征来看,肝癌属于恶性程度高的血管依赖性肿瘤,其生长快、转移早的必须条件之一是肿瘤血管的生成。Tagalsin(角果木提取物)可通过下调bcl-2和Survivin蛋白的表达,从而导致肿瘤细胞的凋亡,具有抑制肿瘤细胞生长的作用[3]。本实验研究不同剂量的Tagalsin对小鼠皮下移植性肝癌组织中微血管生成的影响,从而探讨其抗肿瘤的机制,为Tagalsin的临床应用提供理论依据。现将结果报告如下。
1 材料与方法
1.1材料来源
SPF级昆明种小鼠共70只,雄性,体质量30~32 g,由青岛市药检所提供。肝癌细胞购自中国海洋大学药理研究所;Tagalsin购自北京大学天然药物及仿生药物国家重点实验室,原浓度20 g/L,用食用油稀释成0.24、1.20、6.00 g/L备用。RPMI-1640培养基及胎牛血清购自Gibco公司;兔抗小鼠促血管生成素-1(Ang-1)、促血管生成素-2(Ang-2)免疫组化多克隆抗体、兔抗小鼠CD34免疫组化多克隆抗体、即用型SABC超敏试剂盒及DAB显色试剂盒均购于北京博奥森生物技术有限公司。
1.2方法
1.2.1动物模型的建立 选取接种H22肝癌细胞后8~10 d、肿瘤生长良好的荷瘤小鼠,颈椎脱臼处死,采集腹水(呈乳白色浓稠液),置于已消毒的烧杯内,加生理盐水稀释使细胞密度达到2×109/L;然后于每只小鼠右前肢腋窝处皮下常规接种瘤细胞悬液0.2 mL,制成局灶性实体瘤实验模型。
1.2.2分组及给药 在小鼠接种后8~10 d,可明显观察到皮下移植瘤的生长,此时将已建立皮下移植瘤模型的小鼠随机分为4组: 空白对照组与Tagalsin低剂量组、中剂量组、高剂量组,每组15只小鼠。空白对照组每天灌胃给予相等体积食用油,低剂量组每天灌胃给予Tagalsin 0.66 mg/kg,中剂量组每天灌胃给予Tagalsin 3.30 mg/kg,高剂量组每天灌胃给予Tagalsin 16.50 mg/kg,连用5 d、停用2 d为一疗程,共2疗程。停药后观察24 h,并称取各剂量组小鼠体质量,然后脱颈处死小鼠。
1.2.3抑瘤率计算及标本的制作 完整剥离瘤体并称质量,计算抑瘤率。抑瘤率=(1-剂量组平均瘤质量/空白对照组平均瘤质量)×100%[3]。取1.0 cm×1.0 cm×0.5 cm大小肿瘤组织,置于40 g/L的甲醛溶液中固定2 h,常规梯度乙醇脱水、二甲苯透明、石蜡包埋。
1.2.4移植瘤组织中Ang-1、Ang-2及微血管密度(MVD)表达的检测 将上述石蜡标本行8 μm厚连续切片,烘干,脱蜡抗体修复后免疫组化染色,严格按照SABC试剂盒说明书步骤操作,部分切片滴加0.1 mol/L的PBS代替一抗作为阴性对照。阳性结果判断:Angs阳性染色为棕黄色颗粒状或线网状,分布于细胞浆和胞膜。高倍镜(400倍)下随机选择4个强免疫反应视野,循序计数≥1 000个肿瘤细胞中阳性细胞的个数,计算阳性率及Ang-2/Ang-1比值[4]。CD34阳性染色定位于血管内皮细胞,呈棕黄色,肿瘤组织内孤立的棕黄色血管内皮细胞或细胞簇,代表一条单独的微血管。在10倍物镜下挑选微血管分布最高的区域,然后在40倍物镜下(每视野0.196 mm2)计数5个视野中被CD34染成棕黄色的血管数目,取其平均值作为MVD。分辨不清或染色模糊的细胞不计入[5]。
2 结 果
2.1各组小鼠瘤质量及抑瘤率比较
与空白对照组小鼠瘤质量为(3.51±0.06)g相比较,Tagalsin低、中、高剂量组瘤质量分别为(2.48±
0.05)、(2.32±0.07)、(2.21±0.06)g,差异均有显著意义(F=1 588.76,t=36.42~75.11,P<0.05);高、中、低剂量组的抑瘤率分别为37.03%、33.90%和29.92%。
2.2各组Ang-1、Ang-2表达情况及Ang-2/Ang-1比值比较
免疫组化结果显示,Tagalsin各剂量组Ang-1、Ang-2阳性表达率及Ang-2/Ang-1比值与空白对照组比较差异均有显著性(F=135.81~355.39,t=2.29~47.15,P<0.05)。见表1。
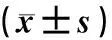

组 别nAng-2(χ/%)Ang-1(χ/%)Ang-2/Ang-1比值空白对照组1575.38±2.1436.59±2.842.03±0.14低剂量组1565.17±2.4154.86±3.441.21±0.13中剂量组1557.57±2.2865.77±3.510.91±0.11高剂量组1549.11±1.5176.17±4.510.72±0.09
2.3各组MVD表达比较
Tagalsin低、中、高剂量组MVD分别为51.23±22.84、33.96±19.37、24.51±12.74,与空白对照组(89.37±31.84)比较差异均有显著性(F=169.27,t=20.39~45.78,P<0.05)。
3 讨 论
Angs 家族是近年来研究发现的一个既含有受体抑制剂,又含有受体激动剂的促血管生成家族。其中Ang-1、Ang-2对血管生成的调节作用效果突出,两者主要参与新血管的成熟及维持血管的稳定性[6]。FUJIKAWA等[7]通过分析敲除Ang-1基因和Tie-2受体的小鼠模型发现,其新生的血管系统没有进一步的塑形,血管扩张且通透性高,尤其是在大血管中表现尤为明显。CHITRA等[8]研究显示,Ang-1可以拮抗不论是VEGF还是其他的炎性因子诱导的漏出作用,这种作用可能与Ang-1在内皮细胞和周围支持细胞及基质之间的优化作用相关联。THURSTON等[9]建立了一种Ang-1过度表达的小鼠模型,研究表明,这些小鼠模型的内皮间质细胞和内皮细胞、周围支持细胞间的连接完整,小血管数量多且管腔大。Ang-2主要在内皮细胞及肿瘤细胞中表达,与其受体Tie-2有较高的亲和力,两者相结合后,并不是使Tie-2磷酸化,而是使其脱磷酸化,即Ang-2是Ang-1的天然拮抗剂,能完全抑制Ang-1激活Tie-2的效应[10]。HOLSH等[11]研究显示,Ang-2可通过拮抗Ang-1的作用从而诱导Tie-2的脱磷酸化,使其发生退行性变,导致血管数目减少,血管发生断裂并伴内皮细胞的凋亡。以往有研究证实,Ang-2/Ang-1的比值可能是决定肿瘤血管生成和肿瘤生长的最终因素。当Ang-2高表达而Ang-1低表达时,促进肿瘤血管的生成,从而推测Angs及其受体系统在肿瘤血管生成中的调节作用以Ang-2的作用为主导。综上所述,我们可以得出如下结论:Ang-2与Ang-1在调控肿瘤组织中微血管表达时主要表现为两种形式:①Ang-2结合内皮细胞上的Tie-2,阻断Ang-1引导的Tie-2受体的磷酸化作用;②肿瘤组织中Ang-1表达的下调和Ang-2的过表达,可以破坏血管生成调节因子的平衡,两种形式共同作用,诱导内皮细胞分裂、移位,使新生血管呈非出芽式生长,参与肿瘤血管生成。
本实验在建立小鼠皮下移植性肝癌模型前提下,灌胃给予不同剂量的Tagalsin进行干预,通过与空白对照组比较,显示小鼠皮下移植瘤生长速度与Tagalsin呈一定的浓度依赖性,即高浓度组的移植瘤生长最为缓慢。免疫组化检测结果显示,随着Tagalsin浓度升高,Ang-1表达增加,Ang-2及MVD表达逐渐减少,且Ang-2/Ang-1的比值亦减小,各组间差异均具有显著性。根据结果我们推测,Tagalsin可能通过下调Ang-2的表达、上调Ang-1的表达,从而使Ang-2/Ang-1的比值降低,达到减少肿瘤组织中微血管的数目,从而达到抑制肿瘤组织生长的目的。但对于该药的最适浓度及其对免疫组织器官的副作用还有待进一步研究。
[1] 钱骏,冯敢生. 原发性肝癌的综合介入治疗[J]. 中华肿瘤杂志, 2003,25(5):417-419.
[2] FOLKMAN J. The role of angiogenesis in tumor growth[J]. Semin Cancer Boil, 1992,3(2):65-71.
[3] 郭允振,宋修歧,薛伟山,等. 角果木提取物Tagalsin对小鼠艾氏腹水瘤抑制作用的研究[J]. 齐鲁医学杂志, 2012,27(2):107-109.
[4] 杨扬,赵长林,袁俊波,等. 直肠癌组织VEGF和Ang-2表达及其与肿瘤血管形成相关性的探讨[J]. 中华肿瘤防治杂志, 2011,18(19):1532-1536.
[5] MAEDA K, CHUNG Y S, TAKATSYKO S, et al. Tumor angiogenesis as a predictor of recurrence in gastric carcinoma[J]. J Clin Oncol, 1995,13(2):477-481.
[6] STEJSKAL D, KARPISEK M, REUTOVA H, et al. Angiopoietin-like protein4: development, analytical characterization, and clinical testing of a new ELISA[J]. Gen Physiol Biophys, 2008,27(1):59-63.
[7] FUJIKAWA K, DE AOS SCHERPENSEEN I, et al. Role of PI3-kinase in angiopoietin-1 mediated migration and attchment-dependent survival of endothelial cells[J]. Exp Cell Res, 1999,253(2):663-672.
[8] CHITRA S, PAMELA F J, SYBILL P, et al. Requisite role Angiopoetin-1,a ligand for the Tie receptor,during embryonic angiogenesis[J]. Cell, 1996,87:1171-1180.
[9] THURSTON G, SURI C, SMITH K, et al. Leakage-resistant blood vessles in mice transgenically overexpressing angiopoietin-1[J]. Science, 1999,286(5499):2511-2514.
[10]TAKAHASHI Y, NISHIKAWA M, TAKAKURA Y. Inhibition of tumor cell growth in the liver by RNS interference-mediated suppression of HIF-1 alpha expression in tumor cells and hepatocytes[J]. Gene Ther, 2008,15(8):572-582.
[11]HOLSH J, MAISONPIERRE P, COMPTON D, et al. Vessel cooption,regression,and growth in tumors meditate by angiopoietins and VEGF[J]. Science, 1999,284(5422):1994-1998.
(本文编辑 厉建强)
ANTI-TUMOR EFFECT OF TAGALSIN ON HEPATOMA
WANGMeng,SONGXiuqi,XUFei
(Department of General Surgery, The Second Affiliated Hospital of Qingdao University Medical College, Qingdao 266042, China)
ObjectiveTo explore the effect of Tagalsin (extracted from Ceriops tagal) on antiangiogenesis activity and inhibition of hepatoma in rats.MethodsA subcutaneously transplanted liver cancer model was created in rats using H22 hepatoma cells. Upon completion of the models, the rats were randomized to blank, high-dose-, moderate-dose- and low-dose-Tagalsin groups. Body weight of the rats before and after experiment was compared, tumor inhibition rate was calculated, Ang-2, Ang-1 and Ang-2/Ang-1 ratio were detected, and MVD counted.ResultsCompared with the blank group, tumor growth in each Tagalsin group was slow (F=1 588.76,t=36.42-75.11,P<0.05), and the inhibition rates of tumor in high-, moderate- and low-dose groups were 37.03%, 33.90%, and 29.92%, respectively. Immunohistology showed the differences between each dose group and the blank group were significant with regard to Ang-1,Ang-2 and Ang-2/Ang-1 ratio (F=135.81-355.39,t=2.29-47.15,P<0.05), The levels of MVD in each dose group decreased along with the increase of the dose of Tagalsin, compared with the blank group, the differences were significant (F=169.27,t=20.39-45.78,P<0.05).ConclusionTagalsin has an inhibition effect on tumor growth by likely through adjusting the expressions of Ang-2 and Ang-1, and thus impact the growth of capillaries in tumor tissue.
liver neoplasm; Tagalsin; angiopoietin-1; angiopoietin-2; neovascularization, pathologic
2014-05-16;
2014-09-27
王萌(1986-),男,硕士研究生。
宋修岐(1953-),男,教授,博士生导师。E-mail:songxiuqi8@126.com。
R73-36
A
1008-0341(2015)01-0012-03

