芽孢杆菌和溶藻弧菌对凡纳滨对虾消化酶、免疫酶活力及抗病力的影响*
许玉洁, 单洪伟, 马 甡
(中国海洋大学海水养殖教育部重点实验室,山东 青岛 26003)
芽孢杆菌和溶藻弧菌对凡纳滨对虾消化酶、免疫酶活力及抗病力的影响*
许玉洁, 单洪伟, 马 甡**
(中国海洋大学海水养殖教育部重点实验室,山东 青岛 26003)
选取初始体重(3.58±0.32)g的凡纳滨对虾,在饲料中分别添加溶藻弧菌(Vibrioalginolyticus)活菌、溶藻弧菌破碎菌、芽孢杆菌(Bacillussp.)活菌和芽孢杆菌破碎菌和使其菌含量为108CFU/g,通过49d的养殖实验研究饲料中添加芽孢杆菌和溶藻弧菌对凡纳滨对虾的消化酶、免疫相关酶和抗病力的影响。结果显示:(1)4个处理组对虾的肠道蛋白酶水平均显著提高。25d时各处理组淀粉酶水平均显著高于对照组,49d时弧菌破碎组和杆菌破碎组对虾的淀粉酶水平高于对照组(P<0.05),其中杆菌破碎组对虾肠道的消化酶水平最高,杆菌组对虾肠道消化酶水平低于其他处理组。(2)49d时弧菌组对虾的超氧化物歧化酶(SOD)水平上升(P<0.05);弧菌破碎组对虾的SOD、酚氧化酶(PO)和抗菌酶水平上升(P<0.05);杆菌组对虾PO水平上升,抗菌酶水平下降(P<0.05);杆菌破碎组对虾SOD和PO水平均上升,抗菌酶水平下降(P<0.05)。(3)WSSV攻毒的半致死时间为杆菌破碎组>弧菌破碎组>弧菌组>杆菌组>对照组。研究表明,饲料中添加芽孢杆菌和溶藻弧菌及其破碎菌体均能在一定程度上提高对虾的消化酶活力和抗病力。其中添加弧菌破碎菌体能更好的提高对虾的免疫酶水平,添加杆菌破碎菌体能促进对虾消化和抗病力。
凡纳滨对虾; 芽孢杆菌; 溶藻弧菌; 消化酶; 免疫
凡纳滨对虾(Litopenaeusvannamei)原产于中、南太平洋海岸水域秘鲁北部至墨西哥桑诺拉[1]。由于适应力强、生长周期短、营养要求低、抗病力强、适盐范围广等特点,使得凡纳滨对虾养殖在我国得到了迅速的发展[2]。然而在对虾养殖中,对虾白斑综合征(White spot syndrome,WSS)因其高传播性、高致病性、高死亡率给对虾养殖业造成了巨大损失。目前尚无有效的疫苗能够防治白斑综合征,主要采用以防为主的策略,通过建立健康的养殖环境和提高对虾的免疫力来达到防治的目的。
益生菌具有改善水质、提高动物产量和免疫力的作用,应用在生产中能够改善养殖水质,减少渔药、抗生素的使用,促进健康养殖业的发展[3]。芽孢杆菌(Bacillussp.)由于其耐高温及干燥环境、便于储藏和运输的特性成为重要的饲料微生物添加剂和微生态制剂[4-5]。研究表明,芽孢杆菌能够降解水体中氨氮、亚硝氮等有害物质;定植于宿主肠道后,能够分泌酶类和代谢产物、建立优势菌群,促进宿主生长,提高宿主的免疫力[6-7]。实验表明在饲料中添加坚强芽孢杆菌能够提高对虾的免疫酶水平和抗病力[8]。
弧菌(Vibrio)是海水养殖环境中的常见菌种,其中包括很多致病菌如哈维氏弧菌(Vibrioharveyi)、鳗弧菌(Vibrioanguillarum)、副溶血弧菌(Vibrioparahaemolyticus)等。溶藻弧菌(Vibrioalginohyticus)被认为是一种条件致病菌,大量存在于海水中,在一定环境、宿主和环境菌群的共同作用下能够对宿主产生致病性[9]。然而已有部分溶藻弧菌作为益生菌应用与水产养殖中。有研究表明,溶藻弧菌能够提高养殖动物的成活率和体重[10-11]。也有实验证明溶藻弧菌能够吸收水体中的氨氮、亚硝氮,具有改善水质的作用[12]。然而关于溶藻弧菌对对虾生长、免疫方面的影响尚不甚清楚,需进一步研究。
活细菌进入肠道后能够在肠道定植,通过调节肠道的菌群平衡,分泌胞外产物等途径提高动物的免疫水平[13]。有研究表明,细菌脂多糖和细菌肽聚糖对介导非特异性免疫起到重要作用[14-15]。采用新城疫病毒感染干乳酪杆菌(Lactobacilluscasei)和嗜酸乳杆菌(Lactobacillusacidophilus)及其破碎菌体处理的鸡胚肠细胞后发现,活菌处理过的细胞干扰素IFN-γ水平较对照组显著降低,破碎菌处理组的IFN-γ水平显著高于对照组[16]。说明细菌活菌和破碎菌产生免疫调控的机制可能有所不同,菌体碎片或细胞内的某些物质可能会对动物产生免疫促进的作用。本实验采用筛选自舟山的芽孢杆菌和溶藻弧菌,通过饲料添加活菌和破碎菌体,比较2株细菌及其破碎菌体对凡纳滨对虾生长、消化酶活力、免疫相关酶活力和抗病力的影响。目的是比较2株细菌和不同添加方法对于免疫促进的效果,定位免疫活性物质的所在位置,为其在对虾养殖生产中的应用提供参考。
1 材料和方法
1.1 实验菌株
溶藻弧菌VZ5株和芽孢杆菌BZ5株均筛选自舟山对虾养殖池塘中,现保存于中国海洋大学水产学院。
1.2 实验饲料
对照组饲料采用正大公司生产的对虾配合饲料,粗蛋白含量为42%,脂肪含量为7%。溶藻弧菌VZ5株和芽孢杆菌BZ5株活化后接种于LB液体培养基中,30℃培养24h。培养液于3000r/min离心10min收集浓缩菌液。菌液分别置于超声波破碎仪中破碎20min(39%,3s,3s)制成破碎菌液。将活菌液和破碎菌液添加于对虾配合饲料中,制成含菌量108CFU/g的饲料,室温晾干后4℃保存备用。
1.3 对虾
凡纳滨对虾来自青岛市宝荣水产科技发展有限公司,体质量为(3.58±0.32)g,体色正常,健康活泼。实验前先暂养7d,每日换水1次,投饵3次。
1.4 养殖实验
实验设5个处理组,弧菌组:投喂添加溶藻弧菌VZ5株活菌的配合饲料;弧菌破碎组:投喂添加破碎溶藻弧菌的配合饲料;杆菌组:投喂添加芽孢杆菌BZ5株活菌的配合饲料;杆菌破碎组:投喂添加破碎芽孢杆菌的配合饲料;对照组:只投喂配合饲料。每组各设6个平行,每个平行20尾对虾。实验期间,每日投饵3次,每日吸污、换水,实验持续49d。
1.5 攻毒实验
攻毒采用从患病死虾中粗提的白斑综合征病毒(White spot syndrome virus,WSSV),从对虾第4、5腹节注射(50μL/尾)。每隔6h观察对虾的死亡情况,统计累计死亡率(Cumulative mortality rate,CMR),计算免疫保护率(Relative Percent Survival, RPS),计算公式如下:
CMR=已死亡对虾数/对虾总数×100%;
1.6 样品采集
分别于实验的第25天和第49天,每组随机取4只虾,解剖取出肠道、肝胰脏,-80℃保存备用。使用一次性无菌注射器从对虾腹部血窦中抽取血淋巴,在4℃下冷藏12h,5000r/min冷冻离心10min,取出上层血清,-80℃保存备用。
1.7 指标测定
1.7.1 生长指标 相对增重率(Weight gain rate, WGR)和特定生长率(Specific growth rate, SGR)分别按照下列公式计算:
WGR =[(Wt-W0) / W0] ×100%;
SGR=[(lnWt- lnW0) /T] ×100%。
其中:W0,Wt分别表示实验开始与结束时对虾湿体质量;T为2次测定期间的间隔天数。
1.7.2 消化酶测定
淀粉酶 采用试剂盒(购自南京建成生物研究所)测定。淀粉酶单位定义为组织中每毫克在37℃与底物作用30min,水解1mg淀粉定义为1个活力单位。酶活性以酶的比活力表示。
蛋白酶 采用南京建成胰蛋白酶测定试剂盒测定。每单位定义为:pH=8.0,37℃条件下,每毫克蛋白中含有的胰蛋白酶每分钟使吸光值变化0.003即为1个酶活力单位。
酶液蛋白浓度 采用考马斯亮蓝蛋白测定试剂盒(购自南京建成生物研究所)测定。
1.7.3 免疫指标测定 各免疫指标采用如下方法进行测定。
(1)血清过氧化物酶(POD)活力的测定采用改进的史成银等[17]的方法。在96孔酶标板中依次加入血清20μL和180μL的显色缓冲液(7.3g柠檬酸,11.86g二水磷酸氢二钠用无菌水稀释至1L)。首先用酶标仪于490nm波长下测定吸光值A1,然后再加入20μL显色液(44μL 30%过氧化氢,4mg邻苯二胺,10mL显色缓冲液),置于酶标仪中摇匀后,避光显色15min,于490nm处测定吸光值A2。血清中POD活力用A2-A1计算。
(2)血清超氧化物歧化酶(SOD)活力测定采用南京建成生物工程研究所的SOD试剂盒。每毫升血清SOD的抑制率达50%时为1个SOD活力单位(U)。
(3)血清酚氧化酶(PO)活力测定采用改进的Ashida等[18]的方法。以L-多巴为底物,在96孔酶标板中进行。在96酶标板中的小孔内依次加入0.01mol/L L-多巴10μL、0.1mol/L磷酸钾缓冲液(pH=6.4)200μL和10μL的血清,再将酶标板放入酶标仪中震荡4次,于490nm波长每2min测一次吸光值。每毫升样品每分钟OD值增加0.001为1个酶活力单位(U)。
(4)抗菌酶活力采用改进的Hultmark等[19]的方法进行。将大肠杆菌用pH=6.4的1mol/L磷酸钾盐缓冲液配成OD570=0.4的菌悬液,取3mL菌悬液放入干净试管中(冰水浴条件下),再向试管中加血清50μL,震荡混匀,用分光光度计于570nm波长下测其吸光值A3,再将试管置于37℃水浴锅中恒温放置30min,冰水浴中终止反应, 570nm下测定此时的吸光值A4。抗菌活力的计算公式为[(A3-A4)/A4]1/2。
1.8 数据处理
使用SPSS19.0软件对实验数据进行单因素方差分析,当差异显著(P<0.05)时,用Duncan检测法进行多重比较。
2 结果
2.1 生长
养殖实验结束后,弧菌组的增重率、特定生长率最低,杆菌破碎组最高,但差异均不显著,各组的成活率差异不显著(见表1)。

表1 凡纳滨对虾的生长和成活率Table 1 The growth weight and survival rate of Litopenaeus vannamei(mean±S.E.)
2.2 消化酶
如图1、2所示,25d时,对照组和杆菌组肝胰脏中蛋白酶活力显著高于其他各组,杆菌破碎组最低(P<0.05)。各处理组肠道中蛋白酶活力显著高于对照组(P<0.05),杆菌破碎组肠道蛋白酶活力最高,杆菌组显著低于其他处理组(P<0.05)。49d时,弧菌组、杆菌组和杆菌破碎组肝胰脏蛋白酶活力显著高于对照组(P<0.05),杆菌组肝胰脏蛋白酶活力最高。各处理组的肠道蛋白酶活力均有所提高并显著高于对照组(P<0.05)。杆菌破碎组肝胰脏蛋白酶活力最高,肠道蛋白酶活力显著低于其他处理组(P<0.05)。

图1 各组肝胰脏胰蛋白酶活力变化
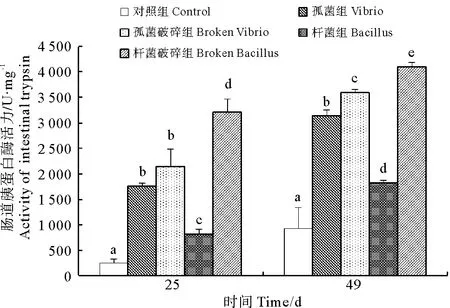
图2 各组肠道胰蛋白酶活力变化
如图3、4所示,25d时,对照组肝胰脏中淀粉酶活力显著高于各处理组(P<0.05),弧菌破碎组和杆菌组最低。对照组肠道中淀粉酶活力最低,杆菌破碎组最高(P<0.05)。49d时,对照组和杆菌破碎组肝胰脏中淀粉酶活力降低,肠道中淀粉酶活力升高。杆菌组肝胰脏中淀粉酶活力上升,肠道中淀粉酶活力下降。弧菌组肝胰脏和肠道中淀粉酶活力均下降,弧菌破碎组肝胰脏和肠道中淀粉酶活力均升高。对照组肝胰脏淀粉酶活力最高,弧菌组和杆菌破碎组最低(P<0.05)。杆菌破碎组肠道淀粉酶活力最高,弧菌组和杆菌组最低(P<0.05)。
2.3 免疫相关酶测定结果
2.3.1 过氧化物酶活力 25d时,弧菌组POD活力高于对照组,杆菌组和杆菌破碎组POD活力低于对照组,但差异不显著(P>0.05)。49d时,弧菌组、杆菌组和杆菌破碎组POD活力均高于对照组,但差异不显著(P>0.05)。

图3 各组肝胰脏淀粉酶活力变化Fig.3 The change trend of hepatopancreas amylase of different treatments
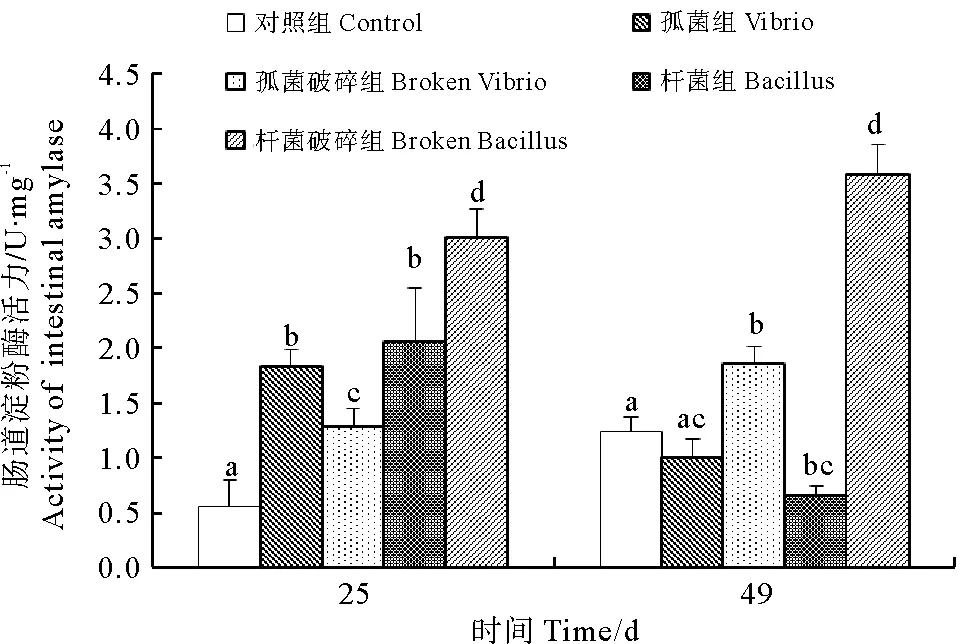
图4 各组肠道淀粉酶活力变化Fig.4 The change trend of intestinal amylase of different treatments
2.3.2 超氧化物歧化酶活力 25d时,弧菌组、弧菌破碎组和杆菌破碎组SOD水平显著高于对照组(P<0.05),其中杆菌破碎组SOD水平最高。49d时,弧菌组、弧菌破碎组和杆菌破碎组SOD水平显著高于对照组(P<0.05)。
2.3.3 酚氧化酶活力 25d时,弧菌破碎组PO水平显著高于对照组,杆菌破碎组PO水平显著低于对照组(P<0.05)。49d时,弧菌破碎组和杆菌组PO水平显著高于对照组(P<0.05),杆菌破碎组PO水平显著高于弧菌组(P<0.05),但与对照组无显著差异。
2.3.4 抗菌酶活力 25d时,弧菌组抗菌酶显著低于对照组(P<0.05)。49d时,弧菌组和弧菌破碎组抗菌酶水平高于对照组,其中弧菌破碎组与对照组之间差异显著(P<0.05)。杆菌组和杆菌破碎组的抗菌酶水平显著低于对照组(P<0.05)。
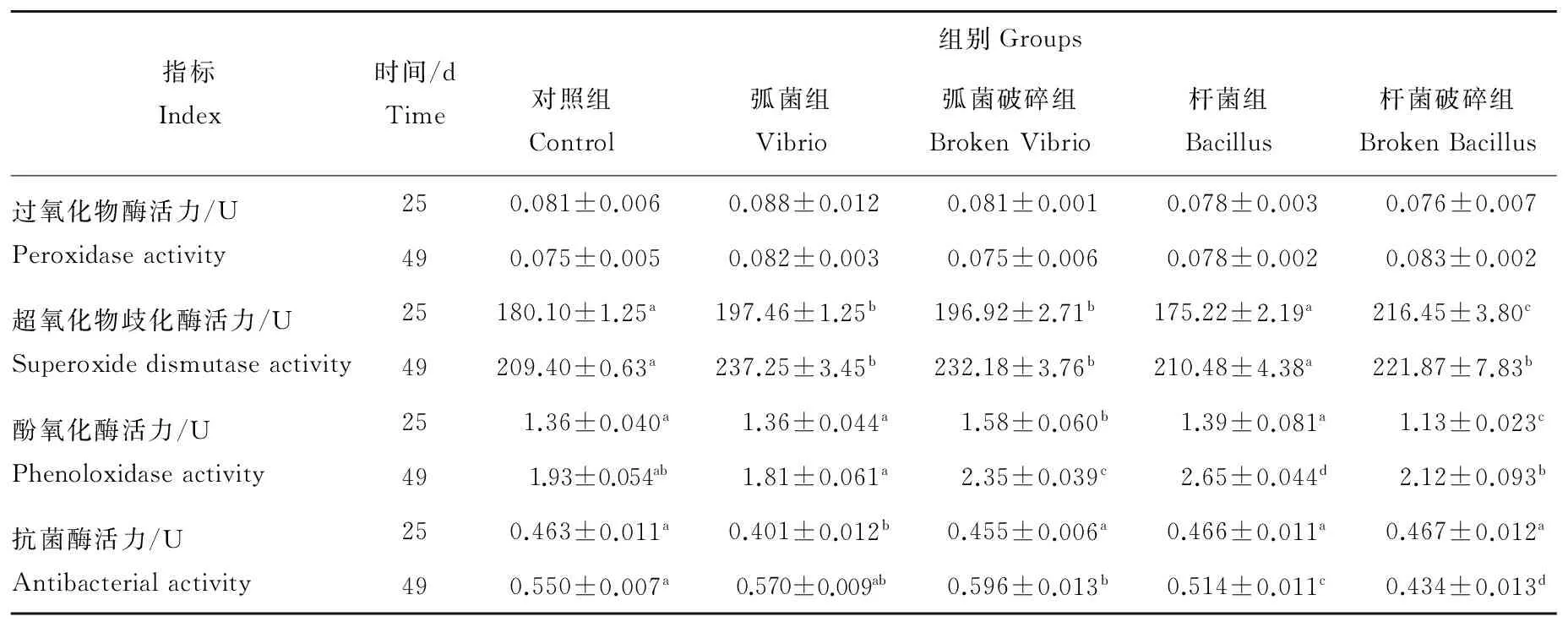
表2 凡纳滨对虾非特异性免疫指标 (mean±S.E.)Table 2 Nonspecific immune index of Litopenaeus vannamei
注:同一行中不同上标为差异显著(P<0.05)。Note:Data in the same row with different superscript letters are significantly different(P<0.05).
2.4 攻毒结果
由图5所示,各组半数致死时间LT50:对照组68h, 弧菌组72h,弧菌破碎组78h,杆菌组70h, 杆菌破碎组90h。各处理组半致死时间分别比对照组延长了5.9%,14.7%,2.9%和32.4%。在96h时,对照组死亡率达到96.67%,弧菌组为86.67%,弧菌破碎组为80%,杆菌组为96.67%,杆菌破碎组为56.67%。
图6显示,杆菌破碎组的免疫保护率最高。48h后,弧菌破碎组的免疫保护率一直高于弧菌组和杆菌组。

图5 凡纳滨对虾注射WSSV后的累计死亡率Fig.5 The cummulative moratality rate of Litopenaeus. vannamei after challenged with WSSV
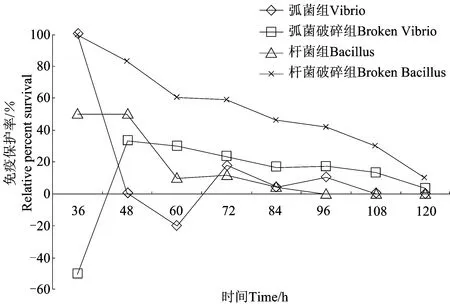
图6 各实验组免疫保护率Fig. 6 The relative percent survival of experiment treatments
3 讨论
3.1 溶藻弧菌和芽孢杆菌对凡纳滨对虾生长存活的影响
本实验中,各组对虾的生长差异并不显著,与李桂英等[20]的研究结果不同,这可能是由于实验时间较短造成的。弧菌组在实验过程中曾有2个平行出现了大量死亡的现象,其余4个平行的成活率与其他4个处理组并没有显著差异;而弧菌破碎组在养殖过程中并未出现大量死亡的现象,提示使用破碎弧菌更加安全。大部分溶藻弧菌被认为是一种条件致病菌,在环境条件变化或动物免疫力下降时可能会产生致病性[9]。此株溶藻弧菌处理的凡纳滨对虾有2组在养殖过程中出现大量死亡的原因尚不能确定,因此此株溶藻弧菌仍需要一定的安全性试验确认其安全性才能进一步投入使用。
3.2 溶藻弧菌和芽孢杆菌对凡纳滨对虾消化酶的影响
冯雪等在草鱼和银鲫的肠道菌群中发现了产蛋白质酶和淀粉酶的弧菌和芽孢杆菌[21]。De Schrijver等发现在饲料中添加解蛋白弧菌(Vibrioproteolyticus)能够提高大菱鲆的蛋白消化效率[22]。实验证明,在饲料中添加芽孢杆菌或外源微生物酶能够促进提高的肠道消化酶活性[23-24]。本实验4个菌添加处理组的肠道蛋白酶活力都显著高于对照组(P<0.05),养殖过程中各组肠道蛋白酶活力均有所上升,支持上述结论。杆菌组肠道蛋白酶活力显著低于杆菌破碎组并且显著低于弧菌组,说明芽孢杆菌和溶藻弧菌的胞外酶可能存在较大的差异,芽孢杆菌的胞内产物能更好的提高肠道蛋白酶活力。4个菌处理组的肝胰脏淀粉酶活力均显著低于对照组,弧菌组和杆菌组的肝胰脏蛋白酶活力在49d时显著高于其他各组,其他各组无显著差异。刘波用地衣芽孢杆菌投喂异育银鲫发现,地衣芽孢杆菌能够提高肠道消化酶活力,对肝胰脏蛋白酶活力无影响,显著降低肝胰脏淀粉酶活力[25],本实验结果与之一致。这可能是由于细菌随饲料进入肠道,无法直接作用到肝胰脏,同时肠道和肝胰脏的消化酶活力可能存在着一定相互作用关系,导致肝胰脏的淀粉酶活力下降。
弧菌破碎组和杆菌破碎组的肠道淀粉酶活力变化趋势与对照组相似,弧菌组和杆菌组的淀粉酶活力在49d时下降,显著低于对照组(P<0.05)。破碎杆菌组的肠道淀粉酶活力始终最高。说明饲料中添加溶藻弧菌和芽孢杆菌活菌以及破碎菌体均能提高对虾肠道的淀粉酶活性,添加芽孢杆菌和溶藻弧菌活菌在短期内具有一定效果,添加破碎菌体有效时间更长,添加破碎杆菌效果最好。曹煜成在凡纳滨对虾消化酶的体外实验中发现,一定量的地衣芽孢杆菌胞外酶能够提高对虾肠道淀粉酶活力,当外源酶添加量大于0.02U/mg时,肠道淀粉酶随着添加量的上升而降低[26]。饲料中添加活菌的处理组在养殖后期肠道淀粉酶活力下降可能是由于持续投喂添加活菌的饲料导致肠道外源酶过多造成的。
刘成荣发现在饲料中添加嗜水气单胞菌的脂多糖和绣球菌菌多糖能够提高泥鳅的免疫功能和消化功能[27]。很多糖类物质如壳聚糖[28]、低聚木糖[29]、葡聚糖和甘露寡糖[30]等被证明添加到饲料中能够促进甲壳动物的消化酶活力。本实验中,破碎菌处理组的肠道消化酶活性均高于活菌处理组,显示破碎菌体对肠道消化酶的促进作用优于活菌的胞外酶,其中破碎菌中的多糖类物质可能具有一定作用功效。芽孢杆菌BZ5株及溶藻弧菌VZ5株菌胞内多糖成分对对虾消化酶活力的影响值得进一步探讨。
3.3 溶藻弧菌和芽孢杆菌对凡纳滨对虾非特异性免疫的影响
酚氧化酶酶原激活系统在对虾的非特异性免疫中承担着识别异物、激活细胞免疫和体液免疫的作用[31]。SOD是甲壳动物中重要的抗氧化酶,可以清除体内的活性氧及其自由基,与机体的抗应激性、抗逆性具有较大的相关性[32]。对虾受到环境胁迫或病原菌感染时,SOD和PO先上升后下降并达到稳定水平,可能高于、低于或等于正常水平,这一过程一般是在48h内完成的[33-35]。本实验中,弧菌组SOD水平显著高于对照组而PO水平与对照组无显著差异,杆菌组则与之相反。说明这2株细菌分别对凡纳滨对虾的SOD和PO具有长期而稳定的影响。提示BZ5株和XZ5株对对虾免疫的影响途径可能有所不同。
3.4 溶藻弧菌和芽孢杆菌对凡纳滨对虾抗病力的影响
各组对虾的半致死时间为杆菌破碎组>弧菌破碎组>弧菌组>杆菌组>对照组。李桂英[20]在用坚强芽孢杆菌和美人鱼发光杆菌投喂南美白对虾的实验中发现,投喂益生菌能显著提高南美白对虾的非特异性免疫酶活性和抗病力。刘君等[8]在实验中也发现投喂芽孢杆菌能显著提高凡纳滨对虾抵抗WSSV的能力。本实验发现溶藻弧菌VZ5株的活菌对于凡纳滨对虾抗病力的提高效果要高于芽孢杆菌BZ5活菌,同时发现饲料添加破碎菌体能比添加活菌更好地提高对虾的抗病力。一般认为在饲料中添加细菌是通过以下几个方面提高养殖动物的抗病力:(1)建立优势菌群,通过细菌间的拮抗作用抑制有害菌的生长,减少发病率[36-37]。(2)菌体本身或分泌的酶类、氨基酸、糖类等代谢物为养殖动物提供了营养,通过改善养殖动物的体质来减少动物的发病率[38]。(3)细菌本身能够刺激养殖动物的免疫系统,或能产生某些免疫调控物质提高对象的免疫水平从而提高养殖动物的抗病力[39]。本实验中破碎细菌能够比活菌更好的提高对虾的抗病力,这提示来自于细菌菌体内部的某些活性成分可能具有促进对虾抗病力的作用。
4 结论
饲料中添加芽孢杆菌和溶藻弧菌及其破碎菌体均能在一定程度上提高对虾的消化、免疫相关酶水平和抗病力。其中添加弧菌破碎菌体能更好的提高对虾的非特异性免疫水平,添加杆菌破碎菌体能更好的提高对虾消化水平和抗病力,破碎弧菌相较于弧菌活菌有更好的安全性。在养殖生产中添加破碎菌体能够达到较好的效果,并在生态环境保护和养殖安全方面有实际应用价值。
[1] 黄凯, 王武. 南美白对虾国外养殖发展概况及我国养殖现状, 存在的问题与对策 [J]. 内陆水产, 2002, 8: 11-14.
[2] 王立新. 我国南美白对虾养殖现状 [J]. 中国渔业经济, 2001, 5: 22-23.
[3] 胡毅, 谭北平, 麦康森,等. 饲料中益生菌对凡纳滨对虾生长、肠道菌群及部分免疫指标的影响 [J]. 中国水产科学, 2008, 15(2): 244-251.
[4] Rengpipat S, Phianphak W, Piyatiratitivorakul S, et al. Effects of a probiotic bacterium on black tiger shrimp(Penaeusmonodon) survival and growth [J]. Aquaculture, 1998, 167(3): 301-313.
[5] Ochoa-Solano J L, Olmos-Soto J. The functional property ofBacillusfor shrimp feeds [J]. Food Microbiol, 2006, 23: 519-525.
[6] Vaseeharan B, Ramasamy P. Control of pathogenic Vibrio spp. by Bacillus subtilis BT23, a possible probiotic treatment for black tiger shrimp Penaeus monodon [J]. Letters in Applied Microbiology, 2003, 36(2): 83-87.
[7] Rengpipat S, Rukpratanporn S, Piyatiratitivorakul S, et al. Immunity enhancement in black tiger shrimp (Penaeusmonodon) by a probiont bacterium (BacillusS11) [J]. Aquaculture, 2000, 191: 271-288.
[8] 刘君, 宋晓玲, 刘莉, 等. 2 株消化道优势菌对凡纳滨对虾免疫酶活性和抗白斑综合征病毒感染力的影响 [J]. 水产学报, 2012, 36(3): 444-450.
[9] 陈强, 鄢庆枇, 马甡. 藻弧菌致病性研究进展 [J]. 海洋科学, 2006, 30(8): 84-89.
[10] Garriques D, Arevalo G. An evaluation of the production and use of a live bacterial isolate to manipulate the microbial flora in commercial production of Penaeus vannamei postlarvae in Ecuador[C]. Browdy C L, Hopkins J S ed. Swimming through Troubled Water. Proceedings of the Special Session on Prawn Farming, Aquaculture'95. San Diego USA: World Aquaculture Society, 1995: 53-59.
[11] Gatesoupe F J. Siderophore production and probiotic effect of Vibrio sp. associated with turbot larvae, Scophthalmus maximus [J]. Aquat Living Resour, 1997, 10: 239-246.
[12] 单洪伟. 底质改良及固定化微生物技术对对虾养殖环境的调控[D]. 青岛: 中国海洋大学, 2013: 47-68.
[13] 李桂英. 对虾肠道益生菌对凡纳滨对虾非特异免疫力和抗病力影响的研究[D]. 青岛: 中国海洋大学, 2011.
[14] 王秀华, 黄健, 宋晓玲. 免疫增强剂一肽聚糖在对虾养殖中的应用 [J]. 海洋水产研究, 2003, 24(1): 69-74.
[15] 路景涛, 陈敏珠. 复方黄芪提取物对细菌脂多糖诱导大鼠腹腔巨噬细胞分泌 TNFα, NO 及 IL-1 的影响 [J]. 安徽医药, 2006, 10(5): 330-331.
[16] 付文卓. 两株益生菌对鸡胚肠细胞 NO, IFN-γ 产生的影响[D]. 哈尔滨: 东北农业大学, 2010.
[17] 史成银, 黄健, 宋晓玲. 对虾皮下及造血组织坏死杆状病毒单克隆抗体的ELISA 快速检测 [J]. 中国水产科学, 1999, 6(3): 116-118.
[18] Ashida M. Purification and characterization of pre-phenoloxidase from hemolymph of the silkworm Bombyx mori [J]. Archives of Biochemistry and Biophysics, 1971, 144(2): 749-762.
[19] Hultmark D, Steiner H, Rasmuson T, et al. Insect immunity. Purification and properties of three inducible bactericidal proteins from hemolymph of immunized pupase of Hyalophera cecropia [J]. Eur Biochen, 1980, 10(6): 7-16.
[20] 李桂英, 宋晓玲, 孙艳, 等. 几株肠道益生菌对凡纳滨对虾非特异免疫力和抗病力的影响 [J]. 中国水产科学, 2011, 18(6): 1358-1367.
[21] 冯雪, 吴志新, 祝东梅, 等. 草鱼和银鲫肠道产消化酶细菌的研究 [J]. 淡水渔业, 2008, 1(3): 51-57.
[22] De Schrijver R, Ollevier F. Protein digestion in juvenile turbot (Scophthalmus maximus) and effects of dietary administration of Vibrio proteolyticus [J]. Aquaculture, 2000, 186(1): 107-116.
[23] 叶元土, 张勇, 张宇, 等. 酶制剂 EA-Ⅱ 和生物制剂 BA-Ⅰ 对鲤肠道, 肝胰脏的蛋白酶和淀粉酶活力的影响 [J]. 大连水产学院学报, 1993, 8(1): 79-82.
[24] 丁贤, 李卓佳, 陈永青, 等. 芽孢杆菌对凡纳滨对虾生长和消化酶活性的影响 [J]. 中国水产科学, 2004, 11(6): 580-584.
[25] 刘波, 刘文斌, 王恬. 地衣芽孢杆菌对异育银鲫消化机能和生长的影响 [J]. 南京农业大学学报, 2006, 28(4): 80-84.
[26] 曹煜成, 李卓佳, 冯娟, 等. 地衣芽孢杆菌 De 株之胞外产物对凡纳滨对虾淀粉酶活性影响的体外研究 [J]. 台湾海峡, 2007, 26(4): 536-5421.
[27] 刘成荣, 陈振平, 张之文. 嗜水气单胞菌脂多糖及绣球菌多糖对泥鳅免疫功能及消化功能的影响 [J]. 海洋科学, 2008, 32(12): 1-9.
[28] 任秀芳, 周鑫, 赵朝阳, 等. 壳聚糖对克氏原螯虾生长, 血清相关免疫因子, 肌肉成分和消化酶的影响 [J]. 大连海洋大学学报, 2013, 28(5): 468-474.
[29] 陈晓瑛, 曹俊明, 王国霞, 等. 芽孢杆菌和低聚木糖对凡纳滨对虾生长和消化酶活力的影响 [J]. 饲料工业, 2011, 32(20): 18-22.
[30] 谭崇桂, 冷向军, 李小勤, 等. 多糖, 寡糖, 蛋白酶对凡纳滨对虾生长, 消化酶活性及血清非特异性免疫的影响 [J]. 上海海洋大学学报, 2013, 22(1): 93-99.
[31] 李光友. 中国对虾疾病与免疫机制 [J]. 海洋科学,1995(4): 1-3.
[32] 孔祥会,王桂忠,艾春香,等. 锯缘青蟹不同器官组织中总抗氧化能力和SOD活性的比较研究 [J]. 台湾海峡,2003: 469-474.
[33] 章跃陵, 王三英, 刘光明, 等. 南美白对虾血蓝蛋白对酚氧化酶活性的影响 [J]. 中国水产科学, 2005, 12(4): 402-406.
[34] 姜令绪, 潘鲁青, 肖国强. 氨氮对凡纳对虾免疫指标的影响 [J]. 中国水产科学, 2004, 11(6): 537-541.
[35] 赵先银, 李健, 陈萍, 等. pH 胁迫对 3 种对虾存活率, 离子转运酶和免疫酶活力的影响 [J]. 上海海洋大学学报, 2011, 20(5): 720-728.
[36] 徐致远. 乳杆菌的肠道定殖和菌群调节作用研究 [D]. 无锡: 江南大学, 2006.
[37] 潘康成, 陈正礼, 崔恒敏, 等. 利用 ERIC-PCR 和 PCR-DGGE 技术分析喂服枯草芽孢杆菌肉鸡肠道菌群的多样性 [J]. 动物营养学报, 2010(4): 985-991.
[38] 权小芳, 马晓丰, 田维熙. 光合细菌对动物的营养作用及对动物疾病的防治作用 [J]. 中国动物保健, 2011(2): 27-30.
[39] 顾笑梅, 孔健, 王富生, 等. 一株乳酸菌所产胞外多糖对荷瘤小鼠机体免疫功能影响的研究 [J]. 微生物学报, 2003, 43(2): 251-256.
责任编辑 朱宝象
Effects of Bacillus sp. and Vibrio alginolyticus on the Activities of Digestive and Immune Enzymes Disease Resistance of Litopenaeus vannamei
XU Yu-Jie,SHAN Hong-Wei,MA Shen
(The Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China )
A 49-day feeding experiment was conducted to evaluate the effects of different bacteria on the activities of peroxidase (POD), superoxide dismutase (SOD) and phenoloxidase (PO) and the resistance of shrimp (Litopenaeusvannamei) with an initial body weight of 3.58±0.32g. Shrimps were fed five diets including the basic pellet, livingBacillus(the basic pellet supplemented withBacillussp. BZ5), livingVibrio(the basic pellet supplemented withVibrioalginolyticusVZ5), deadBacillus(the basic pellet supplemented with brokenBacillussp.), and deadVibrio(the basic pellet supplemented with brokenVibrioalginolyticus). The bacterial dosage supplemented in diets was 108CFU/g diet. Diets with bacterial supplementation improved the activity of protease and amylase in intestine in 25 days (P<0.05). After 49 days, the amylase activity in intestine of shrimps feeding livingand deadVibriosupplemented diets is significantly higher than that of control. The activities of Intestine digestive enzymes of shrimps feeding deadBacillussupplemented diets were higher than those of shrimps feeding livingBacillussupplemented diets. After 49 days, SOD of shrimps feeding livingVibriosupplemented diets was significantly improved, and SOD, PO and bacterial resistance of shrimps feeding deadVibriosupplemented diets were significantly improved. Phenol oxidase of shrimps feeding livingBacillussupplemented diets was significantly higher than that of control while the activity of immune enzymes dropped significantly. The activities of SOD and PO of shrimps feeding deadBacilluswere significantly improved while those of immune enzymes dropped significantly. When challenged by WSSV, the half lethal time of shrimps feeding with deadBacillussupplemented diets was longer than those feeding with deadVibriosupplemented diets, livingVibriosupplemented diets and livingBacillussupplemented diets in an descending order. The results suggested that the diet supplemented with livingVibrioandBacillusimproved the activities of Intestinal digestive enzymes, immunity of shrimp and the disease resistance of shrimps. DeadVibriowas better than others in improving the immunity of shrips while deadBacilluswasbetter in inproving the activity of digestive enzymes and disease resistance.
Litopenaeusvannamei;Bacillus;Vibrioalginolyticus; digestive enzyme; immunity
农业部公益性行业科研专项经费项目(201103034)资助
2014-01-26;
2014-04-10
许玉洁(1988-),女,硕士生。E-mail: xyjouc@163.com
** 通讯作者: E-mail: mashen@ouc.edu.cn
S917.4
A
1672-5174(2015)05-046-08
10.16441/j.cnki.hdxb.20140031

