不同产地加工方法对太子参质量的影响
吴增光,冯 果,2* ,刘 文,李 玮,张建锋,张石宇,郑雪莹
(1.贵阳中医学院,贵州贵阳550002;2.天津中医药大学,天津300193)
太子参为石竹科植物孩儿参Pseudostellaria heterophylla(Miq.)Pax ex Pax et Hoffm.的干燥块根,具有益气健脾、生津润肺的功效,用于脾虚体倦、食欲不振、病后虚弱、气阴不足、自汗口渴、肺燥干咳[1]。现代研究发现,太子参含有氨基酸、多糖、苷类、磷脂类、环肽类、挥发油等多种有效成分[2-9],具有心肌保护作用、增强机体免疫作用、抗氧化作用、镇咳、抗菌、抗病毒、抗应激、抗疲劳、降血糖等多种药理作用[10-16]。
产地加工是形成中药品质的重要环节,不同的加工方法对太子参中主要化学成分的影响不同,2010年版《中国药典》一部收载太子参的加工方法为“夏季茎叶大部分枯萎时采挖,洗净,除去须根,置沸水中略烫后晒干或直接晒干”[1],各地尚有晒干法、烫后晒干法、蒸后晒干法、阴干法、烘干法等加工方法,太子参产地加工方法的优选亟需进一步研究。该研究以皂苷、多糖、氨基酸、水溶性浸出物、醇溶性浸出物为评价指标,采用综合评分法优选太子参的最佳产地加工方法,为太子参的产地加工及质量控制提供参考。
1 材料与方法
1.1 仪器 TU-1810PC型紫外可见分光光度计(北京普析通用仪器有限责任公司)、AE/240型电子天平(上海梅特勒仪器有限公司)、AVY 220型电子天平(日本岛津)、SK 8210 HP型超声波清洗机(上海科导仪器有限公司)、干燥箱(中华人民共和国上海市仪器总厂)。
1.2 药材与试药 太子参鲜药材来源于贵州省施秉县太子参种植基地,经贵阳中医学院李伟副教授鉴定为石竹科植物孩 儿 参 Pseudostellaria heterophylla(Miq.)Pax ex Pax et Hoffm.的干燥块根;葡萄糖对照品(贵州迪大生物科技有限责任公司,批号GZDD-0774)、精氨酸对照品(贵州迪大生物科技有限责任公司,批号GZDD-0886,供含量测定用)、人参皂苷Rg1对照品(中国食品药品检定研究院,批号110703-201529,供含量测定用);其余试剂为分析纯,水为蒸馏水。
1.3 产地加工方法
1.3.1 阴干法。采太子参鲜药材,洁净后置阴凉通风处阴干。
1.3.2 晒干法。采太子参鲜药材,洁净后置太阳下晒干。
1.3.3 烘干法。包括2种:①采太子参鲜药材,洁净后及时置干燥箱内于40、60、80、100℃烘干;②采太子参鲜药材,洁净后分别放置1、2、3、4、5 d 后,于60 ℃烘干。
1.3.4 蒸法。包括2种:①太子参鲜药材蒸透后,分别置干燥箱内于40、60、80、100 ℃烘干;②太子参鲜药材蒸 10、15、20 min后于60℃烘干。
1.3.5 烫法。可分为3 种方法:①分别加4、6、8、10、12 倍量水烫透后,于60℃烘干。②加8倍量水烫3 min后分别于40、60、80、100 ℃ 烘干;③加 8 倍量水分别烫 5、9 min,于60℃烘干。
1.4 指标成分的提取
1.4.1 皂苷的提取。精密称取太子参粗粉1 g,加入10倍量水饱和正丁醇后,浸泡12 h,50℃下超声提取40 min,过滤至25 ml容量瓶中,加水饱和正丁醇溶解并稀释至刻度,摇匀,即得。
1.4.2 多糖的提取。精密称取1 g用10 ml蒸馏水浸泡24 h,超声提取2次,每次30 min,过滤,弃去残渣,合并滤液浓缩,用95%乙醇静置沉淀,过滤得到沉淀,将沉淀溶于丙酮中充分洗涤静置过夜,沉淀再次溶于无水乙醇中充分洗涤静置,待沉淀完全后将沉淀物置水浴锅中加热干燥,得到太子参多糖粗品。
1.4.3 氨基酸的提取。取太子参粉末0.05 g,精密称定,置具塞锥形瓶中,精密加70%乙醇25 ml,超声处理45 min,放冷,摇匀,滤过,收集续滤液,即得供试品溶液。
1.5 指标成分的含量测定
1.5.1 皂苷的含量测定。
1.5.1.1 对照品溶液的制备。精密称取人参皂苷Rg1对照品15 mg于10 ml容量瓶中,加入少量甲醇溶解并定容,即得1.5 mg/ml的对照品溶液。
1.5.1.2 线性关系考察。精密吸取标准溶液 0.2、0.4、0.5、0.6、0.8、1.0 ml,分别置于 10 ml具塞试管中,以1 ml甲醇作为空白,于沸水浴下挥去溶剂,精密加入5%的香草醛冰醋酸溶液(用前临时配制)0.2 ml和高氯酸0.8 ml混匀,密塞。置60℃水浴中加热15 min后取出,用流水冷却。然后精密加入冰醋酸5 ml,摇匀,于560 nm波长处测定吸光度,以吸光度值为纵坐标、浓度为横坐标,绘制标准曲线。
1.5.1.3 样品测定。按“1.4.1”制备供试品溶液,精密吸取供试品溶液0.3 ml,显色后于紫外可见分光光度计测定吸光度,计算其含量。
1.5.2 多糖的含量测定。
1.5.2.1 对照品溶液的制备。精密称取葡萄糖对照品1.36 mg,置于10 ml容量瓶中加水定容至刻度,摇匀即得浓度为0.136 mg/ml的葡萄糖对照品溶液。
1.5.2.2 线性关系考察。分别精密吸取 0.2、0.4、0.6、0.8、1.0、1.2 ml葡萄糖标准溶液于试管中,依次加入蒸馏水使终体积为2.0 ml,蒸馏水作空白对照。各管加入苯酚试液0.5 ml,摇匀,再滴加浓硫酸各 4.0 ml,沸水浴 15 min,取出放至室温,于490 nm处测定吸光度。以吸光度值为纵坐标、浓度为横坐标,绘制标准曲线。
1.5.2.3 样品测定。按“1.4.2”制备供试品溶液,精密吸取供试品溶液1.0 ml,显色后于紫外可见分光光度计测定吸光度,计算其含量。
1.5.3 氨基酸的含量测定。
1.5.3.1 对照品溶液的制备。精密称取精氨酸对照品5.02 mg置于10 ml容量瓶中加水至刻度,摇匀即得浓度为0.502 mg/ml精氨酸对照品溶液。
1.5.3.2 线性关系考察。精密吸取对照品溶液 0.5、1.0、1.5、2.0、2.5、3.0 ml于 10 ml量瓶中,加水至同体积,依次加入醋酸-醋酸钠缓冲液(pH=5.4)2.0 ml和3%茚三酮乙二醇溶液2.0 ml,沸水浴15 min,取出,加50%异丙醇至刻度,摇匀;另以3.0 ml水为空白,同法操作。在570 nm处测定吸光度,以吸光度值为纵坐标、浓度为横坐标,绘制标准曲线。
1.5.3.3 样品测定。分别取各样品按“1.4.3”制备供试品溶液,精密吸取供试品溶液1.0 ml,显色后于紫外可见分光光度计测定吸光度,计算其含量。
1.5.4 浸出物的测定。
1.5.4.1 水溶性浸出物。按2010年版《中国药典》附录XA水溶性浸出物测定方法(热浸法)对样品进行测定,计算水溶性浸出物的量。
1.5.4.2 醇溶性浸出物。按2010年版《中国药典》附录XA醇溶性浸出物测定方法(热浸法)对样品进行测定,计算醇溶性浸出物的量。
1.6 产地加工方法的优选 该试验采用多指标综合评分法[17]优选太子参的产地加工方法,以皂苷、多糖、氨基酸、水溶性浸出物、醇溶性浸出物含量为评价指标,且含量都是越高越好。因此在数据处理时引用一个综合指标“隶属度”,即指标隶属度=(指标值-指标最小值)/(指标最大值-指标最小值);根据各成分在太子参中的重要性,考虑到皂苷和多糖各占30%、氨基酸占20%、水溶性浸出物和醇溶性浸出物各占10%的权重,综合分数=皂苷隶属度×30%+多糖隶属度×30%+氨基酸隶属度×20%+水溶性浸出物隶属度×10%+醇溶性浸出物隶属度×10%,满分为1.00,计算各样品的综合评分值。
2 结果与分析
2.1 含量测定方法学考察结果
2.1.1 皂苷含量。以吸光度值为纵坐标、浓度为横坐标,绘制标准曲线,皂苷含量的回归方程为:A=29.088C-0.017 6,相关系数r=0.999 5,表明人参皂苷Rg1在0.01 ~0.16 mg/ml范围内线性关系良好;皂苷含量测定的精密度试验、稳定性试验、重复性试验的 RSD 分别为0.8%、1.2%、1.7%,均小于 3%;加样回收率试验,其平均回收率为98.66%,RSD为2.8%。
2.1.2 多糖含量。以吸光度值为纵坐标、浓度为横坐标,绘制标准曲线,多糖含量的回归方程为:A=5.378 3C-0.159 3,相关系数r=0.999 2,表明葡萄糖在0.041 8 ~0.251 0 mg/ml范围内线性关系良好;多糖含量测定的精密度试验、稳定性试验、重复性试验的RSD 分别为0.87%、0.94%、2.16%,均小于3%;加样回收率试验,其平均回收率为98.66%,RSD为2.06%。
2.1.3 氨基酸含量。以吸光度值为纵坐标、浓度为横坐标,绘制标准曲线,氨基酸含量的回归方程为:A=11.493C-0.041 9,相关系数r=0.9994,表明精氨酸在0.0251 ~0.1506 mg/ml范围内线性关系良好。氨基酸含量测定的精密度试验、稳定性试验、重复性试验的 RSD 分别为 0.09%、1.75%、2.61%,均小于3%;加样回收率试验,其平均回收率为100.02%,RSD为1.3%。
2.2 综合评分法优选最佳产地加工方法 按“1.5”项下各评价指标的含量测定方法对各样品的指标成分进行测定,并按“1.6”项下方法计算其综合评分值。从表1可得出,1号样品的产地加工方法为阴干法,综合评分值为0.401 5;2号样品为晒干法,综合评分值为0.657 1;3~12号样品为烘干法,其8号样品的综合评分值最高,为0.662 9;13~19号样品为蒸法,其19号样品的综合评分值最高,为0.746 4;20~30号样品为烫法,其24号样品的综合评分值最高,为0.601 6。在不同的产地加工方法中,以综合评分值的大小排序,从大到小的顺序为蒸法(0.746 4)﹥烘干(0.662 9)﹥晒干(0.657 1)﹥烫法(0.601 6)﹥阴干(0.401 5),表明太子参的最佳产地加工方法为蒸法,蒸法的最佳工艺为取太子参鲜药材,蒸20 min,于60℃烘干。
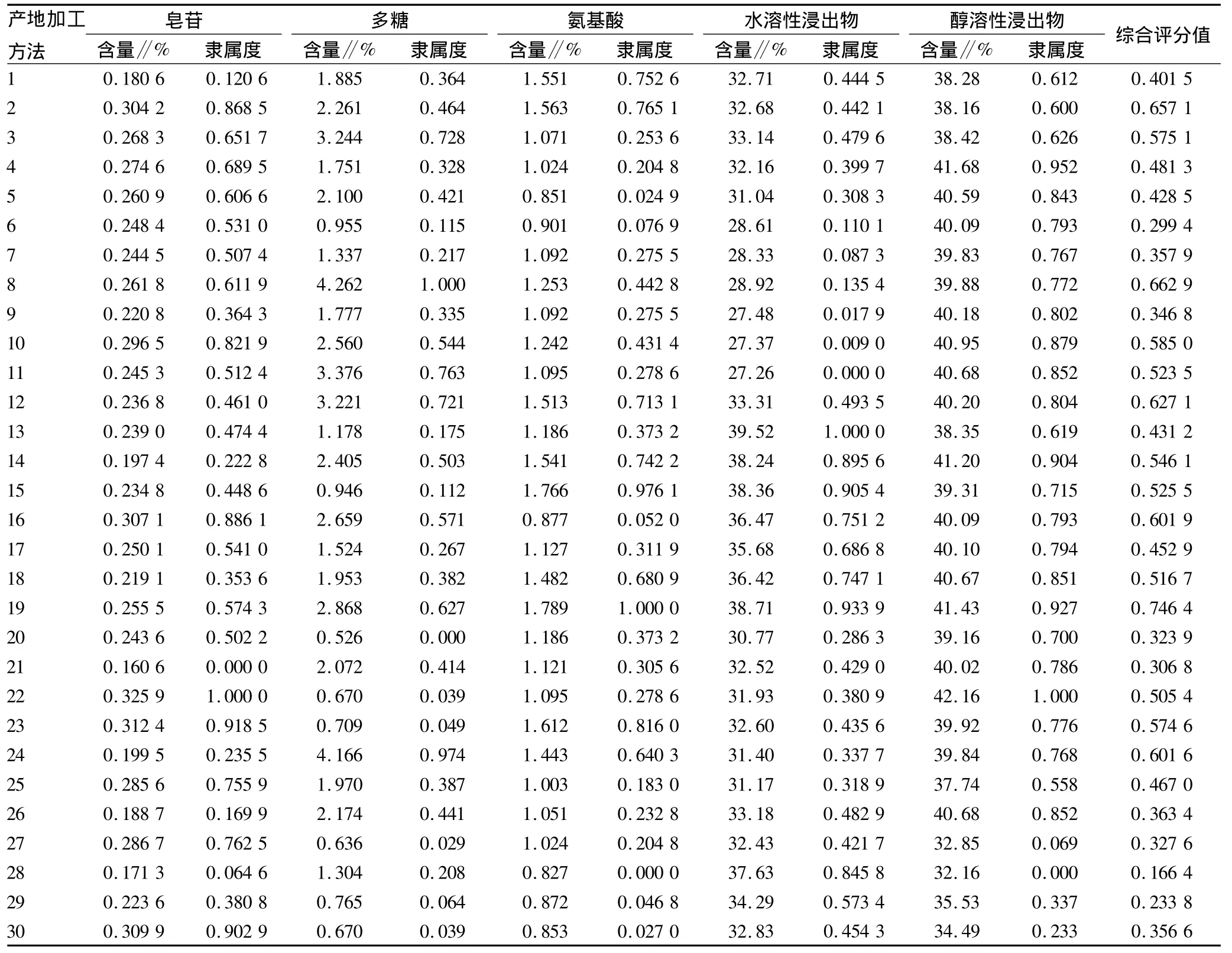
表1 不同产地加工方法对太子参药材质量的影响(n=3)
3 讨论
太子参中皂苷类成分容易受生物活性酶的影响;多糖类成分难溶或不溶于水,但容易被水解成低聚糖、单糖;氨基酸类成分易溶于水,且热稳定性差,长时间加热会导致成分的损失。故不同产地加工方法对太子参药材的质量有较大的影响,在产地加工过程中,应尽快灭活新鲜太子参中的酶的活性,严格控制干燥温度和时间是太子参产地加工的关键技术所在,也是影响太子参质量的主要因素。
多成分、多指标控制中药材质量已成为发展新趋势,是中药现代化发展进程中的必然要求。该研究以太子参皂苷、多糖、氨基酸、水溶性浸出物、醇溶性浸出物作为指标成分,采用综合评分法对太子参的产地加工方法进行优选,所优选出的方法科学合理,其加工工艺简单、耗时短、加工出的药材色泽和品质好,综合评分值较高,使太子参的质量从源头上得到了控制。该产地加工方法的优选对企业及药农的规模化、产业化加工太子参药材具有一定的指导意义。
[1]国家药典委员会.中华人民共和国药典:2010年一部[S].北京:中国医药科技出版社,2010:62-63.
[2]钟方晓,彭广.山东太子参氨基酸和微量元素分析[J].时珍国医国药,1997,8(3):223 -224.
[3]刘训红,阚毓铭,王玉玺,等.太子参多糖的研究[J].中草药,1993,24(3):119-121.
[4]王吉星,徐绥绪,邱峰,等.太子参化学成分的研究[J].中草药,1992,23(6):331,336.
[5]TAN N H,ZHOU J,CHEN C X,et al.Cyclopeptides from the roots of Pseudostellaria heterophylla[J].Phytochemistry,1993,32(5):1327 -1330.
[6]MORITA H,KAYASHITA T,TAKEYA K,et al.Cyclic peptides from higher plants,Part 15.Pseudostellarin H,a new cyclic octapeptide from Pseudostellaria heterophylla[J].JNat Prod,1995,58(6):743 -947.
[7]MORITA H,KAYASHITA T,TAKEYA K,et al.Crystal and solution forms of a cyclic heptapeptide,pseudostellarin D[J].Tetrahedron,1995,51(46):12539-12548.
[8]马阳,侯娅,邹立思,等.不同种质太子参核苷类成分QTRAP LC-MS/MS 分析[J].中药材,2015,38(4):711 -714.
[9]刘义宁,易骏,陈体强.太子参挥发油化学成分研究[J].时珍国医国药,2009,20(1):50 -51.
[10]徐雪琴,龙全江,赵剑.太子参化学成分、药理作用与产地加工技术研究[J].现代中药研究与实践,2014,28(4):73 -75.
[11]龚祝南,王峥涛,余国奠,等.8个不同产地太子参对脾虚及免疫功能的影响[J].中药材,2004,24(4):281 -282.
[12]刘维俊,黄光才,李汉宝,等.太子参补益作用机理的探讨[J].南京部队医药,1992(5):51-58.
[13]SHENG R,XU X X,TANG Q,et al.Polysaccharide of Radix Pseudostellariae improves chronic fatigue syndrome induced by poly I:C in mice[J].Evid Based Complement Alternat Med,2011,8(4):1 -10.
[14]ZHANGCL,ZHENGX X.Effects of polysaccharides from Pseudostellaria heterophylla on exercise endurance capacity and oxidative stress in forced swimming rats[J].Sci Res Essays,2011,6(11):2360 -2365.
[15]PANG W,LIN S,DAI Q,et al.Antitussive activity of Pseudostellaria heterophylla(Miq.)Pax extracts and improvement in lung function via adjustment of multi- cytokine levels[J].Molecules,2011,16(4):3360 -3370.
[16]姚先梅,段贤春,吴健,等.太子参多糖对实验性糖尿病大鼠血糖、血脂代谢和肾脏病理的影响[J].安徽医药,2014,18(1):23 -26.
[17]陈会英,周衍平.综合评分法的改进与应用[J].农业系统科学与综合研究1996,12(1):37 -41.

