温度对沉积物中绿藻微观繁殖体萌发的影响
刘湘庆,王宗灵,李 艳*,宋 伟,范士亮 ,李瑞香,张学雷
(1.国家海洋局 第一海洋研究所,山东 青岛 266061; 2.中国海洋大学 环境科学与工程学院,山东 青岛 266100)
温度对沉积物中绿藻微观繁殖体萌发的影响
刘湘庆1,2,王宗灵1,2,李 艳1,2*,宋 伟1,范士亮1,李瑞香1,张学雷1
(1.国家海洋局 第一海洋研究所,山东 青岛 266061; 2.中国海洋大学 环境科学与工程学院,山东 青岛 266100)
对黄海浒苔绿潮的研究表明,苏北浅滩及其附近海域是每次绿潮早期发展的重要区域,石莼目绿藻微观繁殖体在该水域大量存在。为研究海水温度对其萌发和生长的影响,我们利用2012-10在江苏近岸如东紫菜养殖区采集的沉积物样品,在实验室进行不同温度梯度条件(5,10,15,20,25和30 ℃)绿藻微观繁殖体的培养实验,并通过PCR-RFLP方法鉴定繁殖体幼苗的种类,分析温度对不同种绿藻微观繁殖体萌发的影响。结果表明:5 ℃的低温条件下,繁殖体均不能萌发。10~30 ℃,随温度的升高繁殖体萌发数量呈先增加后降低的趋势。15和20 ℃时,萌发数量出现高值,分别平均为17.0和15.8株/g。在研究区域沉积物中绿藻微观繁殖体萌发种类有浒苔、缘管浒苔、盘苔和Ulvasp.1,其萌发数量的平均值分别为13.7,6.0,2.0和15.4株/g。其中,浒苔萌发数量随温度的升高先升高后降低,在15 ℃时达到最高值为31.2株/g。缘管浒苔在10~20 ℃萌发数量相对较高, 25 ℃时极低(仅为1.6株/g),而5和30 ℃时都未能萌发;Ulvasp.1在10~30 ℃数量变化不明显,一直保持较高值在15.0株/g左右;盘苔萌发数量一直较低,在各温度下均小于3.0株/g。据估算,在苏北浅滩紫菜养殖区(约200 km2)表层沉积物中约有9.8×1013株微观繁殖体,形成一个巨大的“种子库”,这将为黄海浒苔绿潮溯源提供数据支撑。
微观繁殖体;绿潮;温度;沉积物;苏北浅滩
绿藻微观繁殖体是孢子、配子、合子以及显微个体的统称[1-2]。自2007年以来,我国黄海海域每年均不同程度地暴发浒苔绿潮,并且每次起初发现海面漂浮绿藻都位于江苏近岸海域[3-4]。该海域是江苏紫菜养殖的主要海域,整个紫菜养殖区占地约200 km2[5]。方松等[6]研究表明,该区域温度月平均变化范围在1.8~26.6 ℃,季节性温差变化非常大。而且该区域属于露漫滩,每天平均有4~6 h会暴露在空气中,沉积环境温度有别于其他区域,受气温影响比较显著。
微观繁殖体在绿藻的繁殖和生长中起着非常重要的作用。Worm等[7]人在波罗的海沿岸通过对大型藻类的生长试验表明,繁殖体库的存在明显影响具有快速增殖能力的一年生海藻种群数量。方松等[8]认为微观繁殖体在适宜的环境条件下,就会附着萌发生长成幼苗。Gao等[9]认为浒苔微观繁殖体能够附着在绿藻成体上生长,并对漂浮浒苔生物量增加有很大的影响。张华伟等[10]认为微观繁殖体的大量萌发会使藻体的生物量增加。并且在现场调查中发现在成熟的浒苔藻体上附着有萌发的浒苔幼苗。而温度等环境因子对于浒苔属绿藻微观繁殖体的萌发具有重要影响[7,11]。王建伟等[12]认为温度对水体中浒苔微观繁殖体的萌发具有显著影响。
目前对苏北浅滩紫菜养殖区沉积物中繁殖体的研究少有报道,尤其是对沉积物中绿藻微观繁殖体的数量及种类组成、温度对绿藻微观繁殖体萌发的影响缺少清晰的认识。我们通过研究不同温度对苏北浅滩紫菜养殖区域沉积物中绿藻微观繁殖萌发数量及萌发出的幼苗种类的影响,分析沉积物中绿藻微观繁殖体的现状,并探讨温度对于微观繁殖体室内萌发生长的影响,以期为江苏紫菜养殖筏架上定生绿藻来源提供理论基础,为探讨绿藻微观繁殖体“越冬和度夏”机制提供具体数据支撑。
1 材料与方法
1.1 研究海区和站位布设
2012-10沉积物采样,站位于苏北浅滩紫菜养殖区,A站(小洋口)(121°5′23″E,32°40′53″N)、B站(高泥)(121°15′E,32°51′N)、C站(泥螺沙)(121°10′18″E,33°13′27″N),分别代表3个主要的紫菜养殖区域(图1)。
1.2 沉积物样品采集
沉积物样品采用插管取样方法,即待潮水退去后露出底泥,用取样管(底面积7 cm2,高度7.5 cm)采集表层沉积物。每个站位取3个平行样,用铝箔包裹后4 ℃低温保存,带回实验室处理。
1.3 微观繁殖体培养与计数
首先将取样管中的沉积物置于玻璃培养皿中,于25倍体式显微镜(Leica S6E)下观察并去除绿藻藻体片段。然后,称取10 g(约7 cm3)沉积物放入盛有500 mL灭菌海水(S为32)的烧杯中,加入0.5 mL二氧化锗(质量浓度为0.5 mg/cm3)水溶液和10 mL PES培养液(Provasoli’s enriched Seawater Medium)[13],然后转入光照强度为120 μmol/(m2·s)、光暗周期为12L∶12D的培养箱中培养。我们共设计6个温度梯度(5,10,15,20,25和30 ℃),每个温度下设计3个平行样。培养15 d左右就能观察到烧杯底和烧杯壁上生长的绿藻幼苗,长度为1~3 cm,并记录每个烧杯中绿藻的幼苗数量。
1.4 DNA提取、PCR扩增和RFLP分析
从每个烧杯中随机选取10~15株绿藻幼苗进行分子检测,确定其属种,共计140个样品。首先将绿藻藻体用去离子水漂洗3次。然后,用EZNATM HP植物DNA试剂盒提取植株DNA。
根据Leskinen和Hayden等人的方法[14-15]进行ITS序列的扩增,其中包括ITS1,5.8S和ITS2的扩增。由于ITS序列的多态性[16]不能够区分LPP进化枝(linza-prolifera-procera)中的U.prolifera和U.linza的分支,因此根据Lin等[17]使用的引物对5S间隔区进行扩增:正向5'-GGTTGGGCAGGATTAGTA-3'和反向5'-AGGCTTAAGTTGCGAGTT-3'。ITS和5S区域的PCR产物分别用质量分数为1%和2%的琼脂糖凝胶分离,通过5S rDNA间隔区可以区分出缘管浒苔和浒苔种[18]。
ITS PCR扩增的产物分别经4种限制性内切酶BspT107 I,EcoO109 I,Hin1 I and VpaK11B I酶切成小片段,并通过质量分数为3%琼脂糖凝胶电泳分离,在紫外光下显色,根据ITS序列的RFLP电泳图谱区分不同的绿藻种类[18]。
2 结 果
2.1 微观繁殖体的萌发数量
不同温度下绿藻微观繁殖体萌发数量明显不同,5 ℃的低温条件下,A,B,C三个站位表层沉积物中的绿藻微观繁殖体均不能萌发生长。10 ℃时,绿藻微观繁殖体萌发数量为2.4~13.4株/g,其平均值为7.9株/g;15 ℃时,为5.5~27.9株/g,其平均值为17.0株/g;20 ℃时,为7.6~18.9株/g,其平均值为15.8株/g;25 ℃时,为1.7~12.3株/g,其平均值为8.7株/g;30 ℃时,为2.3~12.0株/g,其平均值为7.7株/g。在10~30 ℃,沉积物中绿藻微观繁殖体萌发数量呈现出随着温度的升高先增多后减少的趋势,在15 ℃和20 ℃较适宜其萌发(图2)。
在不同站位繁殖体萌发数量也表现出一定差异,A站位绿藻微观繁殖体萌发数量在20 ℃时出现最大值(7.6株/g),平均值为3.9株/g;B站位也在20 ℃时出现最大值(21株/g),平均值为13.5株/g。C站位则在15 ℃时出现最大值(27.9株/g),平均值为16.9株/g。

图2 微观繁殖体的萌发数量Fig.2 Germinating number of microscopic propagules in different sampling stations
2.2 温度对不同种绿藻微观繁殖体萌发的影响
通过PCR-RFLP分析,鉴别出浒苔(Ulvaprolifera)、缘管浒苔(Ulvalinza)、盘苔(Blidingiasp.)和Ulvasp.1共四种绿藻(图3a中5,8和9为LPP分支,2,4,6和7为Ulvasp., 1,3为盘藻;图3b中2和3为浒苔,4和5为缘管浒苔)。其萌发数量的平均值分别为13.7,6.0,2.0和15.4株/g。
5 ℃的低温条件下,绿藻微观繁殖体均不能萌发生长。10 ℃时,浒苔、缘管浒苔和Ulvasp.1的萌发数量分别为7.8,6.6和11.6株/g。15 ℃时,浒苔的萌发数量迅速增加达到31.2株/g,为6个温度梯度下的最高值;其次是Ulvasp.1,为15.8株/g,较10 ℃略有上升;而缘管浒苔仅为4.1株/g,略有下降。20 ℃时,浒苔的萌发数量减少到19.5株/g,而缘管浒苔上升至11.9株/g,Ulvasp.1较平稳为16.2株/g。25 ℃时,浒苔的萌发数量继续下降,为8.6株/g;缘管浒苔也迅速下降,为1.6株/g;Ulvasp.1保持稳定,为14.3株/g;盘苔较低,为1.6株/g。30 ℃时,浒苔的萌发数量持续降低,为1.4株/g;缘管浒苔为零,已不适宜其萌发;Ulvasp.1略有上升,为19.2株/g;盘苔也有小范围上升,为2.5株/g。
浒苔繁殖体萌发数量随温度的变化呈现先升高后降低的正态分布。缘管浒苔萌发数量随温度的变化略有波动,在10~20 ℃时的数量较高,而在高温环境中其萌发数量较低或不萌发。Ulvasp.1的萌发数量受温度变化的影响较小,在10~30 ℃萌发数量稳定在11.6~19.2株/g。盘苔仅在25 ℃和30 ℃时能够萌发生长,但萌发数量较少。

图3 4种绿藻的RFLP分析结果Fig.3 The RFLP results of four green algae

图4 不同温度对绿藻繁殖体萌发数量的影响Fig.4 Effect of different temperatures on germinating number of microscopic propagules
3 讨 论
3.1 温度对绿潮微观繁殖体萌发的影响
对大型绿藻的研究表明,温度对于绿藻的生长率有至关重要的作用[19-20],且不同种类对温度的喜好表现略有差异。吴洪喜等[21]研究水温对浒苔的影响发现,浒苔系温带海藻,生长适宜水温为10~30 ℃,最适水温为15~25 ℃。张晓红等[22]人对浒苔生长率的研究证实,在20 ℃其特定生长率达到最高。Kim等[23]通过温度对缘管浒苔的研究表明,在10~15 ℃的低温条件下藻体具有较高的光合速率。Taylor等[19]研究温度等环境因子对大藻生长率的影响表明,缘管浒苔在10~20 ℃的生长率较高,25 ℃以上生长率明显降低。Deng等[24]对硬毛藻属Chaetomorpha大型绿藻的研究表明,其在21~29 ℃的条件下最适C.valida的生长。不同温度条件下,浒苔、缘管浒苔和C.valida生长率比较结果明确显示,15~25 ℃浒苔的生长率明显高于其他大型绿藻(图5)。
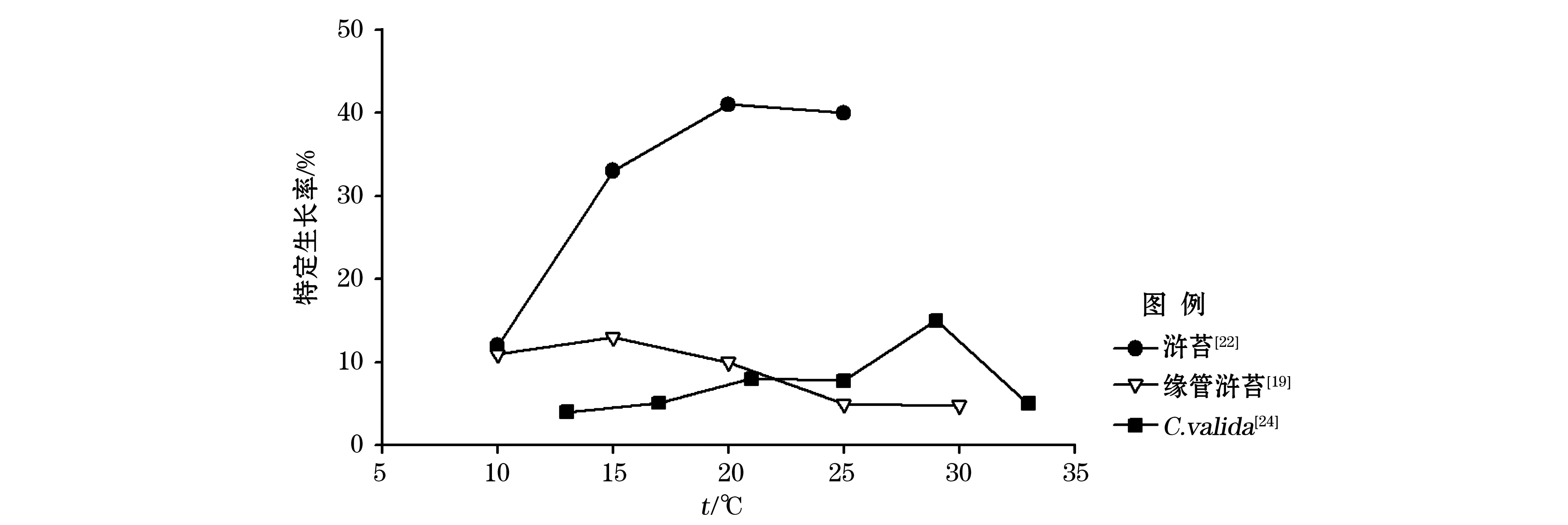
图5 3种大型绿藻生长率比较Fig.5 Growth rates of three green macroalgae
温度对不同种绿藻微观繁殖体的萌发有显著影响。浒苔繁殖体适宜在15~20 ℃萌发,其萌发温度与藻体最适生长温度基本一致。而缘管浒苔繁殖体萌发数量随温度的升高呈现一定的波动性,与浒苔比较,缘管浒苔繁殖体适于在10~20 ℃萌发生长。Ulvasp.1在10~30 ℃的萌发数量均较高,在15株/g左右。盘苔繁殖体萌发数量一直很低,在各个温度下均小于5株/g。
3.2 沉积物中繁殖体在绿潮发生中的作用
方松等[6]研究表明,在20 ℃培养条件下,2011年秋季A站和B站沉积物中绿藻繁殖体数量小于25株/g,而C站的数量则明显较多,为47株/g。我们在20 ℃培养条件下的结果与方松等人的结果基本一致,说明在如东紫菜养殖区沉积物中始终存在绿藻微观繁殖体。
绿藻微观繁殖体在江苏紫菜养殖区的沉积物中大量存在,按实验得出的沉积物中绿藻微观繁殖体数量平均为34.3株/g,即49株/cm2。以紫菜养殖区的面积约200 km2计算[3],我们可以估算出整个养殖区沉积物表层7.5 cm厚度的沉积物中微观繁殖体的总数量,即整个养殖区沉积物中约有9.8×1013株的绿藻微观繁殖体。由此可见,苏北浅滩紫菜养殖区沉积物是一个巨大的绿藻微观繁殖体库,应当是紫菜筏架上定生绿藻的主要来源。
Lotze等[11]认为,形成水华的一年生海藻能够通过形成繁殖体库的形式度过寒冷的冬季,并作为来年春季暴发水华的“种子”来源。我国江苏如东紫菜养殖区的沉积物同样也成为一个巨大的储存库,使裸露的微小的绿藻繁殖体得以度过寒冷冬季,在次年温度适宜时,这些微小的绿藻繁殖体便在养殖设施上附着萌发生长。
4 结 论
通过江苏近岸紫菜养殖区沉积物中绿藻微观繁殖体的室内温度梯度培养实验,分析了重要环境因子温度对绿藻微观繁殖体萌发数量和种类的影响,主要结论:
1)温度对沉积物中繁殖体萌发数量有显著影响,5 ℃的低温条件下,繁殖体均不能萌发。15和20 ℃时,萌发数量出现高值,分别为17.0和15.8株/g。10,25和30 ℃的萌发数量相当,在8.0株/g上下。总体上,随温度的升高繁殖体萌发数量呈先增加后降低的趋势。
2)在研究区域沉积物中绿藻微观繁殖体萌发种类有浒苔、缘管浒苔、盘苔和Ulvasp.1,其萌发数量的平均值分别为13.7,6.0,2.0和15.4株/g。其中,浒苔萌发数量随温度的升高先升高后降低,在15 ℃时达到最高值为31.2株/g。缘管浒苔在10~20 ℃萌发数量相对较高, 25 ℃时极低仅为1.6株/g,而5和30 ℃时都未能萌发。Ulvasp.1在10~30 ℃数量变化不明显,一直保持较高值在15.0株/g左右。而盘苔萌发数量一直较低,在各温度下均小于3.0株/g。
3)苏北浅滩紫菜养殖区(面积约200 km2)表层沉积物中存在一个巨大的绿藻微观繁殖体库,经估算,约有9.8×1013株绿藻微观繁殖体,是紫菜养殖筏架上定生绿藻的潜在来源。
[1] HOFFMANN A J, SANTELICES B. Banks of algal microscopic forms: hypotheses on their functioning and comparisons with seed banks[J]. Marine Ecology-progress Series, 1991, 79(1-2): 185-194.
[2] ZOU D H, XIA J R. Studies progress of sexual reproductive ecology in seaweeds[J]. Acta Ecologica Sinica, 2004, 24(12): 2870-2877. 邹定辉,夏建荣. 海藻有性繁殖生态学研究进展[J]. 生态学报,2004,24(12):2870-2877.
[3] FAN S L, FU M Z, LI Y, et al. Origin and development of Huanghai(Yellow) Sea green-tides in 2009 and 2010[J]. Acta Oceanologica Sinica, 2012, 34(6): 187-194.范士亮,傅明珠,李艳,等.2009—2010年黄海绿潮起源于发生过程调查研究[J].海洋学报,2012,34(6):187-194.
[4] State Oceanic Administration of China.Marine Environment Bulletin of China[EB/OL].[2013-03].http:∥www.soa.gov.cn/zwgk/hygb/zghyhjzlgb/201303/t20130329_24713.html. 国家海洋局.2012年中国海洋环境状况公报[EB/OL].[2013-03].http:∥www.soa.gov.cn/zwgk/hygb/zghyhjzlgb/201303/t20130329_24713.html.
[5] LIU D, JOHN K, HE P, et al. World's largest macroalgal bloom caused by expansion of seaweed aquaculture in China[J]. Marine Pollution Bulletin, 2009, 58(6): 888-895.
[6] FANG S. Study on the Green algae attached toP.yezoensisaquaculture rafts and the micro-propagules in Jiangsu nearshore[D]. Qingdao: The First Institute of Oceanography, SOA, 2012. 方松.江苏近海筏架定生绿藻及微观繁殖体的研究[D].青岛:国家海洋局第一海洋研究所,2012.
[7] WORM B, HEIKE K, SOMMER U. Algal propagules banks modify competition, consumer and resource control on Baltic rocky shores[J]. Oecologia, 2001, 128: 281-293.
[8] FANG S, WANG Z L, LI Y, et al. The dynamics of micro-propagules before the green tide (Ulvaprolifera) outbreak in the Southern Huanghai Sea and Changjiang(Yangtze) River Estuary area[J]. Acta Oceanologica Sinica, 2012, 34(4): 147-154. 方松,王宗灵,李艳,等.南黄海及长江口附近海域绿潮爆发前期微观繁殖体的动态变化[J].海洋学报,2012,34(4):147-154.
[9] GAO S, CHEN X Y, YI Q Q, et al. A strategy for the proliferation ofUlvaprolifera, main causative species of green tides, with formation of sporangia by fragmentation[J]. Plos One, 2010, 5(1): 1-7.
[10] ZHANG H W, MA J H, HU X, et al. Reproductive characteristics of the floating algae in green tide[J]. Journal of Shanghai Ocean University, 2011, 20(4): 600-606. 张华伟,马家海,胡翔,等.绿潮漂浮浒苔繁殖特性研究[J].上海海洋大学学报,2011,20(4):600-606.
[11] LOTZE H K, SCHRAMM W, SCHORIES D, et al. Control of macroalgal blooms at early developmental states:PilayellalittoralisversusEnteromorphaspp.[J]. Oecologia, 1999, 119: 46-54.
[12] WANG J W,YAN B L, LIN A P, et al. Ecological factor research on the growth and induction of spores release inEnteromorphaProlifera(Chlorophyta)[J]. Marine Science Bulletin, 2007, 26(2): 60-65.王建伟,阎斌伦,林阿朋,等.浒苔(Enteromorphaprolifera)生长及孢子释放的生态因子研究[J].海洋通报,2007,26(2):60-65.
[13] PROVASOLI L. Media and prospects for the cultivation of marine algae[J]. Cultures and Collections of Algae, 1968: 63-75.
[14] LESKINEN E, PAMILO P. Evolution of the ITS sequences of ribosomal DNA inEnteromorpha(Chlorophyceae)[J]. Hereditas, 1997, 126: 17-23.
[15] HAYDEN H S, BLOMSTER J, MAGGS C A, et al. Linnaeus was right all along:UlvaandEnteromorphaare not distinct genera[J]. European Journal of Phycology, 2003, 38: 277-294.
[16] LELIAERT F, ZHANG X, YE N, et al. Identity of the Qingdao algal bloom[J]. Phycological Research, 2009, 57: 147-151.
[17] LIN H Z, JIANG P, ZHANG J X, et al. Genetic and marine cyclonic eddy analyses on the largest macroalgal bloom in the world[J]. Environmental Science & Technology, 2011, 45: 5996-6002.
[18] XIAO J, LI Y, SONG W, et al. Discrimination of the common macroalgae (UlvaandBlidingia) in coastal waters of Yellow Sea, northern China, based on restriction fragment-length polymorphism (RFLP) analysis[J]. Harmful Algae, 2013, 23: 130-137.
[19] TAYLOR R, FLETCHER R L, RAVEN J A. Preliminary studies on the growth of selected 'Green Tide' algae in laboratory culture effects of irradiance temperature salinity and nutrients on growth rate[J]. Botanica Marina, 2001, 44: 327-336.
[20] LARGO D B, SEMBRANO J, HIRAOKA M, et al. Taxonomic and ecological profile of green-tide species ofUlva(Ulvales,Chlorophyta) in central Philippines[J]. Hydrobiologia, 2004, 512: 247-253.
[21] WU H X, XU A G, WU M N. Preliminary study on experimental ecology ofEnteromorphaprolifera(Miil1)[J]. Journal of Zhejiang Ocean University:Natural Science, 2000, 19(3):230-234.吴洪喜,徐爱光,吴美宁.浒苔实验生态的初步研究[J].浙江海洋学院学报:自然科学版,2000,19(3):230-234.
[22] ZHANG X H, WANG Z L, LI R X, et al. Microscopic observation on population growth and reproduction ofEnteromorphaproliferaunder different temperature and salinity[J]. Advances in Marine Science, 2012, 30(2): 276-283. 张晓红,王宗灵,李瑞香,等.不同温度、盐度下浒苔(Entromorphraprolifera)群体增长和生殖的显微观测[J].海洋科学进展,2012,30(2):276-283.
[23] KIM J H, KANG E J, PARK M C, et al. Effects of temperature and irradiance on photosynthesis and growth of a green-tide-forming species (Ulvalinza) in the Yellow Sea[J]. Journal of Applied Phycology, 2010, 23(3): 421-432.
[24] DENG Y Y, TANG X R, HUANG B X, et al. Effect of temperature and irradiance on the growth and reproduction of the green macroalgaa,Chaetomorphavalida(Cladophoraceae,Chlorophyta)[J]. Journal of Applied Phycology, 2012, 24: 927-933.
Received: January 20, 2014
Effects of Temperature on the Germination of Green Algal Micro-propagules in the Sediment
LIU Xiang-qing1,2, WANG Zong-ling1,2, LI Yan1,2, SONG Wei1,FAN Shi-liang1, LI Rui-xiang1, ZHANG Xue-lei1
(1.TheFirstInstituteofOceanography,SOA, Qingdao 266061, China;2.CollegeofEnvironmentalScienceandEngineering,OceanUniversityofChina, Qingdao 266100, China)
Subei Shoal and its adjacent waters are important area for early development ofUlvaproliferagreen tides in southern Yellow Sea. It has proved that the micro-propagules were extensively distributed in this water area and the sea water temperature could influence the germination and growth of micro-propagules. The effects of temperature (5,10,15,20,25 and 30 ℃) on the species and germinating quantity of micro-propagules of green algae in the sediment samples were studied in our laboratory using the samples collected fromPorphyraaquaculture area in the southern Jiangsu province in October 2012. Results show that the algae micro-propagules failed to geminate in 5 ℃. With the water temperature rose from 10 ℃ to 30 ℃, the quantity of micro-propagules had a trend of first increase and then decrease, its peak was recorded at 15 ℃ and 20 ℃,being 17.0 ind./g and 15.8 ind./g, respectively. These micro-propagules were identified asUlvaprolifera,Ulvalinza,Ulvasp.1 andBlidingiasp. by PCR-RFLP, the average amount of them were 13.7 ind./g, 6.0 ind./g, 2.0 ind./g and 15.4 ind./g. Among them, the amount of micro-propagules ofUlvaproliferareached the peak at 15 ℃, being 31.2 ind./g, and those ofUlvalinzawere higher at 10~20 ℃, diminished to 1.6 ind./g at 25 ℃ and did not germinate at 5 ℃ or 30 ℃. The micro-propagules ofUlvasp. 1 maintained high amount at 10~30 ℃, being 15 ind./g and those ofBlidingiasp. were in low amount in all temperature, being about 3 ind./g. Accordingly, it was estimated that approximately 9.8×1013ind. micro-propagules would be existed in the sediment ofPorphyraaquaculture area in Subei Shoal (about 200 km2), which will constitute a huge seed bank of green algae. This study will contribute data to support the traceability of green tide in the Yellow Sea.
micro-propagules; green tides; temperature; sediment; Subei Shoal
2014-01-20
国家重点基础研究发展计划——我国近海藻华灾害演变机制与生态安全(2010CB428703);国家海洋局海洋公益性行业科研专项——紫菜筏架区绿藻防控技术研究与示范(201105023-2);青岛市公共领域科技支撑计划——黄海浒苔绿藻起源、发生与发展过程调查研究(11-3-1-7-hy)
刘湘庆(1989-),男,山东青岛人,博士研究生,主要从事海洋生态学方面研究.E-mail:adslalxq@163.com
*通讯作者:李 艳(1974-),女,山东定陶人,副研究员,博士研究生,主要从事浮游植物分类学方面研究.E-mail:liyan@fio.org.cn
(高 峻 编辑)
Q178
A
1671-6647(2015)01-0219-08

