类风湿关节炎患者外周血T淋巴细胞亚群CD4+/CD8+表达的意义*
梅序桥,吴阿阳,郑燕苹,陈宏浦,郑源海,杨惠聪,张佳林(福建医科大学附属漳州市医院:.检验科;.血液科,福建漳州 363000)
·论 著·
类风湿关节炎患者外周血T淋巴细胞亚群CD4+/CD8+表达的意义*
梅序桥1,吴阿阳1,郑燕苹1,陈宏浦2,郑源海1,杨惠聪1,张佳林2
(福建医科大学附属漳州市医院:1.检验科;2.血液科,福建漳州 363000)
目的 探讨类风湿关节炎(RA)患者外周血T淋巴细胞亚群CD4+/CD8+的表达变化对疾病进展的关系。方法 采用流式细胞术检测94例RA患者和22例健康对照者外周血T淋巴细胞亚群CD4+/CD8+。其中94例RA患者按RA疾病活动指数(DAS28)评分分为低值、中值、高值3组。结果 与健康对照组比较,RA组外周血中CD3+CD4+T淋巴细胞的表达率明显升高(P<0.05),其中CD3+CD4+T淋巴细胞在DAS28低值组为(41.03±9.53)%,DAS28中值组为(42.16±7.08)%,DAS28高值组为(43.72±9.63)%;CD3+CD8+T淋巴细胞表达率明显降低(P<0.05),其中CD3+CD8+T淋巴细胞在DAS28低值组为(21.33±6.67)%,DAS28中值组为(21.39±7.36)%,DAS28高值组为(21.28±6.60)%。结论 CD4+/CD8+比值与RA患者疾病进程相关,表明CD4+/CD8+失衡在RA的发病中发挥了重要作用。
类风湿关节炎; 流式细胞; T淋巴细胞亚群
类风湿关节炎(RA)是一种常见的关节慢性炎症的自身免疫性疾病,病理显示T淋巴细胞在关节炎症中浸润和渗出[1]。CD3被认为是所有T细胞均表达的共同标志性抗原,参与T细胞的信号转导,CD3+CD4+T淋巴细胞是T淋巴细胞中重要的亚群,激活后分化成特定的免疫辅助性T细胞,分泌白细胞介素(IL)-4、IL-17、干扰素(INF)-γ等细胞因子,进一步促进免疫应答的产生。研究表明CD3+CD4+T淋巴细胞在RA的发病机制中有重要作用[2],CD3+CD4+T淋巴细胞识别自身抗原而活化,导致炎症因子分泌增加,使自身免疫应答机制失衡,从而造成RA关节的炎性反应[3]。尽管CD3+CD8+T淋巴细胞是免疫系统主要的效应细胞,能够发挥细胞毒性效应,但其在自身免疫性疾病中的作用研究较少。T淋巴细胞亚群中CD4+/CD8+比例的失衡与多种自身免疫性疾病相关,本文采用流式细胞术检测RA患者及健康者外周血CD3、CD4、CD8阳性T淋巴细胞的表达情况,探讨其在RA疾病中的作用。
1 资料与方法
1.1 一般资料 收集福建医科大学附属漳州市医院2013年6~12月门诊及住院的RA患者 94 例(RA组),其中男24例,女70例;年龄16~81岁,平均(50.32±11.70)岁;均符合美国风湿病协会(ACR) 2010 年修订的诊断标准[4]。健康对照组 22 例,其中男4 例,女 18 例;年龄23~72 岁,平均(44.77±15.22)岁;为同期本院健康志愿者,均排除自身免疫性疾病和慢性炎症性疾病。RA病情活动度以RA疾病活动指数(DAS28)评分为标准[5],将RA患者分为低度活动期(DAS28<3.2)22例,其中男9例、女13例,平均年龄(47.09±3.03) 岁;中度活动期(DAS28 3.2~5.1)40例,其中男9例、女31例,平均年龄(53.31±1.85)岁;高度活动期(DAS28>5.1)32例,其中男6例、女26例,平均年龄(50.03±1.64)岁。3组研究对象在年龄、性别构成方面差异无统计学意义(P>0.05)。该研究获得医院伦理委员会通过,针对研究对象的采样均获得研究对象的知情同意。
1.2 主要试剂及仪器 Anti-Human CD4-FITC / CD8-PE / CD3-PerCP组合抗体(美国BD公司),红细胞裂解液(美国Beckman公司),BD FACSCantoTMⅡ流式细胞仪(美国BD公司)。
1.3 方法 经确诊的RA患者及健康对照者,均晨起空腹采集肘静脉血2 mL,用乙二胺四乙酸二钾(EDTA-K2)抗凝。每份标本分别加入50 μL抗凝全血。T标记的试管中加入20 μL的组合抗体CD4-FITC/CD8-PE/CD3-PerCP,涡旋振荡混匀,室温,避光孵育15 min。加入400 μL红细胞裂解液,振荡混匀,室温避光8~10 min。每管中加入2 mL磷酸缓冲盐溶液(PBS),振荡混匀,1 500 r/min,离心5 min,弃上清液。再加入1 mL PBS重悬细胞,上机分析。

2 结 果
RA各组CD3+T淋巴细胞水平与对照组相比差异无统计学意义(P>0.05);而CD3+CD4+T淋巴细胞水平及CD4+/CD8+比值均明显高于对照组(P<0.05),CD3+CD8+T淋巴细胞明显低于对照组(P<0.05),然其在RA不同活动期组间差异无统计学意义(P>0.05)。见表1,图1、2。

图1 流式细胞仪T淋巴细胞亚群CD4/CD8/CD3检测示意图
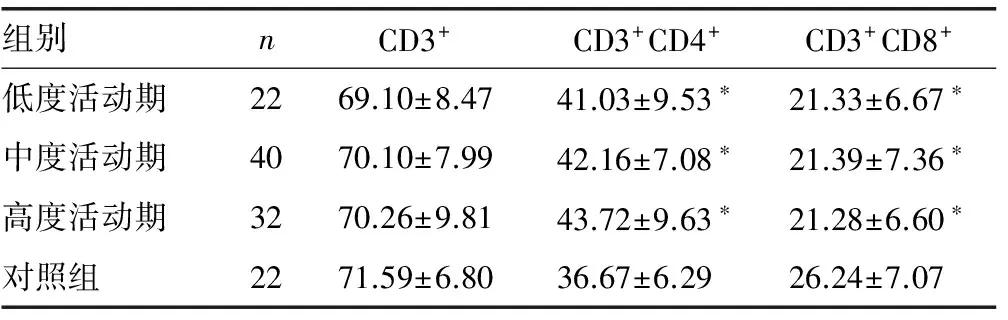
组别nCD3+CD3+CD4+CD3+CD8+低度活动期2269.10±8.4741.03±9.53∗21.33±6.67∗中度活动期4070.10±7.9942.16±7.08∗21.39±7.36∗高度活动期3270.26±9.8143.72±9.63∗21.28±6.60∗对照组2271.59±6.8036.67±6.2926.24±7.07
注:与对照组比较,*P<0.05。

注:*表示P<0.05。
图2 RA患者与健康者外周血CD4/CD8比较
3 讨 论
RA是临床常见的自身免疫性疾病,在中国的发病率约为4‰,它的发病机制涉及多种因素,主要由免疫机制引起,有多种免疫细胞和细胞因子的参与。研究表明T淋巴细胞亚群的失衡在RA疾病的进程中发挥重要作用,尤其是当CD4/CD8平衡被破坏时,患者便表现出关节慢性炎症等相关临床症状[6]。T淋巴细胞按其表面抗原的表达,又分为CD3+CD4+亚群和CD3+CD8+亚群,CD4+T淋巴细胞又称为辅助性T细胞,它可以分泌大量的细胞因子,诱导体液免疫细胞激活,同时通过信号传导,激活CD8+T淋巴细胞。CD8+T淋巴细胞通过多种机制发挥细胞毒性作用,杀伤靶细胞。研究表明CD4+T/CD8+T淋巴细胞的平衡与多种自身免疫性疾病相关[7]。
CD4分子在T淋巴细胞发育及成熟过程中发挥重要作用,它可以促进T淋巴细胞的活化以及信号转导,是适应性免疫应答发生的重要效应分子。当机体内淋巴细胞的CD4分子异常表达时,即可能导致疾病的发生。Dejaco等[8]研究发现在AS患者的外周血及关节腔滑液中可以检测到CD4+T淋巴细胞的活化,并且分泌高水平的炎症因子IFN-γ、IL-6、TNF-α与IL-2等,促进RA发展[9]。也有研究报道RA患者CD4+T细胞高表达CD40L,这可能延长和增强CD4+T淋巴细胞的活化,加重疾病的程度。动物模型试验表明CD4+T淋巴细胞可以导致自身免疫性的关节损伤[10]。此外静脉注射抗CD4 mAb的靶向治疗发现,初次治疗C-反应蛋白的水平出现短暂降低,而循环中CD4+T淋巴细胞的数量没明显改变,再次治疗后,IL-2和IFN-γ mRNA表达明显降低[11];同时采用免疫组化发现滑膜组织中浸润炎症细胞数量减少及黏附分子的表达明显降低,RA患者关节炎症状得到很大改善[12]。本研究发现,RA的DAS 28各组CD3+CD4+T淋巴细胞明显高于对照组,表明在RA中CD4分子处于一种异常表达状态,但DAS 28各组的CD3+CD4+T淋巴细胞相互比较差异无统计学意义(P>0.05),这可能与本次病例选择的数量较少有关系。
CD8+T淋巴细胞的表达减低或是缺失,能导致机体的免疫功能下降,引发自身免疫性疾病,这在几种自身免疫性疾病动物实验模型中得到证实[13-15]。但CD8+T淋巴细胞在RA动物模型中的作用存在争议[16-17]。CD8+T淋巴细胞缺乏的SCW的大鼠模型能诱导早期的RA发病和延长RA病程;而在CD8+T淋巴细胞缺乏的CIA老鼠模型未出现对于RA的诱导,提示CD8+T淋巴细胞在RA的病理机制中的作用并不显著。然而,敲除CD8+T淋巴细胞的小鼠在经过初始免疫的刺激之后才对疾病的进程有影响,表明CD8+T淋巴细胞并没有在RA发病的初始阶段发挥作用,而是在RA的效应阶段发挥重要的作用[18]。Masuko-Hongo等[19]发现RA患者的滑液聚集的寡克隆T细胞主要是CD8+细胞,它们的存在超过一年,主要表达CD25或CD45RO分子,表明这些细胞是记忆细胞。说明了长期存在的CD8+T淋巴细胞参与了RA慢性关节炎症进程。RA易感性的基因是HLA-DR8。Taneja等[20]报道证实了DQ8CD4-/-小鼠能抵抗胶原蛋白所诱发的关节炎(CIA),然而DQ8CD8-/-小鼠相对于DQ8鼠增加CIA的发生率与疾病的严重度。这又说明了CD4+T淋巴细胞启动CIA,而CD8+T淋巴细胞则起免疫调节/保护的作用。本研究发现,RA的DSA28各组CD3+CD8+T淋巴细胞明显低于对照组,说明CD3+CD8+T淋巴细胞对RA疾病的进展还是有一定的影响,尽管DSA28各组的CD3+CD4+T淋巴细胞相互比较并没有显著性差异。故作者认为CD8+T淋巴细胞在RA的病理机制还有待进一步的研究。
淋巴细胞亚群CD4/CD8比例的失衡可导致多种自身免疫性疾病。有研究发现RA患者外周血CD4+T淋巴细胞比例升高,CD8+T淋巴细胞无显著变化,CD4+/CD8+比值明显升高,CD4+/CD8+比例的失衡与RA的发病密切相关[21]。本研究发现,RA组CD3+CD4+T淋巴细胞水平及CD4+/CD8+比值均明显高于对照组,CD3+CD8+T淋巴细胞明显低于对照组,然其在RA不同活动期组间,CD4+T淋巴细胞、CD4+/CD8+比值表现增高趋势,但差异无统计学意义;CD3+T淋巴细胞无显著性变化。本结果所显示的CD8+T淋巴细胞的减少与李忠等[22]的结果相一致,证明了T淋巴细胞,尤其是CD4+T淋巴细胞参与RA发生、发展,CD4+/CD8+失衡在RA的发病中发挥了重要作用且可能与疾病的严重程度相关。
综上所述,RA患者CD4+/CD8+比值升高,且随着疾病程度加重,CD4+/CD8+比值也有增高的趋势,表明CD4+/CD8+失衡在RA的发病中发挥了重要作用,CD4+/CD8+比值可作为RA诊断及疾病进展程度判断的参考指标。
[1]Norton S,Bo F,Scott DL,et al.Health Assessment Questionnaire disability progression in early rheumatoid arthritis:Systematic review and analysis of two inception cohorts[J].Semin Arthritis Rheum,2014,44(2):131-144.
[2]Pawlowska J,Smolenska Z,Daca A,et al.Older age of rheumatoid arthritis onset is associated with higher activation status of peripheral blood CD4(+) T cells and disease activity [J].Clin Exp Immunol,2011,163(2):157-164.
[3]Panayi GS,Lanchbury JS,Kingsley GH.The importance of the T cell in initiating and maintaining the chronic synovitis of rheumatoid arthritis[J].Arthritis Rheum,1992,35(7):729-735.
[4]Aletaha D,Neogi T,Silman AJ,et al.2010 Rheumatoid arthritis classification criteria:An American College of Rheumatology/European League Against Rheumatism collaborative initiative [J].Arthritis Rheum,2010,62(9):2569-2581.
[5]Dougados M,RipertM,Hilliquin P,et al.The influence of the definition of patient global assessment in assessment of disease activity according to the Disease Activity Score (DAS28) in rheumatoid arthritis[J].J Rheumatol,2011,38(11):2326-2328.
[6]Wang B,Gonzalez A,Benoist C,et al.The role of CD8+T cells in the initiation of insulin-dependent diabetes mellitus[J].Eur J Immunol,1996,26(8):1762-1769.
[7]Sun D,Whitaker JN,Huang Z,et al.Myelin antigen-specific CD8+T cells are encephalitogenic and produce severe disease in C57BL/6 mice[J].J Immunol,2001,166(12):7579-7587.
[8]Dejaco C,Duftner C,Klauser A,et al.Altered T-cell subtypes in spondyloarthritis,rheumatoid arthritis and polymayalgia rheumatica[J].Rheumatol Int,2010,30(3):297-303.
[9]Steiner G,Tohidast-Akrad M,Witzmann G,et al.Cytokine production by synovial T cells in rheumatoid arthritis[J].Rheumatology (Oxford),1999,38 (3):202-213.
[10]Banerjee S,Webber C,Poole AR.The induction of arthritis in mice by the cartilage proteoglycan aggrecan:roles of CD4+and CD8+T cells[J].Cell Immunol,1992,144(2):347-357.
[11]Schulze-Koops H,Davis LS,Haverty TP,et al.Reduction of Th1 cell activity in the peripheral circulation of patients with rheumatoid arthritis after treatment with a non-depleting humanized monoclonal antibody to CD4[J].J Rheumatol,1998,25(11):2065-2076.
[12]Tak PP,Van der Lubbe PA,Gauli A,et al.Reduction of synovial inflammation after anti-cd4 monoclonal antibody treatment in early rheumatoid arthritis[J].Arthritis Rheum,1995,38(10):1457-1465.
[13]Huseby ES,Liggitt D,Brabb T,et al.A pathogenic role for myelin-specific CD8(+)Tcells in a model for multiple sclerosis [J].J Exp Med,2001,194(5):669-676.
[14]Najafian N,Chitnis T,Salama AD,et al.Regulatory functions of CD8+CD28-T cells in an autoimmune disease model [J].J Clin Invest,2003,112(7):1037-1048.
[15]Hanyecz A,Olasz K,Tarjanyi O,et al.Proteoglycan aggrecan conducting T cell activation and apoptosis in a murine model of rheumatoid arthritis[J].Biomed Res Int,2014,2014:942148.
[16]van den Broek MF,de Heer E,van Bruggen MC,et al.Immunomodulation of Streptococcal cell wall-induced arthritis.Identification of inflammatory cells and regulatory T cell subsets by mercuric chloride and in vivo CD8 depletion[J].Eur J Immunol,1992,22(12):3091-3095.
[17]Ehinger M,Vestberg M,Johansson AC,et al.Influence of CD4 or CDS deficiency on collagen-induced arthritis[J].Immunology,2001,103(3):291-300.
[18]Williams RO,Whyte A,Waldmann H.Resistance to collagen induced arthritis in DBA/1 mice by in traperitoneal administration of soluble type Ⅱ collagen involves both CD4+and CD8+T lymphocytes[J].Autoimmunity,1989,4(4):237-245.
[19]Masuko-Hongo K,Sekine T,Ueda S,et al.Long term persistent accumulation of CD8+T cells in synovial fluid of rheumatoid arthritis[J].Ann Rheum Dis,1997,56(10):613-620.
[20]TanejaV,TanejaN,PaisansinsupT,etal.CD4andCD8TCellsinSusceptibility/ProtectiontoCollagen-InducedArthritisinHLA-DQ8-TransgenicMice:ImplicationsforRheumatoidArthritis[J].JImmunol,2002,168(11):5867-5875.
[21]仝岩,任伟宏,赵航,等.类风湿性关节炎患者外周血CD4+T细胞亚群的分析[J].细胞与分子免疫学杂志,2013,29(8):854-858.
[22]李忠,谢东霞.类风湿性关节炎患者T细胞亚群及Th1/Th2细胞因子的分析[J].中国中医药杂志,2010,8(23):192-193.
Expression and significance of peripheral blood T-lymphocytes subsets CD4/CD8 in patients with rheumatoid arthritis*
MEIXu-qiao1,WuA-yang1,ZHENGYan-ping1,CHENHong-pu2,ZHENGYuan-hai1,YANGHui-cong1,ZHANGJia-lin2
(1.DepartmentofClinicalLaboratory;2.DepartmentofHematology,AffiliatedZhangzhouMunicipalHospital,FujianMedicalUniversity,Zhangzhou,Fujian363000,China)
Objective To investigate the correlation between the change of peripheral blood T-lymphocyte subsets CD4/CD8 with the disease progress in the patients with rheumatoid arthritis(RA).Methods The peripheral blood T-lymphocytes subsets CD4/CD8 in 94 patients with RA and 22 healthy controls were examined by flow cytometry.94 cases of RA were divided into low value,median value and high value groups by RA disease activity index (DAS28) scores.Results Compared with the healthy controls,the expression rate of peripheral blood CD3+CD4+T cells in the RA group was increased significantly (P<0.05),in which CD3+CD4+T cells were (41.03±9.53)% in DAS28 low value group,(42.16±7.08)% in DAS28 median value group and (43.72±9.63)% in DAS28 high value group.The expression rate of CD3+CD8+T was significantly decreased (P<0.05),in which CD3+CD8+T cells were (21.33±6.67)% in DAS28 low value group,(21.39±7.36)% in DAS28 median value group and (21.28±6.60)% in DAS28 high value group.Conclusion CD4+/CD8+ratio is associated with RA progression,indicating that the CD4+/CD8+imbalances plays an important role in the pathogenesis of RA.
rheumatoid arthritis; flow cytometry; T-lymphocytes subsets
福建省卫生厅青年科研课题立项(2011-2-51)。
梅序桥,男,主管技师,博士,主要从事血液学疾病的实验室诊断。
10.3969/j.issn.1672-9455.2015.21.005
A
1672-9455(2015)21-3144-03
2015-03-04
2015-07-08)

