心房颤动血栓形成机制研究进展
李延广 时向民 林琨 国建萍 李健 综述 单兆亮 王玉堂 审校
(解放军总医院心血管内科,北京100853)
心房颤动血栓形成机制研究进展
李延广 时向民 林琨 国建萍 李健 综述 单兆亮 王玉堂 审校
(解放军总医院心血管内科,北京100853)
作为常见的快速型心律失常,心房颤动导致血栓形成,使脑卒中与系统栓塞的风险增加了5~6倍。心房颤动时血栓形成的病理生理机制复杂,是心房颤动研究的热点。现对心房颤动血栓形成机制的研究进展进行系统性综述,并对可能的机制进行论证。目前认为心房颤动血栓形成的机制主要有3个方面:(1)血流动力学紊乱;(2)内皮功能异常;(3)血液成分的改变。三者相互作用,共同导致了心房颤动时心房、心耳血栓的形成。
1 血流动力学紊乱
血流动力学指的是血液流动时表现的力学、结构学状态。心房颤动时的血流动力学紊乱多指心房、心耳局部血液瘀滞。除血液瘀滞外,湍流的形成也是导致血栓形成的原因。正常情况下血液在体内的流动为层流,表现血小板处于血流中间,避免了血小板与血管内皮的接触,也就防止了血小板的激活。而心房颤动发生时,心房、心耳收缩功能下降,血液在局部形成湍流,增加了血小板与内皮的接触机会,使血小板激活增加,而血小板的激活使得血栓易于形成[1-2]。
与湍流相比血液瘀滞更容易导致血栓形成。瓣膜性心房颤动患者中,二尖瓣狭窄为主时,血流瘀滞最为明显。二尖瓣关闭不全为主时,血液湍流最为明显。研究发现二尖瓣狭窄时的血液瘀滞较二尖瓣反流更易形成血栓,而且反流量越大发生血栓栓塞的概率越小[3]。而且二尖瓣反流并不增加心房颤动局部血液瘀滞,也不增加脑卒中风险[4]。除瓣膜病变外,其他加重血液瘀滞的原因有心房收缩功能的丧失和心房的扩张[5]。而且经过与体表面积校正的心房体积越大,脑卒中风险越高。
心房颤动时更多的血栓形成于左心耳,左心耳血液排空速度对血栓的形成也有影响。Cresti等[6]对1 042例心房颤动患者的左心耳峰流速及血栓情况进行研究,发现左心耳血栓阳性患者的心耳血液峰流速明显低于血栓阴性的患者。
据以上研究结果推测,血流动力学紊乱方面主要是血液瘀滞导致了心房颤动血栓形成。其原因可能在于血液瘀滞时,外周血流冲刷、稀释作用下降,激活的凝血酶可以在局部范围内形成一定浓度,水解纤维蛋白原的能力得到加强,进而导致血栓形成。
此外,值得一提的是除血液瘀滞直接导致血栓形成外,心房顿抑、左房及左心耳收缩功能的下降会导致心房、心耳局部切应力的下降[7]。而切应力在调节心房内皮功能中具有重要作用。切应力的下降可以通过降低内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS)及Apelin/APJ系统的活性,降低一氧化氮(nitric oxide, NO)的含量,进而导致血栓形成[8]。
2 内皮功能损伤及心房组织异常
研究证明在阵发性心房颤动患者的非心房颤动发作期也会面临一定的血栓形成风险[9-10]。说明除血液瘀滞外,还有其他方面因素导致了血栓形成。其中心房内皮与心房组织(心肌)的异常发挥了重要作用[11]。
2.1 内皮功能异常
内皮细胞覆盖整个心血管系统,在心内膜及血管内膜均广泛表达。它能够合成NO,表达血栓调节蛋白(thrombomodulin,TM)、纤维蛋白溶酶原、组织因子途径抑制剂等,具有增强抗凝血酶活性、抑制血小板聚集、调节凝血纤溶活性的功能[12]。研究发现心房颤动患者存在内皮功能损伤[13]。目前关于内皮功能损伤与心房颤动血栓形成机制关系的研究主要有以下几个方面。
2.1.1 eNOS
eNOS主要存在于心脏内膜和血管内皮细胞中,具有催化精氨酸合成NO的作用。NO能够防止血小板的聚集、黏附,减少血栓形成的概率。心房颤动可以导致eNOS表达的下降和NO水平的降低,加重血液瘀滞部位的心内膜损害,使纤溶酶原激活物抑制剂-1的表达上调,降低纤维蛋白溶解酶活性[14],而且导致血小板激活[15]。因而eNOS活性及表达的下降在心房颤动患者的血栓形成中具有重要作用。
2.1.2 血管性血友病因子
血管性血友病因子(von Willebrand factor, vWF)是介导血小板和内皮之间黏附的糖蛋白,主要由内皮细胞合成,在内皮损伤时释放入血。它是反映内皮损伤和功能障碍的主要标志物。一项涉及423例的队列研究发现,血浆的vWF水平能在真实世界中预测心房颤动脑卒中的发生[16]。由于血栓形成主要位于左心耳,而左心耳内皮细胞表达vWF增多较其他部位明显[2],说明以vWF升高为标志的内皮损伤对局部血栓的形成具有重要作用。
2.1.3 不对称二甲基精氨酸
不对称二甲基精氨酸(asymmetric dimethylarginine, ADMA)是eNOS的内源性抑制剂,也是反映内皮功能损伤的重要生化标志物。血液中ADMA水平的升高能抑制NO的合成及其生物功能,增加血栓形成的风险。Lim等[2]以阵发性心房颤动患者为研究对象,在非心房颤动发作期以快速刺激诱发心房颤动并维持15 min后,血液中ADMA水平较心房颤动诱发前明显升高。Goette等[17]在动物实验中也得到了类似的结论。同样,Chao等[18]观察了141例心房颤动患者,发现心房颤动患者ADMA水平高于非心房颤动患者。而且在所有心房颤动患者中,心房颤动负荷及持续时间越长,ADMA水平越高,证明心房颤动是导致ADMA升高、内皮功能障碍的重要因素[18]。更重要的是,经过(30.7±14.4)个月的随访,该研究者发现ADMA水平与CHA2DS2-VASc评分是心血管不良事件(缺血性脑卒中、心源性死亡)的独立预测因素,而且生存分析显示高ADMA水平患者有较高的心血管不良事件发生率(其中以血栓栓塞事件最多)[18]。证明了内皮功能损伤在心房颤动相关的心血管事件,尤其是血栓栓塞事件中有重要作用。
2.1.4 TM
TM是内皮细胞合成的内源性抗凝分子,正常情况下储存于心内膜细胞中,在受到某些刺激时释放入血。它能够与凝血酶结合,抑制纤维蛋白原到纤维蛋白的转换,同时能够增强蛋白C的活性,产生抗凝作用,血中TM水平是反映内皮功能的良好指标。
Dharmasaroja等[19]对脑卒中患者的血浆可溶性TM水平进行分析,发现TM升高与心房颤动发生率的增加有关,而且心源性脑卒中者(以心房颤动脑卒中为主)较其他类型脑卒中患者的血浆TM高。
虽然血浆TM水平是内皮损伤的指标,但TM具有抗凝作用,为何TM的升高会增加血栓风险,为何左心房较右心房更易形成血栓似乎令人费解。基于此,Jorge等[20]通过动物实验对该问题进行了研究,比较了猴子左右心房TM激活蛋白C的能力,发现左房明显低于右房。而TM主要由心房内皮细胞脱落而来。因此,心房颤动时TM与血栓形成的机制可能在于心房颤动导致了三种变化:(1)导致内皮损伤,锚定于内皮表面而发挥局部抗凝作用的TM由内皮表面脱落入血,导致血中TM增加,心房内皮局部TM减少,抗凝作用减弱,血栓易于形成;(2)导致心内膜TM在蛋白、基因水平表达减少,局部抗凝作用减弱;(3)左房TM激活蛋白C的能力本身较右房低。以上解释了为何血中TM增加,而组织表达却减少,并且左房较右房更易形成血栓。但具体机制尚需进一步研究。
2.2 心房组织异常
除内皮功能异常外,心房组织的改变也影响了血栓的形成。心房组织最明显的变化是心肌的纤维化,心肌细胞外胶原蛋白的合成与降解失去平衡,导致细胞外基质增多。有学者将这种改变命名为心房纤维化性心肌病[21]。Marrouche等[22]通过心肌核磁现象发现心房肌纤维化的程度与脑卒中风险相关。但是否心房心肌组织的异常直接导致了血栓形成还是只是两者通过某种机制产生关联尚不清楚。
3 血液成分的改变
3.1 凝血及纤溶系统活性的改变
心房颤动时凝血状态的改变也是导致血栓易于局部形成的重要原因,但凝血状态改变并不独立于内皮损伤与血液瘀血之外。相反,可能正是内皮损伤与血流动力学改变导致或加剧了凝血状态改变,而凝血状态的改变是所有因素导致血栓形成的共同途径。但分而论之,心房颤动时凝血状态的改变主要包括凝血系统活性的改变和纤溶系统活性的改变。
3.1.1 凝血系统活性
由于内、外源凝血通路的最终通路是凝血酶的激活,因此目前研究多用凝血酶活性指标,如凝血酶原激活片段1.2(prothrombin fragments 1.2, F1.2)、凝血酶-抗凝血酶Ⅲ复合物(thrombin-antithrombin Ⅲ complex, TAT)水平来反映凝血系统的激活。
Lim等[2]对20例阵发性心房颤动患者诱发心房颤动15 min,取左心房及外周血液,检测TAT的水平。发现心房颤动可以导致凝血酶激活的增加,而且以左房更为明显。证明了心房颤动导致了凝血系统的激活,而左房凝血系统激活更明显,这也解释了为何心房颤动时左房易于形成血栓。Wu等[1]发现心房颤动患者血浆中的TAT、F1.2水平较高,凝血活性增强。因此,心房颤动与凝血系统活性关系密切,而且较高的TAT、F1.2水平与心房颤动脑卒中的发生密切相关[23],说明心房颤动时存在凝血系统激活,是血栓形成的重要原因。
3.1.2 纤溶系统活性
纤溶系统活性的改变对血栓的形成和溶解具有重要作用。促纤溶因子与抗纤溶因子平衡的改变会影响血栓的形成。心房颤动时纤溶系统的异常也是心房颤动血栓形成的重要因素[24]。心房颤动患者的纤溶抑制物在基因水平表达升高了245%[25],而且既往发生过栓塞或脑卒中的心房颤动患者纤溶酶原激活物抑制剂-1、纤溶酶-抗纤溶酶复合物水平较未发生栓塞、脑卒中事件的患者更高[26]。以上研究证明心房颤动纤溶活性的降低是心房颤动血栓形成的重要因素。
3.2 血小板活化
血小板活化指的是血管内皮损伤及其他生理、病理刺激因子作用下,血小板发生黏附、聚集、释放、变性等活化反应。血小板活化在血管和心内膜损伤中很常见,也是凝血酶形成的重要步骤。P选择素主要存在于血小板中,血小板活化后P选择素释放入血,成为可溶性P选择素。血浆可溶性P选择素水平是反映血小板活化的良好指标。
目前,针对P选择素与心房颤动及心房颤动血栓形成的研究结果存在诸多争议。有研究发现瓣膜性心房颤动患者的外周血P选择素浓度明显高于非心房颤动患者[1],但Choudhury等[27]的研究称虽然与对照组比较心房颤动患者P选择素升高,但这可能是其他心血管合并症的结果,而不是心房颤动本身导致的。但从机制上分析,心房颤动时左房血液湍流、瘀血导致的血小板与内皮的接触会导致血小板激活,而且心房颤动时心内血液P选择素水平较外周高也说明心房颤动本身会导致血小板激活[2]。但不管心房颤动时的血小板激活是否由心房颤动本身导致,抗血小板治疗确实能在一定程度上减少脑卒中事件的发生(虽然其有效性不如华法林等抗凝药物),但这也从侧面说明血小板活化参与了心房颤动血栓的形成。具体血小板活化在心房颤动血栓形成中的重要性如何尚需进一步研究。
3.3 炎症反应
心房颤动会导致炎症指标如C反应蛋白、肿瘤坏死因子-α、白介素-2,6,8等的升高。虽然炎症在心房颤动的发生和维持中的意义已经被广泛接受[28],但心房颤动时炎症与血栓形成之间的关系最近才被关注。研究发现炎症不仅会导致心房颤动,而且与血栓形成和缺血性脑卒中事件的发生关系密切[29]。在相关性分析中,炎症指标的升高与心房重构(如左房扩张)相关,而且与血中组织因子、血小板激活、vWF、P选择素水平明显相关[30]。因此炎症可能通过导致左房重构与内皮功能损伤来导致血栓的形成。体外培养心房颤动患者心耳内皮细胞发现,肿瘤坏死因子-α导致内皮细胞组织因子和纤溶酶原激活物抑制剂-1水平升高,证明炎症可能直接作用于内皮细胞,导致血栓形成风险增加[31]。虽然相关性分析提供了支持性证据,但目前研究结论尚不能说明炎症与心房颤动血栓具有直接关系。
4 结论
Virchow于100多年前提出了血栓形成的三要素:血管壁损伤、血流瘀血、血液成分改变。目前关于心房颤动血栓形成机制的研究中Virchow三要素同样适用,可以概括为:内皮损伤、血流动力学异常、血液成分的异常(图1)。
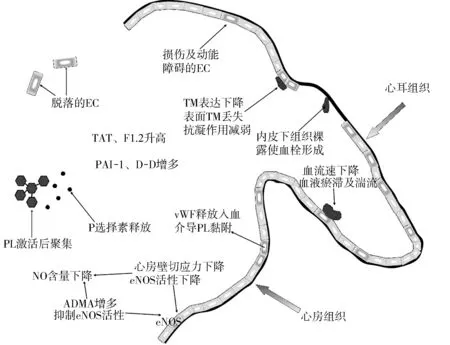
注:内皮损伤及功能障碍(vWF增多、TM表达下降),血流动力学改变(血液瘀滞、湍流),血液成分改变(凝血-纤溶系统异常、血小板激活)在心房颤动血栓形成中具有重要作用。EC=内皮细胞;PL=血小板;PAI-1=纤溶酶原激活物抑制剂-1;D-D=D二聚体。
图1 心房颤动血栓形成机制
目前,关于心房颤动血栓形成机制研究的广泛开展,为临床提供了可能的血栓防治措施,如减少血液瘀血(左心耳封堵),恢复内皮功能(维持窦性心律、抗炎、抗氧化),新型口服抗凝药物(达比加群、利伐沙班)。但仍面临众多问题。如:(1)心房颤动如何导致内皮功能损伤及凝血-纤溶系统活性异常,上游调控机制如何;(2)心房颤动时左右心房与外周血管的内皮功能有无差异;(3)抗氧化、抗炎药物(如他汀类药物、维生素C等)、肾素-血管紧张素系统拮抗剂及受体阻滞剂能否通过抗心肌重构、保护内皮功能等途径减轻心房颤动时的内皮功能损伤及凝血抗凝系统活性异常。以上问题有待解决,并有可能成为今后心房颤动血栓形成机制研究的主要方向。
[1] Wu N,Tong S,Xiang Y,et al.Association of hemostatic markers with atrial fibrillation: a meta analysis and meta-regression[J].PLoS One,2015,10(4):e0124716.
[2] Lim HS,Willoughby SR,Schultz C,et al.Effect of atrial fibrillation on atrial thrombogenesis in humans:impact of rate and rhythm[J].J Am Coll Cardiol,2013,61(8):852-860.
[3] Nobuyuki F,Tadakazu H,Kazumasa O,et al.Relation of the severity of mitral regurgitation to thromboembolic risk in patients with atrial fibrillation[J].Int J Cardiol,2011,146(2):197-201.
[4] Faucheier L,Philippart R,Clementy N,et al.How to define valvular atrial fibrillation?[J]. Arch Cardiovasc Dis,2015,S1875-2136(15):00116-3.
[5] Khoo CW,Krishnamoorthy S,Lim HS,et al.Atrial fibrillation, arrhythmia burden and thrombogenesis[J].Int J Cardiol,2012,157(3):318-323.
[6] Cresti A,García-Fernández MA,Miracapillo G,et al.Frequency and significance of right atrial appendage thrombi in patients with persistent atrial fibrillation or atrial flutter[J].J Am Soc Echocardiogr,2014,27(11):1200-1207.
[7] Jen N,Yu F,Lee J,et al.Atrial fibrillation pacing decreases intravascular shear stress in a New Zealand white rabbit model:implications in endothelial function[J].Biomech Model Mechanobiol,2013,12(4):735-745.
[8] Busch R,Strohbach A,Pennewitz M,et al.Regulation of the endothelial apelin/APJ system by hemodynamic fluid flow[J].Cell Signal,2015,27(7):1286-1296.
[9] Steinberg BA,Hellkamp AS,Lokhnygina Y,et al.Higher risk of death and stroke in patients with persistent vs. paroxysmal atrial fibrillation:results from the ROCKET-AF trial[J].Eur Heart J,2015,36(5):288-296.
[10]Brambatti M,Connolly SJ,Gold MR,et al.Temporal relationship between subclinical atrial fibrillation and embolic events[J]. Circulation,2014,129(21):2094-2099.
[11]Hirsh BJ,Copeland-Halperin RS.Fibrotic atrial cardiomyopathy, atrial fibrillation and thromboembolism: mechanistic links and clinical inferences[J].J Am Coll Cardiol, 2015,65(2):2239-2251.
[12]Matsue Y,Suzuki M,Abe M,et al.Endothelial dysfunction in paroxysmal atrial fibrillation as a prothrombotic state.Comparison with permanent/persistent atrial fibrillation[J].J Atheroscler Thromb,2011,18(4):298-304.
[13]Wong CX,Lim HS,Schultz CD,et al.Assessment of endothelial function in atrial fibrillation:utility of peripheral arterial tonometry[J].Clin Exp Pharmacol Physiol, 2012,39(2):141-144.
[14]Katoh S,Honda S,Watanabe T,et al.Atrial endothelial impairment through Toll-like receptor 4 signaling causes atrial thrombogenesis[J].Heart Vessels,2014,29(2):263-272.
[15]Ko D,Magnani JW,Hylek EM.Biomarkers in lone atrial fibrillation—an additional ‘fine tuning’ of risk[J].Curr Pharm Des,2015,21(5):645-658.
[16]Krishnamoorth S,Khoo CW,Lim HS,et al.Prognostic role of plasma von Willebrand factor and soluble E-selectin levels for future cardiovascular events in a ‘real-world’ community cohort of patients with atrial fibrillation[J].Eur J Clin Invest,2013,43(10):1032-1038.
[17]Goette A,Hammwohner M,Bukowska A,et al.The impact of rapid atrial pacing on ADMA and endothelial NOS[J].Int J Cardiol,2012,154(2):141-146.
[18]Chao TF,Lu TM,Lin YJ,et al.Plasma asymmetric dimethylarginine and adverse events in patients with atrial fibrillation referred for coronary angiogram[J].PLoS One,2013,8(8):e71675.
[19]Dharmasaroja P,Dharmasaroja PA,Sobhon P.Increased plasma soluble thrombomodulin levels in cardioembolic stroke[J].Clin Appl Thromb Hemost,2012,18(3):289-293.
[20]Jorge C,Ramon M,Francisco E,et al.Limited ability to activate protein C confers left atrial endocardium a thrombogenic phenotype.A role in cardioembolic stroke[J].Stroke,2011,42(9):2622-2624.
[21]Kottkamp H.Fibrotic atrial cardiomyopathy:a specific disease/syndrome supplying substrates for atrial fibrillation, atrial tachycardia, sinus node disease[J].J Cardiovasc Electrophysiol,2012,23(7):797-799.
[22]Marrouche NF,Wilber D,Hindricks G.Association of atrial tissue fibrosis identified by delayed enhancement MRI and atrial fibrillation catheter ablation[J].JAMA,2014,311(5):498-506.
[23]Wu N,Chen X,Cai T,et al.Association of inflammatory and hemostatic markers with stroke and thromboembolic events in atrial fibrillation: a systematic review and meta-analysis[J].Can J Cardiol,2015,31(3):278-286.
[24]Berge T,Ulimoen SR,Enger S,et al.Impact of atrial fibrillation on inflammatory and fibrinolytic variables in the elderly[J].Scand J Clin Lab Invest,20113,73(4): 326-333.
[25]Rubanenko AO,Shchukinlu V. Factors associated with thrombosis of the left atrial appendage in patients with chronic atrial fibrillation[J]. Klin Med(Mosk), 2014,92(11):29-34.
[26]Ząbczyk M,Majewski J,Lelakowski J.Thromboembolic events are associated with prolonged clot lysis time in patients with permanent atrial fibrillation[J].Pol Arch Med Wewn,2011,121(11):400-407.
[27]Choudhury A,Chung I,Blann AD,et al.Elevated platelet microparticle levels in nonvalvular atrial fibrillation: relationship to p-selectin and antithrombotic therapy[J].Chest,2007,131(3):809-815.
[28]Guo Y,Lip GY,Apostolakis S.Inflammation in atrial fibrillation[J].J Am Coll Cardiol,2012,60(22):2263-2270.
[29]Yashiro Y,Arimoto T,Hashimoto N,et al.Predictors of left atrial coagulation activity among paroxysmal atrial fibrillation patients[J].Circ J,2015,79(1):61-69.
[30]Jesel L,Arentz T,Herrera-Siklody C,et al.Do atrial differences in endothelial damage, leukocyte and platelet activation, or tissue factor activity contribute to chamber-specific thrombogenic status in patients with atrial fibrillation[J].J Cardiovasc Electrophysiol,2014,25(3):266-270.
[31]Breitenstein A,Glanzmann M,Falk V,et al.Increased prothrombotic profile in the left atrial appendage of atrial fibrillation patients[J].Int J Cardiol,2015, 185(2015):250-255.
Recent Progress in Mechanisms of Thrombogenesis in Atrial Fibrillation
LI Yanguang, SHI Xiangmin, LIN Kun, GUO Jianping, LI Jian, SHAN Zhaoliang, WANG Yutang
(DepartmentofCardiology,ChinesePLAGeneralHospital,Beijing100853,China)
心房颤动是临床常见的心律失常,其严重的危害在于局部血栓形成后脱落,随血液循环至各处动脉导致脑卒中与栓塞。目前主要治疗措施有口服抗凝药物及植入左心耳封堵器。但所有治疗措施的采用均基于对血栓形成机制的研究,目前在血栓形成机制中的血流动力学紊乱、内皮功能异常等方面有了新的研究成果。现对近年研究进展进行综述。
心房颤动;血栓形成;机制
Atrial fibrillation is the most common arrhythmia in clinic practice. Thrombosis formed in the left atrium and left atrial appendage during atrial fibrillation can shed and induce stroke or embolism. Administration of oral anticoagulation drugs and percutaneous left atrial appendage occlusion are the major measures. All these measures are based on thrombogenesis mechanisms research. Recently, developments have been made, especially in hemodynamics disturbance and abnormal endothelial function. This article reviews the progress in mechanisms of thrombogenesis in atrial fibrillation.
atrial fibrillation; thrombogenesis; mechanisms
军队保健专项课题(11BJZ10)
李延广(1990—),住院医师,在读硕士,主要从事心房颤动研究。Email:liyanguangsuper@163.com
王玉堂(1957—),主任医师,博士,主要从事心房颤动、心脏起搏与电生理研究。Email:yutang2@me.com
1004-3934(2015)06-0691-05
R541.7
A
10.3969/j.issn.1004-3934.2015.06.009
2015-06-08
2015-08-07

