3株导管相关血流感染鲍曼不动杆菌同源性分析*
孙恒彪,陈佑明,张 婧,潘祖汉,谢俊杰(南方医科大学第三附属医院检验科,广州 510630)
3株导管相关血流感染鲍曼不动杆菌同源性分析*
孙恒彪,陈佑明△,张 婧,潘祖汉,谢俊杰(南方医科大学第三附属医院检验科,广州 510630)
目的 对分离自同一患者不同血流部位的3株鲍曼不动杆菌进行同源性分析,在基因水平上明确中心静脉导管相关血流感染的实验室诊断,为临床防治提供依据。方法 采用西门子Microscan Walkaway 40 Plus微生物鉴定及药敏系统对分离的3株鲍曼不动杆菌进行细菌鉴定及药敏分析,应用肠杆菌科基因组间重复序列聚合酶链反应(ERIC-PCR)及琼脂糖凝胶电泳进行同源性分析。结果 3株鲍曼不动杆菌ERIC-PCR均扩增出阳性产物,3株细菌均电泳出13条位置相同的条带。结论 3株鲍曼不动杆菌属于相同的基因型,ERIC-PCR可用于鲍曼不动杆菌的同源性分析。
中心静脉导管; 导管相关血流感染; 鲍曼不动杆菌; 同源性
随着医疗技术的不断进步与发展,越来越多的侵入性操作用于临床疾病的诊断与治疗,其中中心静脉导管穿刺术是一种临床最常用的治疗手段。通过中心静脉导管可以进行高渗及强刺激药物输注、血液透析、营养支持治疗及动态监测血流动力学,可以避免多次外周静脉穿刺,减少患者痛苦,还可以避免化疗药物外渗,减少因化疗药物引起的静脉炎[1]。但是随着中心静脉导管的广泛使用,中心静脉导管引起的导管相关血流感染(CRBSI)在普通病房及重症监护病房(ICU)均有发生,不仅增加患者医疗支出及住院时间,而且给患者造成极大的痛苦,甚至威胁患者生命[2-3]。本次调查通过分析分离自同一患者外周血、中心静脉导管血及中心静脉导管尖端3株鲍曼不动杆菌同源性,查找分析造成此次CRBSI的可能原因,加深对CRBSI诊疗的认识,现报道如下。
1 资料与方法
1.1 一般资料 患者,女,84岁,因“反复胸闷、胸痛10年,再发伴头晕、头痛7 d”收入本院心内科。4月26日为了建立静脉输液通路,监测中心静脉血压,行经锁骨下中心静脉穿刺置管术。5月7日12:00左右患者出现发热,体温38.3 ℃,随即分别从中心静脉导管及右上肢抽取静脉血进行血培养,结合患者临床表现经验给予静脉滴注头孢曲松(CRO),当晚19:00左右中心静脉导管血细菌培养报阳性,涂片结果为革兰阴性杆菌,立即拔除导管并送检做导管尖端细菌培养及鉴定,5月8日01:00左右右上肢静脉血细菌培养报阳性,涂片结果为革兰阴性杆菌。5月10日中心静脉导管血、右上肢静脉血及中心静脉导管尖端培养结果均为鲍曼不动杆菌,中心静脉导管尖端鲍曼不动杆菌半定量计数结果为20 cfu。5月11日患者体温恢复正常。
1.2 质控菌株 大肠埃希菌(ATCC 25922)、铜绿假单胞菌(ATCC 27853)均由广东省临床检验中心提供。
1.3 细菌鉴定及药敏试验 采用西门子公司的Microscan Walkaway 40 Plus型微生物鉴定及分析系统对分离得到的3株鲍曼不动杆菌进行鉴定及药敏试验。药敏试验采用微量肉汤稀释法,药敏试验抗菌药物选择哌拉西林(PIP)、四环素(TET)、替卡西林/克拉维酸(TIM)、头孢他啶(CAZ)、CRO、头孢噻肟(CTX)、头孢吡肟(FEP)、美罗培南(MEM)、阿米卡星(AMK)、庆大霉素(GEN)、妥布霉素(TOB)、环丙沙星(CIP)、左氧氟沙星(LVX)、复方磺胺甲噁唑(SXT)14种药物。药敏试验结果以美国临床和实验室标准化协会指南文件2010版作为药敏试验判断标准。
1.4 细菌基因组DNA提取 于血平板上挑取单个菌落加入到含500 μL双蒸水的Eppendorf离心管中,12 000 r/min离心20 s,弃上清液,重复上述步骤洗涤细菌2次,最后弃上清液加入500 μL双蒸水,每管再加入10 mg/mL的蛋白酶K 10 μL,混匀58 ℃温浴60 min,取出离心管放入95 ℃水浴箱中水浴10 min后立即冰浴20 min,12 000 r/min离心1 min,取上清液作为聚合酶链反应(PCR)模板。
1.5 肠杆菌科基因组间重复序列(ERIC)-PCR反应体系 引物序列为ERIC2:5′-AAGTAAGTGACTGGGGTGAGCG-3′,由上海生工生物工程有限公司提供[4-5]。PCR反应体系:总体积40 μL,其中双蒸水20 μL,dNTP 4 μL,10×PCR Buffer 5 μL,引物2.0 μL,模板2.5 μL,Taq酶(5 U/μL)0.5 μL,MgCl26 μL。
1.6 PCR扩增 ERIC-PCR采用罗氏cobas TaqMan 48型PCR仪进行,ERIC-PCR反应条件[6]:先94 ℃变性5 min;后92 ℃变性30 s,52 ℃退火30 s,70℃延伸1 min,共计35个循环;最后再70 ℃延伸10 min。琼脂糖凝胶电泳:采用德国Biometra Compact M电泳仪进行电泳,4 μL扩增产物加1 μLLoading Buffer,共5 μL加入到1.2%琼脂糖凝胶中,电压80 V、电泳3 h。采用英国Uvitec Firereader凝胶成像仪对凝胶进行拍照。采用Quantity One V4.62版本对电泳结果进行聚类分析。
2 结 果
2.1 3株鲍曼不动杆菌耐药性分析 中心静脉导管血、右上肢静脉血及中心静脉导管尖端分离得到的3株鲍曼不动杆菌生物编码均相同,对临床常用抗菌药物敏感性较好。3株鲍曼不动杆菌对临床常用抗菌药物敏感性见表1。

表1 分离自导管静脉血、右上肢静脉血及导管尖端3株鲍曼不动杆菌耐药性分析
注:S表示敏感。
2.2 同源性分析 分离得到的3株鲍曼不动杆菌采用ERIC-PCR进行同源性分析,ERIC-PCR扩增产物进行琼脂糖凝胶电泳并拍照,电泳结果见图1。PCR扩增产物条带数量、位置完全相同为同一基因型;主条带相同,副条带相差1~2条为基因型相似或密切相关;不符合上述条件者为不同基因型。电泳结果显示,3株鲍曼不动杆菌扩增产物条带数均为13条且位置相同,故认为3株鲍曼不动杆菌为同一基因型。聚类分析结果见图2。
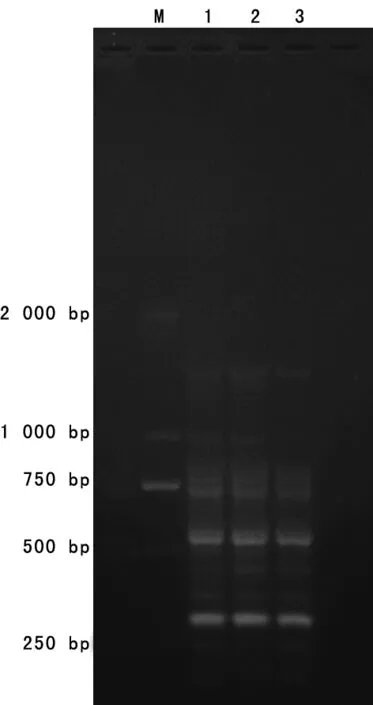
注:1为中心静脉导管血;2为右上肢静脉血;3为中心静脉导管尖端。
图1 3株鲍曼不动杆菌ERIC-PCR电泳结果

注:#1为中心静脉导管血;#2为右上肢静脉血;#3为中心静脉导管尖端。
图2 3株鲍曼不动杆菌聚类分析结果
3 讨 论
CRBSI是临床一种常见的院内感染,引起CRBSI的常见病原菌有凝固酶阴性葡萄球菌、金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌、鲍曼不动杆菌、真菌等,鲍曼不动杆菌已成为引起临床科室尤其是ICU的CRBSI的重要病原菌[7-9]。本次调查通过采用ERIC-PCR在基因水平对鲍曼不动杆菌引起的CRBSI给予确认,ERIC-PCR具有应用广泛、简便、快速、敏感性高及重复性好等特点,可用于细菌鉴定、分类及流行病学调查[10]。随着各种各样导管在临床上的使用,CRBSI时有发生,引起CRBSI有多种多样的原因,常见相关因素有:(1)导管类型及材料。双腔及多腔导管均可增加CRBSI发生的概率;聚乙烯材质的导管因细菌易定植,可使CRBSI发生率上升。(2)导管穿刺部位。锁骨下静脉感染率大于颈静脉,颈静脉感染率大于股静脉。(3)敷料的选择。临床常用半透性聚氨酯敷贴可造成皮肤局部潮湿,增加细菌定植及感染概率。(4)导管留置时间。导管留置时间超过7 d是引起CRBSI的一个重要危险因素。(5)医护人员操作熟练程度。盲穿、穿刺时间过久、操作生疏等均可增加CRBSI的发生率。(6)患者因素。高龄、肿瘤、血液病、重症感染、创伤、营养不良、病情复杂、病程长,以及复杂大手术等均是CRBSI的易感因素[11]。在本次调查中,该患者送检的中心静脉导管血培养报阳时间为4.5 h,右上肢静脉血报阳时间为11.8 h,比中心静脉导管血报阳时间晚7.3 h,中心静脉导管血及右上肢静脉血培养结果均为鲍曼不动杆菌,拔除的中心静脉导管尖端也培养出了鲍曼不动杆菌,3株鲍曼不动杆菌药敏试验结果完全形同,对常用抗菌药物均敏感。依据CRBSI判断标准[12]:导管尖端培养阳性计数大于或等于15 cfu,中心静脉导管血阳性报警时间比外周血报警时间早2 h以上,该患者可确诊为CRBSI,同时ERIC-PCR同源性分析结果在基因水平也显示该患者发生了CRBSI。该患者病情十分复杂,合并多种疾病:(1)冠心病、稳定型心绞痛;(2)高血压;(3)慢性支气管炎、慢性胆囊炎及慢性胃炎;(4)右肾切除术后、慢性肾衰竭、高钾血症;(5)5年前阑尾炎穿孔阑尾及直肠切除,乙状结肠造口术后;(6)骨质疏松;(7)轻度贫血。结合上述,高龄、病情复杂、病程长、复杂大手术等均可能是造成该患者此次CRBSI的原因,但不能排除其他因素。
由于中心静脉导管的广泛使用及易发生CRBSI的特性,这就要求在日常工作中严格无菌操作,组织医护人员进行培训,规范导管操作技术,提高导管护理水平,每天更换敷贴,对导管进行肝素化,防止血栓形成,根据病情及时拔除导管,积极治疗原发疾病,伴有复杂疾病的老年人做好支持治疗,提高患者免疫力[13]。同时,在怀疑CRBSI时应及时送检血培养及导管尖端细菌培养,为临床诊断及治疗提供依据。
[1]熊琼,任小红.中心静脉导管相关血流感染的研究进展[J].护理研究,2010,24(6):475-478.
[2]Pronovost PJ,Goeschel CA,Colantuoni E,et al.Sustaining reductions in catheter related bloodstream infections in Michigan intensive care units:observational study[J].BMJ,2010,340(4):309-319.
[3]Nabi Z,Anwar S,Barhamein M,et al.Catheter related infection in hemodialysis patients[J].Saudi J Kidney Dis Transpl,2009,20(6):1091-1095.
[4]Guimaraes AS,Dorneles EM,Andrade GI,et al.Molecular characterization of Corynebacterium pseudotuberculosis isolates using ERIC-PCR[J].Vet Microbiol,2011,153(3/4):299-306.
[5]Ye Y,Jiang Y,Fan T,et al.Resistance characterization,virulence factors,and ERIC-PCR fingerprinting of aeromonas veronii strains isolated from diseased trionyx sinensis[J].Foodborne Pathog Dis,2012,9(11):1053-1055.
[6]周云芳,袁维荣,曹清.医院多重/泛耐药鲍曼不动杆菌的同源性分析[J].临床儿科杂志,2010,28(6):518-522.
[7]芮晓艳,胡杰贵,熊自忠.耐亚胺培南鲍曼不动杆菌碳青霉烯酶检测及同源性分析[J].安徽医科大学学报,2012,47(2):154-157.
[8]Qasim M,Zafar A,Ejaz H,et al.Changing trends in frequency and antimicrobial susceptibility of pathogens causing catheter related infections in children[J].African J Microbiol Res,2013,5(7):351-360.
[9]郑炘,刘纹,刘晓敏,等.520例肿瘤患者外周置入中心静脉导管相关感染病原菌分布分析[J].现代诊断与治疗,2012,23(9):1554-1555.[10]Chakraborty RD,Surendran PK,Joseph TC.Molecular typing of Vibrio parahaemolyticus strains isolated from Marine finfishshellfish landed along south-west coast ofIndia[J].Indian J Fish,2013,60(1):87-96.
[11]Frasca D,Dahyot-Fizelier C,Mimoz O.Prevention of central venous catheter-related infection in the intensive care unit[J].Crit Care,2010,14(2):212-218.[12]Mermei LA,Allon M,Bouza E,et al.Clinical practice guidelines for the diagnosis and management of intravascular Catheter-Related infection:2009 update by the infectious diseases society of America[J].Clin Infect Dis,2009,49(1):1-45.
[13]王亚霞,刘亚新,沈培琼.中心静脉导管相关感染128例的临床分析和预防措施[J].解放军护理杂志,2010,27(9):680-682.
Analysis on homology of 3 strains of Acinetobacter bnaumannii in catheter-related bloodstream infection*
SUNHeng-biao,CHENYou-ming△,ZHANGJing,PANZu-han,XIEJun-jie
(DepartmentofClinicalLaboratory,ThirdAffiliatedHospital,SouthernMedicalUniversity,Guangzhou,Guangdong510630,China)
Objective To analyze the homology of 3 strains of Acinetobacter baumannii isolated from different bloodstream positions in the same patient for definiting the laboratory diagnosis of central venous catheter-related bloodstream infection at the gene level to provide the basis for clinical prevention and treatment.Methods 3 strains of Acinetobacter baumannii were identified and the drug sensitivity was performed by using Microscan Walkaway 40Plus microbiological idetification and drug susceptibility system(Sienems,German).The homogeneous genotyping was performed by using enterobacteria repetitive intergenic consensus-polymerase chain reaction (ERIC-PCR) and Agarose gel electrophoresis.Results The positive products were amplified from 3 strains of Acinetobacter baumannii.13 bands with the same location appeared by electrophoresis.Conclusion 3 strains of Acinetobacter baumannii belong to the same genotype.ERIC-PCR can be used in the homology analysis of Acinetobacter baumannii.
central venous catheter; catheter-related bloodstream infection; acinetobacter baumanni; homology
广东省广州市科技计划项目(2012Y5-00004)。
孙恒彪,男,本科,主管检验师,主要从事临床微生物检验。
△通讯作者,E-mail:cym38432@163.com。
10.3969/j.issn.1672-9455.2015.09.014
A
1672-9455(2015)09-1215-03
2014-11-15
2015-01-18)

