一株能促进辣椒生长的生防芽孢杆菌
张梦君,谭石勇,薛召东,谈泰猛,孙向平,严准,曾粮斌
(1.中国农业科学院麻类研究所,长沙,410205;2.中南林业科技大学生命科学与技术学院;3.湖南泰谷生物科技股份有限公司;4.农业部植物营养与生物肥料重点实验室)
辣椒(Capsicum annuumL.),又名番椒、秦椒、辣角等,茄科、辣椒属,为一年或有限多年生草本植物。辣椒果实通常呈圆锥形或长圆形,未成熟时呈绿色,成熟后变成鲜红色、绿色或紫色,以红色最为常见[1]。辣椒用途很广,不仅可鲜食、加工成食品、还可作为调料品和医药、化工、军工等方面的原料。其独特的辛辣芳香的诱人剌激和对人体的营养保健功能,吸引了世界上越来越多的人们,比如吃腻了酸甜味的西方人,为了寻求刺激越来越喜欢辣椒美食。辣椒在东南亚、南亚、朝鲜半岛和拉丁美洲等许多国家均有种植,已经成为世界上仅次于豆类、番茄的第三大蔬菜作物[2]。辣椒疫病俗称“死秧病”,是由辣椒疫霉引起的一种土传病害,大水漫灌和高温高湿条件下容易大面积流行,常造成辣椒减产,甚至绝收,已成为世界范围内辣椒的毁灭性病害。化学防治不能从根本上解决辣椒疫病,当辣椒疫病大面积暴发时,农药无法对其有效控制。因此,越来越多的研究人员将目光投向病原菌的拮抗菌,希望通过拮抗菌的生物防治控制辣椒疫病[3]。
芽孢杆菌(Bacillusspp.)是一类好氧兼厌氧、产生抗逆性内生孢子的杆状细菌,可忍受各种不良的环境条件, 是一种常见的根际促生细菌(Plant Growth-promoting Rhizobacteria,简称PGPR)[4]。 芽孢杆菌的促生机制主要包括:一是提高植物根际养分的可利用性,如促进难溶性磷、铁和微量元素的吸收[5];二是产生植物激素类物质,如吲哚乙酸(IAA)、细胞分裂素(cytokinins)和赤霉素(GAs)等[6~8];三是产生挥发性化合物(volatiles)[9]。此外,还可以通过抑制病原物和诱导抗性来间接地促进植物生长[10]。本试验采用盆栽的方法,研究一株芽孢杆菌PBS-14 对辣椒生长和疫病发生的影响,为后续生物菌肥的开发应用提供理论基础。
1 材料与方法
1.1 试验材料
①供试菌及培养基 芽孢杆菌PBS-14 和辣椒疫酶病原真菌都为本实验室前期分离并保存。芽孢杆菌培养采用牛肉膏蛋白胨液体培养基 (NB):蛋白胨10 g、牛肉膏5 g、NaCl 5 g,去离子水定容至1 000 mL,pH 值7.2~7.4,1×105Pa 灭菌30 min。辣椒疫酶病原真菌培养采用PDA 液体培养基:去皮马铃薯200 g、 葡萄糖20 g、 水1 000 mL,pH 值7.2~7.4,1×105Pa 灭菌30 min。
②供试辣椒品种及育苗基质 选用湖南省农业科学院蔬菜研究所提供的甜椒品种茄门。种子用10%双氧水表面消毒20 min,无菌水冲淋3 遍,置于直径9 cm 的培养皿中,30℃下恒温暗光催芽。选取芽长一致(0.5 cm)的种子播于9 孔钵中,基质为市售营养土,辣椒置于 (30±1)℃人工气候箱下生长,光强12 000 lx,光周期L∶D=14∶10,RH=80%±10%。
1.2 试验方法
①试验设计 试验设3 个处理, 分别为清水(CK1)、NB 培养基 (CK2)、 芽孢杆菌PBS-14 菌液(T)。芽孢杆菌PBS-14 在30℃,180 r/min 条件下培养48 h,用无菌水将菌液稀释至1×105cfu/mL。辣椒疫酶病原菌在30℃,180 r/min 条件下培养7 d,用无菌水将菌液稀释至1×108cfu/mL。9 孔钵中每孔播2 粒,保证每个处理18 株苗,待辣椒3~4 叶时根际施加辣椒疫酶病原菌菌液2.5 mL,然后3 个处理各自施加相应处理液2.5 mL。 每隔2 d 每孔施加5 mL 营养液,以保证基质较为湿润,辣椒正常生长。观察辣椒生长态势,40 d 后测定辣椒株高、茎粗、节间距、上半部分鲜(干)质量及根系鲜(干)质量等生长指标,统计每组辣椒疫病发病株数。发病株率(%)=(发病株数/调查总株数)×100%;防治效果 (%)=[1-处理组发病株率/清水对照发病株率]×100%。
②测定方法 测量从辣椒植株基部至主茎顶部即主茎生长点之间的距离为株高、植株近根结的第一节茎的直径为茎粗。植株每小节茎的长度为节间距,选取近根结的前2 节。将辣椒植株从近根结的第一个节点剪断,分别称取上半部分和根系部分质量,记为鲜质量,然后放于85℃烘箱中烘干至恒重,再次分别称量,记为干质量。
③数据处理 数据统计和分析采用 Excel 2007 和SPSS 17.0 软件完成。

图1 不同处理下辣椒的生长态势
2 结果与分析
2.1 不同处理对辣椒生长的影响
从图1 可以看出,施加芽孢杆菌PBS-14 加辣椒疫酶病原菌菌液的辣椒生长态势明显好于两对照组。对照组间,CK2辣椒生长态势明显优于CK1。
由表1 可以看出,在施加芽孢杆菌PBS-14 菌液的情况下,辣椒株高,茎粗,节间距,上半部分鲜、干质量及根系鲜、 干质量均不同程度高于CK1和CK2,CK2各项生长指标较CK1也明显提高。株高方面,与CK1和CK2相比,T 处理分别提高25.3%和15.0%,CK2较CK1提高8.9%。茎粗方面,与CK1和CK2相比,T 处理分别提高20.4%和6.0%,CK2较CK1提高13.6%。第一节节距,与CK1和CK2相比,T处理分别提高18.1%和21.8%,CK2较CK1降了3.1%。第二节节距,与CK1和CK2相比,T 处理分别提高52.5%和10.3%,CK2较CK1提高38.3%。上半部分鲜质量,与CK1和CK2相比,T 处理分别提高43.4%和23.6%,CK2较CK1提高16.0%。上半部分干质量, 与CK1和CK2相比,T 处理分别提高58.3%和18.8%,CK2较CK1提高33.3%。根系鲜质量,与CK1和CK2相比,T 处理分别提高72.3%和3.8%,CK2较CK1提高66.0%。根系干质量,与CK1和CK2相比,T 处理分别提高83.3%和22.2%,CK2较CK1提高50%。

表1 3 个不同处理对辣椒生长的影响
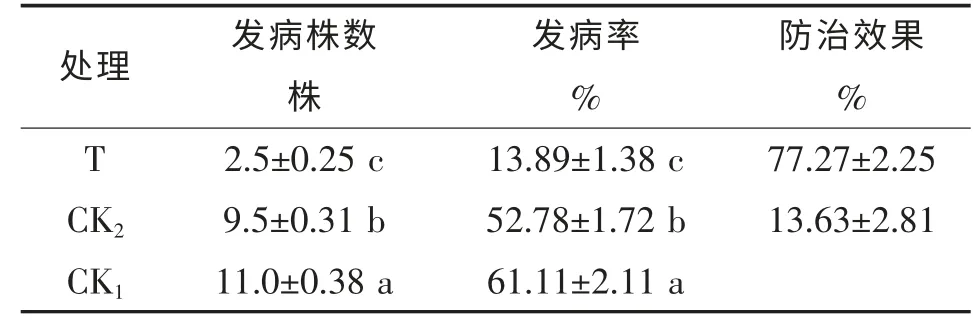
表2 不同处理的辣椒疫病发生情况
2.2 不同处理对辣椒疫病的防治效果
由表2 可知,不同处理之间辣椒疫病发生情况差异较大,T 处理发病株数显著低于CK1和CK2,而加有NB 培养基的CK2发病率也显著低于清水的CK1,说明芽孢杆菌PBS-14 能有效控制辣椒疫病的发生,防治效果可达77.27%,同时,NB 培养基可以通过提高辣椒营养状况来提高辣椒抗疫病能力。
3 讨论与结论
通过盆栽试验可知,芽孢杆菌PBS-14 能促进辣椒生长,同时对辣椒疫病有较好的防治效果。
Rodriguez 等[11]研究发现,Bacillus 属的许多菌株都具有很强的磷溶解能力,并认为这是靠分泌有机酸来降解无机磷的;Idris 等[12]首次证明了B.amyloliquefaciens 菌群可以通过分泌生长素类似物(IAA)来促进植物的生长;张霞等[13]在试验中发现,添加枯草芽孢杆菌B931 后,甘薯苗的发根数和根长均显著增加;蔡学清等[14]对辣椒内生枯草芽孢杆菌BS-2 的研究证明,BS-2 对辣椒苗有明显的促生作用,而且可诱导辣椒体内吲哚乙酸等促生长激素的生成,并可降低脱落酸等抑制植物生长激素的含量。此外,芽孢杆菌作为生防菌防治土传病害的试用已十分广泛。郭坚华等[15]采用芽孢杆菌B13 制成的泥炭制剂防治生姜青枯病在小区试验中防效达100%,增产34.87%~48.15%。Silveria 等[16]发现凝结芽孢杆菌 (Bacillus coagulans)、 巨大芽孢杆菌(B.megaterium)和蜡状芽孢杆菌(B.cereus)3 种芽孢杆菌对番茄青枯病具有防病作用,同时还可以提高种子的发芽率。本试验中,实验组即施加芽孢杆菌PBS-14 加辣椒疫酶病原菌菌液的辣椒株高、茎粗、节间距、上半部分鲜、干质量和根系鲜、干质量等生长指标均明显高于对照组CK1和CK2。由此,可以得出芽孢杆菌PBS-14 对辣椒具有显著的促生效果。
[1]刘林娅.辣椒种质资源遗传多样性的形态学及ISSR 标记分析[D].海口:海南大学,2013.
[2]张西露,毛亦卉,向拉蛟.国内外辣椒产业研究开发的现状分析[J].辣椒杂志,2008(1):1-5.
[3]涂璇.辣椒疫霉生防菌筛选及生防菌剂应用研究[D].杨凌:西北农林科技大学,2004.
[4]胡容平,邓香洁,龚国淑,等.成都市郊区土壤芽孢杆菌的解磷、解钾潜力[J].四川农业大学学报,2008,26(2):167-169.
[5]吴海燕,金荣德,范作伟,等.解磷巨大芽孢杆菌(Bacillus megaterium)的溶磷机理探讨[J].吉林农业大学学报,2014,36(2):171-175.
[6]KaradenizA,TopcuogluSF,InanS.Auxin,gibberellins,cytokinin and abscisic acid production in some bacteria[J].World Journal ofMicrobiologyandBiotechnology,2006,22(10):1061-1064.
[7] Hamdache A, Lamarti A, Aleu J, et al. Non-peptide metabolites from the genus Bacillus [J].Journal of Natural Products,2011,74(4):893-899.
[8]Gamalero E,Glick B R.Mechanisms used by plant growth promoting bacteria[M]//Maheshwari D K.Bacteria in agrobiology:Plant nutrient management.Berlin:Springer-Verlag Berlin and Heidelberg GmbH&Co.K,2011.
[9]李哲.芽孢杆菌促生作用及具有促生作用的挥发物质研究[D].南京:南京农业大学.
[10]叶晶晶,曹宁宁,吴建梅,等.生防芽孢杆菌的应用研究进展[J].西北农林科技大学学报:自然科学版,2014,42(8):185-190.
[11]Rodriguez H,Fraga R.Phosphate solubilizing bacteria and their role in plant growth promotion[J].Bioteehnology Advanees,1999,17:319-339.
[12]Idris E E,Makarewicz O,Farouk A,et al.Extracellular phytase activity of Bacilus amyloliquefaciens FZB45 contributes to its plant-growth promoting effect[J].Microbiology,2002,148:2097-2109.
[13]张霞,唐文华,张力群.枯草芽孢杆菌B931 防治植物病害和促进植物生长的作用[J].作物学报,2007,33(2):236-241.
[14]蔡学清,何红,胡方平.内生菌BS-2 对辣椒苗的促生作用及对内源激素的影响[J].亚热带农业研究,2005,1(4):49-52.
[15]郭坚华,孔平华,吴云波.植物细菌性青枯病的生物防治机制和途径[J].中国生物防治,1997,13(1):42-46.
[16]Silveira E B D,Mariano R,Michereff S J,et al.Antagonism of Bacillus spp.against Psendomonas solancearum and effect on tomato seedling growth[J].Fitopat-biologia Brasileira,1995,20(4):600-612.

