澳大利亚救生药物计划及对我国罕见病医疗救助制度的启示
关轶茹 相 维 张 方
沈阳药科大学工商管理学院 辽宁沈阳 110016
·药物政策·
澳大利亚救生药物计划及对我国罕见病医疗救助制度的启示
关轶茹 相 维 张 方
沈阳药科大学工商管理学院 辽宁沈阳 110016
目的:介绍澳大利亚救生药物计划,为完善我国罕见病医疗救助制度提供参考。方法:根据文献分析澳大利亚救生药物计划的主要内容和特点,并与国内罕见病医疗救助现状进行比较。结果:澳大利亚通过孤儿药资格认证和成本效益评估将符合条件的孤儿药纳入救生药物计划,并通过财政资助为罕见病患者提供免费的治疗药物。该计划规定了严格的孤儿药和患者纳入条件,建立了罕见病临床指南和专家咨询制度,并定期开展上市后再审查,提高了孤儿药的可及性。结论:我国应当借鉴澳大利亚经验,由国家主导罕见病和孤儿药的管理,在大病医疗保险的基础上探索符合我国国情的罕见病医疗救助制度。
救生药物计划; 罕见病; 孤儿药; 医疗保障
澳大利亚的全民医疗保障体系以药物福利计划(Pharmaceutical Benefits Scheme,PBS)为主体,通过政府资助PBS清单内的药品,保障公民的基本用药。在此基础上,澳大利亚政府补充了救生药物计划(Life Saving Drugs Program,LSDP),专门为罕见病患者提供免费的孤儿药。LSDP的实施保障了澳大利亚孤儿药的可及性,是全球罕见病医疗保障领域的先驱。本文通过介绍澳大利亚LSDP,分析其制度优势,为我国罕见病医疗救助制度的实施提供参考。
1 LSDP概况
1.1 历史沿革
1989年,澳大利亚对治疗药物法案(Therapeutic Goods Act)进行修订,通过了一系列激励机制以促进制药企业研发孤儿药。[1]1994年起,澳大利亚开始执行一项计划,帮助之前无法医治的罕见病患者免费获取昂贵的治疗药物。该计划最初选取了部分I型戈谢病患者,根据审计法(Audit Act)的特赦令(Act of Grace),通过财务部支付其接受酶替代疗法的费用。之后,该计划逐渐正规化,并于1995年末正式演变为现在的救生药物计划。[2]LSDP旨在为患有严重或罕见疾病的患者免费提供昂贵的、拯救生命的药物资助。
1.2 药品纳入LSDP的流程
1.2.1 孤儿药资格认证
澳大利亚治疗用品管理局(Therapeutic Goods Administration, TGA)负责药品的注册登记,通过TGA评估的药品获得上市销售资格。对于孤儿药,企业需首先获得TGA授予的孤儿药资格认证,然后提交注册申请。TGA规定若要获得孤儿药资格,必须满足三方面条件:(1)用于治疗、预防、诊断罕见疾病或其他疾病但在澳大利亚境内无法进行商业供应的药物、疫苗或体内诊断试剂;(2)1998年1月1日前未注册过的药品或已注册过但有新的罕见病适应症的药品;(3)使用该药品治疗相应疾病的安全性数据均得到澳大利亚、美国、英国、加拿大、瑞典、荷兰以及欧盟药品管理机构的认可。[3]生产商必须阐明为何该药品为孤儿药,对于疫苗或体内诊断试剂,还需声明该疫苗或试剂的相应疾病或适应症经注册后,每年在澳大利亚的使用人数不超过2 000人。[4]
1.2.2 成本效益评估
澳大利亚药物福利咨询委员会(Pharmaceutical Benefits Advisory Committee, PBAC)负责药品的成本效益评估,并向卫生部提出药品是否纳入PBS的建议。药品申请纳入LSDP计划与申请纳入PBS目录的初始程序相同,但前者的生产商需要在其向PBAC提交的申请中阐明其纳入LSDP计划的要求。PBAC根据生产商提供的临床试验数据和经济性数据展开成本效益分析并评估其对财政支出的影响。如果PBAC认为该药品经济性数据(即成本效益值)不满足纳入PBS目录的条件,但具有临床有效性,则对其是否满足LSDP财政资助标准进行评估,并提出建议。
1.2.3 财政资助申请
澳大利亚卫生部(Department of Health)负责向政府提交财政资助申请。PBAC一旦决定药品适合纳入LSDP,卫生部则会同企业以及相关领域的疾病专家咨询委员会(Disease Advisory Committees, DACs)对患者需满足的特定临床标准、使用该药品的患者数量、每个患者使用的剂量以及药品费用等问题展开非正式讨论,从而为卫生部向政府提交财政资助申请做准备。政府会在年度联邦预算(Commonwealth Budget)中对此进行考量。如果政府批准在LSDP计划下资助该药品,卫生部便与疾病专家咨询委员会制定该药品的临床应用指南,同时与企业确定药品供应的物流问题以及资助协议。[2]
1.3 接受LSDP资助的药品及患者需满足的条件
1.3.1 药品入选条件
药品若要获得LSDP的资助必须满足以下条件:(1)对于某一罕见病来说,该药品被认为是行之有效的治疗方法,即药品的适应症通过TGA批准;(2)流行病学研究表明,该疾病会显著缩短人的预期寿命,而有证据证明使用该药物可直接延长患者寿命;(3)患有该疾病的患者可在合理的诊断精度内确诊;(4)该药品必须通过PBAC评估,并认为其临床有效,但因不能满足成本效益标准而被拒绝纳入PBS清单;(5)在PBS清单内没有替代药品,且公立医院住院患者也无法获得替代药品;(6)没有适当的且符合成本效益标准的非药物疗法(如手术、放射疗法)替代;(7)药品费用对患者或其监护人造成不合理的经济负担。[5]
1.3.2 患者入选条件
患者必须满足以下条件才能获得LSDP计划资助的药品:(1)符合相关药品或疾病LSDP指南中描述的使用该药品治疗的标准;(2)参与相关药品有效性定期评估,或有正当理由可不参与;(3)患者不应患有可能危及药物治疗有效性的其他疾病(包括并发症或后遗症);(4)患者应当为拥有医保资格的澳大利亚常住居民。[5]
患者资格会根据相关药品或疾病LSDP指南中规定的频率进行审核,但通常是开始治疗后每12个月审核一次。
1.4 LSDP发展现状
经过20多年的发展,目前由LSDP免费资助的药品共有10种,用于治疗7种由于基因缺陷而导致的罕见病(表1)。

表1 LSDP资助的药品和对应疾病
数据来源:Australian Government Department of Health. Other supply arrangements outside the Pharmaceutical Benefits Scheme (PBS)[EB/OL]. http://www.health.gov.au/lsdp
2015年2月,澳大利亚卫生部决定通过LSDP为2~18岁庞贝氏症患者提供Myozyme药物治疗,这一决定将改变患有晚发型庞贝氏症(late-onset Pompe)的儿童和青少年患者的生命,而在此前,LSDP只资助婴幼儿庞贝氏症(infantile-onset Pompe)患者。[6]近年来,在LSDP资助下接受罕用药治疗的患者逐年增加,澳大利亚政府对该计划的财政支出也基本呈稳步增长的态势(表2)。据统计,2013—2014年,在该计划下接受治疗的患者达257人。目前,仍有268名患者正接受治疗。通过该计划平均治疗一个患者每年需花费30多万美元。[7]
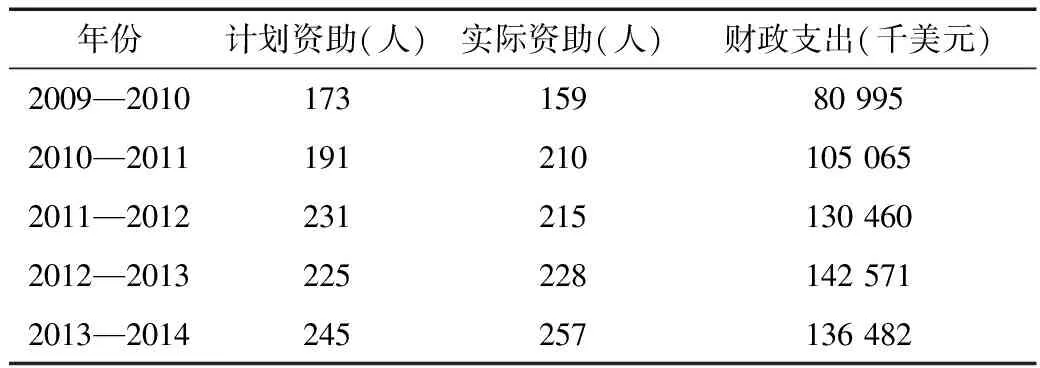
表2 2009—2014年LSDP资助患者人数和财政支出情况
数据来源:Department of Health and AgeingAnnual Report[R]. 2013.
2 LSDP的特点
2.1 打破药物经济学评估框架,强调孤儿药临床有效性
澳大利亚是较早将药物经济学应用于医保药物目录决策的国家之一,成本效益评估是PBAC评估药品是否纳入PBS的重要标准。然而,随着医疗保障水平的提高,各国均意识到以药物经济学标准作为孤儿药纳入医保的硬性门槛有失公允。澳大利亚在基于普通药物评估框架的基础上,将“临床有效”作为标准,将能够挽救生命但不符合成本效益的昂贵药物纳入救生药物计划。这一纳入标准在没有立法基础和专门评价机构的情况下,有目的地将几类极度罕见的疾病纳入其中,效果显著。
2.2 定期展开上市后再审查,保障罕见病患者用药需求
澳大利亚卫生部定期对LSDP进行上市后再审查(Post-marketing Review)。审查内容包括三方面:一是关于LSDP资助的药品,审核其临床有效性和安全性并通过评估每个药物的治疗效果(包括生命质量的改善及其费用)评价LSDP资助的药物是否“物有所值”;二是关于LSDP的管理,审核该计划的管理情况(包括每个疾病的指南),评估其他可供选择的方案,并基于公平原则对国际罕用药补贴以及罕见病/极度罕见病的定义进行比较;三是关于LSDP未来发展,审查未来有潜力通过LSDP资助的最新疗法和疾病,并对澳大利亚罕见病进行数据收集等。
作为政府上市后再审查(Government’s Post-market Reviews)计划的一部分,LSDP的上市后再审查以政府支出审核(Government’s Expenditure Review)所规定的适当性、有效性、效率、绩效考核、一体化和战略政策调整为原则,参考大量临床文献和研究、国际政策、指南和经验,并咨询LSDP所涉及的利益相关者,如澳大利亚政府部门、药物福利咨询委员会、药物福利定价机构(Pharmaceutical Benefits Pricing Authority, PBPA)、行业代表、临床专家以及消费者代表,对当前计划进行回顾,以确保患有严重罕见病的澳大利亚公民能继续获得急需的、昂贵的药物。2014年4月9日,澳大利亚卫生部宣布开始新一轮的救生药物计划上市后再审查,审查程序持续12个月左右。[8]
2.3 建立临床指南和专家咨询制度,完善患者资格审查程序
在患者管理方面,LSDP为该计划下的每个疾病都建立了相应的疾病专家咨询委员会,每个委员会由1名主席和4~5名相关疾病领域的临床专家组成。患者的主治医生负责阐述其临床特征,并向疾病委员会提交申请。疾病委员会负责撰写临床指南,用于规范患者初次纳入计划、持续治疗、监控日程以及停药标准等,并根据指南对患者的治疗资格、最适宜的药物和剂量及其特殊监控日程进行评估,考虑其在LSDP计划中进行治疗的可能性。委员会成员每6个月召开一次面对面会议,针对每个患者的治疗进程进行审核并提出建议。两次会议期间,如果出现患者管理问题或者有新的患者加入,委员会成员会通过电子邮件或电话会议的方式进行内部沟通。
疾病委员会和临床指南的设立使患者的管理系统化、程序化、专业化,同时也是LSDP申请资助的主要依据来源,二者在救生药物计划建立初始阶段的管理中发挥了重要作用。2014年3月,作为澳大利亚政府放宽管制议程的一部分,卫生部批准精简LSDP行政管理流程。为了减轻DAC成员的行政负担,降低其可能存在的利益冲突风险,2014年5月1日起,LSDP患者资格审查的工作由原来的疾病委员会完成并向卫生部报告转为直接由卫生部负责,同时卫生部会根据实际情况和需求向相关领域临床专家寻求建议。[7]由此可以看出,患者申请资助的程序发生了变化(图1)。这一举措将使原来疾病委员会成员能够完全参与到LSDP的上市后再审查中,并代表患者自由提出建议。

注:左:2014年5月1日前,右:2014年5月1日后图1 患者申请纳入LSDP程序变化
2.4 单独筹资和费用控制机制
在筹资方面,LSDP与PBS有很大差异。PBS基于特定的立法基础,而LSDP则通过年度拨款法案(Annual Appropriation Bills)单独筹资,即政府通过议会批准的年度拨款项目为该计划提供资助。此外,LSDP设定了明确的资助范围,即只资助治疗药物的费用,而药物的运输、储藏和管理以及其他与使用该药物相关的医院或医疗费用则不予以资助。[5]
3 LSDP对我国罕见病医疗救助制度的启示
3.1 国家主导罕见病和孤儿药的管理
澳大利亚政府在全国范围内实施救生药物计划,主导罕见病医疗救助制度,其优势主要表现在四个方面:(1)对于纳入LSDP计划的药品以及接受该计划资助的患者设立严格的标准,确保了该计划在全国范围内的统一性和公平性;(2)国家主导罕用药的管理,有利于昂贵资源的优化利用;(3)罕用药的临床试验因为条件匹配的患者有限、疾病表型多变、患者自然病程多变等各种因素而十分复杂,澳大利亚地广人稀的地理特征更增加了罕见病临床试验的难度,而LSDP制度的实施则间接为罕见病临床试验提供了便利条件;(4)专家资源的集中、疾病指南的建立促进了给药方案的最优化,有利于治疗方法的创新。我国可以借鉴澳大利亚救生药物计划,发挥国家主导的优势,建立罕见病和孤儿药管理制度,建立和完善我国的罕见病数据库,推动罕见病医学研究和诊疗水平的提高,保障我国孤儿药的可及性。
3.2 探索符合我国国情的罕见病医疗救助制度
与澳大利亚情况不同,我国的罕见病发病率虽然极低,但数量较多。世界卫生组织将罕见病定义为患病人数占总人口的0.65‰~1‰之间的疾病或病变,按此发生率计算,我国各类罕见病患者总数应超过千万人。[9]目前,通过罕用药市场保障政策的调控管理,将罕见病治疗作为一项社会公共产品由公共医疗保险机构分担相应的医疗费用已成为国际主流发展方向。[10]而我国目前仍未对罕见病进行明确定义,罕见病患者群体的流行病学数据不完整,罕见病的诊疗水平不高。近年来,随着新医改的持续推进,全民医保体系初步建立,我国已经开始探索建立城乡居民大病保险。2012年8月,国家发展改革委、原卫生部等六部委提出《关于开展城乡居民大病保险工作的指导意见》(发改社会〔2012〕2605号),首次提出在参保(合)者患大病发生高额医疗费用的情况下,对城镇居民医保、农村居民新农合补偿后需个人负担的合规医疗费用给予保障。与此同时,各省市也相继探索大病医疗救助制度,如青岛市于2012年宣布“将重大疾病、罕见病、临床使用费用较高、疗效显著、且难以使用其他治疗方案替代的药品,经专家论证后,确定为特药救助项目。”2012—2013年,青岛市将甲型血友病、原发性肺动脉高压、BH4缺乏症、多发性硬化、肢端肥大症五种疾病的特效药纳入罕见病特药救助制度中,共救助50人。[11]青岛市罕见病医疗保障制度同澳大利亚救生药物计划的原则与方法基本一致,且已初显成效。在此背景下,我国应当借鉴澳大利亚救生药物计划的经验,结合青岛市罕见病医疗保障制度的做法,逐步在全国范围内建立合理的罕用药纳入医保目录的标准,探索出符合我国国情的罕见病医疗保障制度。
[1] Franco P. Orphan Drugs: the Regulatory Environment[J]. Drug Discovery Today, 2013, 18(3-4): 163-172.
[2] Goldblatt J. The Australian process for subsidized access to orphan drugs for rare inherited disorders of metabolism[J]. Expert Opinion on Orphan Drugs, 2013, 1(4) : 273-277.
[3] Therapeutic Goods Administration. Applications for orphan drug designation[EB/OL]. (2014-09-12)[2015-07-02]. https://www.tga.gov.au/applications-orphan-drug-designation
[4] Therapeutic Goods Regulations[Z].1990.
[5] Australian Government Department of Health. Life Saving Drugs Program Criteria and Conditions [EB/OL]. (2013-04-29)[2015-03-21]. http://www.health.gov.au/internet/main/publishing.nsf/Content/lsdp-criteria
[6] The Hon Sussan Ley MP. Life-saving Drug for Young Pompe Patients.[EB/OL]. (2015-02-17)[2015-05-19].http://www.health.gov.au/internet/ministers/publishing.nsf/Content/health-mediarel-yr2015-ley010.htm
[7] Australian Government Department of Health. Life Saving Drugs Programme Post Market Review Issue Pape (2015-04-19)[2015-05-23]. http://www.pbs.gov.au/reviews/lsdp-public-consultation-issues-paper-files/lsdp-post-market-issues-paper.pdf
[8] The Pharmaceutical Benefits Scheme. Post-market Review of the Life Saving Drugs Programme (LSDP)[EB/OL]. (2015-05-19)[2015-05-23]. http://www.pbs.gov.au/info/reviews/life-saving-drugs
[9] 刘晓琳, 张海波, 张鹏. 国外罕见病用药市场开发现状(上)[J]. 中国医药技术经济与管理, 2010(11): 32-40.
[10] 丁锦希, 季娜, 白庚亮. 我国罕见病用药市场保障政策研究[J]. 中国医药工业杂志, 2012, 43(11): 959-965.
[11] 梁土坤, 尚珂. 青岛模式:罕见病医疗保障制度的实践与展望[J]. 社会保障研究, 2014(3): 64-73.
(编辑 赵晓娟)
The Australian Life Saving Drugs Program and its implications for medical assistance system for the rare diseases in China
GUANYi-ru,XIANGWei,ZHANGFang
BusinessAdministrationCollege,ShenyangPharmaceuticalUniversity,ShenyangLiaoning110016,China
Objective: To introduce the Australian Life Saving Drugs Program (LSDP) and provide references for medical assistance system for the rare diseases in China. Methods: The main content and characteristics of LSDP were analyzed and compared with the Chinese status quo valuation. Results: Through the orphan drug designation and cost-effectiveness evaluation, eligible drugs are included in LSDP and funded to the rare disease patients. LSDP stipulated the strict funding criteria and conditions, established the Guidelines and Disease Advisory Committees, and processed the post-market reviews program in order to guarantee the medication requirements of the patients. Conclusions: The Australian experience is worth learning and China should implement a country-led management system for the rare disease and orphan drugs, and explore a medical assisstance system in line with the Chinese national condition based on the catastrophic medical insurances.
Australian Life Saving Drugs Program; Rare disease; Orphan drug; Medical security
关轶茹,女(1991年—),硕士研究生,主要研究方向为卫生经济政策评估与药物经济学。 E-mail: guanyiru888@163.com
张方。E-mail: xzhangf@126.com
R197
A
10.3969/j.issn.1674-2982.2015.08.010
2015-06-02
2015-07-15

