重复经颅磁刺激联合康复训练治疗脑梗死偏瘫的临床研究
尤琪,方征宇,谢凌峰,葛林通
经颅磁刺激(transcranial magnetic stimulation,TMS)于1985年由英国学者发明并应用于运动诱发电位检查,以评估大脑皮层的兴奋性和中枢神经的传导。随着技术的进步,21世纪初重复经颅磁刺激(repetitive TMS,rTMS)治疗在我国开始应用于临床治疗,主要适应证为神经系统疾病,包括运动、语言、认知、情感等方面的功能障碍[1-3]。本研究采用高频 rTMS联合康复治疗脑梗死后偏瘫,以探讨rTMS治疗和康复治疗是否有协同作用,及其安全性。
1 资料与方法
1.1 一般资料 2012年1月~12月在同济医院接受治疗的脑梗死偏瘫患者40例,纳入标准:符合中华医学会第四届脑血管病会议制定的诊断标准,并经头颅CT或MRI等影像学检查证实;神志清楚,生命体征平稳;首次发病,病程1~3个月之间,存在一侧肢体运动功能障碍,徒手肌力测定≤3级;签定知情同意书;对研究人员的观察和评价有良好的依从性,承诺坚持治疗2个月以上。排除标准:有明显合并症的患者,如合并心血管、肝、肾和造血系统等严重原发性疾病,以及其他脏器功能不全者;患有严重认知障碍或语言障碍者;脑干及小脑卒中者;有癫痫发作者。患者随机分为2组各20例,①对照组:男13例,女7例;年龄(50.6±10.1)岁;病程(31.0±10.6)d;左侧发病5例,右侧15例;基底节区损伤18例,其他区域2例。②观察组:男12例,女8例;年龄(49.8±9.9)岁;病程(30.2±10.2)d;左侧发病6例;右侧14例;基底节区损伤17例,其他区域3例。2组一般资料比较差异无统计学意义。
1.2 方法 2组患者均给予常规药物及康复治疗:物理治疗师通过Bobath,Brunnstrom,本体感觉神经肌肉促进技术(Proprioceptive neuromuscular facilitation,PNF)等神经生理学技术诱导患者主动运动,抑制痉挛,促进分离运动的发展和肢体功能恢复。包括桥式运动,翻身、坐及坐位平衡、站及站立平衡、步行等训练,还要进行躯干肌控制训练、髋关节控制训练、膝关节控制训练、踝背屈诱发等训练。随着患者肢体功能的恢复,可以加强训练强度,根据患者的情况进行站立练习、单腿站立、行走及上下楼梯训练。以上训练项目,均为每日1次,每周6次。作业治疗主要训练患者上肢功能和手指精细功能,采用功能性作业活动如推磨砂、拧螺丝、套环、九孔柱、拼积木、系纽扣、穿脱衣服等训练。每日1次,每次30min,每周6次。治疗师根据患者情况可以逐步增加这些训练的难度。观察组加用rTMS治疗:采用武汉依瑞德公司生产的Rapid 2型磁刺激仪器,线圈直径为7cm,圆形线圈,最大功率产生的输出强度为2T。刺激部位为脑梗死侧M1区,即病灶侧运动皮层区,频率为20Hz,刺激强度为患者运动阈值的80%,每个序列40个脉冲,总共25个序列,每个序列的持续刺激时间为2s,序列间隔时间为28s,总共治疗时间为12.5min。每天治疗1次,每周5d。
1.3 评定标准 ①运动功能评定:采用Fugl-Meyer运动功能评分量表(Fugle-mayer assessment,FMA)对患肢运动功能进行评定,包括上臂、腕和手、下肢等3部分50项,每项0~2分,满分为100分,得分越高表示患者的运动功能越好。②平衡功能评定:采用Berg平衡量表(Berg balance scale,BBS):对患者平衡功能进行评定,该量表共包括14个项目,每个项目分值为0~4分,满分为56分,得分越高表示患者平衡功能越好。③ADL能力评定:采用改良Barthel指数(modified Barthel index,MBI)评分对患者ADL能力进行评定。该量表评定内容包括进食、修饰、洗澡、穿衣、大便控制、小便控制、如厕、床椅转移、平地行走、上下楼梯共10项内容,满分为100分,得分越高表示患者ADL能力越好。
2 结果
治疗8周后,2组FMA、MBI、BBS评分均明显高于治疗前(P<0.01),且观察组更高于对照组(P<0.05),见表1。
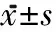
表1 2组治疗前后FMA、MBI及BBS评分比较 分,
与治疗前比较,aP<0.01;与对照组比较,bP<0.05
3 讨论
康复治疗能改善脑梗死偏瘫患者的运动功能、ADL能力和平衡功能,研究表明采用神经生理学技术能够诱导和促进低位中枢控制的联合反应和共同运动的出现,通过输入正确的运动模式,诱导分离运动,促进中枢功能重组,实现功能的恢复[4]。从本研究2组治疗前后FMA、MBI、BBS数据看,治疗后均有显著改善,与众多的研究报道一致。
正常大脑两侧半球通过交互性半球间抑制达到并且维持大脑功能匹配及兴奋平衡和抑制平衡。脑梗死后大脑半球间的相互抑制失去平衡,健侧半球对患侧半球的半球间抑制加强,这可能是脑梗死后偏瘫的重要原因之一。因此,促进脑梗死后偏瘫的康复方法有降低健侧大脑半球的兴奋性和增强患侧大脑半球的兴奋性两种方式。这两种方法均可纠正脑梗死后大脑半球间的抑制失衡,进而达到治疗偏瘫的目的。本研究采用rTMS增强患侧大脑半球的兴奋性,促进皮层运动功能重组[5]。rTMS还可以改变皮质代谢及脑血流,通过促进突触调整影响和多种神经递质的传递,促进神经功能的恢复等作用。
磁刺激是一种无创的治疗方法,磁刺激治疗仪产生的磁刺激信号可基本无衰减地透过颅骨并刺激大脑皮层,调整神经系统的兴奋性,促进脑可塑性发生[5-7],不同的刺激频率、方式、强度所产生的结果不尽相同[8]。研究已经证实>5Hz的磁刺激为高频磁刺激,具有促进皮层兴奋的作用,反之低频磁刺激有抑制皮层的作用,本研究为了提高皮层兴奋性采用了20Hz的高频磁刺激。Peinemann等[9]对8例右利手健康人分2d在左M1区给予5Hz、90%主动运动阈值的rTMS,脉冲次数分别为150次和1800次,研究发现,只有足够多的脉冲次数(1800次)才能诱导神经元细胞膜电位产生有效的去极化,使高频rTMS引起运动皮质长时程兴奋性的改变,从而形成rTMS的综合效应[10],故本研究选择1000个脉冲作为每次的刺激量。
关于刺激序列中的刺激与间歇时间,Jung等[11]报道了作用于健康人M1区的rTMS对运动皮质兴奋性的改变与刺激时间有关。同样都是10Hz的rTMS,当刺激时间设定为1.5s时,皮层的兴奋可持续120min;当刺激时间设定为5s时,皮层出现抑制且持续90min。因此该研究推断,如果刺激持续时间较长,即使高频刺激也可能抑制运动皮质兴奋性。根据这个原理,为了避免出现皮层抑制,我们刺激序列中的刺激时间为2s,间歇期28s,即为一个脉冲系列。
Todd等[12]在受试者肌肉无自主收缩时给予刺激频率为6Hz,刺激强度为80%主动运动阈值,每个序列刺激5s、间歇25s,共20个序列600次脉冲的rTMS刺激后,与只接受同参数rTMS的受试者相比,皮质兴奋程度虽有提高但维持时间很短;在rTMS刺激前或后受试者进行肌肉自主收缩,对皮质兴奋程度无明显影响;而刺激的同时受试者进行肌肉自主收缩,皮质兴奋程度明显提高并持续30min。该研究还发现,以上3种方式刺激后受试者的手指敲击测试、Grooved钉板测试和目标操作等运动能力指标均没有明显变化。该研究认为,当受试者接受rTMS的同时进行肌肉自主收缩可以强化rTMS对皮质兴奋性的调节效应,但尚不足以引起有效的运动功能的提高。
这种结果的产生可能依赖于突触的可塑性[13],即神经元之间如果经常受到相关连的刺激,可以使神经元之间的突触连接加强。肌肉自主收缩和脑刺激技术均可以在皮质运动区产生这种可塑性改变,因此肌肉自主收缩作为rTMS的干预措施可以更有效促进神经元突触连接的形成。但是rTMS联合单纯的短时间的肌肉自主收缩所引起的突触变化较微弱,rTMS可能需要联合反复的行为学训练才能有效诱导大脑重组。
尽管本研究没有将主动运动及时结合rTMS治疗但结果显示仍有促进作用,观察组FAM、MBI、BBS等评分有显著差异,国内外均有研究报道功能训练结合rTMS能有效地改善运动功能[14],这些改变的机制还有待上升到理论高度。为了更好地进行关联刺激未来的研究将会在肢体主动运动的同时进行rTMS,这也有待于进一步的临床证实。
[1] 吴涛,李蕴琛.经颅重复磁刺激对人脑皮层兴奋性的影响[J].中华神经科杂志,2001,34(1):40-42.
[2] 丁则昱,崔丽英.经颅重复磁刺激技术在治疗中的应用进展[J].国外医学神经病学神经外科学分册,2004,31(6):508-511.
[3] 高峻岭,梅元武,振建,等.低频重复经颅磁刺激在帕金森病中的康复治疗作用[J]. 中华物理医学与康复杂志,2003,15(1):672-674.
[4] 胡永善,白玉龙,陈文华,等.规范三级康复治疗对缺血性脑卒中患者运动功能的影响[J].中国康复医学杂志,2007,22(7):605-608.
[5] Corti M, Patten C, Triggs W. Repetitive Transcranial Magnetic Stimulation of Motor Cortex after Stroke: A Focused Review[J]. Am J Phys Med Rehabil,2012, 91(3): 254-270.
[6] Floel A, Cohen LG. Recovery of function in humans: cortical stimulation and harmacological treatments after stroke[J]. Neurobiol Dis, 2010, 37(2): 243-251.
[7] Ridding MC, Ziemann U. Determinants of the induction of cortical plasticity by non-invasive brain stimulation in healthy subjects[J].J Physiol, 2010, 588(13): 2291-2304.
[8] 殷稚飞,沈滢盂,殿怀,等.不同频率低频重复经颅磁刺激对脑梗死患者上肢功能的影响[J].中华物理医学与康复杂志,2014, 36(6):596-601.
[9] Peinemann A, Reimer B, Lö er C, et al. Long-lasting increase in corticospinal excitability after 1800 pulses of subthreshold 5 Hz repetitive TMS to the primary motor cortex[J].Clin Neurophysiol,2004, 115(7): 1519-1526.
[10] Vlachos A, Müller-Dahlhaus F, Rosskopp J, et al. Repetitive magnetic stimulation induces functional and structural plasticity of excitatory postsynapses in mouse organotypic hippocampal slice cultures[J]. J Neurosci, 2012, 32(4): 17514-17523.
[11] Jung SH, Shin JE, Jeong YS, et al. Changes in motor cortical excitability induced by high-frequency repetitive transcranial magnetic stimulation of different stimulation durations[J]. Clin Neurophysiol,2008, 119(1): 71-79.
[12] Todd G, Rogasch NC, Flavel SC, et al. Voluntary movement and repetitive transcranial magnetic stimulation over human motor cortex[J]. J Appl Physiol, 2009,106(5):1593-1603.
[13] Butefisch CM, Wessling M, Netz J, et al. Relationship between interhemispheric inhibition and motor cortex excitability in subacute stroke patients[J]. Neurorehabil Neural Repair,2008, 22(1): 4-21.
[14] Yang YR, Tseng CY, Chiou SY, et al. Combination of rTMS and treadmill training modulates corticomotor inhibition and improves walking in Parkinson disease: a randomized trial[J]. Neurorehabil Neural Repair, 2013, 27(1): 79-86.

