象山港春、夏季大中型浮游动物空间异质性
杜 萍,徐晓群,刘晶晶,江志兵,陈全震,曾江宁,*
1 国家海洋局第二海洋研究所, 国家海洋局海洋生态系统与生物地球化学重点实验室, 杭州 310012 2 宁波大学, 宁波 315211
象山港春、夏季大中型浮游动物空间异质性
杜 萍1,2,徐晓群1,刘晶晶1,江志兵1,2,陈全震1,曾江宁1,*
1 国家海洋局第二海洋研究所, 国家海洋局海洋生态系统与生物地球化学重点实验室, 杭州 310012 2 宁波大学, 宁波 315211
为探明象山港大中型浮游动物空间分布特征及主要影响因素,分别于2010年4月、7月大、小潮期对浮游动物群落和相关环境因子进行调查。四个航次共检出浮游动物成体14大类64种、浮游幼体10大类14种,春、夏季群落结构差异极显著(P=0.001),物种更替率为66.7%,优势种差异明显,共同优势种仅有短尾类溞状幼虫(Brachyura zoea)和仔鱼(Fish larvae)两类幼体;同一季节大、小潮物种相似度约为60%,群落结构差异较小(P=0.031);春季生物量和丰度高于夏季,但物种多样性低于夏季。温度是浮游动物群落季节变化的主导因素。方差分析、聚类和多维尺度分析显示:浮游动物群落空间异质性分布方式受潮流影响,群落结构在大潮期梯度分布特征明显,小潮期通常呈斑块性分布;生物量、丰度和多样性等参数的空间分布取决于群落的分布特征,并受影响于该参数在狭湾口内外的差异。典范对应分析及环境参数统计分析表明:梯度分布主要由盐度、悬浮物的梯度性特征决定;主导斑块性分布的因素多样,不同情况下可能为水深、叶绿素a、营养盐和内外水团相互作用;梯度性和斑块性分布均受到潮流影响。总体来看,象山港浮游动物空间分布主要受水文因素控制,受化学和生物因素影响较弱,其中叶绿素a浓度仅在春季与浮游动物丰度有一定相关性,溶解氧、酸碱度和营养盐等水质参数对浮游动物空间分布几乎无直接影响。
浮游动物; 空间异质性; 象山港; 潮流
空间异质性指生态学过程和格局在空间分布上的不均匀性及复杂性,一般可理解为斑块性和梯度性的总和[1]。空间异质性概念在生态学领域的应用较早且广泛,而海洋环境的空间异质性与浮游生物群落空间分布的关系由于海水的流动性和浮游生物的弱运动性而较为复杂,且研究较晚[2]。海洋环境的空间异质性对海洋生物群落结构与功能的多样性至关重要,且会影响到海洋生态系统的结构与生产力,因此浮游生物群落与空间异质性的关系成为海洋生态学者不断深入探讨的课题。
海洋浮游生物的空间异质性是垂直方向和水平方向的总和。垂直方向的研究主要在陆架及以外的深海,目前除少数区域得到垂直分布是物理因素驱动的结果外,多数研究认为垂直异质性主因是动物物种行为(昼夜垂直迁移、聚集和捕食等)特异性[3- 4]。水平方向异质性的研究涉及河口、近岸和陆架海等海区:盐度主导着河口和近岸区浮游动物群落的梯度分布基本已得到共识[5- 7];河口区浮游动物丰度、生物量和群落结构的波动被认为是淡水输入量、潮汐和近岸水团、叶绿素a、盐度和温度相互作用的结果[7];陆架区等开阔海区,通常认为是水团和海流结构决定了浮游动物群落的空间异质性[8- 9];此外,也有其他多种影响因素,如上升流区浮游动物群落可因温度差异与邻近海区形成异质性[10]等。
象山港属亚热带的半封闭狭长海湾,纵长约为70 km,外邻东海陆架。湾口外东海沿岸受台湾暖流水、浙闽沿岸流及长江冲淡水等影响,而海湾内环流受到潮汐运动、余流、内部密度分布和风力的驱动[11],环境因子呈现明显梯度分布[12]。因此,象山港是研究海湾生态系统浮游动物空间异质性分布的理想场所。浮游动物因其在海洋生态系统的中枢地位和短世代周期性而可以对其周围环境物理、化学和生物因子的微小变化作出响应,近来关于海流对浮游动物群落结构影响的研究在增多[13- 15]。目前,象山港浮游动物的研究报道已有多篇,但仅为对浮游动物生物量、丰度或群落的描述[16- 19],而未见对浮游动物空间异质性及与水文、生化因子关系的研究。本研究拟探讨象山港水团、地形、潮流及生化等环境因子与大中型浮游动物空间异质性的关系,以期了解决定海湾大中型浮游动物空间分布的主要因素,同时,为港湾内合理开发布局提供科学参考资料。
1 材料与方法
1.1 区域概况
象山港位于浙江省北部(121.40°—121.90°E,29.40°—29.70°N),北邻杭州湾,水域面积为563 km2,平均水深约为10 m。象山港水域由象山港狭湾、牛鼻山水道和佛渡水道三大部分组成。象山港狭湾长约50 km,湾口宽约9.5 km。座落在湾口的六横岛把象山港狭湾以外区域分成了东南侧的牛鼻山水道和东北侧的佛渡水道:牛鼻山水道宽约9 km,是连接象山港与东海的重要通道;佛渡水道通过其外侧的条帚门、虾峙门等众多的潮通道将象山港同东海相连。象山港水域主要通过这两个水道同外海进行水交换。
1.2 样品采集
本研究范围为六横岛以西的整个象山港狭湾,共17个站位,采样分别于2010年4月(春季)、7月(夏季)大、小潮进行(图1)。浮游动物样品用带Hydro-bios流量计的浅水I型浮游生物网由底至表垂直拖网采集,将样品装入600 mL塑料瓶中,加中性甲醛溶液固定保存(终浓度5%)带回实验室。
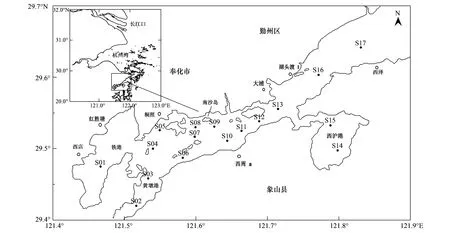
图1 象山港全港春、夏季采样站位示意图Fig.1 The map of sampling stations of Xiangshan Bay in spring and summer
1.3 样品分析
浮游动物样品于室内用孔径为0.160 mm的筛绢过滤,挑去杂物后用感量0.1 mg电子天平称湿重,根据湿重和滤水量计算浮游动物的湿重生物量[20]。浮游动物样品的种类鉴定和计数在体视镜和显微镜下按《海洋调查规范—海洋生物调查》[20]进行。根据计数结果和滤水量计算浮游动物丰度。
环境因子中温度、盐度、水深、pH值、透明度、溶解氧、悬浮物、营养盐的测定按《海洋监测规范—海水分析》[21]进行,叶绿素a的测定按《海洋调查规范—海洋生物调查》[20]进行。
1.4 数据分析
浮游动物Shannon-Wiener多样性指数(H′)的计算公式为:
式中,Pi为该站第i种浮游动物个体数占该站总个体数的比值,S代表该站动物的种类数。
优势度(Y)计算公式为:
Y=(ni/N)×fi
式中,N为该海区出现的所有种类的总丰度;ni为第i种的丰度;fi为该种在各站位出现的频率。取Y≥0.02时,即为浮游动物优势种。
季节更替率(R)计算公式为:
R=(a+b-2c)/(a+b-c)×100%
式中,a与b分别为相邻季节的种数;c为相邻季节共享的种数。
采用STATISTICA6.0检验季节间及区域间浮游动物和环境参数差异,首先对数据(或经转换后数据)进行正态性(K-S test)和方差同质性(Levene test)检验,显著性水平设置为0.05,若两者均满足则进行单因子方差分析(one-way ANOVA),反之进行非参数检验(M-W U test)。采用PRIMER6.0进行浮游动物群落的聚类分析(cluster analysis)和非度量多维标度(non-metric Multi-dimensional Scaling,MDS)排序,及检验浮游动物群落季节和潮汛差异(2-way crossed ANOSIM)。采用CANOCO软件包进行浮游动物群落与环境因子的典范对应分析(CCA)。
2 结果与分析
2.1 浮游动物群落参数的时空分布
浮游动物生物量存在时空差异。春季生物量显著高于夏季(P=0.02),且大潮均显著高于小潮(P=0.02)。春季大、小潮均值分别为(113.06±110.70) mg/m3、(46.20±13.05) mg/m3;夏季大、小潮均值分别为(53.67±25.37) mg/m3、(35.25±17.24) mg/m3。水平分布,春季小潮生物量分布较均匀,高值出现在中西部S07站附近,大潮生物量呈现内低外高趋势;夏季小潮生物量分布整体均匀,而在铁港和南沙岛附近出现低值点;大潮期斑块性分布明显,在铁港北部至桐照海域、西沪港底及西沪港外狭湾处出现高值斑块(图2)。
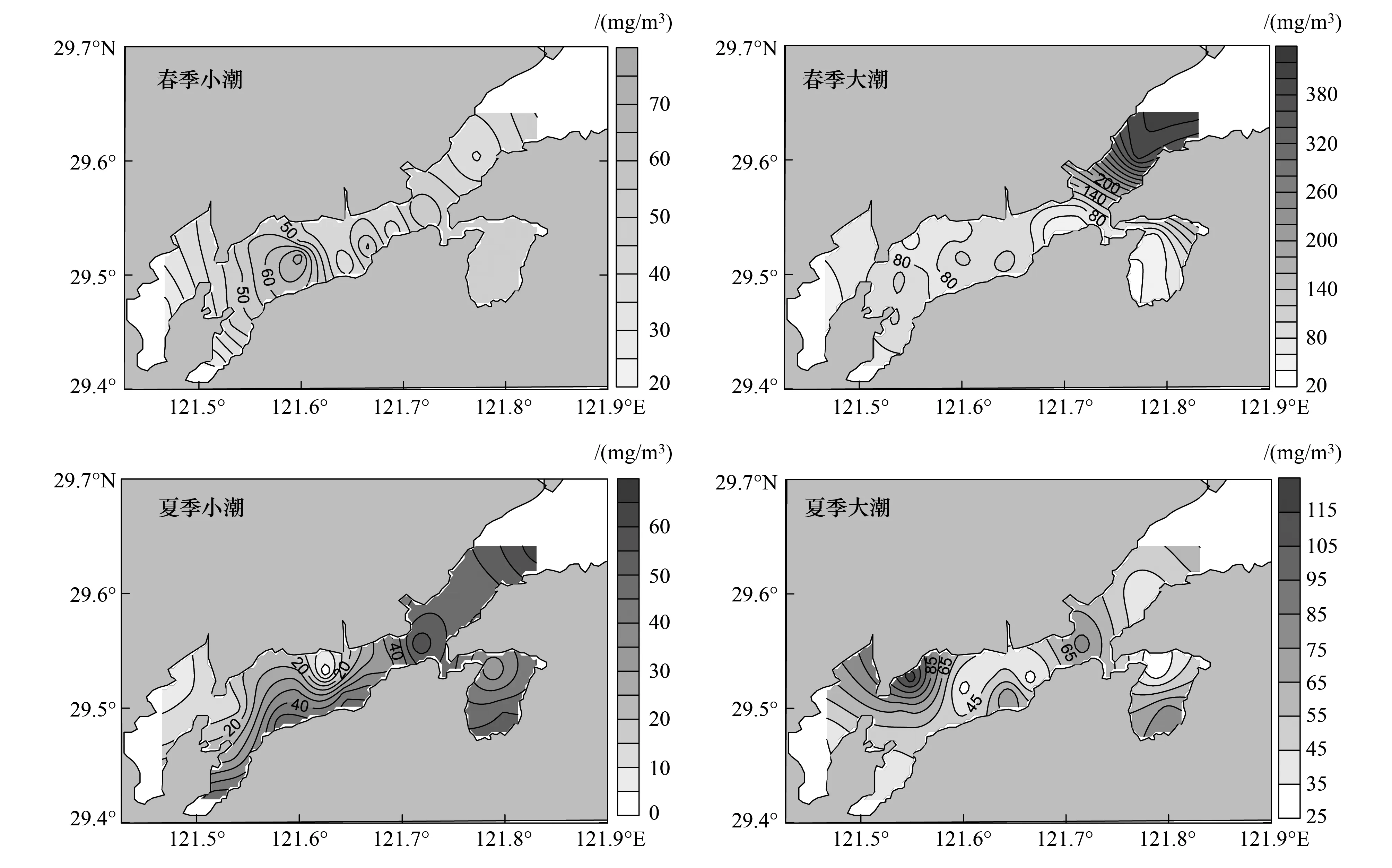
图2 浮游动物生物量空间分布图Fig.2 Spatial distribution of zooplankton biomass
浮游动物丰度也存在时空差异。春季丰度显著高于夏季(P=0.00),春季大潮均值((317.64±151.93) 个/m3)显著高于小潮((172.65±92.61) 个/m3) (P=0.00);夏季大、小潮均值分别为(98.05±43.36) 个/m3、(121.18±72.48) 个/m3,无显著差异(P=0.27)。水平分布,春季小潮丰度呈现西沪港以西主港高于3个支港及西沪港以东海域的特征,大潮基本呈主港高于支港的特征;夏季,小潮丰度分布与生物量相似,整体均匀,略呈内低外高、北岸低南岸高的趋势;大潮丰度在湾顶和湾口较高,而西沪港和南沙岛海域出现低值点(图3)。
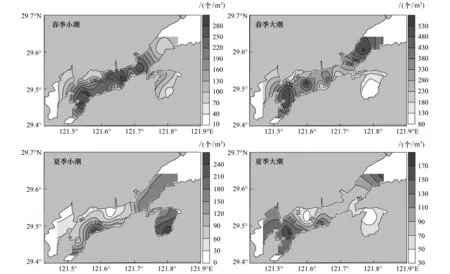
图3 浮游动物丰度空间分布图Fig.3 Spatial distribution of zooplankton abundance
浮游动物Shannon-Wiener多样性指数的时间差异较大,春季大、小潮均值分别为1.48±0.49、1.41±0.63,无显著差异(P=0.48);夏季显著高于春季(P=0.00),且大潮均值(3.33±0.50)显著高于小潮(2.74±0.56)(P=0.00)。Shannon-Wiener多样性指数的空间差异较小:春季小潮整体分布均匀,仅S04和S09站略低;春季大潮多样性高值出现在铁港北部至桐照海域和西沪港内,并呈向湾口方向递减趋势;夏季小潮整体分布也较均匀,而在南沙岛附近和西沪港内出现两个低值点;夏季大潮基本呈现由内向外递增趋势(图4)。
图4 浮游动物多样性指数空间分布图Fig.4 Spatial distribution of zooplankton diversity index
2.2 浮游动物群落的时间变化
2.2.1 种类组成
本研究春、夏季共检出浮游动物成体14大类64种,浮游幼体10大类14种,其中,春季种类数为11大类42种、夏季为13大类58种,种类的季节更替率为66.7%。两季均以桡足类种类数最多,春、夏季分别占总种类数的43.48%和32.76%。同一季节大、小潮的浮游动物种类相似度均约为60%,其中成体种类数差异较大(表1)。
2.2.2 优势种
四个航次的浮游动物优势种及优势度如表2。研究海区春、夏季浮游动物优势种差异明显,两季共同优势种仅有短尾类溞状幼虫和仔鱼2类幼体。春季大、小潮期优势种稍有差异,腹针胸刺水蚤在大、小潮期均占绝对优势,而中华哲水蚤和捷氏歪水蚤仅为大潮期优势种;夏季,大、小潮优势种组成差异很小,仅球型侧腕水母为大潮期独有优势种,其他差异为优势度,其中差异较大的是太平洋纺锤水蚤和短尾类溞状幼虫 (表2)。
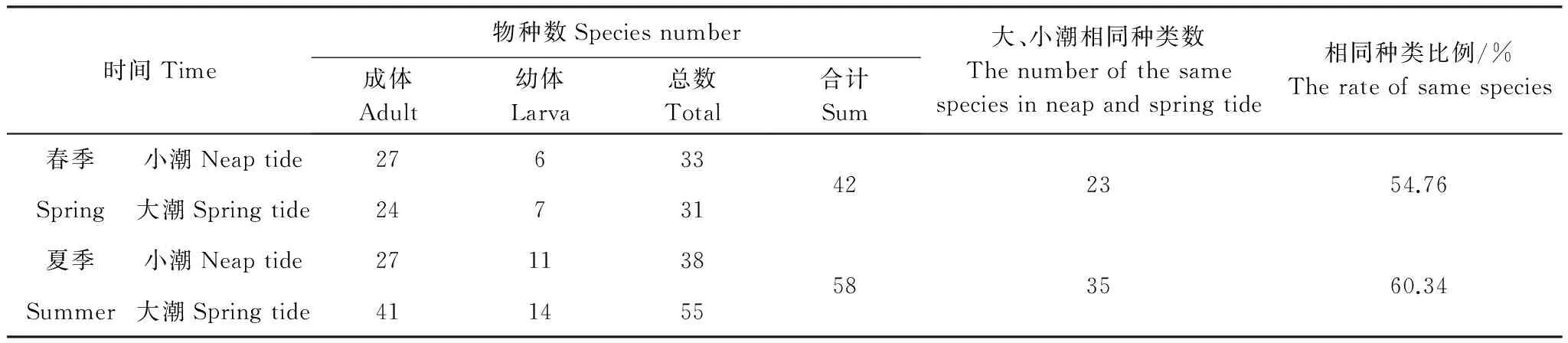
表1 浮游动物种类数Table 1 The number of zooplankton species
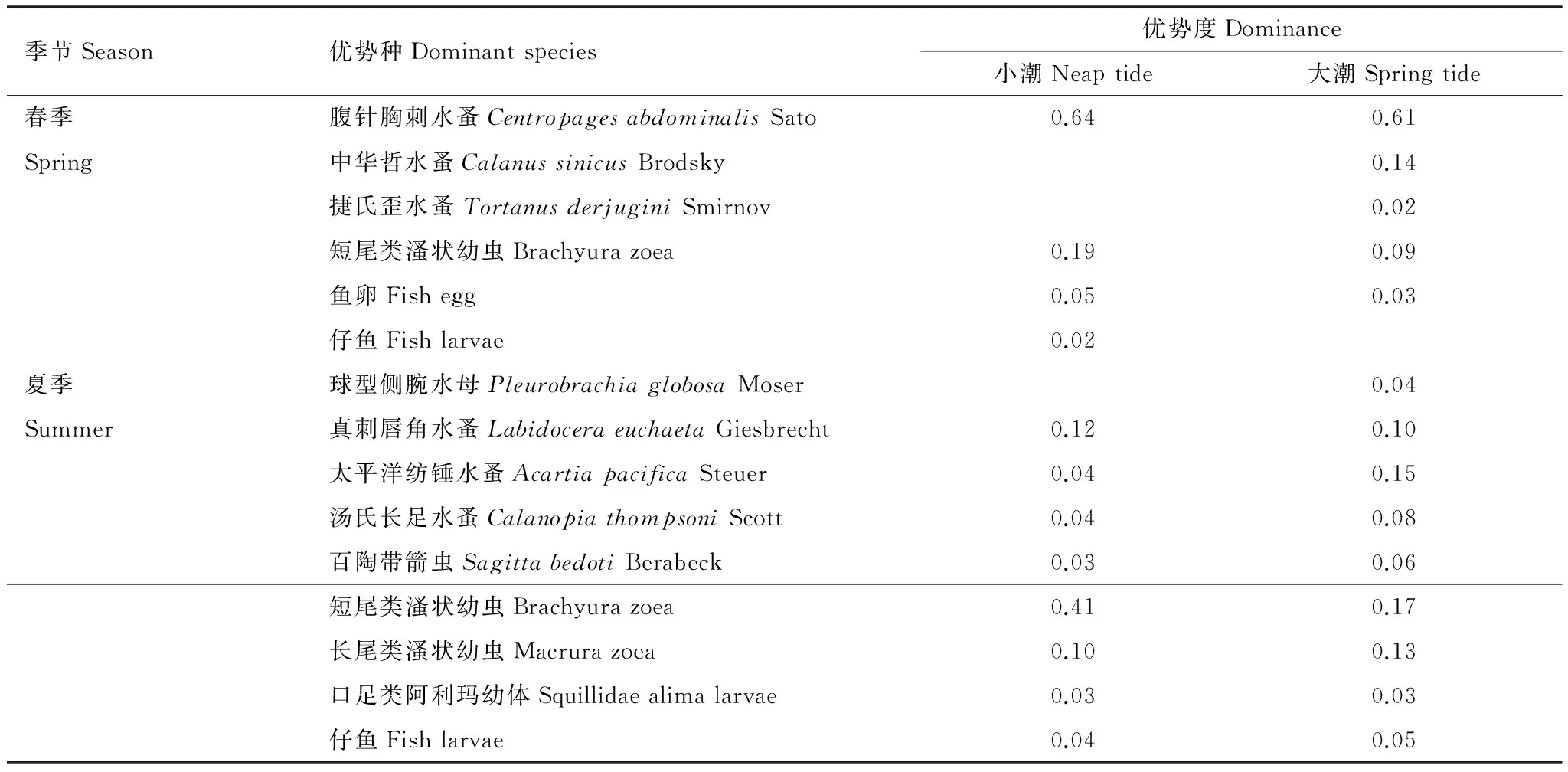
表2 象山港浮游动物的优势种及优势度(Y )Table 2 Dominant species and dominance of zooplankton in Xiangshan Bay
2.2.3 群落组成
浮游动物群落组成的ANOSIM结果显示,象山港浮游动物群落的季节差异极显著(GlobalR=0.65,P=0.001),大、小潮间有差异(GlobalR=0.058,P=0.031),但差异较小。
2.3 浮游动物群落的空间变化
2.3.1 基于浮游动物群落的空间划分
对四航次的浮游动物群落分别进行Bray-Curtis相似性分析,在相似性矩阵的基础上进行聚类分析并建立MDS排序图(图5)。MDS图中Stress值均小于或等于0.15,可见在二维空间,MDS排序图可很好地表示出在同一组浮游动物的相似性和不同组的差异性[22]。
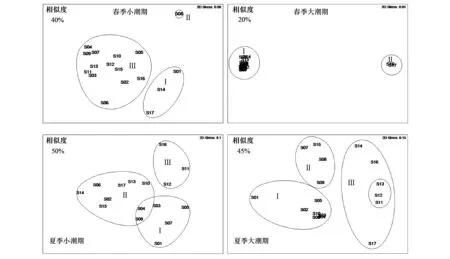
图5 浮游动物群落MDS图Fig.5 MDS ordination of zooplankton community in four cruises
春季小潮期浮游动物群落以40%群落相似性可分为3组,夏季小潮期浮游动物群落以50%相似度也可分为3组,主要呈斑块状分布,其中夏季小潮S09与其他站位的群落相似度极低(similarity≈2%),MDS排序图中去除该样品。春季大潮期浮游动物群落以20%群落相似性可分为2组,夏季大潮期群落以45%相似度可分为3组,基本呈沿狭湾的梯度分布(图6)。
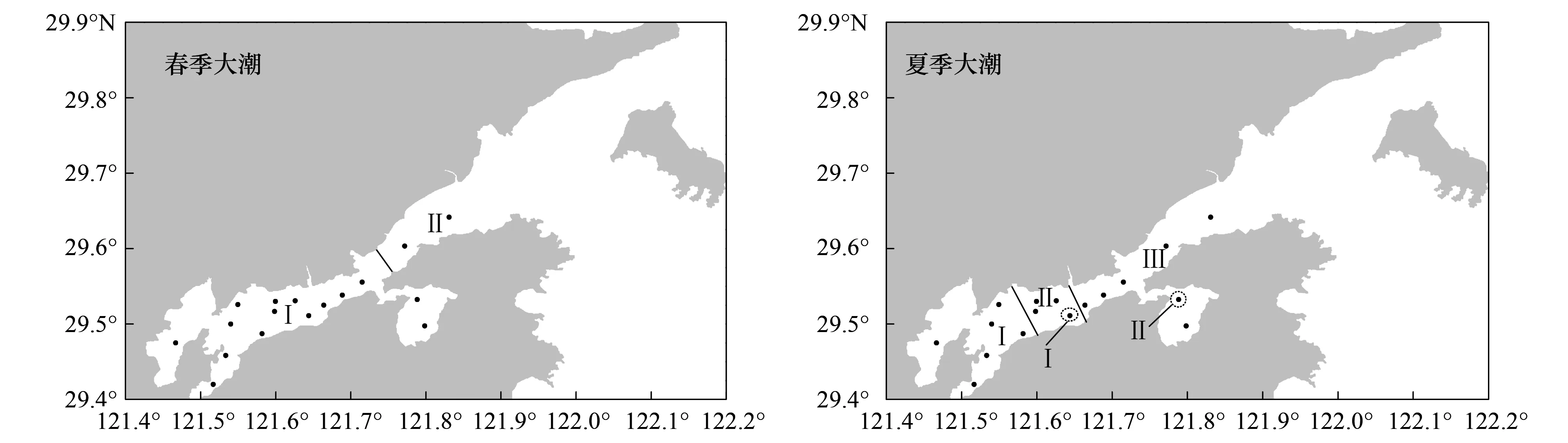
图6 浮游动物群落空间异质性分布Fig.6 Spatial heterogeneity distribution of zooplankton community
2.3.2 浮游动物组间差异
根据以上基于浮游动物群落结构的空间划分结果,分别对各组的浮游动物优势种组成(表3)和生物量、丰度、多样性指数等参数(表4)进行统计。表3显示:春季大、小潮,各组间的优势种组成差异均非常明显;夏季大、小潮,组间的差异较春季小,差异主要存在于Ⅲ组与另外两组之间,而Ⅰ组与Ⅱ组的优势种类几乎相同,仅存在优势度的差异。表4显示,浮游动物参数的统计差异性并不普遍,仅见于春季小潮期Ⅲ组丰度高于Ⅰ、Ⅱ组,春季大潮期Ⅱ组生物量高于Ⅰ组,夏季小潮期Ⅱ组丰度依次高于Ⅲ组、Ⅰ组,夏季大潮期Ⅰ、Ⅲ组丰度高于Ⅱ组。
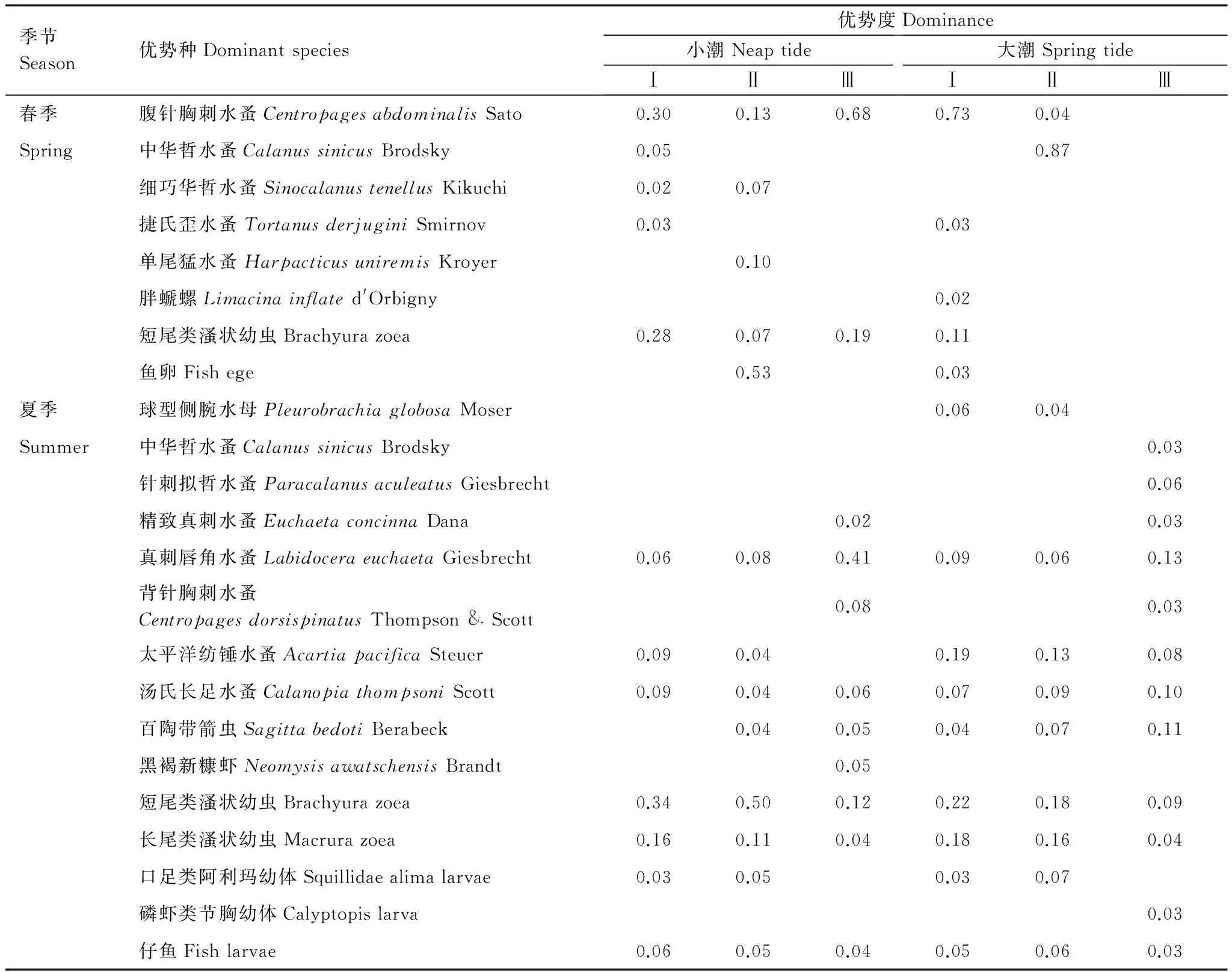
表3 各组浮游动物的优势种及优势度(Y )Table 3 Dominant species and dominance in groups
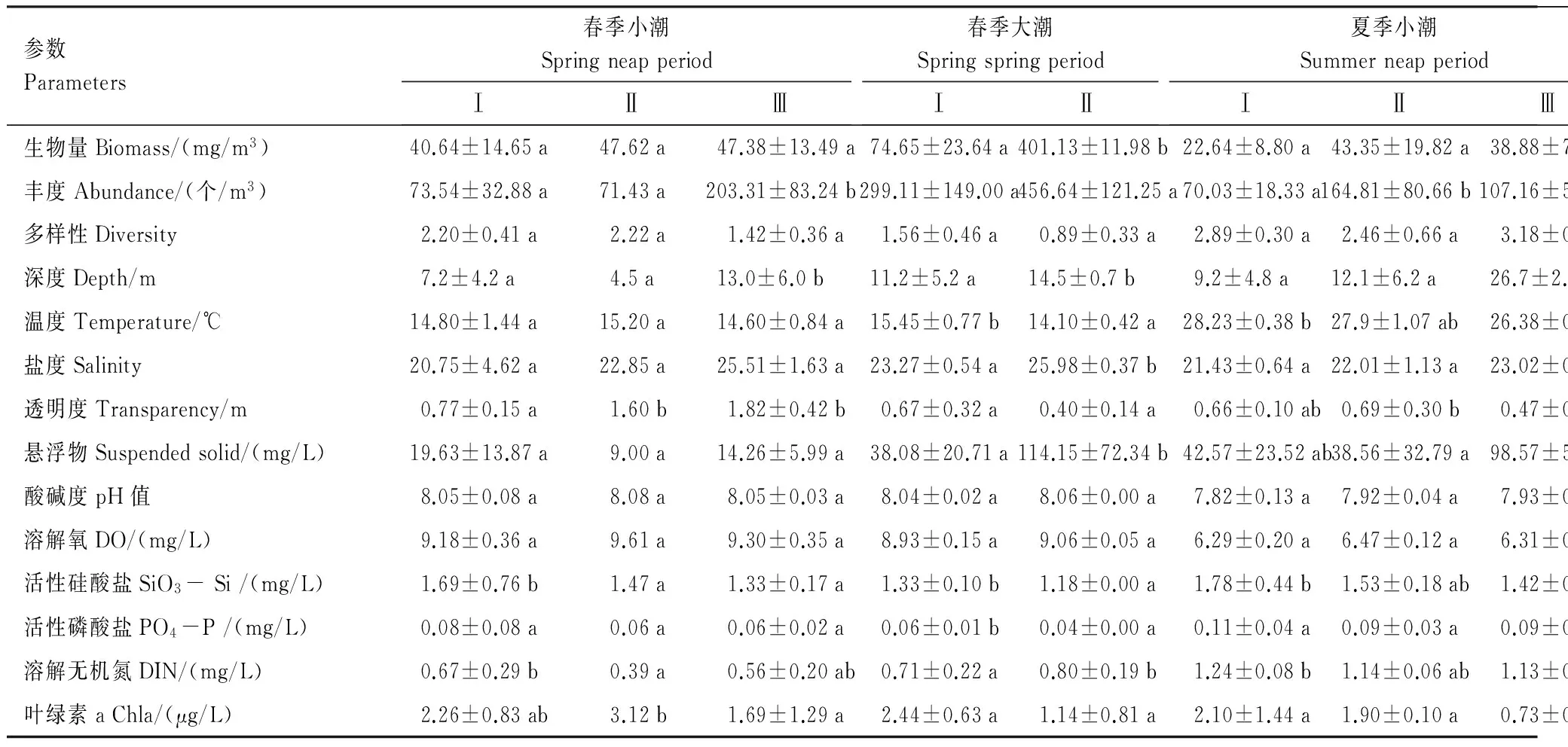
表4 浮游动物及环境参数的空间划分统计Table 4 Space partition statistics of zooplankton and environmental parameters
a、b、c字母相同表示区域间无显著差异,字母不同表示区域间差异显著,显著性水平P=0.05; DO: 溶解氧dissolved oxygen;SiO3- Si:活性硅酸盐silicate;PO4-P: 活性磷酸盐phosphate;DIN: 溶解无机氮dissolved inorganic nitrogen;Chla: 叶绿素a chlorophyll a
2.4 环境因素的时空分布
因研究区域多数站位水深小于15 m,表、底层水的环境参数相差小,故本研究各环境参数取表、底层水的均值。环境参数存在明显的季节差异,温度、悬浮物和营养盐浓度为夏季高于春季,盐度、酸碱度、溶解氧、透明度和叶绿素a为春季高于夏季;而大、小潮差异较小。空间分布上:水温、酸碱度、溶解氧分布较均匀;盐度和悬浮物浓度由湾顶到湾口逐渐升高;营养盐浓度基本由湾顶到湾口逐渐降低;叶绿素a浓度则在几个支港内和象山港湾口处较高。
表4按浮游动物群落空间划分结果列出了各组11种环境参数的均值、标准差及统计差异性。统计结果显示:各航次酸碱度和溶解氧均无组间差异;春季小潮期,水深、透明度、活性硅酸盐、溶解无机氮和叶绿素a存在显著组间差异;春季大潮期,水深、盐度、悬浮物和溶解无机氮呈Ⅰ组显著低于Ⅱ组,温度、活性硅酸盐和活性磷酸盐呈Ⅰ组显著高于Ⅱ组;夏季小潮期,水深、温度、透明度、悬浮物、活性硅酸盐和溶解无机氮存在显著组间差异;夏季大潮期,仅悬浮物浓度存在显著组间差异。
2.5 浮游动物群落变化的影响因素
本研究选择可能影响浮游动物的14种环境因子,进行与浮游动物群落的相关性分析。其中,水深反映了地形特征;温度、盐度、透明度、悬浮物为水文参数;酸碱度、溶解氧、活性硅酸盐、活性磷酸盐和溶解无机氮为水质参数;叶绿素a是生物参数。
首先对所有物种数据进行去趋势对应分析(Detrended correspondence analysis,DCA),排序轴最大梯度长度为3.845,表明相关性分析适宜选用CCA。蒙特卡罗检验(Monte Carlo test)表明,第1轴和全部轴均呈极显著差异(P=0.002),故CCA排序结果是可信的。表5的CCA统计信息显示,CCA分析中14种环境因子可解释浮游动物群落总变量的52.3%(所有典范特征值之和1.621/所有特征值之和3.097),第1轴和第2轴的特征值分别解释了68.6%和54.0%的物种变量,且物种与环境的相关系数分别达到0.971和0.858,表明物种与环境的相关性较好。
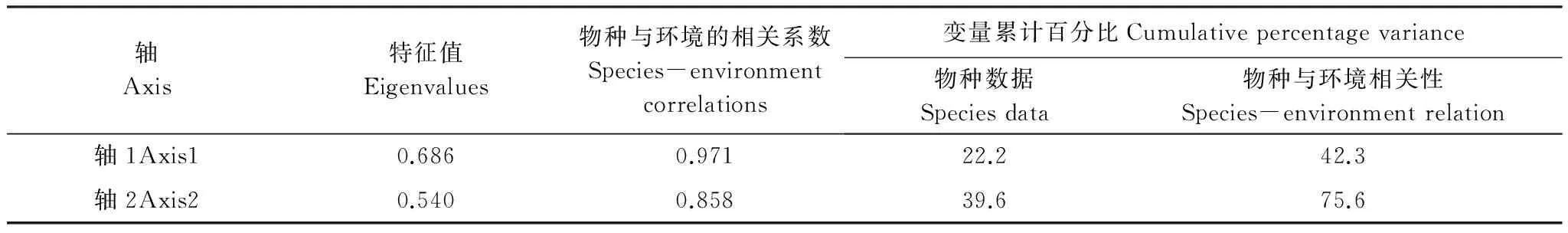
表5 CCA分析的统计信息Table 5 Statistical information of CCA
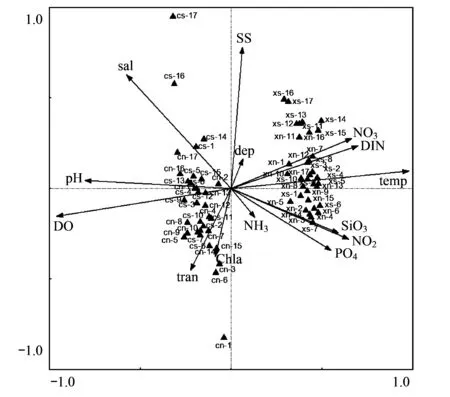
图7 两季浮游动物群落与环境因子的CCA排序图Fig.7 CCA ordination of zooplankton community and environment factors in two seasons
样品与环境因子的CCA排序结果(图7)显示:两季浮游动物群落的季节分化明显,与ANOSIM结果一致,季节分化的主导因素是温度和溶解氧浓度,其次为酸碱度、盐度、溶解无机氮、硝酸盐、亚硝酸盐、活性硅酸盐和活性磷酸盐浓度;而大、小潮浮游动物群落的分化不明显。CCA排序图同时显示,浮游动物群落也存在明显的空间分化,同MDS排序结果一致,空间分化的主导因素是盐度和悬浮物浓度,其次透明度、叶绿素a、活性磷酸盐、亚硝酸盐、活性硅酸盐、硝酸盐和溶解无机氮浓度也有较小影响。
3 讨论
3.1 浮游动物群落的春、夏季差异
象山港属亚热带季风气候区,四季分明,浮游动物群落也存在明显的季节变化,主要表现为物种的季节更替和群落参数的变化:春、夏两季成体优势种完全不同,春季主要为腹针胸刺水蚤和中华哲水蚤,夏季主要为真刺唇角水蚤、太平洋纺锤水蚤、汤氏长足水蚤、百陶带箭虫和球型侧腕水母;生物量和丰度为夏季较春季低,多样性指数为夏季较春季高。
与我国其他温带和亚热带近海、海湾、河口[23- 25]类似,象山港浮游动物季节变化主要是水温、径流和沿岸流季节变化的结果。象山港春季水温界于12.0—17.4 ℃,盐度界于15.7—26.4。腹针胸刺水蚤为适温较低的近岸低盐种[17],生长最适温度范围是10—15 ℃,最适盐度范围为20—27[26],是象山港狭湾内春季的绝对优势种。象山港夏季水温界于24.8—29.4 ℃,盐度界于20.2—24.1,腹针胸刺水蚤几乎消失,优势种被浮游幼体和真刺唇角水蚤、汤氏长足水蚤、太平洋纺锤水蚤替代。太平洋纺锤水蚤适温范围为24—29 ℃,适盐范围为23—25,7—9月聚集在象山港底部和中部[18];真刺唇角水蚤和汤氏长足水蚤在我国沿岸广布[27],为广温低盐种,在浙江北部杭州湾和长江口区域周年存在[28],夏、秋季在象山港出现,其中真刺唇角水蚤在象山港中部聚集。
中华哲水蚤、百陶带箭虫和球型侧腕水母是浙江中北部沿岸流的优势种[23,29],通常随潮流进入象山港。中华哲水蚤是浙江近岸春、夏两季优势种,但由于其最适盐度为30[30],因此仅能到达象山港湾口位置。百陶带箭虫属近岸暖水种,是东海春、夏、秋三季的毛颚类优势种[31],也是浙江中部和南部近岸这三季的浮游动物优势种,而在浙江北部近岸仅为夏、秋两季的优势种[23],此主要与水温和台湾暖流对浙北沿岸流的影响有关,百陶带箭虫随潮流几乎可达象山港全港。球型侧腕水母是东海分布最广的栉水母,栉水母是暖水性物种,被认为是暖流指示生物,春季到夏季,栉水母由水温较高的东海南部和受暖流影响明显的东海外海向东海北部和近岸发展[29],球型侧腕水母通常在秋季成为浙江北部近岸优势种[23],而本研究检测到球型侧腕水母夏季随潮流进入象山港,大潮期优势度已达到0.04。
温盐变化是浮游动物季节变化的主要原因,其次,象山港浮游动物季节分化还通过浮游植物间接受到溶解氧、酸碱度和营养盐的影响。春季浮游植物生长旺盛,光合作用对营养盐和CO2的吸收强烈,溶解氧产生量高,同时,春季温度较夏季低,生物呼吸分解作用较弱,溶解氧消耗量和营养盐产生量相对较低,因此与夏季相比,春季水体溶解氧和酸碱度较高、营养盐浓度较低,而浮游植物生物量较高,进而带来较高的浮游动物生物量和丰度。
春、夏两季浮游动物群落的另一差异是,夏季,象山港由于径流量增加和沿岸水受北上台湾暖流影响,内外水团的混合加强[12,32],浮游动物群落的空间相似度较春季高。
3.2 浮游动物群落的空间变化
本研究结果显示,象山港浮游动物的群落结构和群落参数均存在空间变化。群落结构在大潮期呈明显的沿港轴线的梯度分布,在小潮期斑块性分布特征更明显,即潮流速度影响着浮游动物群落的空间分布方式;生物量、丰度和多样性等群落参数的空间变化方式除取决于浮游动物群落的分布特征外、还受影响于参数在狭湾口内外有无明显差异,如春季狭湾口外生物量较口内高、多样性较口内低,夏季狭湾口外多样性高于口内,则这些参数在大潮期也呈沿港轴线的梯度分布,而春季丰度和夏季生物量、丰度在狭湾口内外无明显差异,则他们在大潮期呈均匀分布或斑块状分布特征。
潮流速度能明显影响象山港浮游动物的空间异质性分布方式是由象山港狭长的地形特征决定的。象山港由于港湾狭长且湾口较窄,湾内水体交换能力差,狭湾口内15 km处90%湾内水被置换需65 d,口内20 km以西的水交换速度更慢,湾顶90%湾内水被置换需80 d;而狭湾口附近90%湾内水被置换只需15 d,牛鼻山水道至佛渡水道的潮通道中水交换速度更快,90%水体被外海水置换的时间不足5 d[33]。因此狭湾口内外的水体特征和浮游动物群落结构差异较狭湾内的空间差异明显很多(未发表数据)。当潮流速度较小时,狭湾外海水到达狭湾内的位置不够深入,难以使湾内浮游生物群落形成明显梯度;而当潮流速度较大时,狭湾外海水到达狭湾内位置较深入、与狭湾内海水混合范围扩大,从而使湾内浮游生物群落形成湾顶、湾口及过渡区的明显梯度分布特征。
影响浮游动物群落梯度分布的主导因素为盐度和悬浮物。象山港盐度是外海水团与湾内径流相互作用的结果,狭湾西部盐度较低且常年变化不大,湾口受长江冲淡水或台湾暖流等影响盐度较高且季节变化大[12],因此,象山港盐度基本呈由湾顶到湾口逐渐升高的趋势。因水体混合状况和控制机理不同,象山港可划分为狭湾外平流和潮弥散混合区、狭湾内段重力环流和潮振荡垂向切变混合区及狭湾外段过渡区三区[34],又因沉积底质不同,西泽-咸祥连线以西粘土占优势、以东粉砂占优势,象山港悬浮物浓度也呈由湾顶到湾口逐渐升高趋势。因此象山港地形、底质和水团交换特征决定的盐度和悬浮物的梯度性是象山港主要的水文空间特征,其决定了浮游动物群落沿港轴线的空间梯度异质性。该特征类似河口区浮游动物梯度分布[5- 7]。
主导浮游动物群落斑块状分布的环境因素是多样的。从CCA和分组环境参数统计的结果看,影响因素可能有水深、叶绿素a和营养盐等。如春季小潮期,Ⅱ组S08站由于水深仅有4.5 m,底栖类物种(如猛水蚤、麦秆虫)和适宜浑浊环境生活的物种(如细巧华哲水蚤)丰度比例升高,因此群落结构与其他站位差异大;而Ⅰ组S01、S14和S17站所在的支港和湾口处叶绿素a和营养盐浓度高,可能是主导该处浮游动物丰度明显高的因素。此外,浮游动物斑块状分布的另一主要因素是内外水团的交汇,两种水团的交汇区常表现为斑块区,如夏季小潮期的Ⅲ组S11、S12和S16站位于西沪港口东、西两侧,分别为港外水团与主港内港水和西沪港支港水的交叉区;夏季大潮期S10和S15站分别位于南沙岛南侧和西沪港内,亦为港外水团分别与主港内港水和西沪港支港水的交叉区。
潮流速度对浮游动物群落空间分布的影响还表现在对内外水团交汇位置的影响。春季,小潮期S16站群落与其以西站位划为一组,而大潮期与S17站划为一组,生物量和丰度的空间分布也表明,狭湾外的高值区在大潮期已深入到达湾口处。夏季,大、小潮期浮游动物群落划分中的内外水团交汇位置也不同,小潮期交汇区分别位于西沪港口西侧和东侧,而大潮期分别深入到南沙岛南侧和西沪港内。浮游动物群落交汇区在夏季大、小潮的分布位置与黄秀清等[35]2001年夏季用拉格朗日法模拟的象山港水质点漂移距离的结果非常吻合,其模拟结果显示:夏季小潮涨潮时西泽横山一线的质点可漂移至西沪港口西侧和西沪港口处,夏季大潮涨潮时西泽横山一线的质点可漂移至南沙岛附近和西沪港内。以上现象也说明大潮期的外海水较小潮期更加深入狭湾,扩大了内外水团混合的范围。此外,潮流的影响还表现出季节的差异,与春季相比,由于夏季径流量增加和沿岸水受北上台湾暖流影响,夏季外海水团可更加深入象山港狭湾,如春季外海潮流可影响到西沪港以东至湾口,而夏季可深入影响到南沙岛以东至狭湾口。
从本研究结果看,水质因素和生物因素对象山港大中型浮游动物空间分布的影响较弱。且叶绿素a与浮游动物丰度的相关性仅在春季观察到,这可能主要与浮游动物的选择性摄食有关,大中型浮游动物主要以硅藻等较大粒径浮游植物或微型浮游动物为食[36],而象山港春季的硅藻丰度及比例远高于夏季[37- 38],因此,春季大中型浮游动物的摄食强度可由叶绿素a浓度反映出,而夏季小粒径浮游植物增加,叶绿素a浓度不能反映大中型浮游动物摄食强度。象山港水体的溶解氧和酸碱度几乎无空间差异,因此对浮游动物的空间分布也基本无影响。象山港的营养盐水平高,春、夏两季全港均处于富营养化状态[39]。Badosa等[40]报道盐沼小型浮游动物物种多样性与营养盐水平关系密切,而Chen等[41]对富营养的珠江口和中营养的香港近海进行比较研究发现,河流输入的富营养水仅会在夏季引起桡足类无节幼体的增加,而对浮游动物群落其他组成无明显影响。综合相关研究和本研究结果认为象山港营养盐浓度虽有空间变化,但对大中型浮游动物的空间分布几乎无直接影响。
致谢:环境因子数据由国家海洋局第二海洋研究所刘小涯、姚龙奎等提供,寿鹿、廖一波对写作给予帮助,特此致谢。
[1] 邬建国. 景观生态学——格局、过程、尺度与等级(第二版). 北京: 高度教育出版社, 2007: 19- 21.
[2] Pinel-Alloul P. Spatial heterogeneity as a multiscale characteristic of zooplankton community. Hydrobiologia, 1995, 300- 301(1): 17- 42.
[3] Marrari M, Daly K L, Timonin A, Semenova T. The zooplankton of Marguerite Bay, western Antarctic Peninsula-Part II: Vertical distributions and habitat partitioning. Deep-Sea Research II, 2011, 58(13- 16): 1614- 1629.
[4] Morozov A, Arashkevich E, Reigstad M, Falk-Petersen S. Influence of spatial heterogeneity on the type of zooplankton functional response: A study based on field observations. Deep-Sea Research II, 2008, 55(20- 21): 2285- 2291.
[5] Gao Q, Xu Z L, Zhuang P. The relation between distribution of zooplankton and salinity in the Changjiang Estuary. Chinese Journal of Oceanology and Limnology, 2008, 26(2): 178- 185.
[6] Speckman S G, Piatt J F, Minte-Vera C V, Parrish J K. Parallel structure among environmental gradients and three trophic levels in a subarctic estuary. Progress in Oceanography, 2005, 66(1): 25- 65.
[7] Li K Z, Yin J Q, Huang L M, Tan Y H. Spatial and temporal variations of mesozooplankton in the Pearl River estuary, China. Estuarine, Coastal and Shelf Science, 2006, 67(4): 543- 552.
[8] Chen H J, Qi Y P, Liu G X. Spatial and temporal variations of macro- and mesozooplankton community in the Huanghai Sea (Yellow Sea) and East China Sea in summer and winter. Acta Oceanologica Sinica, 2011, 30(2): 84- 95.
[9] Jagadeesan L, Jyothibabu R, Anjusha A, Mohan A P, Madhu N V, Muraleedharan K R, Sudheesh K. Ocean currents structuring the mesozooplankton in the Gulf of Mannar and the Palk Bay, southeast coast of India. Progress in Oceanography, 2013, 110: 27- 48.
[10] Giraldo A, Escribano R, Marin V. A field test of temperature effects on ecophysiological responses of copepodidCalanuschilensisduring coastal upwelling in northern Chile. Continental Shelf Research, 2006, 26(11): 1307- 1315.
[11] Fan A D, Jin X S. Tidal effect on nutrient exchange in Xiangshan Bay, China. Marine Chemistry, 1989, 27(3/4): 259- 281.
[12] 中国海湾志编纂委员会. 中国海湾志, 第五分册. 北京: 海洋出版社, 1992: 166- 184.
[13] Hwang J S, Wong C K. The China Coastal Current as a driving force for transportingCalanussinicus(Copepoda: Calanoida) from its population centers to waters off Taiwan and Hong Kong during the winter northeast monsoon period. Journal of Plankton Research, 2005, 27(2): 205- 210.
[14] Hwang J S, Souissi S, Tseng L C, Seuront L, Schmitt F G, Fang L S, Peng S H, Wu C H, Hsiao S H, Twan W H, Wei T P, Kumar R, Fang T H, Chen Q C, Wong C K. A 5-year study of the influence of the northeast and Southwest monsoons on copepod assemblages in the boundary coastal waters between the East China Sea and the Taiwan Strait. Journal of Plankton Research, 2006, 28(10): 943- 958.
[15] Ka S, Hwang J S. Mesozooplankton distribution and composition on the northeastern coast of Taiwan during autumn: effects of the Kuroshio current and hydrothermal vents. Zoological Studies, 2011, 50(2): 155- 163.
[16] 刘镇盛, 王春生, 杨俊毅, 张健, 朱根海. 象山港冬季浮游动物的分布. 东海海洋, 2004, 22(1): 34- 42.
[17] 王春生, 刘镇盛, 何德华. 象山港浮游动物生物量和丰度的季节变动. 水产学报, 2003, 27(6): 595- 599.
[18] 王晓波, 邱武生, 秦铭俐, 魏永杰. 象山港浮游动物生态群落分布的研究. 海洋环境科学, 2009, 28(增刊1): 62- 64.
[19] 朱艺峰, 王银, 林霞, 吴燕萍, 赵金龙, 严小军. 象山港两种网目网采浮游动物群落比较. 应用生态学报, 2012, 23(8): 2277- 2286.
[20] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 海洋调查规范 第6部分:海洋生物调查(GB/ T12763.6- 2007). 北京: 中国标准出版社, 2007.
[21] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 海洋监测规范 第4部分:海水分析(GB 17378. 4- 2007). 北京: 中国标准出版社, 2007.
[22] Clarke K R, Warwick R M. Change in Marine Communities: An Approach to Statistical Analysis and Interpretation. 2nd ed. Plymouth: PRIMER-E Ltd., 2001: 5- 6.
[23] 王婕妤, 唐静亮, 胡颢琰, 黄备, 魏娜. 浙江近岸海域浮游动物的生态分布特征. 浙江海洋学院学报: 自然科学版, 2008, 27(4): 384- 389.
[24] 高原, 赖子尼, 王超, 庞世勋, 魏泰莉, 杨婉玲, 谢文平. 珠江口浮游动物分布特征研究. 中国水产科学, 2008, 15(2): 260- 268.
[25] 徐晓群, 曾江宁, 寿鹿, 曾淦宁, 胡锡钢. 兴化湾浮游动物群落季节变化和水平分布. 生态学报, 2010, 30(3): 734- 744.
[26] 林霞, 朱艺峰, 赵崖. 几种环境因子对墨氏胸刺水蚤摄食的影响. 海洋湖沼通报, 2002, (4): 38- 45.
[27] 郑重, 李松, 李少菁. 我国海洋浮游桡足类的种类组成和地理分布. 厦门大学学报: 自然科学版, 1978, (2): 51- 63.
[28] 徐兆礼, 高倩. 长江口海域真刺唇角水蚤的分布及其对全球变暖的响应. 应用生态学报, 2009, 20(5): 1196- 1201.
[29] 徐兆礼, 张凤英, 罗民波. 东海栉水母(Ctenophora)生态特征. 生态学杂志, 2006, 25(11): 1301- 1305.
[30] 黄加祺, 郑重. 温度和盐度对厦门港几种桡足类存活率的影响. 海洋与湖沼, 1986, 17(2): 161- 167.
[31] 徐兆礼, 陈亚瞿. 东海毛颚类优势种及与环境的关系. 中国水产科学, 2005, 12(1): 76- 82.
[32] 董礼先, 苏纪兰. 象山港盐度分布和水体混合Ⅰ.盐度分布和环流结构. 海洋与湖沼, 2000, 31(2): 151- 158.
[33] 董礼先, 苏纪兰. 象山港水交换数值研究Ⅱ.模型应用和水交换研究. 海洋与湖沼, 1999, 30(5): 465- 470.
[34] 董礼先, 苏纪兰. 象山港盐度分布和水体混合Ⅱ.混合分析. 海洋与湖沼, 2000, 31(3): 322- 326.
[35] 黄秀清, 王金辉, 蒋晓山. 象山港海洋环境容量及污染物总量控制研究. 北京: 海洋出版社, 2008: 61- 68.
[36] Silvert W, Platt T. Dynamic energy-flow model of the particle size distribution in pelagic ecosystems // Evolution and Ecology of Zooplankton Communities. Hanover: University of New England Press, 1980: 754- 763.
[37] Chen B Z, Liu H B, Landry M R, Chen M, Sun J, Shek L, Chen X H, Harrison P J. Estuarine nutrient loading affects phytoplankton growth and microzooplankton grazing at two contrasting sites in Hong Kong coastal waters. Marine Ecological Progress Series, 2009, 379: 77- 90.
[38] Jiang Z B, Zhu X Y, Gao Yu, Chen Q Z, Zeng J N, Zhu G H. Spatio-temporal distribution of net-collected phytoplankton community and its response to marine exploitation in Xiangshan Bay. Chinese Journal of Oceanology and Limnology, 2013, 31(4): 762- 773.
[39] 张丽旭, 蒋晓山, 蔡燕红. 象山港海水中营养盐分布与富营养化特征分析. 海洋环境科学, 2008, 27(5): 488- 491.
[40] Badosa A, Boix D, Brucet S, López-Flores R, Gascón S, Quintana X D. Zooplankton taxonomic and size diversity in Mediterranean coastal lagoons (NE Iberian Peninsula): Influence of hydrology, nutrient composition, food resource availability and predation. Estuarine, Coastal and Shelf Science, 2007, 71(1/2): 335- 346.
[41] Chen M, Chen B Z, Harrison P, Liu H B. Dynamics of mesozooplankton assemblages in subtropical coastal waters of Hong Kong: A comparative study between a eutrophic estuarine and a mesotrophic coastal site. Continental Shelf Research, 2011, 31(10): 1075- 1086.
Spatial heterogeneity of macro- and meso-zooplankton in Xiangshan Bay in spring and summer
DU Ping1,2, XU Xiaoqun1, LIU Jingjing1, JIANG Zhibing1,2, CHEN Quanzhen1, ZENG Jiangning1,*
1LaboratoryofMarineEcosystemandBiogeochemistry,StateOceanicAdministration,SecondInstituteofOceanography,Hangzhou310012,China2NingboUniversity,Ningbo315211,China
Spatial heterogeneity refers to non-uniformity and complexity of spatial distribution in ecological systems, and is generally regarded as the sum of patchy and gradient distribution patterns. The concept of spatial heterogeneity has long been applied to the field of ecology, but was introduced later in the marine environment because of the complexity caused by water fluidity and the weak motility of plankton. However, spatial heterogeneity of the marine environment is crucial to the diversity of structure and function of marine communities. Thus, spatial heterogeneity of plankton communities has been frequently discussed by marine ecologists. To investigate the spatial distribution of macro- and meso-zooplankton in Xiangshan Bay, the zooplankton community and associated environmental factors were investigated at neap and spring tide in April and July 2010. Using a shallow water type I plankton net, seventeen tows from the inner bay to the outer bay were conducted on each sampling occasion. Water quality parameters including: temperature, salinity, depth, pH, water clarity, dissolved oxygen, suspended solid concentrations and nutrient levels were also measured. A total of 64 adult zooplankton species representing fourteen taxa, and fourteen planktonic larval species from ten taxa were identified from the four cruises. Species composition changed 66.7% between spring and summer. While brachyuran zoea and larval fish were dominant in both seasons, other dominant species changed between the two seasons resulting in a significant difference (P= 0.001) in community structure. Species similarity between neap tide and spring tide was about 60% within the same season (P= 0.031). Biomass and abundance was higher in spring than in summer, while species diversity was lower. Temperature was the main factor which influenced seasonal variation in zooplankton. Analysis of variance, community clustering and non-metric multi-dimensional scaling analyses showed that the distribution framework of the zooplankton community was influenced by tide. Community structure exhibited a stronger gradient during spring tide, and was patchily distributed during neap tide. Community structure determined patterns of distribution, but this was influenced by differences in biomass, abundance and diversity inside and outside the mouth of Xiangshan Bay. Canonical correspondence analysis and regional analysis of environmental parameters showed that gradients in distribution were mainly determined by salinity and suspended solids. The main environmental parameters associated with patchiness included depth, chlorophyllaconcentration, nutrients and the interaction of water masses in and out of Xiangshan Bay under different conditions. Gradient and patchiness patterns of zooplankton distribution were both influenced by the tide. The spatial distribution of zooplankton in Xiangshan Bay was strongly influenced by hydrological factors, and weakly influenced by chemical and biological factors. Zooplankton abundance and chlorophyllaconcentration were correlated during spring. Water quality parameters including dissolved oxygen, pH and nutrient levels had little direct influence on the spatial distribution of zooplankton in the bay.
zooplankton; spatial heterogeneity; Xiangshan Bay; tide
国家重点基础研究发展规划项目(2010CB428903);海洋公益性行业科研专项(201305043- 3; 201305009);国家海洋局青年海洋科学基金(2013140; 2013144);浙江省自然科学基金(Y14D060031);浙江省海水养殖重点科技创新团队项目(2010R50025- 28);国家海洋局第二海洋研究所基本科研业务费专项(JG1412)
2013- 06- 09;
日期:2014- 10- 09
10.5846/stxb201306091487
*通讯作者Corresponding author.E-mail: jiangningz@126.com
杜萍,徐晓群,刘晶晶,江志兵,陈全震,曾江宁.象山港春、夏季大中型浮游动物空间异质性.生态学报,2015,35(7):2308- 2321.
Du P, Xu X Q, Liu J J, Jiang Z B, Chen Q Z, Zeng J N.Spatial heterogeneity of macro- and meso-zooplankton in Xiangshan Bay in spring and summer.Acta Ecologica Sinica,2015,35(7):2308- 2321.
——以“不同咖啡因饮料对水蚤心率的影响”为例

