青岛市不同功能区冬季空气微生物群落代谢与多样性特征
吴等等,宋志文,徐爱玲,郑 远,夏 岩
青岛理工大学, 青岛 266033
青岛市不同功能区冬季空气微生物群落代谢与多样性特征
吴等等,宋志文*,徐爱玲,郑 远,夏 岩
青岛理工大学, 青岛 266033
选取青岛市5个功能区(市区街道、海滨区域、饮用水源地、垃圾填埋场和人工湿地污水处理系统),采用SAS ISO100空气浮游菌采样器于2013年冬季采集空气微生物样品,应用BIOLOG方法分析空气微生物群落代谢功能多样性,阐明群落代谢与环境相关性。结果表明,不同功能区空气微生物群落碳源代谢强度存在差异,代谢稳定时,海滨区域和饮用水源地样品平均光密度值(AWCD)分别为0.302、0.210,而人工湿地、市区街道及垃圾填埋场分别为0.063、0.025和0.034,海滨区域和饮用水源地空气微生物群落碳源代谢强度明显高于其他功能区。不同功能区空气微生物群落Shannon指数和Simpson指数接近,但海滨区域和饮用水源地McIntosh指数明显高于其他功能区。海滨区域和饮用水源地空气微生物群落碳源代谢类型丰富,代谢水平高,人工湿地、市区街道和垃圾填埋场碳源代谢类型单一,代谢水平低。5个功能区空气微生物群落碳源代谢差异呈现区域性,分异代谢差异的主要是羧酸类碳源。风速、温度、湿度等非生物因素对空气微生物群落碳源代谢具有不同程度影响,且不同功能区主导非生物因素存在差异。BIOLOG方法可以提供大量多维数据,能够分析样品间微生物群落碳源代谢差异,客观、全面表征空气微生物群落碳源代谢多样性特征,是研究空气微生物群落功能多样性较理想的方法之一。
青岛市; 城市功能区; 空气微生物; 代谢特征; 群落多样性; BIOLOG方法
空气微生物是指空气中细菌、霉菌和放线菌等有生命的活体,主要来源于土壤、水体、动植物和人类,此外污水处理、动物饲养、发酵过程和农业活动等也是空气微生物的重要来源[1- 4]。已知存在空气中的细菌及放线菌有1200种,真菌有40000种[5]。空气微生物不仅具有重要的生态系统功能,还与空气污染、环境质量和人体健康密切相关[6]。了解城市空气微生物群落特征、物种组成及浓度,对控制城市微生物污染、改善环境质量、维持人群健康和提高工农业生产具有重要的理论和实际意义。国内外学者已经对城市不同功能区、垃圾填埋场、污水处理厂、养殖环境等空气微生物区系、时空分布特征进行研究[1,7- 14]。但这些研究大多采用传统微生物培养方法[15- 20],由于“可培养类”微生物仅占总微生物的不到1%[21- 22],并且还有部分微生物处于活的不可培养状态,加上培养结果受培养基组分影响较大,导致测得的数据与实际情况有较大偏差。为了较准确的反映空气微生物群落和生态功能,需要从空气微生物种类、群落结构、功能多样性以及生物量等层次来研究。新发展的基于微生物群落代谢单一碳源特征的BIOLOG方法能够弥补传统方法的不足,底物碳源的多样性决定了BIOLOG微平板可以提供大量多维数据,且能够比较样品间微生物群落差异,较全面地表征微生物群落结构、总体代谢活性与功能信息,该方法已在微生物鉴定、污水处理工艺、污染土壤修复中得到广泛应用。
本文以青岛市5个城市功能区(市区街道、海滨区域、饮用水源地、城市生活垃圾填埋场和人工湿地污水处理系统)为研究对象,应用BIOLOG方法分析空气微生物群落碳源代谢功能多样性,阐明空气微生物群落代谢与环境相关性。对了解沿海城市不同功能区空气微生物特征及其对大气环境和人体健康的影响具有重要意义。
1 研究地区与研究方法
1.1 实验地点概况
选择青岛市区街道(抚顺路青岛理工大学段)、海滨区域(鲁迅公园)、饮用水源地(棘洪滩水库)、垃圾填埋场(小涧西生活垃圾综合处理厂)、人工湿地(胶南人工湿地污水处理系统)5个功能区作为采样地点。其中,(1)抚顺路位于青岛市市北区,是青岛市主要交通枢纽,人流量和车流量较大,汽车尾气和扬尘污染较严重;(2)鲁迅公园位于青岛市市南区,南面紧邻大海,长约1 km,占地面积0.04 km2,绿化面积75%以上,是青岛4A级旅游景点,冬季人流量较少;(3)棘洪滩水库位于青岛市城阳区,是引黄济青工程唯一调蓄水库,库区面积14.4 km2,是青岛市主要饮用水源地,供应青岛市50%以上居民用水,周围是农田,人流量较少;(4)小涧西生活垃圾综合处理厂位于青岛市城阳区,是青岛市内六区唯一的生活垃圾填埋场,设计库容7.1×106m3,占地面积0.66 km2,填埋区面积0.27 km2,绿地率41.25%,实际日填埋量3500 t/d,垃圾渗滤液经垂直和水平收集系统收集后排入污水处理厂进行处理;(5)人工湿地污水处理系统位于青岛市黄岛区,东南面紧邻黄海,采用自由表面流芦苇湿地工艺,由99个并联运行湿地单元组成,每个单元大小为140 m×32 m,总占地面积76.7 km2,处理规模3×104m3/d,污水来源为生活污水和工业废水(约1∶1)。
1.2 研究方法
1.2.1 样品采集
采样时间为2013年1月1日—5日,采用SAS ISO 100空气微生物采样器采集空气微生物样品,空气流量100 L/min,采样时间30 min。采样后取下凝胶膜,加到100 mL灭菌生理盐水中,摇床震荡10 min,凝胶膜溶解后作为接种液。采样期间利用TASI- 620数字式温湿度计测定采样环境温度和湿度,利用TASI- 641风速仪测定风速(表1)。
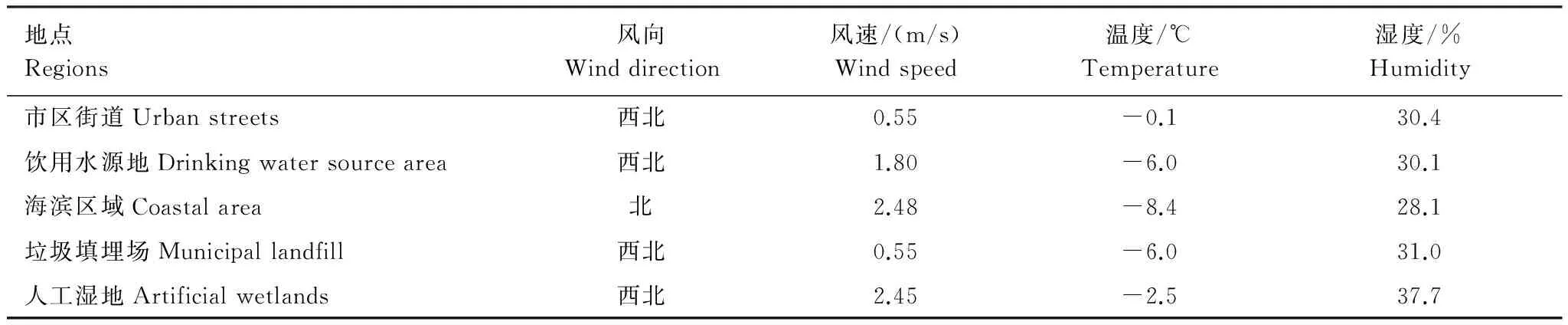
表1 采样点环境因子Table 1 Environmental factors of sampling sites
1.2.2 BIOLOG-GN操作方法
接种混匀的接种液于BIOLOG-GN板中,每孔接种量125 μL,接种后的BIOLOG-GN板置于25 ℃恒温培养箱中培养[23],每隔24 h于BIOLOG读数器上读数,波长590 nm,直至光密度值稳定为止,整个培养过程共持续8d。
1.3 计算方法
1.3.1 微生物碳源代谢水平
平均光密度值(AWCD)计算方法[23]:AWCD=∑(C-R)/n,式中C为反应孔光密度值,R为对照孔光密度值,n为底物数量,对于不同BIOLOG微平板n值不同, BIOLOG-GN板为95。
1.3.2 微生物多样性计算方法
选用72 h光密度值计算5个不同功能区空气微生物群落多样性指数[24]: Shannon指数(H′)、McIntosh指数(U)和Simpson指数(D)。计算公式见表2。

表2 空气微生物群落多样性指数计算方法Table 2 Computational methods for diversity index of airborne microbial community
1.3.3 统计分析方法
选取72 h平均光密度值(AWCD)利用SPSS 17.0软件进行主成分分析(PCA),利用CANOCA软件进行典范对应分析(CCA)[25]。
2 结果与分析
2.1 空气微生物群落碳源代谢强度变化
平均光密度值(AWCD)能够衡量空气微生物利用不同碳源的整体能力,表征微生物生理活性,从代谢水平上揭示空气微生物群落功能多样性。青岛市5个功能区AWCD随时间延长而增大,最初48 h内曲线较平缓,72 h AWCD值进入指数增长期,192 h达到稳定状态(图1)。方差分析表明,海滨区域和饮用水源地空气微生物碳源代谢水平与其余各功能区存在显著性差异(P<0.05)。培养过程中,人工湿地、市区街道和垃圾填埋场空气微生物碳源代谢水平较低,在192 h时AWCD值仍小于0.1,而海滨区域和饮用水源地空气微生物碳源代谢水平相对较高。5个功能区AWCD值变化趋势不同,表明各功能区空气微生物碳源利用能力、丰度等存在差异。
2.2 空气微生物群落碳源利用水平分析
BIOLOG-GN板包含95种碳源,根据碳源官能团可将其划为6类,其中糖类(Carbohydrates)30种、羧酸类(Carboxylic acids)24种、氨基酸类(Amino acids)20种、胺/氨类(Amines/amides)6种、聚合物类(Polymers)5种、其他(Miscellaneous)10种[26]。5个功能区空气微生物对6类碳源利用程度存在差异,海滨区域和饮用水源地空气微生物碳源代谢水平高于其他功能区。空气微生物碳源代谢优势群落依次为羧酸类代谢群落、糖类代谢群落、氨基酸类代谢群落。5个功能区空气微生物对羧酸类和糖类碳源利用程度均较高,对其它化合物类利用程度较低,其中,对胺/氨类代谢水平最低,市区街道、垃圾填埋场和饮用水源地空气微生物基本不能代谢这类碳源。同一功能区对不同碳源的利用程度也存在差异(图2)。

图1 青岛市5个功能区空气微生物AWCD变化Fig.1 Average well color development (AWCD) changes of airborne microbes at five city functional regions in Qingdao City
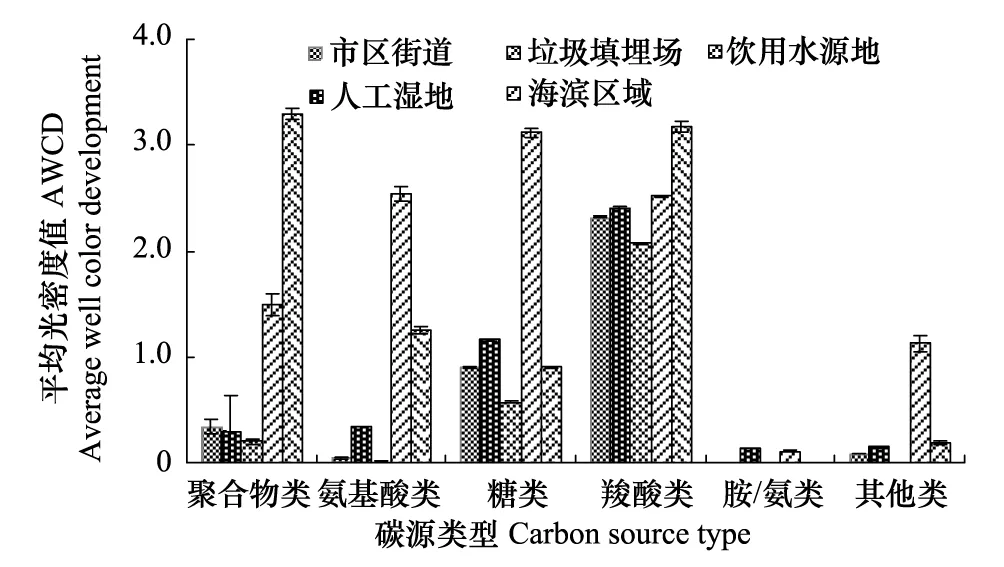
图2 青岛市5个功能区空气微生物群落对BIOLOG平板碳源的相对利用率Fig.2 Relative utilization ratios of carbon sources in BIOLOG plate by the airborne microbes at five city functional regions in Qingdao City
2.3 空气微生物群落种群多样性分析
采用Shannon指数、Simpson指数和McIntosh指数分析5个功能区空气微生物群落功能多样性,3种多样性指数反映了空气微生物群落功能多样性不同侧面,其中,Shannon指数受群落物种丰富度影响较大,反映了微生物群落物种种数及种间个体分配的均匀性;Simpson指数反映了群落中最常见的物种,是评估微生物群落优势度的指标;McIntosh指数则是度量群落物种均一度的指标。可以看出,Shannon指数饮用水源地最低,其次为海滨区域,其余3个功能区基本相同,Simpson指数除饮用水源地较低外,其余4个功能区基本相同,McIntosh指数差异较大,饮用水源地和海滨区域明显高于其余3个功能区(表3)。
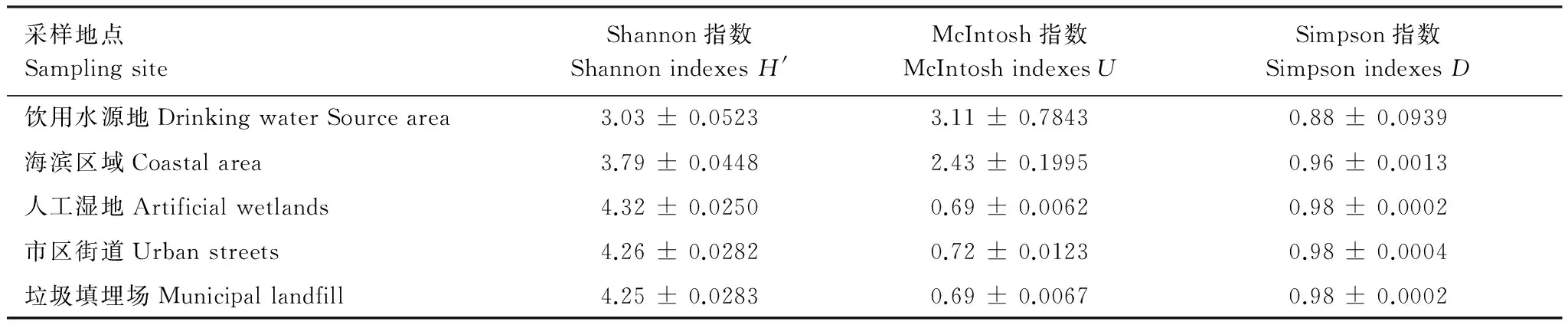
表3 不同功能区空气微生物群落多样性指数Table 3 Diversity index of airborne microbial community at five city functional regions in Qingdao City
2.4 空气微生物群落代谢功能主成分分析(PCA)
利用主成分分析法(PCA)分析青岛市5个功能区空气微生物群落代谢功能,共提取2个主成分,其中主成分1(PC1)方差贡献率37.6%,主成分2(PC2)方差贡献率23.0%,累计方差贡献率60.6%,能够解释原有变量大部分变异。在PC1上载荷大于0.9的基质有15种,主要是羧酸类、氨基酸及糖类,其中D-葡萄糖二酸载荷最大(0.968);在PC2上载荷大于0.9的基质有9种,主要是氨基酸和糖类,其中D-葡萄糖- 6-磷酸载荷最大(0.984)(表4)。PC1、PC2上载荷大于0.9的基质类型和利用率较高的碳源类型一致。
表4 与PC1、PC2相关系数大于0.9的基质
Table 4 Correlation coefficients greater than 0.9 between carbon substrates and Principal component 1(PC1) or Principal component 2 (PC2)

基质Carbonsource主成分1Principalcomponent1PC1(r)基质Carbonsource主成分2Principalcomponent2PC2(r)D-葡萄糖二酸0.968D-葡萄糖-6-磷酸0.984肝糖0.960α-环式糊精0.978L-谷氨酸0.959L-苏氨酸0.976N-乙酰-D-半乳糖胺0.958L-鸟氨酸0.972L-丙氨酸0.955L-丝氨酸0.966L-脯氨酸0.954D-阿拉伯醇0.965吐温800.953麦芽糖0.963α-戊酮酸0.948尿苷0.939乙酸0.944松二糖0.900α-D-乳糖0.931D-葡萄糖0.925奎宁酸/金鸡钠酸0.914γ-羟丁酸0.904L-海藻糖0.902i-赤藓糖醇0.903
根据青岛市5个功能区空气微生物群落碳源代谢相似性可以将5个功能区归为3类,其中市区街道、人工湿地及垃圾填埋场归为一类;海滨区域归为一类;饮用水源地归为一类。在PC1上,3类区域空气微生物碳源代谢差异显著,碳源利用谱容易区分。考察成分载荷矩阵可知,羧酸类在PC1上载荷较大,是碳源代谢差异区域性的主要分异碳源类型(图3)。
2.5 非生物因素对空气微生物群落碳源代谢水平的影响
研究表明,非生物因素(温度、湿度、海拔、风速、风向等)对空气微生物群落碳源代谢强度和单一碳源利用能力有不同程度影响[27- 29]。CCA典范对应分析能够从统计学角度分析环境因子和空气微生物群落碳源代谢相关性,揭示不同环境条件下微生物群落结构变化原因。从青岛市5个功能区空气微生物群落碳源代谢强度与环境因子CCA分析排序图中可以看出,温度、湿度与人工湿地、垃圾填埋场、市区街道空气微生物群落碳源代谢水平呈正相关,与海滨区域、饮用水源地呈负相关;风速与人工湿地、垃圾填埋场、市区街道空气微生物群落碳源代谢水平呈负相关,与海滨区域、饮用水源地呈正相关(图4)。

图3 5个功能区空气微生物群落BIOLOG微平板中底物碳源代谢的主成分分析Fig.3 Principal Component analysis (PCA) of BIOLOG plate data profiles revealed the patterns of microbial communities at five city functional regions in Qingdao City

图4 5个功能区碳源代谢强度与环境因子CCA分析排序Fig.4 A two-dimensional graph analysis of canonical correspondence analysis (CCA) coordination for AWCD of five airborne microbial community and environment factors
3 讨论
不同环境条件或不同环境介质微生物群落碳源代谢强度、碳源代谢类型差异显著,微生物群落碳源代谢呈现区域性,并且分异这种区域性的碳源类型随环境条件和环境介质改变而不同[23,27,29- 31]。
3.1 空气微生物群落碳源代谢强度变化
AWCD可以评估空气微生物利用不同碳源的整体能力,从功能代谢水平上揭示空气微生物群落结构多样性,是反映空气微生物活性、描述空气微生物群落功能多样性的重要指标[29]。青岛市5个功能区空气微生物群落碳源代谢强度存在差异,其中,海滨区域、饮用水源地空气微生物群落碳源代谢强度较高,人工湿地、市区街道和垃圾填埋场空气微生物群落碳源代谢强度较低。研究表明,高辐射、寡营养及干燥环境使得一些生长缓慢、产孢子和芽孢的类群(如放线菌和芽孢杆菌)占优势,导致碳源利用能力降低[32],而BIOLOG方法对生长缓慢、不能很好利用BIOLOG板中碳源的微生物反映能力较差[33]。海滨区域和饮用水源地环境湿度较大,导致空气微生物生理活性和碳源利用强度相对较高。对比BIOLOG方法在土壤微生物群落代谢中的研究结果[34- 43],发现空气微生物群落碳源代谢整体水平较低,可能与空气微生物组成及采样季节有关[44]。
3.2 空气微生物群落多样性
Shannon指数(H′)、McIntosh指数(U)和Simpson指数(D)分别从微生物群落丰富度、均一性及常见种群优势度等方面反映空气微生物群落多样性。青岛市不同功能区空气微生物群落丰富度和优势度接近,但群落均一度存在差异,饮用水源地和海滨区域空气微生物群落物种较均一,可能由于该功能区环境湿度大,昼夜温差小,为一些微生物种群提供适宜生存条件[27,29],同时,冬季海滨区域和饮用水源地受人为因素影响较少,扬尘等对空气微生物群落组成扰动较小,从而形成相对均一稳定的空气微生物群落。
3.3 空气微生物群落碳源代谢水平差异
青岛市5个功能区空气微生物群落碳源代谢类型和代谢水平存在差异,且呈现区域性。海滨区域空气微生物群落碳源代谢类型主要是糖类、氨基酸类、羧酸类及聚合物类,对糖类代谢水平最高;饮用水源地碳源代谢类型主要是聚合物类、羧酸类、氨基酸类及糖类,对聚合物类碳源代谢水平最高;市区街道、人工湿地和垃圾填埋场空气微生物群落主要碳源代谢类型是羧酸类、糖类;5个功能区空气微生物群落对羧酸类碳源代谢水平均较高。研究发现,空气微生物群落碳源代谢水平与所处环境条件具有相关性,环境条件影响空气微生物的来源,同时构成微生物生存的特殊生境,影响其生理活性,使空气微生物群落碳源代谢差异呈现区域性[17,19]。冬季人工湿地、垃圾填埋场和市区街道均有湿度低、温差大的特点,并且垃圾填埋场和市区街道空气微生物群落组成受人为活动影响较大,但研究发现人工湿地、市区街道和垃圾填埋场空气微生物群落碳源代谢相近,推测这3个功能区空气微生物群落组成及生理活性受温度、湿度等环境因子影响较大。海滨区域和饮用水源地尽管有着相似的温度、湿度条件,但由于海水环境和淡水环境差异,形成空气微生物生境差异,同时海风也会影响空气微生物群落组成,导致海滨区域和饮用水源地空气微生物群落碳源代谢存在差异。
4 结论
(1)青岛市5个功能区冬季空气微生物群落碳源代谢强度和代谢类型存在差异。海滨区域和饮用水源地空气微生物群落碳源代谢强度明显高于其他功能区,且碳源代谢类型丰富,代谢水平相对较高。
(2)青岛市5个功能区冬季空气微生物丰富度和种群优势度接近,而群落物种均一度存在差异。空气微生物群落碳源代谢差异呈现区域性,可以归为3类,分别为:①海滨区域、②饮用水源地、③人工湿地、市区街道和垃圾填埋场。羧酸类是分异不同功能区空气微生物碳源代谢差异区域性的主要碳源类型。
(3)BIOLOG方法能够从微生物群落碳源代谢强度、碳源代谢类型及碳源利用区域性分异等方面研究微生物群落代谢,但只能反映在BIOLOG-GN板上能够生长的微生物。要全面研究空气微生物群落结构特征,还需要结合基因多样性方面的研究。
[1] Bovallius A, Bucht B, Roffey R, Anäs P. Three-Year investigation of the natural airborne bacterial flora at four localities in Sweden. Applied and Environmental Microbiology, 1978, 35(5): 847- 852.
[2] Lindmanm J, Constantinidou H, Barchet W, Christen D. Plants as sources of airborne bacteria including ice nucleation-active bacteria. Applied and Environmental Microbiology, 1982, 44(5): 1059- 1063.
[3] Mancinelli R, Shulls W A. Airborne bacteria in an urban environment. Applied and Environmental Microbiology, 1978, 35(6): 1095- 1011.
[4] Martinez K F, Sheehy J W, Jones J H, Cusick L B. Microbial containment in conventional fermentation processes. Applied Industrial Hygiene, 1988, 3(6): 177- 181.
[5] 周连玉, 乔枫. 中国绿地空气微生物研究现状与展望. 中国农学通报, 2011, 27(20): 269- 273.
[6] Lacey J, Dutkiewicz J. Bioaerosols and occupational lung disease. Journal of Aerosol Science, 1994, 25(8): 1371- 1404.
[7] Wright T J, Greene V W, Paulus H J. Viable microorganisms in an urban atmosphere. Journal of the Air Pollution Control Associate, 1969, 19(5): 337- 341.
[8] 方治国, 欧阳志云, 胡利锋, 王效科, 林学强. 北京市夏季空气微生物群落结构和生态分布. 生态学报, 2005, 25(1): 83- 88.
[9] 岳冰, 夏立江, 杜文利, 邝溯琳, 李轶伦, 许建民. 北京某垃圾填埋场空气微生物污染状况. 中国环境科学, 2006, 26(S1): 102- 105.
[10] 任启文, 王成, 杨颖, 胡立香. 城市绿地空气微生物浓度研究——以北京元大都公园为例. 干旱区资源与环境, 2007, 21(4): 80- 83.
[11] 蔡旭玲, 刘坚, 姚振江, 周俊立, 陈思东. 广州部分大型汽车客运站候车厅空气微生物污染状况. 环境与健康杂志, 2010, 27(8): 725.
[12] 王友斌, 康怀雄, 邓俊兴, 申志新, 李素红, 邱贺民, 刘秀岩, 孙宗科, 李霞, 张伟, 丁培, 陈西平. 商场与超市室内空气微生物污染状况调查. 中国卫生检验杂志, 2011, 21(8): 2038- 2040.
[13] 孙宗科, 康怀雄, 申志新, 李素红, 吴建荣, 唐建红, 卢志坚, 张淑红, 邱贺民, 张伟, 陈西平. 南方和北方城市住宅室内空气微生物调查. 环境与健康杂志, 2011, 28(2): 130- 132.
[14] 欧阳友生, 谢小保, 陈仪本, 黄小茉, 彭红, 施庆珊. 广州市空气微生物含量及其变化规律研究. 微生物学通报, 2006, 33(3): 47- 51.
[15] Choi D S, Park Y K, Oh S K, Yoon H J, Kim J C, Seo W J, Cha S H. Distribution of airborne microorganisms in Yellow Sands of Korea. The Journal of Microbiology, 1997, 35(1): 1- 9.
[16] Yeo H G, Kim J H. SPM and fungal spores in the ambient air of west Korea during the Asian dust (Yellow Sand) period. Atmospheric Environment, 2002, 36(35): 5437- 5442.
[17] Griffin D W, Kubilay N, Koçak M, Gray M A, Borden T C, Shinn E A. Airborne desert dust and aeromicrobiology over the Turkish Mediterranean coastline. Atmospheric Environment, 2007, 41(19): 4050- 4062.
[18] Hua N P, Kobayashi F, Iwasaka Y, Shi G Y, Naganuma T. Detailed identification of desert-originated bacteria carried by Asian dust storms to Japan. Aerobiologia, 2007, 23(4): 291- 298.
[19] Polymenakou P N, Mandalakis M, Stephanou E G, Tselepides A. Particle size distribution of airborne microorganisms and pathogens during an intense African dust event in the eastern Mediterranean. Environmental Health Perspectives, 2008, 116(3): 292- 296.
[20] Meyer C, Bernard N, Moskura M, Toussaint M L, Denayer F, Gilbert D. Effects of urban particulate deposition on microbial communities living in bryophytes: An experimental study. Ecotoxicology and Environmental Safety, 2010, 73(7): 1776- 1784.
[21] Brock T D. The study of microorganismsinsitu: Progress and problems. Symposium of the Society for General Microbiology, 1987, 41: 1- 17.
[22] Amann R I, Ludwig W, Schleifer K H. Phylogenetic identification and in situ detection of individual microbial cells without cultivation. Microbiology Reviews, 1995, 59(1): 143- 169.
[23] 郑华, 陈法霖, 欧阳志云, 方治国, 王效科, 苗鸿. 不同森林土壤微生物群落对BIOLOG-GN板碳源的利用. 环境科学, 2007, 28(5): 1126- 1130.
[24] Jeffrey S B, Donald D K. Microbial diversity in the rhizosphere of corn grown under conventional and low-input systems. Applied Soil Ecology, 1996, 5(1): 21- 27.
[25] 王强, 戴九兰, 吴大千, 余悦, 申天琳, 王仁卿. 微生物生态研究中基于BIOLOG方法的数据分析. 生态学报, 2010, 30(3): 817- 823.
[26] Preston-Mafham J, Boddy L, Randerson P F. Analysis of microbial community functional diversity using sole-carbon-source utilisation profiles-a critique. FEMS Microbiology Ecology, 2002, 42(1): 1- 14.
[27] 段魏魏, 娄恺, 曾军, 胡蓉, 史应武, 何清, 刘新春, 孙建, 晁群芳. 塔克拉玛干沙尘暴源区空气微生物群落的代谢特征. 环境科学, 2012, 33(1): 27- 31.
[28] 凌琪, 王晏平. 黄山风景区夏季空气微生物分布特征初步研究. 微生物学通报, 2008, 35(9): 1379- 1384.
[29] 凌琪, 包金梅, 李瑞, 陶勇, 鲍立宁, 毛钦焱. BIOLOG-ECO解析黄山风景区空气微生物碳代谢多样性特征. 应用基础与工程科学学报, 2012, 20(1): 56- 63.
[30] 郑琼, 崔晓阳, 邸雪颖, 金森. 不同林火强度对大兴安岭偃松林土壤微生物功能多样性的影响. 林业科学, 2012, 48(5): 96- 100.
[31] 姜睿玲, 杨统一, 陈芳艳, 唐玉斌. 桑园土壤微生物群落功能多样性对PAHs污染的响应. 生态与农村环境学报, 2012, 28(4): 439- 444.
[32] Griffin D W. Atmospheric movement of microorganisms in clouds of desert dust and implications for human health. Clinical Microbiology Reviews, 2007, 20(3): 459- 477.
[33] 李鑫, 张会慧, 岳冰冰, 金薇薇, 许楠, 朱文旭, 孙广玉. 桑树-大豆间作对盐碱土碳代谢微生物多样性的影响. 应用生态学报, 2012, 23(7): 1825- 1831.
[34] 张瑞, 张贵龙, 陈冬青, 姬艳艳, 张海芳, 杨殿林. 不同施肥对农田土壤微生物功能多样性的影响. 中国农学通报, 2013, 29(2): 133- 139.
[35] 邵丽, 谷洁, 张社奇, 高华, 秦清军. 生物复混肥对土壤微生物功能多样性及土壤酶活性的影响. 农业环境科学学报, 2012, 31(6): 1153- 1159.
[36] Xue D, Yao H Y, Ge D Y, Huang C Y. Soil microbial community structure in diverse land use systems: a comparative study using Biolog, DGGE, and PLFA Analyses. Pedosphere, 2008, 18(5): 653- 663.
[37] 曹均, 吴姬, 赵小蓉, 李贵桐, 孙明德, 曹庆昌, 林启美. 北京9个典型板栗园土壤碳代谢微生物多样性特征. 生态学报, 2010, 30(2): 527- 532.
[38] 孔滨, 孙波, 郑宪清, 陈小云, 隋跃宇, 王帘里. 水热条件和施肥对黑土中微生物群落代谢特征的影响. 土壤学报, 2009, 46(1): 100- 106.
[39] 安韶山, 李国辉, 陈利顶. 宁南山区典型植物根际与非根际土壤微生物功能多样性. 生态学报, 2011, 31(18): 5225- 5234.
[40] 杨宇虹, 陈冬梅, 晋艳, 王海斌, 段玉琦, 郭徐魁, 何海斌, 林文雄. 不同肥料种类对连作烟草根际土壤微生物功能多样性的影响. 作物学报, 2011, 37(1): 105- 111.
[41] 刘继明, 黄炳军, 徐演鹏, 卢萍, 林英华. 河南鸡公山自然保护区典型森林类型土壤微生物群落功能多样性. 林业资源管理, 2013, (1): 76- 79,85.
[42] 陈法霖, 郑华, 阳柏苏, 张凯, 肖燚, 屠乃美. 中亚热带几种针、阔叶树种凋落物混合分解对土壤微生物群落碳代谢多样性的影响. 生态学报, 2011, 31(11): 3027- 3035.
[43] 姬艳艳, 张贵龙, 张瑞, 刘玉升, 杨殿林, 王彩灵. 耕作方式对农田土壤微生物功能多样性的影响. 中国农学通报, 2013, 29(6): 117- 123.
[44] 潘立勇, 李勇, 付红, 潘宏博. 徐州城市主要环境功能区空气微生物污染状况评价. 中国环境监测, 2008, 24(3): 72- 74.
Metabolic characteristics and community diversities of airborne microbes at different functional regions in Qingdao in winter
WU Dengdeng, SONG Zhiwen*, XU Ailing, ZHENG Yuan, XIA Yan
CollegeofEnvironmentandMunicipalEngineering,QingdaoTechnologicalUniversity,Qingdao266033,China
Airborne microbes are major biological components of the ecosystem that have important ecosystem functions, affect human health and air pollution, and are key indicators of air quality. To determine the metabolic characteristics and community diversity of airborne microbes in different functional regions of Qingdao in winter, sampling sites were set up in five different functional regions (urban streets, a coastal area, drinking water source area, municipal landfill, and artificial wetlands). Airborne microbes were then collected using an SAS ISO100 air sampler in January 2013 and their carbon source metabolic characteristics, functional diversity, and relationship with environmental factors were systematically analyzed by the BIOLOG method. The results revealed significant differences in carbon metabolic profiles of air microbial communities from the five locations. When metabolism was stable, the average well color developments of samples from the coastal area and drinking water source area were 0.302 and 0.21, respectively, whereas those of artificial wetlands, urban streets, and municipal landfill were 0.063, 0.025, and 0.034, respectively. Therefore, the levels of carbon metabolism in the coastal area and drinking water source area were higher than those at other locations. The Shannon indexes and Simpson indexes at the five different functional regions were similar. However, the McIntosh indexes at the coastal area and drinking water source area were higher than those at other locations. Overall, the microbial diversity and dominant species differed among functional regions, but microflora was distributed more evenly in the coastal area and drinking water source area. Among the five locations, carbon catabolic types and levels in the coastal area and drinking water source area were richer and higher than those in the artificial wetlands, urban streets, and municipal landfill. Overall, the airborne microbes in various functional areas had high carbohydrate and carboxylic acid metabolism, and air microbial communities in the coastal and drinking water source areas had better ability to metabolize polymers, carbohydrates, carboxylic acids, and amino acids than those in the artificial wetlands, urban streets, and municipal landfill. The characteristics of carbon metabolism revealed regional differences that were mainly caused by carboxylic acids. Specifically, urban streets, municipal landfills, and artificial wetlands had similar metabolic characteristics, and could be classified together. Additionally, coastal and drinking water source areas had different characteristics, and could be classified respectively. Environmental factors such as wind speed, temperature, and humidity may affect carbon utilization to a certain degree; however, the dominant factors will differ among environments. The results of canonical correspondence analysis (CCA) showed that wind speed and the carbon metabolism of the coastal area and drinking water source area were positively correlated, while they were negatively correlated with temperature and humidity. However, urban streets, municipal landfill, and artificial wetlands were positively correlated with temperature and humidity and negatively correlated with wind speed. The BIOLOG method could provide a large amount of multi-dimensional data, compare carbon metabolic characteristics of the microbial community between samplers, and reflect characteristics of the carbon metabolic diversity of airborne microbes objectively and generally, making it an ideal method for studying functional diversity of airborne microbes.
Qingdao City; city functional regions; airborne microbial community; metabolic characteristics; microbial diversity; BIOLOG method
国家自然科学基金项目(31170509)
2013- 06- 05;
日期:2014- 05- 08
10.5846/stxb201306051339
*通讯作者Corresponding author.E-mail: songzhiwen@qtech.edu.cn
吴等等,宋志文,徐爱玲,郑远,夏岩.青岛市不同功能区冬季空气微生物群落代谢与多样性特征.生态学报,2015,35(7):2277- 2284.
Wu D D, Song Z W, Xu A L, Zheng Y, Xia Y.Metabolic characteristics and community diversities of airborne microbes at different functional regions in Qingdao in winter.Acta Ecologica Sinica,2015,35(7):2277- 2284.

