美洲黑杨凋落叶分解初期对小白菜生长的影响
贺 维, 陈 刚, 陈 洪, 胡庭兴, 王 彬, 胡 义, 杜朝云
四川农业大学林学院, 雅安 625014
美洲黑杨凋落叶分解初期对小白菜生长的影响
贺 维, 陈 刚, 陈 洪, 胡庭兴*, 王 彬, 胡 义, 杜朝云
四川农业大学林学院, 雅安 625014
采用盆栽试验,研究了美洲黑杨(Populusdeltoides)凋落叶分解初期对受体植物小白菜(Brassicachinensis)生长和生理的影响。试验设置0、30、60和90 g/盆 4个凋落叶施用水平(分别记作CK、L30、L60和L90)。同时,为检验凋落叶施入是否对土壤通气透水性产生明显影响进而影响受体植物的生长,用蒸煮后的凋落叶设置平行空白试验,即30、60、90 g/盆 3个蒸著后的凋落叶处理(分别记作Z30、Z60和Z90)。将各处理的凋落叶分别与7 kg土壤混合,播种小白菜。在播种后50、80 d测定小白菜株高和生理指标。结果表明:1) 高量(L90)凋落叶下小白菜的高生长和鲜重于50 d时被显著抑制,80 d时长势恢复正常;2)80 d时各处理净光合速率(Pn)与CK水平相当,色素含量略低于CK;3)50、80 d时,低(L30)、中(L60)量处理的超氧化物歧化酶(SOD)活性无明显变化,高量处理下SOD活性升高;4)各处理丙二醛(MDA)含量在50、80 d时与CK均无显著差异。总的来看,杨树各凋落叶量处理对小白菜的影响表现为:低、中量促进,高量抑制,而经蒸煮后的凋落叶处理间差异不显著。表明,低、中量杨树凋落叶在土壤中分解对小白菜生长及生理代谢的影响主要表现为促进作用,而施入高量凋落叶的初期,化感抑制作用明显。
美洲黑杨; 凋落叶; 小白菜; 化感作用; 生长
杨树(Populusspp.)是杨柳科(Salicaceae)杨属(Populus)落叶乔木的通称,地域分布广、适应性强且生长速度快[1]。我国杨树人工林面积约700万hm2[2],占全国人工林面积的20%,是世界上其它地区杨树人工林面积的4倍[3],居世界首位[4]。由于杨树具有生长快、轮伐期短、成活率高、木材用途广、防护作用明显和经济效益高等优点,在植被恢复、生态环境治理、防护林建设、工业用材林建设等方面均有着重要的地位。一般植物只能利用太阳能的0.2%左右,而杨树却高达到3%—4%,是一般树种固碳能力的20多倍[5],因此杨树人工林不仅对温室气体减少具有非常大的贡献,而且对全球碳循环机制研究有着重要的参考价值。
面对人口增长、资源短缺和环境恶化的严峻现实,农林复合经营模式是目前改善生态环境较为广泛的应对措施之一,因而农林复合经营成为农林生产的重要发展方向[6]。与单相纯林相比,农林复合种植模式不仅可增强生物多样性,而且可有效地防止水土流失、培肥地力、促进中下层灌木及草本植物的生长,形成复杂稳定的群落结构,增强对外界不良环境的抵抗能力,并可同时获得多种效益[7]。在农林复合进行物种配置的过程中,化感作用不容忽视,因为它可能影响复合系统的生态功能和经济效益。化感作用(Allelopathy),最早由奥地利植物生理学家Molish提出,它是指一种植物(包括微生物)通过其本身产生的、并释放到周围环境中去的化学物质对自身或另一些植物(或微生物)产生直接或间接的相互排斥或促进的效应[8]。杨树是我国目前发展人工林的主要树种,利用杨树为落叶树种这一特点,在林下种植冬性作物,发展林下经济,增加林农收入具有良好的前景。因此选择适宜的间种作物尤为重要。目前,与杨树搭配的作物已有许多,如小麦(Triticumaestivum)[9]、大豆(Glycinemax)[9]、莴苣(Lactucasativa)[10]、白菜(Brassicapekinensis)[11]、辣椒(Capsicumannuum)[12]等,但现实中对作物的选择存在着很大的盲目性。有报道显示,杨树凋落叶水浸液对小麦、玉米等种子萌发及幼苗生长具有不同程度的抑制作用[9];中林- 46杨树根浸提液对大豆幼苗的生长有极显著的促进作用,浸提液质量浓度>10 g/L时对小麦、玉米的生长表现出极显著的抑制作用,高浓度的浸提液对反枝苋(Amaranthusretroflexus)、马唐(Digitariasanguinajis)、狗尾草(Setayiaviridis)有明显的抑制作用[13];南林95杨和NL- 80351杨根系浸提液对紫花苜蓿(Medicagosativa)、白三叶(Trifoliumrepens)的种子发芽率、幼苗高生长、根系生长及种子活力主要表现为抑制作用,浓度较高时影响更为明显[14];而将741杨与花生、大豆间作有较好的效果[15]。
有研究指出,植物的化感作用强弱因器官不同而异[16]。对于凋落叶量大的落叶树种,国内外大部分研究都以凋落叶作为供体材料。不过,前人通常采用浸提法来提取其中的化感物质,并利用水培受体的方法对供体的化感效果进行测试[9,14],这虽然有利于了解凋落叶中次生代谢物的化感潜力,但与自然状态下凋落叶分解过程中化感物质的释放和作用过程存在很大差异。黑杨派中的美洲黑杨(Populusdeltoides)是杨树速生丰产的主要栽培品种,是中纬度地区最适合发展短轮伐期工业原料林的用材树种之一[17],其经济价值与遗传育种价值备受重视[18]。在我国南方美洲黑杨常用于退耕坡、河滩地以及弃耕地造林,也常种植于房前屋后以及路旁,并且多与农田菜地毗邻,而小白菜作为四川南方的主要蔬菜作物,秋末冬初常种植于美洲黑杨林下或与之毗邻种植,此时大量的凋落叶则作为补充土壤养分和改良土壤通透性的有机肥被翻耕于土中。故本研究试图通过模拟美洲黑杨凋落叶在土壤中分解释放营养物质和次生代谢物的过程,分析凋落叶分解初期对小白菜(Brassicachinensis)生长和生理过程的影响,为杨树林下套种类似作物提供依据和参考。
1 材料与方法
1.1 试验地概况
试验地设在在四川农业大学科研园区的塑料大棚内,位于东经102°59′16″,北纬29°58′52″,海拨580 m。多年平均气温16.2 ℃,≥10 ℃的积温5231 ℃,月平均最高温29.9 ℃(7月),月平均最低温3.7 ℃(1月),年均日照时数1039.6 h,无霜期298 d,多年平均降雨量1774.3 mm,空气平均湿度79%,属于亚热带湿润气候。
1.2 试验材料的收集及预处理
供体材料:美洲黑杨(Populusdeltoides),采集时间为2011年10月16日,于雅安市雨城区大兴镇雅东路两侧(紧邻农田) 作为行道路的25年生杨树下收集自然凋落到地表的新鲜、干净的树叶,取回后风干,为便于与土壤混合均匀,将其剪成面积2 cm2左右的碎片。
受体植物:小白菜(Brassicachinensis),于当地种苗服务部购买。播种前,挑选饱满、大小均一的种子,用0.5% KMnO4溶液消毒30 min,再以初始温度65 ℃浸种12 h,随即在室温条件下催芽12 h。
土壤与容器:于当地农田中采集土壤,土壤基本理化性质为:pH值 7. 47,有机质18.93 g/kg,全氮0. 87 g/kg,全磷0. 93 g/kg,全钾5. 14 g/kg,速效磷20.31 mg/kg,速效钾14.05 mg/kg。使用前用多菌灵消毒,混匀,平铺晾置2 d,待用。采用规格一致的口径25 cm、底面直径16 cm、高25 cm的白色聚乙烯塑料盆作为栽植容器,装入等量的土壤(7 kg),土层表面离桶缘5 cm左右。
1.3 试验设计
1.3.1 处理水平的设计
采用单因素随机试验设计,参照万猛[19]等的研究结果,杨-农复合系统中13 年生杨树的年凋落物量为13.90 t/hm2(其中凋落物包括:枝、叶、花序、碎屑、昆虫粪便、小动物尸体等)。本实验主要以25 年生美洲黑杨的凋落叶作为研究对象,故以13.00 t/hm2美洲黑杨凋落叶作为基本处理水平,凋落叶施用量以每盆中所含凋落叶克数(g/盆)表示,即基本施用量大约为60 g/盆。并另设0.5倍(30 g)和1.5倍基本量(90 g)两个处理水平。4个凋落叶处理水平分别为:0、30、60和90 g/盆,分别记为CK、L30、L60、L90,每个处理设置4个重复。为观测施加凋落叶是否影响土壤的通气透水性进而影响受体植物生长,是否干扰化感效应的观测,本试验参照吴秀华[20]等的方法,设置去除化感物质(水溶性的和非水溶性的次生代谢物)的平行空白试验,具体操作是:将剪成2 cm2左右的美洲黑杨凋落叶置于过量蒸馏水中,常温下浸提,每隔6 h更换1次蒸馏水,48 h后将浸提的凋落叶全部过滤,再置于蒸锅中蒸煮4 h,然后取出风干(简称蒸著落叶)。处理方式与上述相同,对应地设置3个凋落叶水平:30、60、90 g/盆,分别记为Z30、Z60、Z90,每处理4个重复。
其次,为分析土壤经过多菌灵消毒后可能引起的土壤微生物群落变化,进而干扰美洲黑杨凋落叶中化感物质的降解,于3月20日进行补充实验。实验中4个凋落叶处理水平同上,其中每个水平设置两个土壤处理,即经过多菌灵消毒与未经多菌灵消毒的土壤,每处理3个重复,于40 d时测定小白菜株高和鲜重。
1.3.2 播种及管理
播种前,根据试验设计,称取不同处理量的杨树凋落叶分别与土壤混匀后装盆,浇透水。放置2 d后,于2011年12月20日将小白菜种子均匀点播于各盆中(25 粒/盆),覆盖1 cm厚的土壤,浇透水以利于发芽。每3 d用HH2土壤水分速测仪(ML2x,GBR)测定土壤湿度,控制土壤体积含水量在15%—18%左右。各处理种子全部出苗后第10天间苗,保持每盆10株,管理期间及时除草和防治病虫害。
1.3.3 取样
于播种后50、80 d取样,从各处理中随机抽取6株小白菜,分别用塑料袋装好,置于冰盒中带回实验室,测定小白菜的形态指标以及每株第2、3片新鲜功能叶片的抗性生理指标。并选择晴朗天气测定小白菜的光合生理指标。
1.4 指标测定及方法
株高:采用直尺测量,6次重复。
整株小白菜鲜重:电子天平称量,6次重复。
超氧化物歧化酶(SOD)活性:用NBT光化还原法[21],以抑制NBT光化还原的50%为1个酶活力单位U。
丙二醛(MDA):采用硫代巴比妥酸加热显色法[22]。
叶绿素(Chl a、Chl b)、类胡萝卜素(Car)含量:分光光度法[23]。
净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci):使用LI- 6400便携式远红外光合测定仪(LI-Cor Inc.,USA)在晴朗天气下测定。
1.5 数据处理
用Williamson和Richardson[24]提出的敏感指数(RI)为指标来度量杨树凋落叶对小白菜的化感效应。
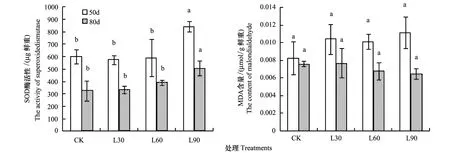
RI=1-C/T(当T≥C时) 或RI=T/C-1(当T 式中,T为处理值,C为对照值,RI>0表示促进作用,<0表示抑制作用,RI的绝对值代表化感作用强度的大小。最后某一处理的化感综合效应(CE)用该处理下株高、整株小白菜鲜重和净光合速率的RI算术平均值表示。 采用SPSS 16.0统计分析软件(SPSS Inc.,USA)对试验数据进行单因素方差分析(One-way ANOVA),用最小显著差数法(LSD法)进行多重比较。 2.1 美洲黑杨凋落叶分解对小白菜形态特征的影响 表1显示,未经多菌灵消毒和经过多菌灵消毒的土壤分别与美洲黑杨凋落叶混匀后栽种小白菜,40 d后各处理之间的株高和鲜重均无明显差异(P>0.05),表明土壤经过多菌灵消毒后并未干扰美洲黑杨凋落叶中化感物质的释放。 表1 美洲黑杨凋落叶分解40 d后对小白菜株高及生物量的影响Table 1 Effects of P.deltoides leaf litter on the height and fresh weight of B.chinensis after 40 d of decomposition 表中同列相同小写字母表示差异未达P<0.05显著水平 由图1可知,50、80 d时随凋落叶量的增加,株高呈现出先升高再降低的趋势;随着时间的延长,L30相对于CK依次增加12.93%、13.84%(P<0.05),L60依次增加14.25%、26.42%(P<0.05),L90依次降低22.96%(P<0.05)、6.59%(P>0.05)。且图1显示,各处理小白菜鲜重的变化趋势与株高一致,其中L90在50 d时受到显著抑制(P<0.05),而80 d时与CK差异甚小(P>0.05)。这表明50、80 d时低、中量凋落叶处理对小白菜株高和鲜重有明显的促进作用,而高量处理对其有明显的抑制作用,但随时间延长抑制作用减弱。 由图1可知,50 d时蒸煮后的杨树凋落叶各处理间小白菜的株高和鲜重差异均未达显著水平(P>0.05),且Z90与CK相比亦无明显差异(P>0.05)。表明加入美洲黑杨凋落叶对小白菜的生长和鲜重影响不大,说明一定用量范围的凋落叶与土壤混合后不会明显改变土壤的通气透水性和小白菜的生长发育,各处理间受体植物生长和生理的差异主要是凋落叶分解过程中释放的次生代谢物以及其他营养物质作用所致(包括抑制和促进)。这一现象在表2和表5中都可以明显观察到。 图1 美洲黑杨凋落叶不同处理量对小白菜株高及鲜重的影响Fig.1 Effects of P.deltoides leaf litter on the height and fresh weight of B.chinensis图中方柱上不同小写字母表示差异达0.05显著水平 2.2 美洲黑杨凋落叶分解对小白菜叶片光合生理特性的影响 2.2.1 光合色素含量 由表2可以看出,50、80 d时随着土壤中凋落叶含量的增加,小白菜各色素含量变化趋势一致。其中,L30与CK无显著差异(P>0.05),而L60、L90均显著低于CK(P<0.05)(Car含量在L90时才与CK差异明显)。各处理下Chl a/b值无显著变化(P>0.05)。可见50、80 d时低凋落叶量对小白菜色素含量作用不明显,而中、高量处理明显降低其色素含量。Chl a/b值变化不大进一步说明凋落叶分解对两种光合色素的影响程度相近。表3显示,经蒸煮凋落叶处理的小白菜在50 d后,各色素含量和Chl a/b值均与CK无明显差异(P>0.05)。表明加入蒸煮后的凋落叶对小白菜色素含量影响不明显。 2.2.2 净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr) 由表4可知,50 d时,Gs、Ci、Tr都随凋落叶量的增加而增加,且除L30的Ci与CK无显著差异外(P>0.05),其他处理的各指标均显著高于CK(P<0.05)。而Pn呈先上升后下降的趋势,具体表现为:L30>L60>CK>L90,其中,L30、L60均显著大于CK(P<0.05),L90与CK差异不明显(P>0.05)。80 d时各处理的Pn、Gs、Ci、Tr与CK均无明显差异(P>0.05)。施加凋落叶50 d时,低、中量处理的Pn受到明显促进,而在80 d时这种促进作用已经明显减弱。从表5可见,到50 d时,蒸煮后的凋落叶在土壤中分解并没有显著改变受体的Pn、Gs、Ci(P>0.05),Tr虽有所增加,但增幅相对于同一时段原样凋落叶处理组来说有所减小,表明经过蒸煮的美洲黑杨凋落叶施入土壤没有显著影响小白菜的光合能力。 表2 美洲黑杨凋落叶不同处理量对小白菜光合色素含量的影响Table 2 Effects of P.deltoides leaf litter on the content of photosynthetic pigments of B. chinensis 表3 50 d时蒸煮的美洲黑杨凋落叶对小白菜光合色素含量的影响Table 3 Effects of steamed P. deltoides leaf litter on the content of photosynthetic pigment of B. chinensis on 50th d 表4 美洲黑杨凋落叶不同处理量对小白菜Pn、Gs、Ci、Tr的影响Table 4 Effects of P.deltoides leaf litter on Pn、Gs、Ci and Tr of B. chinensis 表5 50 d时蒸煮的美洲黑杨凋落叶处理对小白菜Pn、Gs、Ci、Tr的影响Table 5 Effects of steamed P.deltoides leaf litter on Pn、Gs、Ci and Tr of B. chinensis on 50th d 2.3 美洲黑杨凋落叶分解对小白菜活性氧代谢的影响 由图2可知,50、80 d时,低、中量凋落叶处理对小白菜超氧化物歧化酶(SOD)活性影响不大(P>0.05),而当凋落叶含量增加到L90时,小白菜的SOD活性显著提高(P<0.05),但50、80 d时各处理小白菜的MDA含量与CK并无显著差异(P>0.05)。表明,高凋落叶施入量可能导致小白菜体内积累较多的活性氧,而通过SOD等保护酶活性将其控制在正常水平,故膜系统未受到明显的过氧化伤害。 图2 美洲黑杨凋落叶不同处理量对小白菜SOD酶活性以及MDA含量的影响Fig.2 Effects of P.deltoides leaf litter on SOD activity and MDA content of B. chinensis图中方柱上不同小写字母表示差异达0.05显著水平 表6 美洲黑杨凋落叶在土壤内分解过程中对小白菜的综合效应 Table 6 Compound effect(CE) ofP.deltoidesleaf litter onB.chinensiswhile decomposing in soil 播种后天数/dDaysaftersowing各处理综合效应CEofdifferenttreatmentsL30L60L90500.22370.2389-0.2673800.12000.1248-0.0329 2.4 美洲黑杨凋落叶分解对小白菜的化感综合效应 总体来说,50、80 d时高凋落叶量处理对小白菜生长具有综合抑制效应,低、中量处理具有综合促进效应。在同一处理时间内,L30和L60综合促进效应相当,而当凋落叶量>60 g时,综合抑制效应增强。在试验期内,随着处理时间延长,各凋落叶量处理的综合效应(促进、抑制)都相应减弱(表6)。 试验表明,美洲黑杨凋落叶在分解过程中对小白菜的生长均有明显影响(表现出低处理量促进,而中、高处理量抑制的现象),而经蒸煮后凋落叶对小白菜的株高、光合色素含量影响不明显,表明经过蒸煮后可能去除了或大部分去除了凋落叶中易离析、易分解的、对受体植物生长具有抑制或促进作用的组分[20],在被施入土壤后对土壤物理性质即通气透水性的影响不显著,所以经蒸煮后的凋落叶在土壤中分解并没有显著影响小白菜生长。 3.1 小白菜生长对美洲黑杨凋落叶化感作用的响应 相关研究表明,受体的生长受到显著抑制,可能与化感物质影响受体细胞分裂和伸长有关[25],导致细胞排列紊乱,细胞器被破坏[26]。普遍研究认为,植物叶片的化感抑制作用高于其他器官[27- 28],此外,水溶性成分很容易通过降水从叶片表面进入土壤[29]。报道显示,烟管蓟(CirsiumpendulumFisch.)叶水浸提物对紫花苜蓿(Medicagosativa)幼苗抑制作用明显,且远远高于根、茎[30];而高浓度的落叶松(Larixgmelinii)叶水浸提液对胡桃楸(Juglansmandshuric)种子萌发和幼苗生长有明显的促进作用[31]。本试验中,50 d时各处理小白菜的生长已与CK表现出明显差异,表明此时凋落叶中释放的化感物质已经对小白菜的生长造成了影响。但低、中量处理表现为促进作用,高量处理表现为抑制作用,这与使用单纯化感物质处理受体植物出现的低促高抑现象一致[32],但在本实验中出现这种现象的原因可能更为复杂。凋落叶中释放出的是混合物质,包括多种营养物质和化感物质,营养物质对小白菜的生长具有促进作用,一些化感物质则主要起抑制作用。本实验中出现这种现象可能是因为在低、中量凋落叶施用水平上促进作用大于抑制作用,在高量水平上抑制作用大于促进作用,这与Chon[33]的研究结果一致,即在化感临界值以下会促进植物生长,但高于临界值则被严重抑制。80 d时,各处理的生长状况与50 d时趋势相同,但高量的抑制作用并未达显著水平(P>0.05),这表明随着时间的推移,化感抑制作用表现为减弱的趋势。 3.2 小白菜光合生理特性对美洲黑杨凋落叶化感作用的响应 化感物质可以通过影响受体植物Gs、Ci和Tr等气孔限制因素直接影响其光合作用,Patterson[34]研究表明,肉桂酸、苯甲酸、水杨酸等10多种化感物质可以抑制大豆叶片Pn和Gs。此外,化感物质还可以通过影响光合色素等非气孔限制因素来间接影响植物光合作用,如Einhellig报道称香草酸、阿魏酸处理大豆可以降低其叶绿素含量[35];周凯等[36]对菊花(Dendranthemamorifolium)的研究也表明,化感物质能显著抑制光合色素的合成等。本研究中,50、80 d后小白菜色素含量在低凋落叶量下无明显变化,而中、高量处理却受到显著抑制,可能是化感物质妨碍了小白菜根系对水分、矿质元素[25]的吸收,导致色素合成受阻。50 d后Gs、Ci和Tr都随着凋落叶量的增加而增大,这与吴秀华对巨桉凋落叶的研究[20]结果不同,原因可能是美洲黑杨凋落叶分解释放的营养物质促进了气孔开放,增强了气体交换。Pn在低量处理下最大,随着凋落叶量的增加,Pn逐渐下降至与CK水平相当,说明化感物质通过抑制色素合成进而间接影响Pn,但由于化感作用较弱,无法掩盖营养物质的促进作用,只是在较小程度上有所削弱。而80 d后各凋落叶量处理下的Gs、Ci、Tr与CK相比均无明显差异,这再次表明凋落叶中的大部分化感物质可能已经释放,因而其化感抑制作用减弱,同时也可能受体已经在一定程度上产生了适应性。此外,虽然色素含量随凋落叶量的增加而减少,但Pn却并未明显下降,可以推测小白菜的光合作用主要是受气孔因素的直接影响。总之,美洲黑杨凋落叶对小白菜的化感抑制作用较弱,且化感物质释放较快,对受体的抑制作用时间较短。 3.3 小白菜活性氧代谢对美洲黑杨凋落叶化感作用的响应 SOD活性在活性氧清除系统中起到核心作用,细胞内90%的O2-靠SOD清除,是植物抵御自由基伤害的第一道防线[37]。而MDA是细胞膜质过氧化的最终产物。本研究中,50、80 d时在低、中凋落叶量处理中,小白菜SOD活性无明显变化;且各处理MDA含量与CK均无显著差异。有研究发现,酚酸类物质只有积累到一定程度才会诱发活性氧的过量产生,影响植物的正常生理代谢[38],因此本实验中低、中量处理并没有显著影响小白菜活性氧代谢。高凋落叶量下SOD活性被诱导升高,及时地清除过多的活性氧自由基,或者是与非酶促防御系统[39]共同起作用清除自由基,最终致使活性氧没有在其体内大量积累,因此MDA含量无明显变化,细胞膜并未受到过氧化伤害。 3.4 综合评价 综上所述,在美洲黑杨凋落叶分解初期(50 d),低、中量凋落叶处理下,由于其分解释放的营养物质起主要作用,故促进小白菜生长,而高量凋落叶处理则可能是化感物质起主导作用,抑制了小白菜生长;随时间延长(80 d),美洲黑杨凋落叶的化感综合效应(促进、抑制)减弱。这与陈洪[40]对巨桉化感的研究、黄溦溦[41]对银木化感的研究结果并不一致。从化感作用的角度看,与巨桉、银木凋落叶相比,美洲黑杨凋落叶的化感作用较弱,故在杨树-小白菜间作模式中,当杨树栽植密度不大,单位面积上的凋落叶量较小时,对小白菜生长具有明显的促进作用。鉴于此,在杨树林下合理种植类似于小白菜的冬性作物,有利于发展林下经济,为林农增收提供一条有效途径。 [1] 方升佐. 中国杨树人工林培育技术研究进展. 应用生态学报, 2008, 19(10): 2308- 2316. [2] 温志宏, 吴子诚. 四川发展杨树的策略. 四川林业科技, 1993, 14(2): 37- 40. [3] 张津林, 张志强, 查同刚, 陈吉泉, 孙阁, 刘晨峰, 崔令军, 陈军, 申李华. 沙地杨树人工林生理生态特性. 生态学报, 2006, 26(5): 1523- 1532. [4] 尹春英. 青杨组不同种对干旱胁迫的反应差异 [D]. 成都: 中国科学院研究生院 (成都生物研究所), 2005. [5] 刘文国, 张旭东, 黄玲玲, 刘玲, 张鹏. 我国杨树生理生态研究进展. 世界林业研究, 2010, 23(1): 50- 55. [6] Fang S Z, Xu X Z, Yu X, Li Z C. Poplar in wetland agroforestry: a case study of ecological benefits, site productivity, and economics. Wetlands Ecology and Management, 2005, 13(1): 93- 104. [7] 沈国舫, 翟明普. 混交林研究. 北京: 中国林业出版社, 1997: 281- 284. [8] Molish H D. Der Einfluss einer pflanze auf die andere, allelopathie. Nature, 1937, 141(3568): 493- 493. [9] 赵勇, 陈桢, 王科举, 王谦, 樊巍. 泡桐、杨树叶水浸液对作物种子萌发的化感作用. 农业工程学报, 2010, 26(增刊1): 400- 405. [10] 万开元, 陈防, 陶勇, 陈树森, 罗治建. 杨树对莴苣的化感作用. 东北林业大学学报, 2009, 37(1): 21- 22. [11] 罗诚彬, 黄鹏程, 田野, 方升佐. 杨树根系浸提液对几种农作物种子萌发及幼苗生长的影响. 南京林业大学学报: 自然科学版, 2004, 28(2): 43- 46. [12] 万开元, 陈防, 余常兵, 钟志祥. 杨树-农作物复合系统中的化感作用. 生态科学, 2005, 24(1): 57- 60. [13] 祝心如, 王大力. 苹果、杨树等林木根系浸取物对小麦生长的潜在影响. 植物生态学报, 1997, 21(3): 226- 233. [14] 罗诚彬, 方升佐, 田野. 杨树根系浸提液对3种牧草种子萌发及幼苗生长的影响. 植物资源与环境学报, 2003, 12(4): 27- 30. [15] 王德艺, 冯新满, 魏红侠, 邵吉祥, 崔秀英. 741杨他感作用的研究. 河北农业大学学报, 1999, 22(3): 47- 51. [16] 吕品. 国内植物化感作用及其在农业和环境保护中的应用研究. 安徽农学通报, 2009, 15(15): 29- 34, 54- 54. [17] 赵凤君, 沈应柏, 高荣孚, 苏晓华, 张冰玉. 叶片δ13C与长期水分利用效率的关系. 北京林业大学学报, 2006, 28(6): 41- 45. [18] 赵天锡. 美洲黑杨及其杂种在世界和我国杨树栽培中的地位与作用. 世界林业研究, 1992, (1): 74- 81. [19] 万猛, 田大伦, 樊巍. 豫东平原杨-农复合系统凋落物的数量、组成及其动态. 生态学报, 2009, 29(5): 2507- 2513. [20] 吴秀华, 胡庭兴, 杨万勤, 陈洪, 胡红玲, 涂利华, 泮永祥, 曾凡明. 巨桉凋落叶分解对菊苣生长及光合特性的影响. 应用生态学报, 2012, 23(1): 1- 8. [21] Giannopolitis C N, Roes S K. Superoxide dismutases I. Occurrence in higher plants. Plant Physiology, 1977, 59(2): 309- 314. [22] 熊庆娥. 植物生理学实验教程. 成都: 四川科学技术出版社, 2003. [23] 赵世杰, 史国安, 董新纯. 植物生理学实验指导. 北京: 中国农业科学技术出版社, 2002. [24] Williamson G B, Richardson D. Bioassays for allelopathy: measuring treatment responses with independent controls. Journal of Chemical Ecology, 1988, 14(1): 181- 187. [25] 李寿田, 周健民, 王火焰, 陈小琴. 植物化感作用研究概况. 中国生态农业学报, 2002, 10(4): 68- 70. [26] Kaur H, Inderjit, Kaushik S. Cellular evidence of allelopathic interference of benzoic acid to mustard (BrassicajunceaL.) seedling growth. Plant Physiology and Biochemistry, 2005, 43(1): 77- 81. [27] Miller D A. Allelopathy in forage crop systems. Agronomy Journal, 1996, 88(6): 854- 859. [28] Chung I M, Miller D A. Differences in autotoxicity among seven alfalfa cultivars. Agronomy Journal, 1995, 87(3): 596- 600. [29] Vivrette N, Muller C. Mechanism of invasion and dominance of coastal grassland by Mesembryanthemum crystallinum. Ecological Monographs, 1977, 47(3): 301- 318. [30] Chon S U. Allelopathic potential of common thistle (Cirsiumjaponicum) leaf extracts and residues. Korean Journal of Weed Science, 2004, 24(2): 79- 86. [31] 杨立学. 落叶松水浸液对胡桃楸种子萌发和幼苗生长的影响. 应用生态学报, 2006, 17(6): 1145- 1147. [32] 王璞, 赵秀琴. 几种化感物质对棉花种子萌发及幼苗生长的影响. 中国农业大学学报, 2001, 6(3): 26- 31. [33] Chon S U, Nelson C J. Allelopathy in compositae plants. A review. Agronomy for Sustainable Development, 2010, 30(2): 349- 358. [34] Patterson D T. Effects of allelopathic chemicals on growth and physiological responses of soybean (Glycinemax). Weed Science, 1981, 29(1): 53- 59. [35] Einhellig F A. Mechanism of action of allelochemicals in allelopathy // Inderjit, Dakshini K M M, Einhellig F A, eds. Allelopathy: Organisms, Processes, and Applications. Washington, DC: American Chemical Society, 1995, 582: 96- 116. [36] 周凯, 郭维明, 王智芳, 郝峰鸽. 菊花不同部位及根际土壤水浸液处理对光合作用的自毒作用研究. 中国生态农业学报, 2009, 17(2): 318- 322. [37] 李合生. 现代植物生理学. 北京: 高等教育出版社, 2006. [38] Xiao C L, Zheng J H, Zou L Y, Sun Y, Zhou Y H, Yu J Q. Autotoxic effects of root exudates of soybean. Allelopathy Journal, 2006, 18(1): 121- 127. [39] 李明, 王根轩. 干旱胁迫对甘草幼苗保护酶活性及脂质过氧化作用的影响. 生态学报, 2002, 22(4): 503- 507. [40] 陈洪, 胡庭兴, 杨万勤, 吴秀华, 尹丽, 李彬, 米小华, 曾凡明, 弓平. 巨桉凋落叶分解初期对老芒麦幼苗生长和抗性生理的影响. 草业学报, 2011, 20(5): 57- 65. [41] 黄溦溦, 胡庭兴, 张念念, 肖银龙, 何远洋, 李仲彬, 丁伟. 银木凋落叶腐解过程对小白菜生长和抗性生理的影响. 生态学报, 2012, 32(12): 3883- 3891. Effects of decomposing leaf litter ofPopulusdeltoideson the growth and physiology ofBrassicachinensis HE Wei, CHEN Gang, CHEN Hong, HU Tingxing*, WANG Bin, HU Yi, DU Chaoyun CollegeofForestry,SichuanAgriculturalUniversity,Ya′an625014,China A pot experiment was conducted to study the effects of secondary metabolites released by decomposingPopulusdeltoidesleaf litter on the growth and physiology ofBrassicachinensis. In the main test four leaf litter application levels was set as 0, 30, 60 and 90 g/pot (respectively denoted as CK, L30, L60 and L90). Meanwhile, in order to test whether the physical form of the leaf litter could obviously influence the soil aeration, water permeability and even the growth ofB.chinensis, the parallel blank test was performed with the steamed leaf litter, and the design of the test was set as same as the main test, namely 0, 30, 60 and 90 g/pot steamed leaf litter treatments (denoted as Z30, Z60 and Z90). Each pot contained 7 kg soil mixed withP.deltoidesleaf litter and then sowed the seeds ofB.chinensis. The height and physiological indices ofB.chinensiswere determined on 50th, 80thd after sowing. The results showed that: 1) The height and fresh weight ofB.chinensiswith high leaf litter addition (L90) ofP.deltoidesto the soil was significantly inhibited on 50thd, afterwards, the growth gradually resumed to normal on 80thd, while the height and fresh weight ofB.chinensisin the other two treatments were markedly promoted consistently during the experimental period; 2) After 50 days of sowing, the net photosynthetic rate(Pn) ofB.chinensiswas largely improved under low(L30) and medium(L60) addition of leaf litter relative to CK. As time went by, there were no obvious differences between all treatments and CK on 80thd. The variation trends of pigment contents on 50thand 80thday were substantially the same, both slightly lower than CK, yet, Chl a/b almost remained unchanged for all the time; 3) The activity of Superoxidedismutase(SOD) did not change apparently in low and medium addition of leaf litter, but increased in high addition from beginning to the end in this experiment; 4) The content of Malondialdehyde(MDA) on 50thand 80thday did not show any conspicuous differences whether there was leaf litter in soil or not, and no matter how much leaf litter was added to the soil within the amount range of litter designed in this experiment. In summary, the impacts that different amount ofP.deltoidesleaf litter militated onB.chinensisillustrated that: low and medium amount treatments ofP.deltoidesleaf litter mixed in soil stimulated the growth ofB.chinensis, on the contrary high amount inhibited the growth. Besides, the result of parallel blank test showed that there was no evident disparity in regard to the growth and physiological indexes ofB.chinensisamong the steamed leaf litter treatments. On the whole, low and medium addition ofP.deltoidesleaf litter to the soil was absolutely conducive to the growth and physiological metabolism ofB.chinensis, however, the suppression of allelopathic effect was remarkable with high addition of leaf litter in its initial decomposition stage. Populusdeltoids; leaf litter;Brassicachinensis; allelopathy; growth 国家“十二五”科技支撑计划项目(2011BAC09B05); 四川省“十二五”农作物育种攻关课题(2011NZ0098- 10) 2013- 06- 03; 日期:2014- 05- 08 10.5846/stxb201306031297 *通讯作者Corresponding author.E-mail: hutx001@yahoo.com.cn 贺维, 陈刚, 陈洪, 胡庭兴, 王彬, 胡义, 杜朝云.美洲黑杨凋落叶分解初期对小白菜生长的影响.生态学报,2015,35(7):2067- 2075. He W, Chen G, Chen H, Hu T X, Wang B, Hu Y, Du C Y.Effects of decomposing leaf litter ofPopulusdeltoideson the growth and physiology ofBrassicachinensis.Acta Ecologica Sinica,2015,35(7):2067- 2075.2 结果与分析

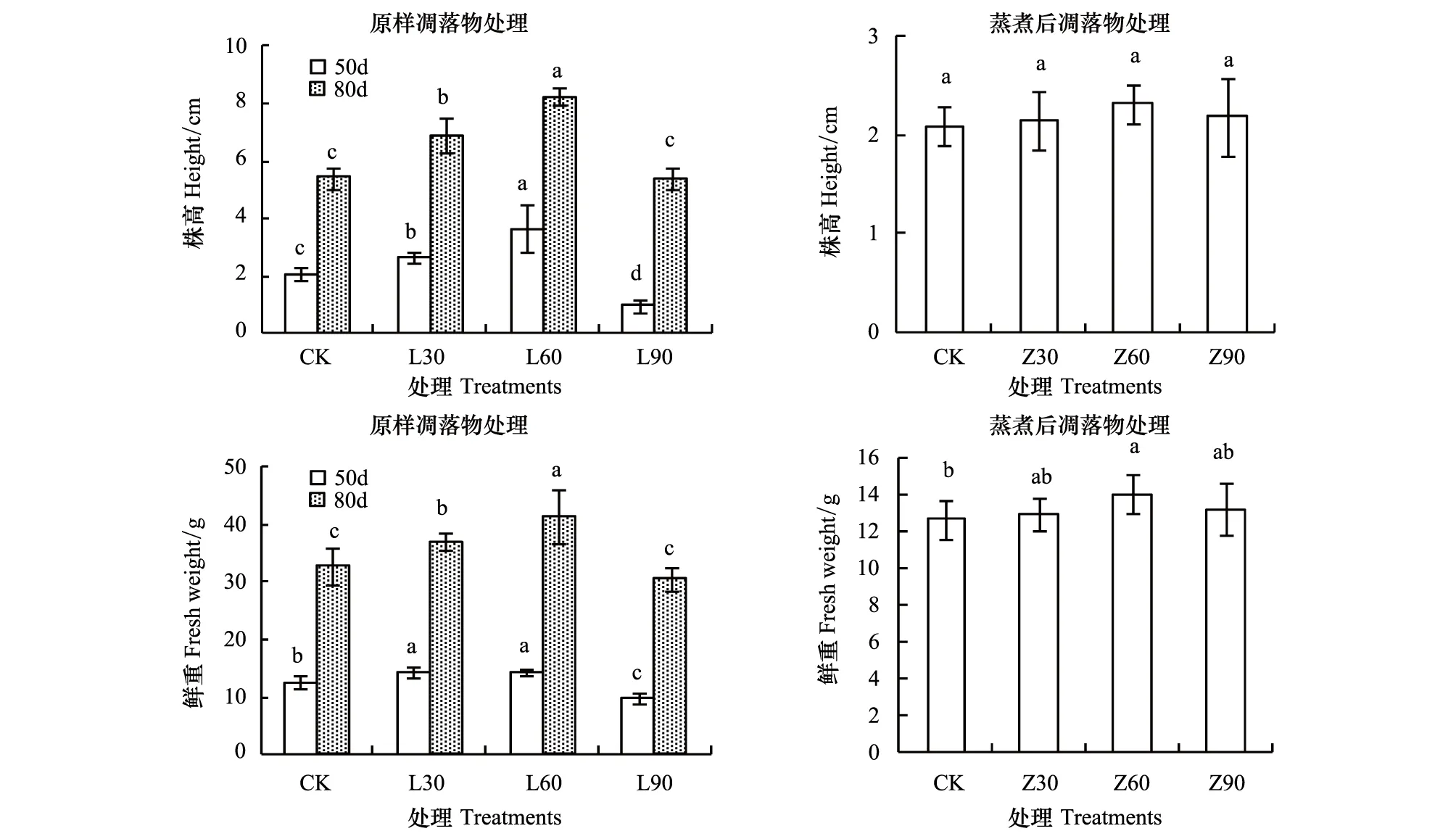
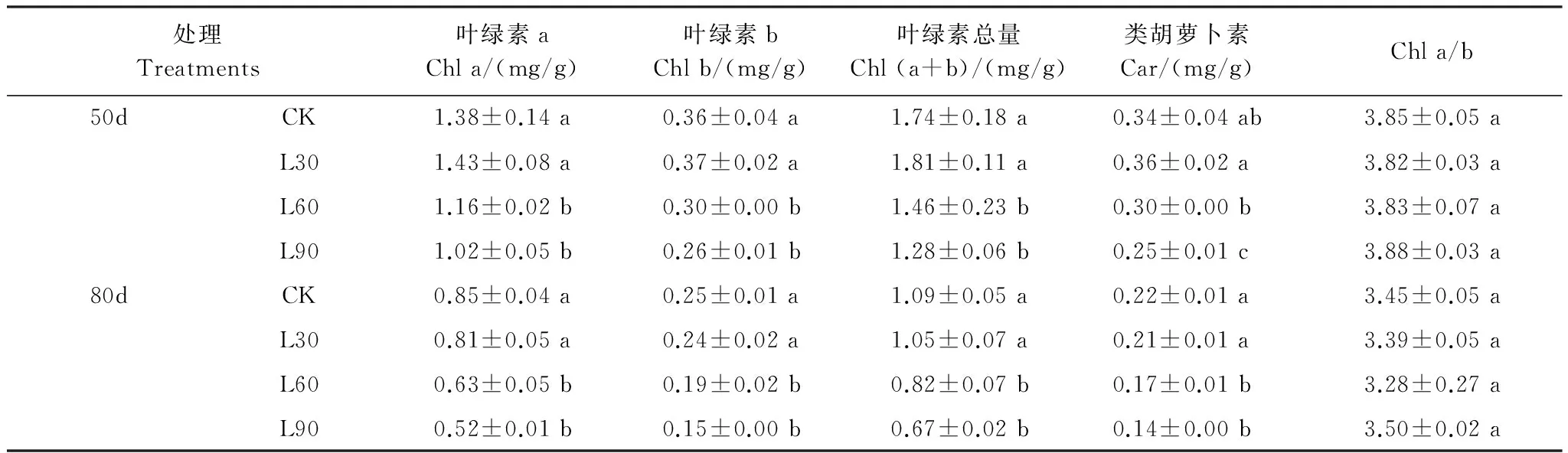
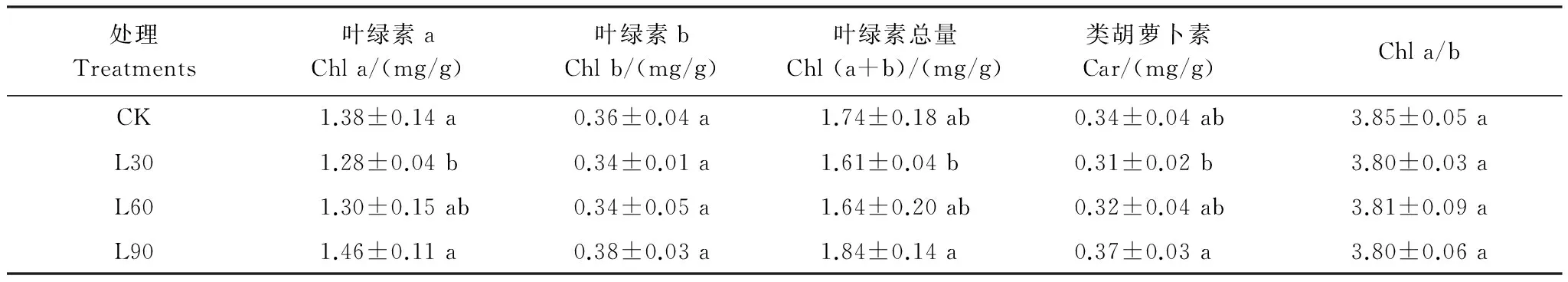
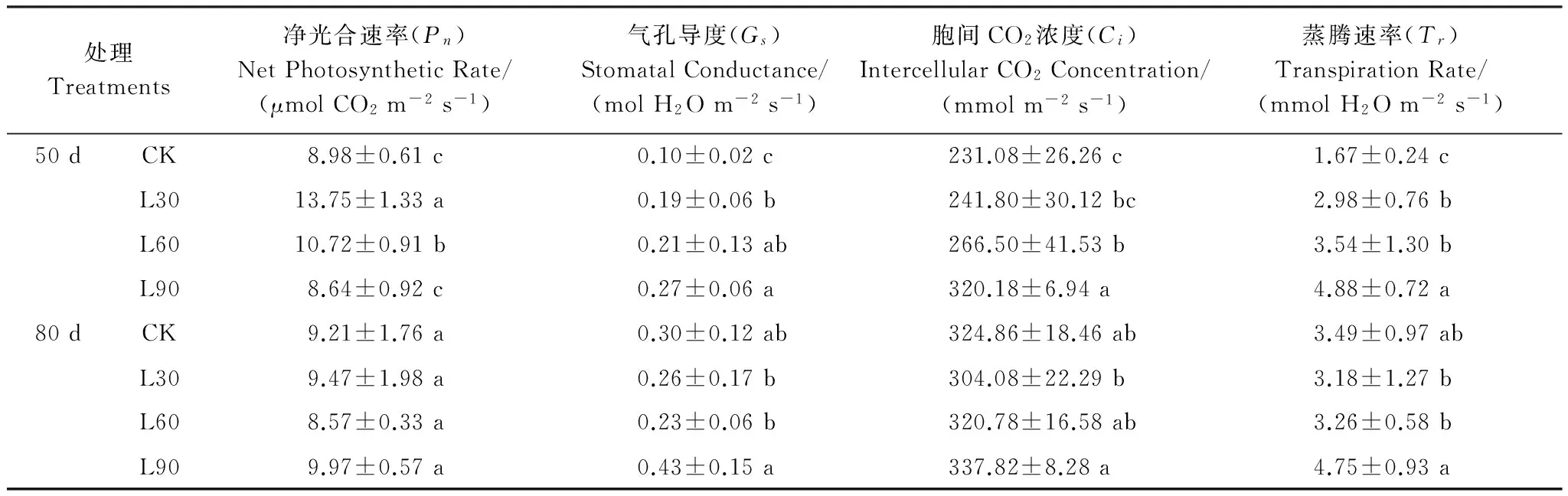


3 讨论

