卵黄抗体三种提取方法的比较研究
张莹辉,吴思捷,薛麒,梁琦,姚文生,*
(1中国兽医药品监察所,北京100081;2中国农业大学动物医学院,北京100193)
卵黄抗体三种提取方法的比较研究
张莹辉1,吴思捷1,薛麒1,梁琦2,姚文生1,*
(1中国兽医药品监察所,北京100081;2中国农业大学动物医学院,北京100193)
运用硫酸铵法、聚乙二醇(PEG)法、冷乙醇法对卵黄抗体进行提取,并使用间接竞争酶联免疫吸附试验(ELISA)方法测定所得卵黄抗体的特异性,用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)测其纯度,用Nanodrop2000测其蛋白浓度并计算提取量,比较三种方法所得抗体的特异性、纯度和提取量。结果显示,三种提取方法所得卵黄抗体特异性高低依次为硫酸铵法、冷乙醇法、PEG法;纯度高低依次为硫酸铵法、冷乙醇法、PEG法;三种方法的提取量高低依次为PEG法、硫酸铵法、冷乙醇法。经综合分析与评价,硫酸铵法的抗体特异性较好、纯度较高、提取量也较高,且其操作方法相对简便,是比较具有优势的提取方法。
卵黄抗体;提取;硫酸铵法;聚乙二醇法;冷乙醇法
卵黄抗体(Egg yolk antibodies,IgY)是指免疫后禽类卵黄中存在的抗体,是由禽类血液中的特异性抗体
(IgG、IgA、IgM等)转移至卵黄中对子代产生保护性作用的抗体[1]。IgY具有稳定、安全、高效、无毒副作用等优点[2],主要用于兽药产品、免疫检测、生化检测、人类保健品、化妆品等方面[3]。常用的卵黄抗体提取方法包括有机物沉淀法、有机溶剂沉淀法、水稀释法、超临界气体提取法、去污剂分离法等,不同提取方法各有其优缺点[4]。本研究以沃尼妙林为模式药物,筛选成本较低且操作相对简便的硫酸铵法、PEG法、冷乙醇法等三种提取卵黄抗体方法进行比较研究,综合比较其优缺点,以期为今后工业化生产提供依据。
1 材料与方法
1.1 材料
1.1.1 沃尼妙林高免鸡蛋 使用沃尼妙林-BSA抗原[5]注射免疫27周龄普通级产蛋鸡3只,每两周加强免疫1次,共免疫5次。在首免后5 d开始收集鸡蛋,并放至4 ℃环境中保存备用。
1.1.2 试剂 Marker-ProteinRuler 2(12kDa-100 kDa):购自北京全式金生物技术有限公司;沃尼妙林标准品:购自中国兽医药品监察所;HRP标记的抗鼠二抗:购自Jackson公司;沃尼妙林-OVA包被原(V-G-OVA):实验室前期合成。
1.1.3 仪器与耗材 离心机:购自湘仪离心机有限公司;电子天平:购自赛多利斯科学仪器(北京)有限公司;酶标仪:购自北京普朗新技术有限公司;Nanodrop-2000:购自美国Thermo公司;电热恒温培养箱:购自海森信实验仪器有限公司;电泳仪:购自北京市六一仪器厂;96 孔反应板:购自美国Corning Costar 公司;10、200、1000 μL微量移液枪:购自美国Thermo公司。
1.2 方法
1.2.1 卵黄液的收集用 75%酒精消毒蛋壳后打开鸡蛋,流掉蛋清,用滤纸吸去剩余蛋清,将卵黄液混匀。取10 mL蛋黄液放于离心管中。分别用下述方法提取卵黄抗体。
1.2.2 硫酸铵法提取卵黄抗体 用去离子水7倍稀释蛋黄,再用3 mL 0.1mol/L HCl调pH至5.2后,4 ℃静置6 h,12000 r/min离心30 min,过滤取上清液。各取2 mL上清液3份,加入饱和硫酸铵溶液至其终浓度分别为40%、60%、80%,4 ℃过夜后,5000 r/min离心25 min。弃去上清液,将沉淀物分别以2 mL纯水复溶,并编号为B40、B60、B80。
1.2.3 聚乙二醇法提取卵黄抗体 蛋黄中加入20 mL 0.1 mol/L的pH为7.6的Tris-HCL缓冲液,混合均匀后加入PEG至其浓度为3.5%(W/V)并充分混合。8000r/min离心25min,取上清液再加入PEG至其终浓度为12%(W/V)并充分混合。12000r/min离心10min,弃去上清液,将沉淀物用10mL0.01mol/L的PBS溶液复溶,再加入PEG至终浓度为12%(W/V),充分混合。12000r/min离心10min,弃去上清液,将沉淀物用2mLPBS溶液复溶,并编号为P。
1.2.4 冷乙醇法提取卵黄抗体 用去离子水7倍稀释蛋黄,用3mL0.1mol/LHCl调pH至5.2后,4 ℃静置6h,12000r/min离心30min,过滤取上清液。再加入95%的冷乙醇,使终浓度至60%(V/V),4 ℃搅拌30min,置于4 ℃环境下10000r/min离心30min。将沉淀物溶于10mL0.028mol/L的NaCl溶液中,室温下过滤除脂,滤液中加入95%冷乙醇,使终浓度至30%(V/V),充分混匀,并在4 ℃环境10000r/min离心30min,再将沉淀物溶解于2mL0.01mol/L的PBS溶液中,并编号为L。
1.2.5 检测提取量 用Nanodrop2000分别测定样品B40、B60、B80、P、L的蛋白浓度值,并按照下方公示计算提取量:1.2.6 检测特异性 采用间接竞争ELISA测定卵黄抗体的IC50,以判断特异性的优劣。V-G-OVA用CB稀释液1:5000稀释,每孔100μL加入酶标板,37 ℃温育2h。洗板后各孔加入150μL封闭液,37 ℃温育1h。加入沃尼妙林标准品(500ng/mL)、PBS缓冲液和待检样品各50μL,37 ℃温育30min。洗涤后加入HRP标记的抗鼠二抗,37 ℃温育30min。加入100μL/孔A+B显色液室温下避光显色15min,加入50μL/孔终止液,测OD450值。
1.2.7 检测纯度 用SDS-PAGE测三种提取方法所得卵黄抗体的纯度。样品前处理:样品测完蛋白含量后,计算所需抗体样品量、纯水量和5×SDS上样缓冲液的量。使5×SDS上样缓冲液至终浓度为1倍。上样前要将样品于沸水中煮3min使蛋白变性;电泳流程:清洗玻璃板→检测密封性→灌入分离胶→液封→凝固后排水→灌入浓缩胶→插入梳子→凝固后拔出梳子→加电泳液→上样→电泳(浓缩胶80V,分离胶120V)→考马斯亮蓝染色→脱色。根据marker找到卵黄抗体的重链,即67~70kD位置,观察目的条带外其他杂带的多少,以此来判断所得卵黄抗体的纯度。
2 结果与分析
2.1 蛋白浓度测定结果 实验测得的BSA标准曲线数据:蛋白质浓度分别为0、0.025、0.05、0.1、0.2、0.4、0.5 mg/mL 时,其对应的OD450nm分别为0.581、0.655、0.712、0.807、0.931、1.075、1.195、1.269由此得到的标准曲线如图1所示。
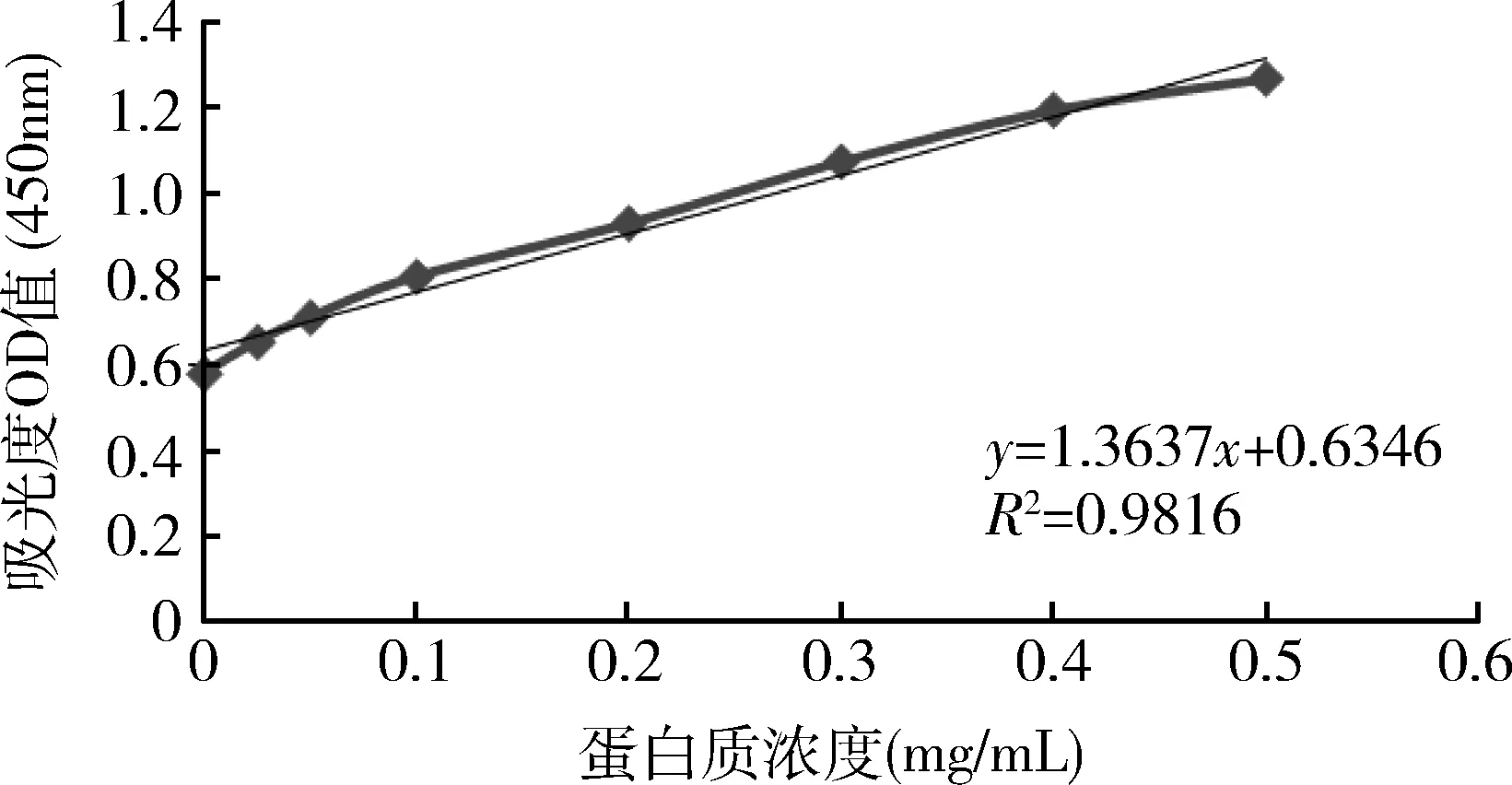
图1 测定蛋白质浓度的标准曲线图
该标准曲线经过线性拟合,得到一次曲线方程为y=1.3637x+0.6346,R2=0.9816,证明测得的标准曲线线性良好,可以作为测定蛋白浓度的参考标准。根据此拟合方程,得到待测样品浓度,根据样品体积可计算出每10mL卵黄原液所提取的卵黄抗体量如表1所示。

表1 各种提取方法所得的IgY的浓度及提取量
由表1所示,每10 mL卵黄中卵黄抗体提取量最高的是聚乙二醇法,其次为80%硫酸铵法、60%硫酸铵法、40%硫酸铵法、冷乙醇法。
2.2 卵黄抗体特异性(IC50)测定结果 结果如表2所示。

表2 各种提取方法所得的IgY特异性
由表2所示,60%硫酸铵法提取的卵黄抗体特异性最好,其次为40%硫酸铵法、80%硫酸铵法、冷乙醇法、聚乙二醇法。
2.3 凝胶电泳结果 结果如图2所示。
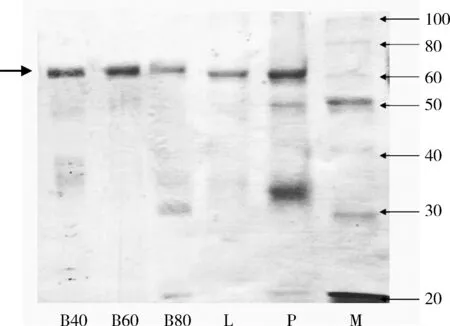
B40、B60、B80、P、L为样品号;M为Marker箭头所指为IgY重链条带(67~70 kD)图2 各种提取方法所得的IgY的SDS-PAGE图谱
由图2所示,60%硫酸铵法和冷乙醇法的电泳图中在相对分子量67~70 kD处可见一条明显且单一的蛋白条带,且在其他相对分子量处几乎没有杂蛋白,说明其提取的IgY纯度高,而其他方法的电泳图中存在较为明显的多个条带,说明其提取物含杂质多、纯度低。
2.4 三种方法操作过程比较 结果如表3所示。
从操作上来说,PEG法和80%硫酸铵法试剂消耗量均较大,同时PEG法和冷乙醇法要比硫酸铵法多离心1次。另外为防止蛋白变性,冷乙醇法需要在低温下操作,相对比较繁琐。
由以上结果可知,60%硫酸铵法所提取的卵黄抗体纯度好、特异性高,且相对提取量也较好,应是沃尼妙林卵黄抗体较为理想的提取方法。

表3 各种提取方法操作比较
3 讨论与小结
卵黄液的主要成分包括50%水、30%脂肪和20%蛋白质,大多数蛋白质与脂肪结合以脂蛋白形式存在,脂蛋白难溶于水,溶于水的蛋白质包括α蛋白、β蛋白和γ蛋白,其中卵黄免疫球蛋白是属于γ蛋白,因此除去卵黄中的非水溶性成分是提取卵黄抗体的重点[6]。硫酸铵法可以有效去除卵黄抗体中的杂蛋白,具有生产成本低、环境污染小、抗体回收率高且纯度好等优点,如结合超滤等进一步脱盐处理,应比较适合工业化生产。冷春玲[7]使用超滤膜包对硫酸铵法所得大肠杆菌K88卵黄抗体进行超滤制得冷冻干燥制品,其抗体保持了完整的抗体结构和良好的活性。聚乙二醇进行卵黄抗体沉淀,所用试剂少,操作条件温和、沉淀效率高(沉淀时间比硫酸铵法和乙醇法都短,不影响离心处理)、不易引起蛋白质失活。郑立勇[8]在研究大肠杆菌卵黄抗体提取方法时比较得出了聚乙二醇法提取到的卵黄抗体的产量高于氯仿法和辛酸萃取法,但其所得抗体含杂蛋白较多,在对抗体纯度不作高要求的情况下,如制作饲料添加剂及其他口服制品时可以适当选择此方法,但聚乙二醇溶于水后尚无可靠去除方法,其残留可能对畜禽产生危害[9],需要引起注意。冷乙醇法所提取的抗体纯度较高,优点是其沉淀不需脱盐处理,缺点是操作时蛋白质易变性,需在低温下进行,且存在有机溶剂残留问题和多步离心操作较繁琐的问题,限制了其工业化应用。本文从提取量、纯度、特异性及操作和应用等方面展现了三种不同提取方法的优缺点,希望在日后深入研究和比较更多提取方法的基础上综合利用各种提取方法的优势,克服单一方法的缺陷,建立较全面的抗体提取方法,同时引入如超滤、抽提、色谱、质谱等纯化方法,以期探索出更加安全高效的提取工艺,同时应加快制定卵黄抗体的质量标准,以便于加快卵黄抗体的产业化进程,使其在疾病的诊断、防治方面发挥更大的作用。
[1] De MeulengerB,Huyghebaert A. Isolation and purification of chicken egg yolk immunoglobulins[J].Food and Agrcultural immunology,2001,13(4):275-288.
[2] 史同瑞,黄宇翔,苏永福.卵黄免疫球蛋白的性质与特点[J].动物医学进展,2010,31(2):114-117.
[3] 燕海峰,邓缘,朱立军,等.家禽卵黄抗体作用机理及应用现状分析[J].畜禽业,2006,(18):28-31.
[4] 李宇琴.鸭肝炎病毒分离株的鉴定及其卵黄抗体的制备[D].扬州:扬州大学,2010.
[5] 李伟岭,岳永波,李金明,等.沃尼妙林人工抗原的合成与鉴定[J].中国兽医杂志,2012,48(2):78~80.
[6] 那红,杨翟中,袁勤生,等.鸡卵黄免疫球蛋白的研究进展[J]中国生化杂志,1997,18(3):151-155.
[7] 冷春玲.盐析法提取卵黄免疫球蛋白的研究[J].食品与生物技术学报,2007,26(2):30-33.
[8] 郑立勇,乔彦良,马凤龙,等.卵黄抗体不同提取方法的比较[J].黑龙江畜牧兽医,2009,(1):106-107.
[9] 张金.聚乙二醇高效水解菌的分离、鉴定及其工程化应用[D].南京:南京农业大学,2012.
(编 辑:侯向辉)
Comparison of Extracting Egg Yolk Antibody by Three Different Methods
ZHANG Ying-hui1,WU Si-jie1,XUE Qi1,LIANG Qi2,YAO Wen-sheng1,*
(1.ChinaInstituteofVeterinaryDrugsControl,Beijing100081,China;2.CollegeofVeterinaryMedicineatCAU,Beijing100193,China)
In our research, egg yolk antibody was extracted by ammonium sulfate method, polyethylene glycol method (PEG) method and cold ethanol method, and its specificity, purity, and the extract quantity were determined by indirect competitive enzyme-linked immunosorbent assay(ELISA) method, sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE) method and Nanodrop2000, respectively. The result showed that the specificity and purity of egg yolk extracted by ammonium sulfatemethod was better than that of cold ethanol method which seemed better than PEG method; however, the extracting ratio of egg yolk antibody extracted by three methods from high to low was that PEG method, ammonium sulfate method and cold ethanolmethod. In summary, antibody extracted by the ammonium sulfate method presented good specificity, high purity and ideal extracting ratio with the relatively simple operation, so ithad more advantages than other two methods.
egg yolk antibody; extraction;ammonium sulfatemethod; PEG method; cold ethanol method
张莹辉,研究实习员,从事动物实验管理工作;吴思捷,助理研究员,从事动物实验管理工作。
姚文生。E-mail:yaowensheng@ivdc.org.cn
2015-06-12
A
1002-1280 (2015) 08-0051-04
S852.43

