山羊绒DNA的提取及验证
王玫+任亮+孔平+颜怀玉+肇慧君+杨春光

摘要
提取DNA是利用PCR技术检测纤维的关键技术难点。本文对山羊绒DNA的提取方法进行了试验,并通过PCR扩增的方法进行验证。结果表明:使用TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver.5.0 试剂盒,将纤维样品尽量处理成粉末状,并在样品经裂解液处理后先离心除去其中尚未完全溶解的纤维,然后进行PCR扩增是比较有利的,完全能够得到满足PCR扩增要求的DNA样品。
关键词:山羊绒;DNA;提取方法;验证
山羊绒是一种珍贵的动物纤维,山羊绒的价格比绵羊毛、马海毛的价格高出很多倍,一些商家为了牟取利益,将细支绵羊毛、马海毛等混纺产品冠以“纯羊绒”的桂冠,使消费者上当[1]。目前羊绒羊毛纤维普遍采用的鉴别方法是投影仪法、扫描电镜法,其原理为通过纤维的外观形态、微观结构辨别纤维种类,由于主观因素大,准确率不高[2]。利用PCR技术鉴别动物纤维是近年来的研究热点,而DNA的提取是利用PCR技术检测纤维的关键技术难点。
毛发中的DNA主要集中在毛囊细胞中,毛干部分仅含有少量线粒体DNA[3]。在从动物体上采集或脱落的毛发中,绝大多数都带有完整的毛囊[4]。王庆林等研究表明从被毛毛囊细胞中提取DNA的最大缺点是获得的DNA量非常少,如操作不慎,就有可能提取不到DNA[5]。毛干相对于毛囊,其DNA含量更少,几乎所有成分都是角蛋白,但作为动物组织,毛干具有细胞结构,如果提取方法得当仍可以获得一定量的DNA[6]。吴云良通过对细胞的煮沸和冷却,使细胞破裂、蛋白质变性,从而获得用于PCR扩增的模板DNA的法为提取东北虎毛发中DNA[7]。徐怀亮等提出一种快捷、简便、经济、高效、安全、有效的提取藏酋猴毛干中DNA的方法——纳米磁珠法,并指出进行毛发取样时以5~10根较为合适[8]。目前,国内从动物毛皮中提取DNA的方法,主要采用经典的DNA提取技术:蛋白酶K法裂解结合酚-氯仿抽提[9];研究对象主要是一些珍稀动物如小熊猫[10]、鬣羚[11]、麝科动物[12]、扬子鳄[13]等的陈旧毛皮标本。虽然有关毛干DNA提取的报道已屡见不鲜,但由于毛干DNA含量低、髓质层与皮质层中含大量色素不易与DNA分离而抑制PCR扩增等问题[14-15],常造成DNA提取、纯化困难,导致分子生物学相关研究受到限制,影响下游工作。关于山羊绒DNA提取方面的报道较少,本文对山羊绒DNA提取方法进行了试验与研究,采用PCR扩增的手段对方法的可靠性进行验证。
1 试验材料与仪器
1.1 试剂
试验用水应符合GB/T 6682中一级水的规格,组织和毛发提取试剂盒TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver.5.0(TaKaRa Code.9765),Premix Ex Taq? (Probe qPCR) (TaKaRa Code. RR390A),100%乙醇,DNA Laddar Marker。
1.2 仪器与设备
冰箱:4℃~20℃,天平:感量0.0001g,分析研磨机,剪刀,恒温水浴锅,离心机(12000 rpm),涡旋混合器,微量可调移液器:0.1μL~2.5μL,1μL~10μL,2μL~20μL,10μL~100μL,20μL~200μL,100μL~1000μL,1.5mL离心管,超净工作台,PCR仪,实时荧光定量PCR仪,电泳装置,凝胶成像仪。
2 试验方法与步骤
2.1 取样
从山羊绒制品的不用部位取样,共取约1 g试样。
2.2 制样
用剪刀将样品剪碎,经分析研磨机打散混匀,再用剪刀尽量剪碎至2 mm以下,再次用分析研磨机混匀。
2.3 DNA的提取
从混匀的样品中称取约5 mg试样,放入2 mL离心管中,每个样平行提取两管,提取步骤严格按照试剂盒说明书进行操作,此处不赘述。提取过程注意如残存纤维状组织无法完全裂解,裂解之后先12000 rpm离心2分钟,去除杂质之后再进行后续操作。提取试剂盒由宝生物工程(大连)有限公司提供,试剂盒型号TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver.5.0。
2.4 引物探针信息
本文所用的引物和探针均由TakaRa宝生物工程(大连)有限公司合成,具体见表1。
表1 山羊绒成分荧光定量PCR引物及探针
3 结果与分析
3.1 DNA提取效果
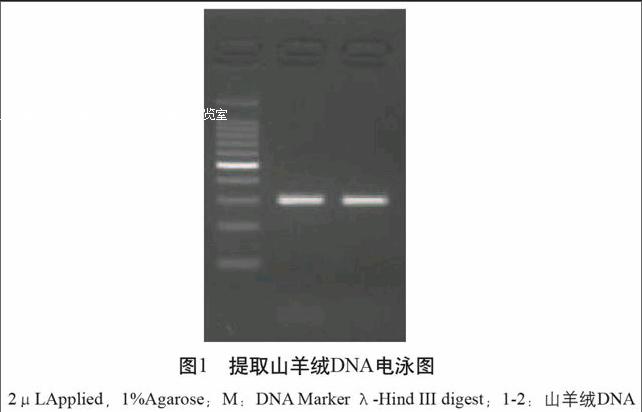
DNA提取结束后对其进行DNA电泳以确保其DNA的提出,具体结果见图1。 由图1可见,提取的DNA扩增条带清晰,提取效果良好。
图1 提取山羊绒DNA电泳图
2μLApplied,1%Agarose;M:DNA Marker λ-Hind III digest;1-2:山羊绒DNA
3.2 引物特异性验证
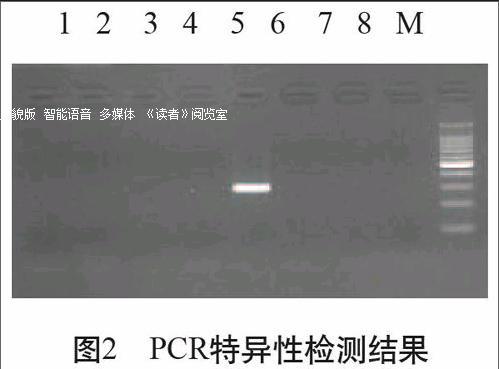
在优化好的PCR反应条件和反应体系下,以鸭绒、鹅绒、绵羊毛、兔毛、山羊绒、牦牛绒、羊驼毛的DNA为特异性试验对照进行PCR检测。电泳结果显示,仅有山羊绒被扩增出条带,而阴性对照未扩增出条带,证明山羊绒引物的特异性良好,将其应用于PCR方法,山羊绒成分可以从其他纤维中有效地鉴别出来,具体结果见图2。图2所显示的扩增片段大小约是300bp,大小符合所设计的引物片段大小303bp,且阴性对照和其他非山羊绒模板对照均未出现特异性条带。
1 2 3 4 5 6 7 8 M
图2 PCR特异性检测结果
5μL Applied, 3% Agarose,M:100bp DNA Laddar Marker;1:鸭绒PCR产物;2:鹅绒PCR产物;3:绵羊毛PCR产物;4:兔毛PCR产物;5:山羊绒 PCR产物;6:牦牛绒PCR产物;7:羊驼毛PCR产物;8:阴性对照(Negative Control)。
3.3 检测体系及结果
3.3.1 反应体系及反应条件
(1) PCR反应体系
以提取的山羊绒DNA为模板,每次反应均设阴性对照和阳性对照。实时荧光PCR反应体系25 μL,具体见表2。
表2 荧光定量PCR反应体系
注: Negative control反应时,加入RNase free dH2O;Positive反应时,做两个平行样。
(2)反应条件
本试验建立的荧光定量PCR初步反应参数包括预变性、变性、退火延伸三步。实时荧光定量PCR初步反应参数见表3。
表3 荧光定量反应条件参数
ABI 7500 Fast Real Time System荧光定量PCR仪完全封闭操作,仪器可以直接读数,荧光定量PCR荧信号在每一循环延伸步骤完成后收集,并立即显示出结果,可实时观察每一循环收集荧光信号的强度。
3.3.2 检测结果
(1) Ct值及结果判定
在优化好的荧光PCR反应条件和反应体系下,选择鸭绒、鹅绒、绵羊毛、兔毛、山羊绒、牦牛绒、羊驼毛的DNA为特异性试验的对照来进行荧光PCR检测。检测结果显示,仅山羊绒Ct值为26.125,而其他样品及阴性对照无Ct值,Ct值及结果判定见表4。
(2) 荧光PCR检测特异性试验结果
在优化好的荧光PCR反应条件和反应体系下,选择鸭绒、鹅绒、绵羊毛、兔毛、山羊绒、牦牛绒、羊驼毛的DNA为特异性试验的对照来进行荧光PCR检测。检测结果显示,仅山羊绒有扩增曲线,而其他对照以及空白对照均没有扩增曲线,表明本试验设计的特异性引物和探针与山羊基因具有较高同源性,而与其他常见动物物种的基因并没有同源性,该检测方法具较强的特异性。具体结果见图3。
图3 山羊绒DNA荧光PCR结果
4 结论
本文使用TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver.5.0 试剂盒提取山羊绒DNA,经检测验证,DNA扩增曲线良好,电泳条带清晰,空白对照是阴性结果,引物对在其他几种动物纤维体系内,包含鸭绒、鹅绒、绵羊毛、兔毛、牦牛绒和羊驼毛,没有扩增。引物探针反应性能和特异性良好,该试剂盒提取山羊绒纤维DNA可以用于山羊绒检测。试验时将纤维样品尽量处理成粉末状,并在样品经裂解液处理后先离心除去其中尚未完全溶解的纤维,然后进行PCR扩增是比较有利的,完全能够得到满足PCR扩增要求的DNA样品。
参考文献:
[1] 林志武.用生物芯片法快速鉴别羊绒羊毛的展望[J].毛纺科技,2000,(4):28-29.
[2] 金关菊,阮勇,李翔,等.基于基因技术的羊绒与羊毛纤维定性鉴别方法[J].纺织学报,2012,33(8):19-22.
[3] 黄娅琳.一种简便的DNA提取方法在动物毛发检验中的应用[J].中国司法鉴定,2008,(2):25-27.
[4] 赵春江,李宁.一种从毛发中提取DNA的简易方法[J].遗传2003,25(1):69-70.
[5] 王庆林,梁子安,郑应志,等.从南阳黄牛被毛毛囊中提取DNA方法初探[J].河南农业科学,2005,(7):95-96.
[6] 苏一,边连全,宣之兴.猪毛干部位基因组DNA的三种提取方法比较[J].湖北农业科学,2010,49(10):2337-2340.
[7] 吴云良,陈晶,陈清,等.提取东北虎毛发DNA两种方法的比较研究[J].中国畜牧兽医,2007,34(9):33-35.
[8] 徐怀亮,汪宴廷,姚永芳.藏酋猴毛干DNA的3种提取方法[J].东北林业大学学报,2010,38(2):58-61.
[9] 蔡大伟,于慧鑫,赵欣,等.一种简便高效的古代动物毛皮DNA提取方法[J].吉林大学学报(理学版),2010,48(4):689-693.
[10] 饶刚,李明,牛屹东,等.陈旧皮张中DNA提取的新方法[J].动物学杂志,2001,36(4):53-57.
[11] 崔雨新,王小明.鬣羚干皮标本中的DNA提取和PCR扩增[J].四川动物,2000,19(1):16-18.
[12] 李明,王小明,黄步军,等.麝科动物干皮标本中的DNA扩增[J].华东师范大学学报:自然科学版,1998,(1):110-111.
[13] 史燕,吴孝兵,晏鹏,等.扬子鳄鞣制皮革和鳞片的DNA提取方法[J].动物学报,2004,50(2):297-301.
[14] UCHIHI R,TAMAKI K,KOJlMA T,eta1.Deoxyribonucleic-acid(DNA) typing of human-leukocyte antigen(hla)-dqal from singte hairs in japanese[J].Journal of Forensic Sciences,1992,37(3):853-859.
[15] NOZAWA H,YAMAMOTO T,UCHIHI R,eta1.Purification of nuclear DNA from single hair shafts for DNA analysis in forensic sciences[J].Legal Medicine(T-okyo,Japan),1999,1(2):61-67.
(作者单位:辽宁出入境检验检疫局)

