三种奶牛常见病菌多重PCR 诊断方法的建立
高瑞娜,张 婷
(1.朔州职业技术学院生物工程系,山西 朔州036000;2.新乡医学院三全学院生命科学技术学院)
近年来我省牛人畜共患病呈回升趋势,布病老疫区死灰复燃,新疫区不断出现,疽、牛结核病和布病还危害其它动物,一旦出现只能扑杀,这不但给我省北部地区牛羊养殖业带来了巨大的损害,还可以通过各种途径传染给人,人们饮用未经消毒的病牛奶就可被传染结核病和布病并引起流行。所以这几种人兽共患病的存在严重威胁着人类的健康,而人畜的交叉传播则造成了它们的广泛流行。因此,对引起这些感染的细菌正确快速的鉴别极为重要。
传统的分离培养及血清学检测方法费时繁琐,导致检测不及时,灵敏度不够。近年来,检测方法在不断的进步,特别是基于聚合酶链反应(polymerase chain reaction,PCR)的分子诊断法具有快速、灵敏、特异等显著特点,已成为人畜微生物检测的新标准。1988 年Chamberlain 首次报道了一种衍生的PCR 方法多重PCR(multiplex-PCR),即不同病原体的特异基因引物加入同一个反应体系中,在一个反应中同时检测多个病原体靶基因,给临床疾病诊断和治疗提供极大帮助。本研究立志于建立利用多重PCR 方法建立一种同时快速检测牛布鲁氏菌、牛分枝杆菌、炭疽杆菌的方法,可以通过一种检测一次性检测出三种最常见的危害较大的人兽共患病,能够大量节省人力物力,同时具有很大的实用价值和公共卫生意义。
1 材料与方法
1.1 材料
1.1.1 样本的收集 收集我市古城乳业奶牛厂患病奶牛的奶液,共30份。
1.1.2 标准品 含有目的基因的pMD18T 重组质粒作为标准品,重组质粒由上海生工(北京)公司提供。
1.1.3 阳性对照 采用104拷贝/μL 标准品作为阳性对照。
1.1.4 阴性对照 采用核酸提取试剂盒中的洗脱液作为阴性对照。
1.1.5 内部控制 针对牛的Rnase P 基因设计引物作为PCR 反应的内控品。
1.2 方法
1.2.1 标本中总核酸的抽提 奶液100μL,采用Magna pure LC robot(Roche Molecular Systems,Mannheim,Germany)试剂盒抽提核酸。操作按照说明书进行。
1.2.2 引物 针对细菌靶基因保守区设计引物作为特异性引物,再对特异性引物的两端分别加上通用引物Tag。各种细菌的引物(引物由上海生物工程公司合成)见表1。
1.2.3 多重荧光定量PCR 采用PCR master mix(Roche)试剂盒进行荧光定量PCR,操作按照说明书进行。在Roche480PCR 仪运行PCR 程序,程序如下:50 ℃,2 min;95 ℃5 min;10 个 循 环(95℃,15s,60 ℃15s,72 ℃15s);40个循环(95 ℃15s,74 ℃30s);之后收集荧光。每份样本进行2组反应(表2),重复3次。
1.2.4 数据分析 程序运行完毕,仪器自动给出Ct值,再进行溶解曲线分析。
若内控品Ct值<35 且溶解曲线呈单峰,则说明样品质量良好;若内控品Ct值>35,则需要重新提取样本。
若阴控品Ct值>35 且溶解曲线无特异性峰,说明实验无污染;若阴控品Ct值<35,说明实验有污染,需重配制反应体系。
若每组阳控品Ct值都<35 且出现三个预期Tm 的单峰,则说明反应体系和程序运行良好;若阳控品没有达到预期的峰,则需要检查反应体系和程序编辑是否有误。
每个组与其相对应的阳控品比较,出现对应的峰则说明感染相应细菌,没有对应的峰说明没有该对应细菌感染或是感染量非常少达不到检测下线。

表1 3种病菌靶基因引物

表2 PCR 反应体系
2 结果与分析
2.1 引物验证
阳性标本均显示相应特异性产物大小片段,阴性对照无显著条带。

图1 引物PCR 结果验证图
2.2 多重荧光定量PCR 检测体系建立
该检测体系应用磁珠法提取核酸和多重荧光定量PCR 技术,有效检测线性范围为1×101~1×106拷贝/μL,最低检测限为10 拷贝/μL,阴性对照没有扩增,说明该方法敏感性和特异性均较高,符合临床检测要求。
2.3 多重检测体系单模板灵敏度及特异性试验结果
多重检测体系中,每组反应只加单一模板,按浓度梯度(101~106拷贝/μL)依次加入,每个反应只出现一个特异性溶解曲线,相对应的Tm 值分别为83.29、86.04、88.93,无交叉反应;内控特异性Tm值为91.12。
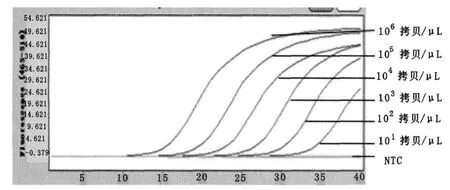
图2 多重实时荧光定量PCR 检测体系灵敏度检测结果

图3 多重体系中单模板检测结果
2.4 多模板灵敏度及特异性试验结果
将3种标准品等拷贝混合,并梯度稀释至101~106拷贝/μL,其余反应成分和反应程序不变,3次重复。根据荧光定量信号值大小,进行引物浓度微调整,优化检测体系。
优化后的体系检测结果如图4,灵敏度为102拷贝/μL,特异性良好,与其他细菌无交叉反应。
2.5 临床标本检测验证体系试验结果
该检测体系对临床样本(其中炭疽杆菌、牛布鲁氏菌或者牛分枝杆菌感染非免疫牛27份)30份奶样,分别进行细菌分离和PCR 检测,检测结果如表3,准确度为100%,阳性检出率为88.89%,符合临床检测要求。

图4 多重体系中多模板检测结果

表3 临床标本检测结果
3 讨论
最早检测布氏杆菌的基础PCR 是针对布氏杆菌上高度保守的单个基因(如BCSP31 和6SrRNA基因)而设计的,主要是用于鉴定布氏杆菌种的类型。刘思国等根据已发表的牛分枝杆菌的pncA 的基因序列,设计和合成了一对可扩增294bp目的片段的引物,建立了特异性检测牛分枝杆菌的PCR 方法。肖履中等以多个炭疽杆菌菌种为试验苗对毒力基因tox和cap基因进行了PCR 检测的研究。这些研究证明PCR 检测方法对病菌检测的特异性。
多重荧光定量PCR 因其价廉、快速灵敏等特点而在临床病原体检测方面具有巨大的潜在应用价值,国内外也对此方面已开展了大量研究。Weltia等比较了单个荧光定量PCR 和多重荧光定量PCR检测肺炎衣原体、肺炎支原体和嗜肺军团菌3种病原体的效果,发现两种方法灵敏度相当,但后者明显具有简便经济的优势。陈玉霞等对奶牛常见乳房炎病菌进行特异快速的PCR 检测方法,实现了奶牛乳房炎准确、快速的诊断。Angela M 等介绍了多重荧光定量PCR 技术在临床病原体检测中的应用,其中包括Idaho公司的FilmArray技术,Qiagen公司的RespPlex 技术,韩健等自动化分子检测平台。但是,鉴于先进的技术都需要昂贵的仪器或试剂,本研究在前人的基础上优化了检测体系,能在2h之内同时分别检测出Bac、My、Br三种病菌,克服了传统的PCR 检测时间长;通用引物降低了多重PCR 偏向性扩增、特异性差等问题;荧光信号判读结果容易,降低了检测成本。同时,该检测体系可以扩展,根据需要优化3种病原体为一组,在96孔板上检测种类可多可少,最多可同时检测几十种。
但是该检测体系也存在一些缺陷,由于病原体变异较快,加之有些病原体保守区非常短,扩增产物只有100-200bp,发生一两个碱基的突变都会导致特异性Tm 值变化,影响结果判读;需不断优化体系。
[1] 刘延玲.奶牛几种常见病的防治[J].山西农业,2007(5):31.
[2] 王光明,白常乐.传染病诊断新技术-聚合酶链反应在体外扩增病原微生物DNA [J].地方病译丛,1991(3):1-4.
[3] Chamberlain JS,Gibbs RA,Ranier JE,et al.Deletion screening of the Duchenne muscular dystrophy locus via multiplex DNA amplification [J].Nucleic Acids Research,1988,16(23):11141-11156.
[4] 李彦伟,高明春,张文龙,等.牛布鲁菌奶液PCR 检测方法的建立及初步应用[J].中国兽医杂志,2011,47(4):25-27.
[5] 刘思国,王春来,宫强,等.牛分枝杆菌特异性PCR 检测方法的建立及初步应用[J].中国预防兽医学报,2006,28(1):80-83.
[6] 肖履中,赵青.PCR 检测炭疽杆菌的研究[J].中国动物检疫,2004,21(10):25-27.
[7] Weltia M,Jatona K,Altweggb M,et al.Development of a multiplex real time quantitative PCR assay to detect Chlamy dia pneu moniae,Legionella pneumophila and Mycoplasma pneumoniae in respiratory tract secretions[J].Diagn Microbiol and Infect Dis,2003,45:85-95.
[8] 陈玉霞,林峰.3 种奶牛乳房炎主要病原菌PCR 检测方法 的 建 立[J].中 国 农 学 通 报,2012,28(17):105-108.
[9] Angela M.Caliendo.Multiplex PCR and Emerging Technologies for the Detection of Respiratory Pathogens[J].Clinical Infectious Diseases,2011,52(S4):S326-S330.
[10] Loeffelholz MJ,Pong DL,Pyles RB,et al.Comparison of the FilmArray Respiratory Panel and Prodesse real-time PCR assays for detection of respiratory pathogens[J].Journal of clinical microbiology,2011,49(12):4083-4088.
[11] Xie Z,Pang YS,Liu J,et al.A multiplex RT-PCR for detection of type A influenza virus and differentiation of avian H5,H7,and H9hemagglutinin subtypes[J].Molecular Cellular Probes,2006,20(3-4):245-249.

