三种肉桂酰胺衍生物的制备及其与人血清白蛋白的结合
杜传荣,逯东伟,石 康,陈丹丹,林翠梧,3*
(1.广西大学化学化工学院,广西南宁 530004; 2.广西桂林电子科技大学信息与通信学院,广西桂林 541000; 3.广西高校应用化学技术与资源开发重点实验室,广西南宁 530004)
三种肉桂酰胺衍生物的制备及其与人血清白蛋白的结合
杜传荣1,逯东伟1,石 康2,陈丹丹1,林翠梧1,3*
(1.广西大学化学化工学院,广西南宁 530004; 2.广西桂林电子科技大学信息与通信学院,广西桂林 541000; 3.广西高校应用化学技术与资源开发重点实验室,广西南宁 530004)
基于临床上肉桂酰胺类药物的广泛应用及优异性能,以间羟基肉桂酸为母体,分别与不同氨基酸反应,设计合成了3种未见报道的肉桂酰胺类衍生物,并用MS、IR、1H NMR、13C NMR进行结构表征。采用分子对接技术和荧光光谱法、同步荧光光谱法、紫外-可见光谱法共同研究了3种衍生物分别和人血清白蛋白(HSA)相结合的机理。AutoDock对接显示,这3种衍生物结合在HSA亚结构域ⅡA(即siteⅠ)的疏水腔内,维系衍生物与HSA的主要作用力为氢键和范德华力,同时还存在着疏水作用。光谱实验结果表明,在体外生理条件下,衍生物都与HSA形成复合物,对HSA内源荧光产生静态猝灭,且对其构象产生影响。根据不同温度下的热力学函数,确定主要作用力均是氢键和范德华力。分子对接与实验获得了一致的结果。
肉桂酰胺衍生物;光谱法;分子模拟;人血清白蛋白(HSA)
1 引 言
药物被吸收进入人体后,大多数会先与血浆蛋白结合,继而被转运到受体部位发挥作用。人血清白蛋白(HSA)是血浆中含量最多的蛋白,具有保持血液正常渗透压的功能,可以结合、运输脂肪酸、氨基酸以及许多药物小分子等内源和外源性化合物分子,在生命活动中起着非常重要的作用。且其结构已被探知,故常被作为探讨药物与蛋白相互作用机理的最佳模型[1-5]。药物小分子与HSA的结合,极大地影响其在人体内的吸收、分布和代谢情况。因此,研究小分子与HSA间的结合作用,不但可以帮助人们深入分子水平了解其作用机理,而且对阐明药物在体内的代谢动力学具有极其重要意义,也为设计及研发新型高活性且毒副作用小的药物提供有价值的参考及理论指导[5-6]。
临床上,肉桂酰胺类化合物作为药物的应用历史久远。国内外对其生物活性的研究主要集中于抗惊厥、扩张血管、抗诱变、抗肿瘤、杀虫以及消炎等方面,并取得了显著成果[7-14]。基于此,本文以间羟基肉桂酸为起始原料,分别与β-丙氨酸、γ-氨基丁酸、6-氨基己酸反应,设计合成了3种未见文献报道的肉桂酰胺类衍生物,以期得到有更强生物活性且毒副作用小的药物。在模拟生理条件下,采用Autodock分子对接结合荧光光谱法、UVVis光谱法研究了这3种肉桂酰胺类衍生物分别与HSA的结合特性。分别确定了其对HSA荧光猝灭的机理、结合常数和结合位点数,并探讨了其对人血清白蛋白构象的影响,实验与分子对接获得了一致的结果。本研究为深入阐明这3种肉桂酰胺类衍生物在体内的作用机理、运输及代谢情况提供了确切的实验依据和理论参考。
2 实 验
2.1 仪器与试剂
仪器:Agilent Cary Eclipse Fluorescence Spectrophotometer荧光分光光度计(带恒温装置,美国Agilent Technologies),Agilent Cary 60 UV-Vis紫外-可见分光光度计(带恒温装置,美国Agilent Technologies),Shimadzu LCMS-8040液质联用仪(日本Shimadzu),Boetius显微熔点测定仪(德国Boetius),Bruker Tensor 27红外光谱仪(德国Bruker),Bruker Avance-600 NMR Spectrometer核磁共振仪(600 MHz,德国Bruker),Milli-Q Advantage A10(美国Millipore)
试剂:间羟基肉桂酸(珠海嘉信康医药科技有限公司,HPLC≥95%),人血清白蛋白(HSA, 99%,美国Sigma),pH 7.4 PBS缓冲液(粉剂,美国Sigma),其余试剂均为国产分析纯,实验用水为Milli-Q超纯水。
2.2 衍生物Ⅰ~Ⅲ的合成及表征
衍生物Ⅰ~Ⅲ的合成路线如图1所示。

图1 衍生物Ⅰ~Ⅲ的合成路线Fig.1 Synthetic route ofthe derivatives
2.2.1 中间体间乙酰基肉桂酸的制备
间羟基肉桂酸50 mmol,乙酸酐50 mL,吡啶3 mL,80℃反应12 h。将反应液倾入冰水中,并剧烈搅拌,生成大量白色沉淀,静置过夜,抽滤,滤饼用水洗至洗液为中性,干燥,直接用于下一步反应。
2.2.2 中间体间乙酰基肉桂酰氯的制备
间乙酰基肉桂酸20 mmol,SOCl215 mL,油浴80℃加热回流反应5 h,减压旋蒸除去溶剂即得粗产物,直接用于下一步反应。
2.2.3 衍生物Ⅰ~Ⅲ的制备
将40 mmol β-丙氨酸(γ-氨基丁酸/6-氨基己酸)溶于20 mL NaOH(2 mol·L-1)溶液,滴入间乙酰基肉桂酰氯(3 mL THF溶解),10~15℃反应3 h,用HCl溶液调节pH为4~5,有白色固体析出,过滤,甲醇重结晶,分别得到目标衍生物Ⅰ、Ⅱ、Ⅲ。
2.2.4 衍生物Ⅰ~Ⅲ的结构表征波谱数据
(E)-3-[3'-(3″-羟基苯基)丙烯酰胺基]丙酸(衍生物Ⅰ):白色粉末状固体。收率:88.5%。m.p.:164~165℃。ESI-MS(m/z):234.2[M--1]。IR(KBr)vmax(cm-1):3 571.3,3 483.6(—OH(COOH)),3 357.9(—NH—),1 702.5, 1 657.5(—C==O—),1 647.9(—C==C—), 1 594.7,1451.3(Ar),1270.3(—CO—(ArOH)),874.0,799.6,691.6(γArH)。1H NMR (600 MHz,DMSO-d6)δ:12.21(1 H,s,—COOH), 9.61(1 H,s,—OH),8.19(1 H,t,J=6.6 Hz,—CO—NH—),7.32(1 H,d,J=15.8 Hz,H-3', 7.19(1 H,t,J=7.8 Hz,H-5″),6.97(1 H,d, J=7.8 Hz,H-6″),6.92(1 H,s,H-2'),6.78 (1 H,d,J=7.8 Hz,H-4″),6.56(1 H,d,J= 15.8 Hz,H-2'),3.37(2 H,q,J=6.6 Hz, H-3),2.45(2 H,t,J=6.6 Hz,H-2)。13C NMR (151 MHz,DMSO-d6,TMS)δ:173.4(—COOH), 165.5(—CO—NH—),158.2(C-3″),139.3 (C-3'),136.6(C-1″),130.4(C-5″),122.3 (C-6″),119.2(C-2'),117.1(C-2″),114.2 (C-4″),35.5(C-3),34.4(C-2)。
(E)-4-[3'-(3″-羟基苯基)丙烯酰胺基]丁酸(衍生物Ⅱ):白色粉末状固体。收率:90.2%。m.p.:150~151℃,ESI-MS(m/z):248.3[M--1];IR(KBr)vmax(cm-1):3 518.3,3 458.9(—OH (COOH)),3354.6(—NH—),1 720.2,1 694.3 (—C==O—),1 650.1(—C==C—),1 592.4, 1 457.8(Ar),1285.7(—CO—(ArOH)),891.9, 789.5,682.9(γArH)。1H NMR(600 MHz,DMSO-d6)δ:12.08(1 H,s,—COOH),9.59(1 H,s,—OH),8.13(1 H,t,J=6.0 Hz,—CO—NH—), 7.31(1 H,d,J=15.6 Hz,H-3'),7.19(1 H,t, J=7.8 Hz,H-5″),6.97(1 H,d,J=7.8 Hz, H-6″),6.92(1 H,s,H-2″),6.77(1 H,dd,J1= 7.8 Hz,J2=1.8 Hz,H-4″),6.53(1 H,d,J= 15.6 Hz,H-2'),3.19(2 H,q,J=6.0 Hz,H-4),2.26(2 H,t,J=7.2 Hz,H-2),1.67(2 H, m,H-3)。13C NMR(151 MHz,DMSO-d6,TMS)δ: 174.7(—COOH),165.4(—CO—NH—),158.1 (C-3″),139.2(C-3'),136.6(C-1″),130.4 (C-5″),122.4(C-6″),119.1(C-2'),117.1 (C-2″),114.1(C-4″),38.6(C-4),31.6(C-2),25.1(C-3)。
(E)-6-[3'-(3″-羟基苯基)丙烯酰胺基]己酸(衍生物Ⅲ):白色粉末状固体。收率:95.1%。m.p.:170~171℃。ESI-MS(m/z):276.3[M--1]。IR(KBr)vmax(cm-1):3 571.2(—OH(COOH)), 3 349.3(—NH—),1 722.2,1 696.4(—C== O—),1 651.9(—C==C—),1 591.6,1 449.8 (ArH),874.9,784.9,679.1(γArH),1 237.1(—CO—(ArOH))。1H NMR(600 MHz,DMSO-d6)δ:8.22 (1 H,t,J=6.0 Hz,—CO—NH—),7.29(1 H,d, J=15.6 Hz,H-3'),7.18(1 H,t,J=7.8 Hz,H-5″),6.95(1 H,d,J=7.8 Hz,H-6″),6.94(1 H, s,H-2″),6.78(1 H,dd,J1=7.8 Hz,J2=1.8 Hz,H-4″),6.56(1 H,d,J=15.6 Hz,H-2'), 3.14(2 H,q,J=6.0 Hz,H-6),2.18(2 H,t,J= 7.2 Hz,H-2),1.41~1.52(4 H,m,H-3&5), 1.26~1.30(2 H,m,H-4)。13C NMR(151 MHz, DMSO-d6,TMS)δ:174.9(—COOH),165.1(—CO—NH—),157.9(C-3″),138.7(C-3'),136.3 (C-1″),130.0(C-5″),122.2(C-6″),118.8(C-2'),116.8(C-2″),113.8(C-4″),38.7(C-6), 34.0(C-2),29.0(C-5),26.2(C-4),24.5 (C-3)。
2.3 分子模拟
ACD/Labs(version12.00)构建衍生物Ⅰ、Ⅱ、Ⅲ的三维结构mol文件,通过Open Bable(version2.3.2)MM94力场进行结构优化。HSA-warfarin复合物晶体结构来自Protein Data Bank数据库(http://www.rcsb.org/pdb,PDB编码:1H9Z)。对接前除去HSA-warfarin复合物中包含的配体及水分子,继而对其加氢,添加偏电荷及调整质子化状态。通过AutoDock 4.2建立衍生物Ⅰ、Ⅱ、Ⅲ分别与HSA的相互作用模型,将其对接到HSA的活性口袋,进行计算。运用拉马克遗传算法(LGA)预测衍生物与HSA结合时可能存在的构象。对接过程中,所有对接参数采用缺省值,考虑了衍生物的10个构象。最终得到10种对接模型,结合能最负的为最佳。进一步通过LigPlot+软件[15-16]分析最佳构象时衍生物与HSA之间的结合模式。
2.4 光谱测定
储备液的配制:以pH 7.4 PBS缓冲液为溶剂,分别配制1.0×10-4mol·L-1人血清白蛋白,1.0×10-3mol·L-1不同衍生物的储备液,4℃下保存备用。
扫描溶液的配制:于10支10 mL比色管中依次准确加入1.0 mL人血清白蛋白溶液,再依次加入不同量衍生物储备液,定容。分别在298,303, 308 K下恒温静置30 min。
设置激发波长为280 nm,激发、发射狭缝宽度分别为5 nm、2.5 nm,快速扫描不同浓度衍生物-HSA体系荧光发射光谱(波长范围300~500 nm)。同时扫描同步荧光光谱(Δλ=15 nm和Δλ=60 nm)。
以PBS缓冲液为参比,分别测定298,303, 308 K时不同浓度衍生物-HSA体系300~500 nm的吸收光谱。
3 结果与讨论

图2 不同衍生物-HSA体系的分子对接图Fig.2 Molecular docking mode of different derivative-HSA systems
3.1 分子模拟研究衍生物与HSA的相互作用
蛋白质的晶体结构研究[17-18]表明,HSA分子三维晶体结构呈心形,有3个同源结构域:Ⅰ(1~195氨基酸残基)、Ⅱ(196~383氨基酸残基)、Ⅲ(384~585氨基酸残基)。每个域包含A和B两个子域,每个子域又分为不同的亚域,分别为ⅠA、ⅠB、ⅡA、ⅡB、ⅢA、ⅢB。它们分别以槽口相对的方式形成圆筒状结构,几乎所有的疏水性氨基酸均包围在圆筒内部,构成疏水腔。大多数药物分子与HSA相互作用于亚结构域ⅡA、ⅢA形成的疏水腔中,即siteⅠ、siteⅡ。对接结果的最佳构象及衍生物与HSA的结合模式见图2。
图2清晰地展示了衍生物与HSA相互作用的结合位域及相互作用力。可以看出,衍生物与HSA相互作用时均主要位于ⅡA的键合口袋中。衍生物Ⅰ结构中的酚羟基的氧原子与周围残基Trp214、Val344、Glu450形成氢键,羧基的氧原子与周围残基Ser324、Leu345、Arg348、Arg485形成氢键,周围还存在疏水性残基Leu453、Ser454、Leu457、Leu481。衍生物Ⅱ结构中的酚羟基的氧原子与周围残基Trp214、Val344、Glu450形成氢键,酰胺键的氧原子与周围残基Arg348、Arg484、Arg485形成氢键,羧基的氧原子与周围残基Ser324、Arg348、Arg485形成氢键,周围还存在着疏水性残基Leu198、Ser454、Leu481。衍生物Ⅲ结构中的酚羟基的氧原子与周围残基Arg348、Arg484、Arg485、Leu481形成氢键,酰胺键的氧原子与周围残基Trp214形成氢键,羧基的氧原子与周围残基Arg218、Arg222形成氢键,周围还存在着疏水性残基Val344、Glu450、Asp451、Ser454。可见,不同衍生物的引入改变了Trp214残基周围微环境的疏水性,从而对HSA的荧光发射光谱产生影响,并产生猝灭效应。它们之间的相互作用力都主要是氢键和范德华力,同时还存在着疏水作用。对接计算得到298 K时衍生物Ⅰ-HSA体系的ΔG=-26.37 kJ·mol-1;化合物Ⅱ-HSA体系的ΔG=-31.14 kJ·mol-1,化合物Ⅲ-HSA体系的ΔG=-22.14 kJ·mol-1,说明衍生物Ⅰ(Ⅱ/Ⅲ)与HSA的结合都是自发进行的。分子对接形象地展现了衍生物与HSA的结合模式,分析了衍生物与HSA相互作用的结合位域和作用力,为实验提供了可靠的理论信息。理论结果和实验结果存在略微差异,这种差异可能是由于分子对接时HSA是以晶体形态与衍生物结合,而实验时HSA是在溶液中与衍生物发生作用的[5]。
3.2 衍生物与HSA相互作用的荧光发射光谱
当激发波长为280 nm时,HSA在350 nm附近出现最大荧光发射峰。衍生物Ⅰ、Ⅱ、Ⅲ在此测试条件下并无荧光发射,不会对实验产生干扰。但衍生物Ⅰ、Ⅱ、Ⅲ在λex、λem处均有一定吸收,其猝灭行为中包含“内滤光效应”,需根据公式(1)予以校正[19-20]。

图3 不同衍生物-HSA体系的荧光猝灭光谱Fig.3 Fluorescence quenching spectra of different derivative-HSA systems

Fo和Fc分别表示测试和校正后的荧光发射峰强度,Aex、Aem分别是溶液在λex、λem处的吸收值。
图3是衍生物Ⅰ、Ⅱ、Ⅲ分别与HSA相互作用的荧光猝灭光谱。由图可知,HSA的最大荧光发射峰为355 nm,随着体系中衍生物浓度的增加,HSA内源性荧光发生不同程度的猝灭,但峰形保持不变,而最大荧光发射峰有轻微红移(Ⅰ-HSA:由355 nm移动至358 nm;Ⅱ-HSA:由355 nm移动至360 nm;Ⅲ-HSA:由355 nm移动至357 nm)。这表明衍生物Ⅰ、Ⅱ、Ⅲ均与HSA发生结合,使得色氨酸残基(Trp)周围环境极性变大,疏水性变小,从而导致HSA空间构象发生改变[21]。
3.3 衍生物与HSA相互作用的猝灭机理
荧光猝灭机理通常分为静态猝灭和动态猝灭两种。静态猝灭是指荧光分子和猝灭剂之间通过结合作用,形成不发光的复合物而产生荧光猝灭;动态猝灭则仅仅是荧光物质的激发态分子和猝灭剂分子间通过碰撞作用,使其荧光猝灭,其作用过程符合Stern-Volmer方程[22]:

式中F0、F分别表示存在和不存在猝灭剂时的荧光强度,KSV表示Stern-Volmer猝灭常数,Kq表示双分子猝灭速率常数,τ0表示荧光分子的平均寿命(1×10-8s),[Q]是药物浓度。
分别绘制298,303,308 K温度下衍生物Ⅰ(Ⅱ/Ⅲ)-HSA体系的Stern-Volmer曲线(见图4),可见,数据有良好的线性关系,由直线斜率可以得到不同温度下的猝灭常数(见表1)。表1显示,KSV随着温度的升高而降低,可见是静态猝灭引起HSA发生荧光猝灭[23]。结果表明,衍生物Ⅰ(Ⅱ/Ⅲ)均与HSA形成不发光的复合物。另外,不同衍生物-HSA体系的Kq均远大于小分子猝灭剂对蛋白质大分子的最大碰撞猝灭速率2.0× 1010L·mol-1·s-1[24],进一步说明衍生物Ⅰ、Ⅱ、Ⅲ均能分别与HSA有效地形成稳定的非共价复合物,其荧光猝灭过程是静态猝灭。

图4 不同温度下衍生物-HSA体系的荧光猝灭Stern-Volmer图Fig.4 Stern-Volmer plots of fluorescence quenching of derivative-HSA systems at different temperatures

表1 不同温度下衍生物-HSA体系的猝灭参数Table 1 Quenching constants of derivative-HSA systems at different temperatures
3.4 衍生物与HSA相互作用的紫外-可见吸收光谱
为了更进一步验证衍生物与HSA相互作用的猝灭机理,测定了不同衍生物-HSA体系的吸收光谱。不同衍生物-HSA体系溶液的吸收光谱如图5所示。由图可知,随着衍生物Ⅰ、Ⅱ、Ⅲ浓度的逐渐增加,HSA最大吸收峰强度明显增大,说明不同衍生物的加入均使HSA分子构象发生变化,肽链部分伸展开来,促使本来包含在HSA内部的Trp和酪氨酸残基(Tyr)等的芳杂环疏水基团出现裸露现象,基团间疏水作用减弱,导致吸收强度增加[25]。另外,紫外吸收光谱显示衍生物Ⅰ(Ⅱ/Ⅲ)-HSA体系和游离Ⅰ(Ⅱ/Ⅲ)的差谱与HSA的紫外吸收曲线明显不重合(见图5中小图)。这两方面都进一步说明衍生物Ⅰ、Ⅱ、Ⅲ均分别与HSA基态分子发生相互作用形成了基态配合物,进一步证实其猝灭机制为静态猝灭[26]。
3.5 衍生物与HSA相互作用的结合常数(KA)及结合位点数(n)
衍生物Ⅰ、Ⅱ、Ⅲ对HSA的荧光猝灭均为静态猝灭,即其可分别与HSA相互作用形成基态复合物。假设衍生物与HSA有n个相同并且独立的结合位点,则HSA的荧光强度与衍生物浓度的关系可用公式(3)来描述[23]:

图5 不同衍生物-HSA体系的紫外吸收光谱Fig.5 UV absorption spectrum of different derivative-HSA systems

不同衍生物-HSA体系的lg[(F0-F)/F]对lg[Q]双对数图如图6所示,由直线截距和斜率得到不同体系的KA和n值(表2)。由表2可知:不同温度下n值均接近于1,表明衍生物Ⅰ、Ⅱ、Ⅲ分别与HSA相互作用均只有1个结合位点。且KA均随温度升高而降低,说明温度升高导致复合物稳定性降低,更进一步证明各体系的猝灭过程为静态猝灭[27]。
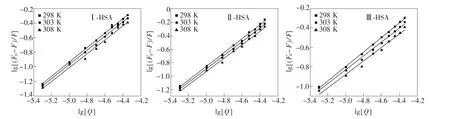
图6 不同温度下衍生物-HSA体系的荧光猝灭双对数图Fig.6 Double lg plots of fluorescence quenching of derivative-HSA systems at different temperatures

表2 不同温度下衍生物-HSA体系的结合参数Table 2 Binding parameters of derivative-HSA systems at different temperatures
3.6 不同衍生物-HSA体系结合距离(r)及能量转移效率(E)
根据非辐射能量转移理论,供体大分子蛋白与受体小分子相互作用的E与r之间关系如下[28-29]:

其中,F0为供体的荧光强度,F为供体和受体浓度为1∶1时的荧光强度,R0为临界能量转移距离,N为介质折射指数(1.336),K2为偶极空间取向因子(2/3),φ为供体的荧光量子产率(0.118)[30],J为供体的荧光光谱与受体的吸收光谱的重叠积分,F(λ)、ε(λ)分别为供体在波长λ处的荧光强度、摩尔吸光系数。
HSA荧光光谱与衍生物紫外吸收光谱的重叠图如图7所示。据公式(4)~(6)得到J、E、r,见表3。r均小于7 nm,且0.5R0<r<1.5R0,表明Trp残基可将能量以非辐射方式转移至衍生物Ⅰ、Ⅱ、Ⅲ,引起HSA内源性荧光猝灭。r均大于R0,说明非辐能量转移引起的猝灭概率小于静态猝灭,衍生物与HSA发生作用的主要猝灭方式为形成复合物导致的静态猝灭[28,31]。
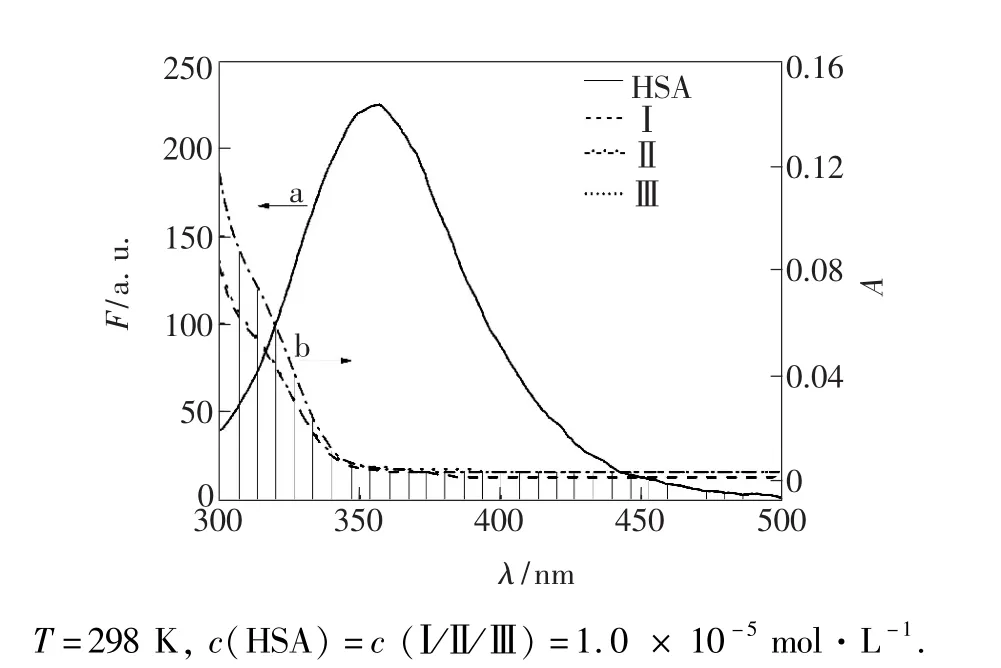
图7 HSA的荧光发射光谱(a)与不同衍生物(b)的紫外吸收光谱重叠图Fig.7 Overlap of fluorescence emission spectrum of HSA(a) and absorption spectra of different derivatives(b)

表3 不同衍生物-HSA体系的结合距离参数Table 3 Distance parameters of different derivative-HSA systems
3.7 不同衍生物-HSA体系作用力类型
氢键、疏水作用、范德华力和静电力是配体小分子与生物大分子间的主要结合力类型。反应前后热力学参数ΔH、ΔS的变化可以用来判断不同的作用力类型[28]。实验温度在25~35℃之间, HSA不会发生任何结构降解。根据van't Hoff定律,两物质间相互作用的热力学参数符合下列关系:

以lnKA对1/T作图得到直线(图8),由直线截距和斜率得到衍生物与HSA相互作用的ΔH、ΔS,通过公式(8)可以计算出不同温度下的ΔG(表4)。不同温度下ΔG<0,表明衍生物Ⅰ、Ⅱ、Ⅲ与HSA的结合均是自发进行的;ΔS<0,ΔH<0,表明其结合是焓驱动过程,相互作用力均主要是氢键和范德华力[32]。

表4 不同温度下衍生物-HSA体系的热力学参数Table 4 Thermodynamic parameters of derivative-HSA systems at different temperatures
3.8 不同衍生物对HSA构象的影响
同步荧光光谱法具有谱图简化、选择性高、光散射干扰减少等特点,广泛应用于食品检测、药物分析、蛋白质构象变化分析等[33-34]。它可以反映不同发色团的性质,当固定激发波长与发射波长的间距为Δλ=15 nm时,只反映Tyr残基的荧光光谱特性;当Δλ=60 nm时,只反映Trp残基的荧光光谱特性。

图9 不同衍生物-HSA体系的同步荧光光谱Fig.9 Synchronous fluorescence spectra of different derivative-HSA systems
图9为298 K时不同衍生物-HSA体系的同步荧光光谱。由图可见,HSA荧光随不同衍生物浓度的升高而呈显著下降趋势。Tyr残基最大荧光发射峰所在波长没有变化,而Trp残基最大荧光发射峰所在波长明显红移(3种衍生物-HSA体系均从279 nm移动至290 nm)。即Tyr残基周围环境没有明显变化,而Trp残基周围环境极性增大,疏水性降低[30]。这表明衍生物的加入使HSA构象发生改变,分子内部肽键更加伸展开来,疏水腔发生部分瓦解,水分子进入其中,使得原本处于疏水腔中的Trp残基暴露在更加亲水的环境中[23]。由此可见,各衍生物与HSA的结合位点更接近于Trp残基,同时印证了分子对接的结果。
4 结 论
采用分子对接技术结合光谱法研究了3种未见报道的肉桂酰胺类衍生物与HSA的相互作用。分子对接揭示了衍生物在HSA上的结合部位主要位于亚结构域ⅡA(即siteⅠ)中,相互作用力主要是氢键和范德华力,兼有疏水作用。光谱法实验表明,在体外生理条件下,衍生物Ⅰ、Ⅱ、Ⅲ都使HSA内源荧光发生显著猝灭,猝灭过程均遵循静态猝灭,主要作用力均是氢键和范德华力,且HSA空间构象发生改变。分子对接预测和实验结果一致,二者相互作证,提高了实验结果推断的准确度。这些信息对深入探究重要活性成分肉桂酸衍生物在生物体内的药代动力学及可能存在的毒副作用具有重要意义,为药物研发、改良提供有价值的理论参考。
[1]Xiao J B,Chen T T,Cao H,et al.Molecular property-affinity relationship of flavanoids and flavonoids for HSA in vitro [J].Mol.Nutr.Food Res.,2011,55(2):310-317.
[2]Guo S H,Shi X L,Yang F,et al.Structural basis of transport of lysophospholipids by human serum albumin[J].Biochem.J.,2009,423(1):23-30.
[3]Yang M L,Song Y M,Lu X Q.Preparation,anticoagulant property test and mechanism discussion of water soluble compound of β-cyclodextrin with warfarin/frulic acid[J].Chin.J.Anal.Chem.(分析化学),2015,43(6):836-842(in Chinese).
[4]Ma J H,Qin D D,Song Y M.Synthesis of superoxide dismutase-like activity of Co(Ⅱ),Ni(Ⅱ)complexes containing aromatic amines and glycylglycine[J].Chin.J.Anal.Chem.(分析化学),2015,43(8):1136-1144(in Chinese).
[5]Liang J,Feng S L.Interaction between ambroxol hydrochloride and human serum albumin studied by spectroscopic and molecular modeling methods[J].Spectrosc.Spect.Anal.(光谱学与光谱分析),2011,31(4):1020-1024(in Chinese).
[6]Xin J W,Ma H Y,Yang M.Spectroscopic studies on the interaction between mecobalamin and bovine serum albumin [J].Chin.J.Lumin.(发光学报),2012,33(5):553-557(in Chinese).
[7]Wu D.Synthesis and Antidepressant Activity of N-(2-hydroxyethyl)Cinnamam Derivatives[D].Yanji:Yanbian University,2011(in Chinese).
[8]Guan L P,Wei C X,Deng X Q,et al.Synthesis and anticonvulsant activity of N-(2-hydroxyethyl)cinnamamide derivatives[J].Eur.J.Med.Chem.,2009,44(9):3654-3657.
[9]Kong J O,Lee S M,Moon Y S,et al.Nematicidal activity of cassia and cinnamon oil compounds and related compounds toward Bursaphelenchus xylophilus(Nematoda:Parasitaphelenchidae)[J].J.Nematol.,2007,39(1):31-36.
[10]Motohashi N,Ashihara Y,Yamagami C,et al.Structure-antimutagenic activity relationships of benzalacetone derivatives against UV-induced mutagenesis in E.coli WP2uvrA and γ-induced mutagenesis in Salmonella typhimurium TA2638[J]. Mutat.Res-Fund.Mol.M,2001,474(1-2):113-120.
[11]Nie W,Luo J G,Wang X B,et al.Synthesis of new α-glucosidase inhibitors based on oleanolic acid incorporating cinnamic amides[J].Chem.Pharm.Bull.,2011,59(8):1051-1056.
[12]Deng X Q,Wu D,Wei C X,et al.Synthesis and antidepressant-like action of N-(2-hydroxyethyl)cinnamamide derivatives in mice[J].Med.Chem.Res.,2011,20(8):1273-1279.
[13]Ronad P M,Hunashal R D,Darbhamalla S,et al.Synthesis and evaluation of anti-inflammatory and analgesic activities of a novel series of substituted-N-(4-methyl-2-oxo-2H-chromen-7-yl)benzamides[J].Arzneim.Forsch.,2008,58(12): 641-646.
[14]Mou L Y,Lin Z Y,Zhu L Y,et al.Synthesis and vasodilative activities of α-phenylcinnamide[J].Acta Pharmaceut. Sinica(药学学报),2001,36(7):502-506(in Chinese).
[15]Laskowski R A,Swindells M B.LigPlot+:Multiple ligand-protein interaction diagrams for drug discovery[J].J.Chem.Inf.Model.,2011,51(10):2778-2786.
[16]Jiang B L,Hu Y R,Zhao A R,et al.Characterization of taurine and its derivative binding to HSA using calorimetry and docking[J].J.Chem.Pharm.Res.,2013,5(12):1529-1536.
[17]Zaidi N,Ajmal M R,Rabbani G,et al.A comprehensive insight into binding of hippuric acid to human serum albumin: A study to uncover its impaired elimination through hemodialysis[J].PLoS One,2013,8(8):e71422.
[18]Bijari N,Shokoohinia Y,Ashrafi-Kooshk M R,et al.Spectroscopic study of interaction between osthole and human serum albumin:Identification of possible binding site of the compound[J].J.Lumin.,2013,143:328-336.
[19]Pacheco M E,Bruzzone L.Synchronous fluorescence spectrometry:Conformational investigation or inner filter effect? [J].J.Lumin.,2013,137:138-142.
[20]Li D J,Hong D F,Guo H,et al.Probing the influences of urea on the interaction of sinomenine with human serum albumin by steady-state fluorescence[J].J.Photoch.Photobio.B,2012,117:126-131.
[21]Xie M X,Long M,Liu Y,et al.Characterization of the interaction between human serum albumin and morin[J].BBAGen.Subjects,2006,1760(8):1184-1191.
[22]Yan Z Y,Shao X F,Yan L,et al.Interaction between gatifloxacin and bovine serum albumin[J].J.Chin.Pharm. Sci.,2005,14(1):33-37.
[23]Du C R,Luo X,Wei J R,et al.Preparation of(2E)-3-(4'-halophenyl)-prop-2-enoyl sulfachlorpyridazine sodium salts and their interaction with bovine serum albumin by fluorescence spectroscopy[J].Chem.Res.Chin.Univ.,2013,29 (5):854-860.
[24]Wang C,Wu Q H,Li C R,et al.Interaction of tetrandrine with human serum albumin:A fluorescence quenching study [J].Anal.Sci.,2007,23(4):429-433.
[25]Zhang Q,Song Y M,Liu J C,et al.Interaction between complexes of transition metal with warfarin and human serum albumin[J].Chin.J.Inorg.Chem.(无机化学学报),2011,27(9):1772-1780(in Chinese).
[26]Feng X Q,Fu G Q,Li X F,et al.Interaction of rare earth with bovine serum albumin[J].Chin.J.Lumin.(发光学报),2011,32(2):205-209(in Chinese).
[27]Wu J X,Li M,Liu Z G,et al.Study on interaction of Y3+and bovine serum albumin by spectrometry[J].Chin.J.Lumin.(发光学报),2012,33(10):1153-1159(in Chinese).
[28]Wang J,Zheng X F,Cao H Y,et al.Synthesis of 4-thio-5-iodouridine and the interaction between it and human serum albumin[J].Chin.J.Lumin.(发光学报),2013,34(3):361-368(in Chinese).
[29]Liu Y,Xie M X,Kang J,et al.Studies on the interaction of total saponins of Panax notoginseng and human serum albumin by Fourier transform infrared spectroscopy[J].Spectrochim.Acta A,2003,59A(12):2747-2758.
[30]Luo X,Du C R,Wei J R,et al.Study of the interaction between sodium salts of(2E)-3-(4'-halophenyl)prop-2-enoyl sulfachloropyrazine and bovine serum albumin by fluorescence spectroscopy[J].J.Lumin.,2013,28(2):202-210.
[31]Mandal P,Bardhan M,Ganguly T.A detailed spectroscopic study on the interaction of Rhodamine 6G with human hemoglobin[J].J.Photoch.Photobio.B,2010,99(2):78-86.
[32]Ross P D,Subramanian S.Thermodynamics of protein association reactions:Forces contributing to stability[J].Biochemistry,1981,20(11):3096-3102.
[33]Lloyd J B F.Synchronized excitation of fluorescence emission spectra[J].Nat.Phys.Sci.,1971,231(20):64-65.
[34]Xiao H B,Zhao J H,Yuan H C,et al.Determination of tetracycline content in pork by synchronous fluorescence spectroscopy with CARS method[J].Opt.Precision Eng.(光学精密工程),2013,21(10):2513-2519(in Chinese).

杜传荣(1988-),女,山东滕州人,博士研究生,2010年于广西大学获得学士学位,主要从事天然药物化学方面的研究。
E-mail:duchuanrong123@163.com

林翠梧(1958-),女,广西北流人,教授,博士生导师,2000年于中山大学获得博士学位,主要从事天然药物化学方面的研究。
E-mail:cuiwulin114@163.com
Synthesis of Three Cinnamamide Derivatives and Their Interaction Mechanism with Human Serum Albumin
DU Chuan-rong1,LU Dong-wei1,SHI Kang2,CHEN Dan-dan1,LIN Cui-wu1,3*
(1.School of Chemistry and Chemical Engineering,Guangxi University,Nanning 530004,China; 2.School of Information and Communication,Guilin University of Electronic Technology,Guilin 541000,China; 3.Guangxi Colleges and Universities Key Laboratory of Applied Chemistry Technology and Resource Development,Nanning 530004,China) *Corresponding Author,E-mail:cuiwulin114@163.com
Because of the excellent properties and wide applications of cinnamamide medicines in clinic,three m-hydroxycinnamic acid derivatives were designed and synthetised by the reaction of mhydroxybenzoic acid with different amino acids,respectively.Their structures were characterized by mass spectrometry,infrared spectroscopy,and nuclear magnetic resonance.The interaction mechanism of derivatives and human serum albumin(HSA)were investigated by AutoDock molecular docking,fluorescence spectroscopy and UV-visible absorption spectroscopy.The results of molecular docking represent that derivatives exist in the hydrophobic pocket of subdomainⅡA(siteⅠ)of HSA.Hydrogen bonds and van der Waals'forces are main acting forces and hydrophobic force is just the secondary consideration.The spectra experiment results indicate that the derivatives can form complexes with HSA respectively and strongly quench the intrinsic fluorescence of HSA through static quenching at different temperatures.Meanwhile,the secondary structure of HSA is influenced. The change in enthalpy(ΔH)and entropy(ΔS)suggest that hydrogen bonds and van der Waals forces are main acting forces.The molecular docking data are consistent with experimental results.
cinnamamide derivatives;spectroscopic methodology;molecular docking;human serum albumin(HSA)
O625.5
:ADOI:10.3788/fgxb20153611.1342
1000-7032(2015)11-1342-11
2015-08-11;
:2015-09-21
广西研究生教育创新计划(YCBZ2013011);国家自然科学基金(21362001);广西自然科学基金重点项目(2013GXNSFDA019005);广西中药质量标准研究重点实验室开放课题(桂中重开201102)资助项目

