放线菌Act12与腐植酸钾配施对丹参生长及其根域微生态的影响
段佳丽,薛泉宏,*,舒志明,王东胜,何 斐
1 西北农林科技大学资源环境学院, 杨凌 712100 2 西北农林科技大学生命科学学院, 杨凌 712100
放线菌Act12与腐植酸钾配施对丹参生长及其根域微生态的影响
段佳丽1,薛泉宏1,*,舒志明2,王东胜1,何 斐2
1 西北农林科技大学资源环境学院, 杨凌 712100 2 西北农林科技大学生命科学学院, 杨凌 712100
探讨生防放线菌菌剂与腐植酸钾配施对丹参生长及其根域微生态的影响。以常规移栽处理为对照,研究小区试验中放线菌菌剂与腐植酸钾不同配施比例下对丹参生长、产量及抗根结线虫侵染的影响;并采用稀释平皿涂抹法测定丹参根区土壤、根表土壤、根外土壤及根系中细菌(B)、真菌(F)与放线菌(A)的数量,同时对优势细菌、真菌和放线菌进行了分子生物学鉴定,研究放线菌菌剂与腐植酸钾配施处理下丹参根域微生态变化。研究结果表明:①配施能增强菌剂对丹参的促生效果。菌剂与腐植酸钾配施T20处理丹参出苗率较对照提高8.7%,收获时的死亡率较对照减少39.0%;茎叶鲜质量、根鲜质量、单株根鲜质量、根干质量以及单株根干质量分别较对照增加6.1%、28.6%、11.1%、36.3%以及9.0%。②可以调整丹参植株根域土壤微生态平衡,降低有害微生物数量,增加有益微生物数量,改善微生物区系。在丹参根表土壤中,菌剂与腐植酸钾配施处理B/A值较对照降低78.4%,A/F值较对照增加95.0%。在丹参根系内,菌剂与腐植酸钾配施处理细菌数量较对照增加195.0%,未检测到真菌和放线菌存在。③在放线菌处理丹参根区、根表土壤中,有6株优势菌可能对丹参生长及抗病有益:3株优势细菌分别为硝基愈疮木胶节杆菌(Arthrobacternitroguajacolicus)、放射型根瘤菌(Rhizobiumradiobacter)和弗雷德里克斯堡假单胞菌(Pseudomonasfrederiksbergensis);3株优势放线菌分别为淀粉酶产色链霉菌(Streptomycesdiastatochromogenes)、砖红链霉菌(S.lateritius)和卡伍尔链霉菌(S.cavourensis)。有2株优势菌疑为有害微生物:优势细菌为耐寒短杆菌(Brevibacteriumfrigoritolerans),优势放线菌为肿痂链霉菌(S.turgidiscabies)。这2种菌对其他作物的有害作用已有报道。④对丹参根结线虫侵染有强烈抑制作用,可使田间根结线虫侵染率降低49.3%。生防放线菌与腐植酸钾配施处理后能明显促进丹参生长,提高丹参产量及抗病虫能力,调节丹参根域微生态平衡。
丹参;放线菌剂;腐植酸钾;土壤微生物区系;优势微生物
丹参(SalviamiltiorrhizaBge.)是唇形科鼠尾草属的多年生草本植物,以根入药,是我国常用的中草药,具有活血化瘀、调经止痛、养血安神等功效[1]。由于丹参需求量增加而引起的人工栽培规模扩大化,促使丹参连作障碍愈加严重。丹参为根用药材,其特性决定不能大量施用化学农药防治丹参的根系病害,因此微生物制剂对丹参连作障碍修复有重要意义。本研究使用的多功能放线菌Act12菌剂对植物生长有刺激作用并能提高作物的诱导抗性,同时通过对根域土壤微生物区系的调节作用抑制有害微生物生长,促进有益菌生长繁殖,实现菌剂的防病促生效果。已有研究表明,放线菌Act12菌剂接种能显著增加黄瓜、甜瓜生物量,促进其生长发育并产生诱导抗性[2-3]。利用生防放线菌菌剂Act12蘸根接种可以促进丹参生长及有效成分含量的提高,并且对根结线虫侵染有强烈的抑制作用[4]。
但是,目前研究肥料与放线菌剂混合施用对植物的防病促生作用的报道很少。有研究指出,向土壤中施入有机养分或有机与无机混合养分,可显著促进接入生防放线菌在土壤中生长繁殖,提高生防放线菌的防病促生效果[5]。赵娟发现在施用复合肥和有机肥条件下,放线菌Act12菌剂能显著促进甜瓜生长,增加产量,提高品质,并增强甜瓜的抗病抗逆能力;改善甜瓜根际微生态环境达到微生态平衡,降低发生病害的风险[6]。申光辉等研究发现,硅肥与放线菌剂配施可以降低草莓死亡率,增加草莓生物量,提高果实品质,并能有效降低草莓根腐病的发生率[7]。肥料本身对作物生长就有良好的促进作用,菌剂与适合的肥料配合使用时对菌剂中的有益活菌繁殖有促进效应,对菌剂有增效作用;同时,菌剂对作物根系的刺激作用促进了肥料效应的发挥。放线菌是土壤微生物中数量仅次于细菌的三大微生物类群之一,主要依赖土壤中的有机物质生长繁殖。土壤有机物质中的腐植酸是放线菌生长所需的碳源及能源物质之一。在接种放线菌制剂的同时配合使用腐植酸物质,有利于放线菌生长繁殖,提高菌剂的作用效果;加之腐植酸本身对植物就有良好的促生作用。二者结合,具有相互的增效作用。本研究进行了放线菌菌剂与腐植酸钾的配施试验,旨在探索二者配施时对丹参的促生效果及微生态机制,为放线菌菌剂在丹参上的高效施用技术确立提供科学依据。
1 材料与方法
1.1 材料
丹参品种:商洛丹参,由陕西天士力植物药业有限公司药源基地提供。
放线菌剂:利用放线菌Act12通过固态发酵制备,菌剂活菌数为2.0×109cfu/g。该菌是微生物资源研究室从分离自青藏高原、黄土高原土壤的万余株放线菌中筛选到的1株多功能放线菌,经16S rDNA序列分析鉴定为密旋链霉菌(Streptomycespactum),该菌具有良好的抑菌抗病解毒及促生作用[8]。
腐植酸钾:水溶性腐植酸含量大于400.0g/kg,K2O含量≥50.0g/kg,由新疆双龙腐植酸有限公司生产。
培养基:牛肉膏蛋白胨琼脂(BPA)、马铃薯蔗糖琼脂(PDA)、高氏1号(GA)[9]。
1.2 方法
1.2.1 试验设计
试验地点为陕西杨凌现代农业示范园中药基地。
试验设5个处理:CK为对照,常规移栽;T0为腐植酸钾蘸根;T10为放线菌剂Act12与腐植酸钾(1∶9)配施蘸根;T20为放线菌剂Act12与腐植酸钾(1∶19)配施蘸根;T50为放线菌剂Act12与腐植酸钾(1∶49)配施蘸根。底肥为N、P、K复合肥,50 kg/667 m2。试验采用完全随机设计,每个处理重复3小区,小区面积20 m2,每区栽种12行,每行13株,行距30 cm,共156株。
菌剂+腐植酸钾配施:丹参移栽时用不同比例混合的腐植酸钾-生防菌混合菌粉蘸根并穴施。具体方法是,将大小一致的丹参幼苗根系用水浸湿,蘸根接种菌粉后移栽(保证丹参根系表面均匀粘上菌粉),此外每穴再施入5 g混合菌粉。移栽时尽量将幼苗的芦头(发根部位)用土掩盖并压实。
1.2.2 丹参出苗率调查及丹参生物量统计
2010-04-01移栽,2010-06-01调查丹参出苗率。2010-11-30收获时,将每个小区中心4行丹参划为精确采样区,所余8行为非精确采样区。
精确采样区采样:将样区内4行丹参根系完整挖出后去掉地上部分,称地上部分总鲜质量;然后将每株根系分别装入1个样品袋并编号,统计实际收获株数,每小区合并1袋,带回研究室,洗净根系称单株鲜质量,观察统计单株根系条数;统计样区根结线虫侵染率;烘干称样区总干质量。
非精确采样区采样:将非精确采样区内所余8行丹参全部完整挖出,统计实际收获株数,称地上部分总鲜质量,去土后称根系总鲜质量,观察统计样区根结线虫侵染率,晾干称总干质量。
利用精确采样区与非精确采样区所得数据计算相关指标。其中丹参出苗率根据整个小区12行数据进行统计;丹参死亡率根据丹参移栽后出苗株数与收获时丹参实际存活株数之差计算;单株根系鲜质量和单株根系条数根据精确采样区数据统计;茎叶鲜质量、根鲜质量、根干质量、单株根干质量以及根结线虫侵染率根据精确采样区与非精确采样区数据进行统计。
1.2.3 土壤样品采集与制备
在CK、T0和T20三个处理中各选取2株长势良好的代表性植株,按照周永强等方法采集土壤样品:去掉表层1 cm土壤,尽可能挖取完整根系及其密集分布区内的土壤,将样品装入新购自封袋。所采样品编号后带回实验室及时分离。根区土壤:将附着在丹参根系上的土抖落至自封袋中,混匀,称取10.0 g,置于装有少量石英砂和90 mL无菌水的三角瓶中,在摇床上振荡30 min后备用。根表土壤:指将根系上附着的大量土抖落后根表面仍粘附的少量土壤。将已抖落丹参根区土壤的须根剪下,称质量(W1)后置于装有90 mL无菌水的三角瓶中,手摇振荡1—2 min,待根表面粘附的土壤洗下即可,取出根系,用吸水纸将根表面水吸干后称根系质量(W2),W1-W2即为根表土质量[10]。
使用无菌小刀从供试根系样品中截取直径约5 mm且较均匀的根系各5段,用自来水冲洗干净,再用吸水纸吸干根表水分,在体积分数为75%乙醇溶液中处理30 s,除去根表气泡,然后将其在浓度为1 g/L的升汞溶液中浸泡消毒。此消毒时间需在分离前进行预试验确定,以确保根系表面消毒彻底而又不影响内部微生物存活。将根系样品浸泡消毒完毕后用无菌水冲洗5次,分别放入加有一小勺灭菌石英砂和10 mL无菌水的无菌研钵充分研磨,使根内的微生物释放出来。研磨好的样品采用稀释平皿涂抹法进行分离培养。
1.2.4 微生物分离计数
细菌、真菌和放线菌分离测数均采用稀释平皿涂抹法,所用培养基分别为BPA、PDA及GA,28℃培养,计数后挑取优势菌菌落,纯化、保藏、备用。
1.2.5 优势菌种鉴定
采用酶解法提取细菌、放线菌总DNA[11-13]。用细菌16S rRNA通用引物(27F:5′-AGA GTT TGA TCC TGG CTC AG-3′;1541R:5′-AAG GAG GTG ATC CAG CCG CA-3′)进行PCR扩增,得到长度为1.4—1.5 kp的片段。扩增条件:94℃预变性4 min,94℃变性1 min,57℃退火55 s,72℃延长2 min,变性到延长30个循环,72℃延长10 min,4℃保存。真菌总DNA提取采用CTAB法[14-16]。参照Pryce等方法对rDNA-ITS序列进行PCR扩增[17]。扩增引物采用通用引物ITS1和ITS4,分别为5′-TCC GTA GGT GAA CCT GCG G -3′(ITS1)和5′-TCC TCC GCT TAT TGA TAT GC -3′(ITS4),得到长度为400—500 pb的片段。扩增条件:94℃预变性5 min,94℃变性30 s,50℃退火30 s,72℃延长40 s,变性到延长30个循环,72℃延长10 min,4℃保存。扩增产物胶纯化后送南京金斯瑞生物科技有限公司进行测序。将获得序列校对后,采用BLAST方法从GenBank数据库中调取相关序列,采用CLUSTAL X2.0软件进行同源性分析,采用Mega 4.0软件中Neighbor-Joining方法构建系统进化树。
1.2.6 数据处理与分析
丹参出苗率(%)、死亡率(%)、根结线虫侵染率(%)以及单株根干质量(g/株)的计算:
(1)
(2)
(3)
(4)
腐植酸钾蘸根T0处理、放线菌剂Act12+腐植酸钾配施蘸根处理各指标较对照CK的增率均用ΔCK%表示,用式(5)计算;放线菌剂Act12+腐植酸钾配施蘸根处理各指标较腐植酸钾蘸根T0处理的增率用ΔT0%表示,用式(6)计算。土壤样品中某种优势细菌、真菌及放线菌相对多度用RA表示,用式(7)计算[18]。对照及处理细菌、真菌和放线菌总数量及优势微生物数量最终数值均为2个代表性植株样品(即重复)的测定数据平均值。数据分析用SAS软件进行。
(5)
(6)
(7)
2 结果与分析
2.1 放线菌剂与腐植酸钾配施对丹参的促生作用
由表1、表2可以看出,腐植酸钾单施、放线菌剂与腐植酸钾配施均能提高丹参出苗率并降低根结线虫侵染率。与对照CK相比,单施腐植酸钾T0的丹参出苗率增加1.8%;根结线虫侵染率降低9.9%;根鲜质量、单株根鲜质量、根干质量以及单株根干质量分别增加25.0%(P<0.05)、17.3%(P<0.05)、28.8%以及11.1%。
表1 放线菌剂与腐植酸钾配施对丹参出苗率、死亡率及侵染率的影响
Table 1 Effect of combined actinomycetes with potassium humate on emergence rate, mortality rate and incidence rate ofSalviamiltiorrhizaBge.

处理Treatment出苗率EmergencerateValue/%ΔCK/%ΔT0/%死亡率MortalityrateValue/%ΔCK/%ΔT0/%线虫侵染率IncidencerateValue/%ΔCK/%ΔT0/%对照CK83.5±12.6b——33.1±10.0a——7.1±0.3a——腐植酸钾单施T085.0±10.6b1.8—25.6±9.6ab-22.7—6.4±1.0ab-9.9—Act12与腐植酸钾(1∶9)配施T1085.3±11.2b2.20.419.6±10.4b-40.8-23.45.7±0.9b-19.7-10.9Act12与腐植酸钾(1∶19)配施T2090.8±8.0a8.76.820.2±6.7b-39.0-21.13.6±0.3c-49.3-43.8Act12与腐植酸钾(1∶49)配施T5082.7±12.9b-1.0-2.727.4±8.8ab-17.27.05.3±0.5b-25.4-17.2
Value:测值数据均为平均值±标准差Average value±Standard deviation;ΔCK:单施或配施处理各指标较对照CK的增率Increased rate of potassium humate or combined application with the control treatment;ΔT0:配施处理各指标较腐植酸钾单施T0处理的增率Increased rate of combined application with the potassium humate application treatment; CK:对照The control treatment;T0:腐植酸钾单施Application of potassium humate treatment;T10:Act12与腐植酸钾(1∶9)配施Combined application of actinomycetes Act12 bio-control agents and potassium humate treatment (1∶9);T20:Act12与腐植酸钾(1∶19)配施Combined application of actinomycetes Act12 bio-control agents and potassium humate treatment (1∶19);T50:Act12与腐植酸钾(1∶49)配施Combined application of actinomycetes Act12 bio-control agents and potassium humate treatment (1∶49); 同列数据后标不同小写字母者表示差异显著(P<0.05) Different letters in the same column indicate significant difference (P<0.05)
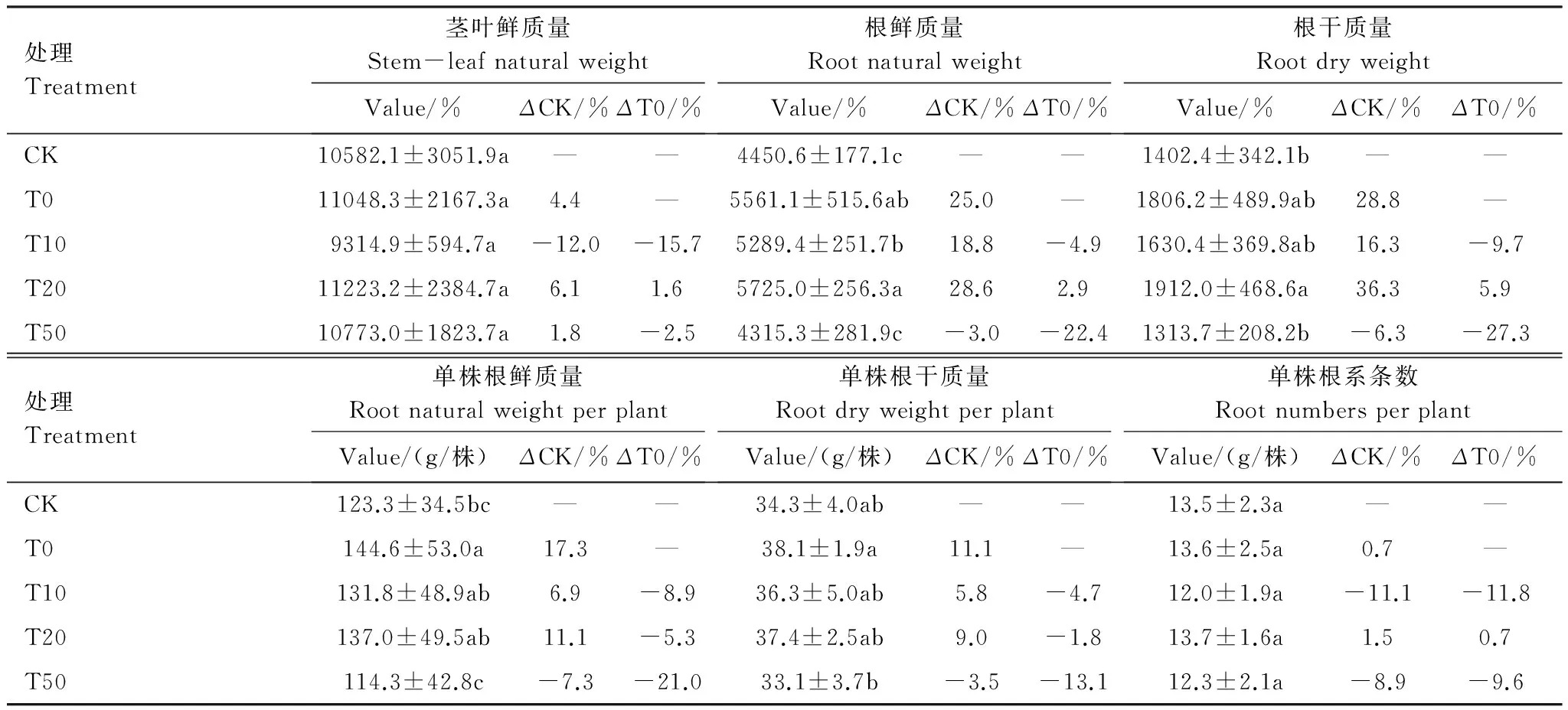
表2 放线菌剂与腐植酸钾配施对丹参生物量的影响Table 2 Effect of combined actinomycetes with potassium humate on biomass of Salvia miltiorrhiza Bge.
从表1、表2看出,菌剂与腐植酸钾配施T20处理各指标的处理效应最好。该处理丹参出苗率较对照CK增加8.7%(P<0.05),收获时的死亡率及线虫侵染率分别较对照CK减少39.0%及49.3%(P<0.05)。根系鲜质量、根系干质量分别较对照CK增加了28.6%(P<0.05)、36.3%(P<0.05),其余指标差异不大。
表1、表2中,ΔT0为菌剂效应。在处理T20(配施比1∶19)中,放线菌剂的作用在3种配施处理中效果最好。丹参出苗率较纯腐植酸钾T0增加6.8%,死亡率及根结线虫侵染率分别较T0降低21.1%及43.8%,根鲜质量较T0增加2.9%(P<0.05),其余指标差异不大。
2.2 放线菌剂处理丹参根域土壤微生物区系
2.2.1 根区土壤
如表3所示,在丹参根区土壤中,与对照CK相比,腐植酸钾单施、放线菌剂与腐植酸钾配施都能明显降低土壤细菌、放线菌数量。单施腐植酸钾T0处理的细菌、真菌和放线菌数量分别较对照CK减少33.3%、5.1%和26.5%;B/F、A/F和B/A值分别较对照CK减少29.4%、23.0%和8.6%。
菌剂与腐植酸钾配施(1∶19)T20处理的细菌和放线菌数量分别较对照CK减少31.3%和20.6%,但真菌数量显著增加52.3%(P<0.05);B/F、A/F以及B/A值分别较对照CK减少56.4%、47.6%以及16.5%。从生防菌剂的效应ΔT0看,菌剂对细菌和放线菌数量影响不大,真菌数量增加59.5%;B/F、A/F值分别增加38.3%、31.9%。

表3 放线菌与腐植酸钾配施丹参根域土壤微生物数量及3大类群组成比例Table 3 Microbial quantities and ratio of the three major microbial groups of S. miltiorrhiza root domain soil
B/F:细菌与真菌数量之比The ratio of bacteria to fungi;A/F:放线菌与真菌数量之比The ratio of actinomycetes to fungi;B/A:细菌与放线菌数量之比The ratio of bacteria to actinomycetes
2.2.2 根表土壤
由表3可以看出,在根表土壤中,腐植酸钾处理可以增加细菌和真菌数量,菌剂与腐植酸钾配施能增加真菌和放线菌数量。
在单施腐植酸钾T0处理中,细菌、真菌数量分别较对照CK增加125.6%、103.3%,放线菌数量差异不明显;B/F、B/A分别增加10.2%、120.7%,A/F减少50.2%。
菌剂与腐植酸钾配施T20处理中,细菌数量变化不大,真菌、放线菌数量分别较对照CK增加133.3%、356.4%(P<0.05)。B/F、B/A值分别降低57.1%、78.4%,A/F值增加95.0%。
从生防菌剂的效应ΔT0看,在T20处理中,菌剂使细菌数量较T0处理减少55.7%,真菌和放线菌数量分别增加14.8%和345.0%;B/F、B/A值分别降低61.1%、90.2%,A/F值增加291.8%。
2.2.3 根系
由表3可知,在丹参根系内,腐植酸钾单施、放线菌剂与腐植酸钾配施都能使细菌数量有所增加。但是,丹参植株根系内未检测到真菌和放线菌存在。
2.3 放线菌处理丹参根域土壤中的优势微生物
采用16S rRNA序列和rDNA-ITS序列分析技术分别对丹参根区、根表土壤样品中的优势细菌、放线菌和真菌种类进行分子鉴定,共获得13株优势菌,其中优势细菌5株,优势真菌2株,放线菌6株(表4)。
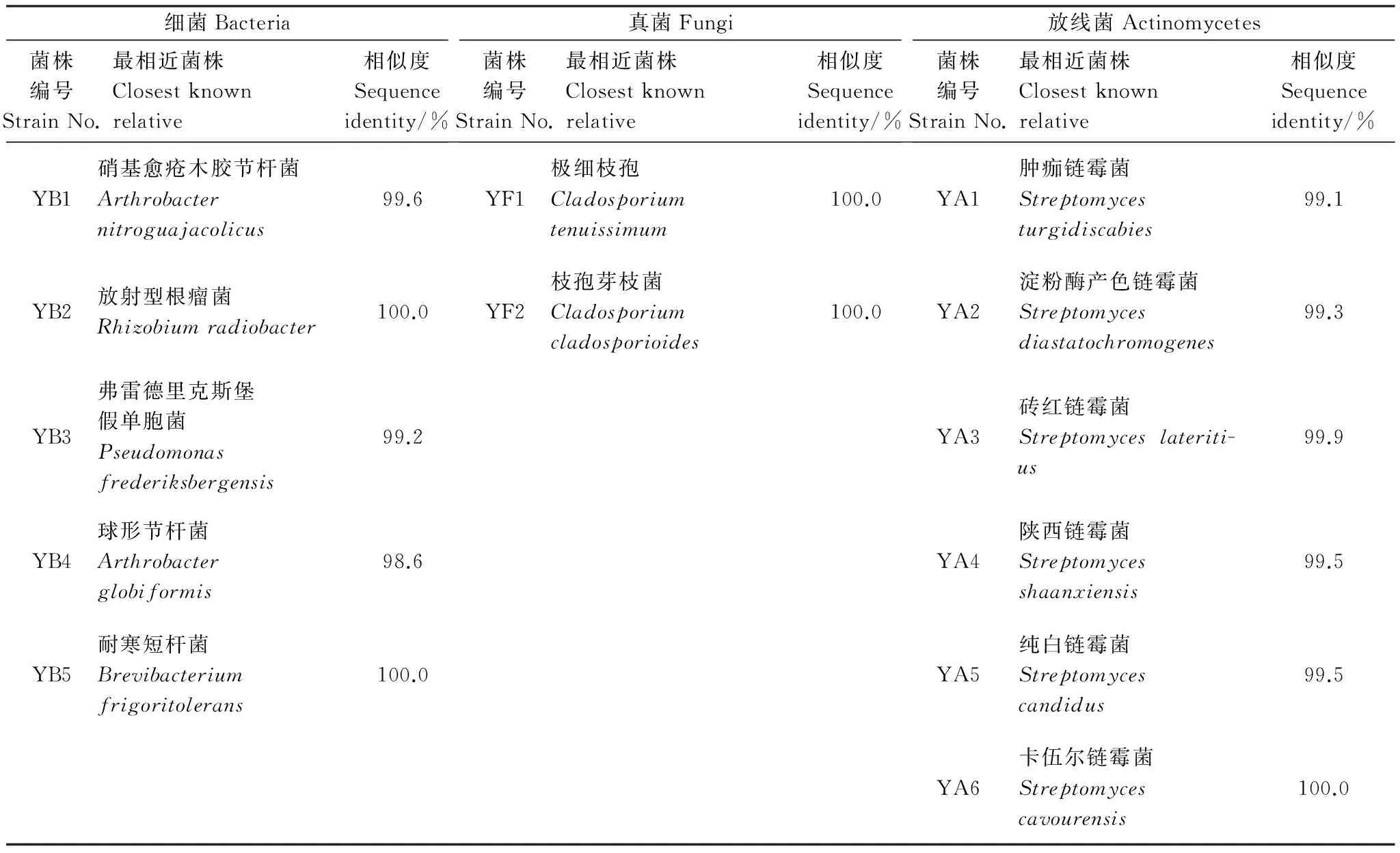
表4 丹参根区根表土壤中的优势微生物Table 4 Identification of the predominant microorganism in S. miltiorrhiza rhizosphere and rhizoplane soils
2.3.1 细菌
由表5可以看出,在根区土壤中,菌剂与腐植酸钾配施T20处理的放射型根瘤菌(R.radiobacter, YB2)数量较腐植酸钾T0处理增加120.0%,较对照CK增加57.1%;弗雷德里克斯堡假单胞菌(P.frederiksbergensis, YB3)数量较腐植酸钾T0处理减少40.0%,较对照CK减少33.3%;球形节杆菌(Ar.globiformis, YB4)和耐寒短杆菌(B.frigoritolerans, YB5)数量较腐植酸钾T0处理分别增加37.1%和50.0%,较对照CK分别减少21.3%和60.0%;菌剂与腐植酸钾配施T20处理较腐植酸钾T0处理各优势细菌相对多度变化与数量变化趋势一致。此外,腐植酸钾T0处理使硝基愈疮木胶节杆菌(A.nitroguajacolicus, YB1)、放射型根瘤菌(R.radiobacter, YB2)、球形节杆菌(A.globiformis, YB4)和耐寒短杆菌(B.frigoritolerans, YB5)数量分别较对照CK减少54.5%、28.6%、42.6%和73.3%。
在根表土壤中,放射型根瘤菌(R.radiobacter, YB2)和球形节杆菌(A.globiformis, YB4)数量在菌剂与腐植酸钾配施T20处理下较腐植酸钾T0处理分别增加211.1%和60.3%,较对照CK分别增加180.0%和48.8%;耐寒短杆菌(B.frigoritolerans, YB5)在菌剂与腐植酸钾配施T20处理下的数量分别较腐植酸钾T0处理和对照CK减少50.0%和55.6%;硝基愈疮木胶节杆菌(A.nitroguajacolicus, YB1)、弗雷德里克斯堡假单胞菌(P.frederiksbergensis, YB3)在菌剂与腐植酸钾配施T20处理下数量分别较腐植酸钾T0处理减少16.7%、68.3%,但是分别达到对照CK的7.5倍、2.4倍。此外,腐植酸钾T0处理的硝基愈疮木胶节杆菌(A.nitroguajacolicus, YB1)、弗雷德里克斯堡假单胞菌(P.frederiksbergensis, YB3)数量分别是对照CK的9倍、7.5倍。

表5 丹参根区、根表土壤优势细菌数量及相对多度RATable 5 Predominant bacteria quantity and relative abundance in S. miltiorrhiza rhizosphere and rhizoplane soils
在丹参根系中,放射型根瘤菌(R.radiobacter, YB2)在菌剂与腐植酸钾配施T20处理中的数量较腐植酸钾T0处理减少16.4%,在对照CK中未检出;弗雷德里克斯堡假单胞菌(P.frederiksbergensis, YB3)在菌剂与腐植酸钾配施T20处理下的数量约为腐植酸钾T0处理的43倍及对照CK的14倍。
硝基愈疮木胶节杆菌(A.nitroguajacolicus, YB1)、放射型根瘤菌(R.radiobacter, YB2)和弗雷德里克斯堡假单胞菌(P.frederiksbergensis, YB3)在丹参根表土壤和根系中的大量存在说明,它们有可能对植株的生长起到了一定的促进作用。
2.3.2 真菌
从表6可知,在丹参根区土壤中,极细枝孢(C.tenuissimum, YF1)和枝孢芽枝菌(C.cladosporioides, YF2)在菌剂与腐植酸钾配施T20处理中的数量分别较腐植酸钾T0处理增加41.6%和96.3%;在腐植酸钾T0处理、菌剂与腐植酸钾配施T20处理中,极细枝孢(C.tenuissimum, YF1)数量分别较对照CK减少54.4%、35.4%,而枝孢芽枝菌(C.cladosporioides, YF2)数量约分别为对照CK的2倍、4倍。
在根表土壤中,极细枝孢(C.tenuissimum, YF1)在菌剂与腐植酸钾配施T20处理中的数量约为腐植酸钾T0处理的2倍,在对照CK中未检测到;枝孢芽枝菌(C.cladosporioides, YF2)在菌剂与腐植酸钾配施T20处理中的数量分别较腐植酸钾T0、对照CK处理减少37.8%、35.8%。

表6 丹参根区、根表土壤中优势真菌数量及相对多度RATable 6 Predominant fungi quantity and relative abundance in S. miltiorrhiza rhizosphere and rhizoplane soils
2.3.3 放线菌
从表7可知,在丹参根区土壤中,肿痂链霉菌(S.turgidiscabies, YA1)、淀粉酶产色链霉菌(S.diastatochromogenes, YA2)和砖红链霉菌(S.lateritius, YA3)在菌剂与腐植酸钾配施T20处理中的数量分别较腐植酸钾T0增加14.3%、23.1%和72.7%,分别较对照CK增加100.0%、68.4%和46.2%;陕西链霉菌(S.shaanxiensis, YA4)、纯白链霉菌(S.candidus, YA5)分别较腐植酸钾T0减少68.8%、63.6%,分别较对照CK减少54.5%、81.0%。
在根表土壤中,砖红链霉菌(S.lateritius, YA3)和陕西链霉菌(S.shaanxiensis, YA4)在菌剂与腐植酸钾配施T20处理中的数量分别较腐植酸钾T0处理增加18.2%和33.3%;肿痂链霉菌(S.turgidiscabies, YA1)、淀粉酶产色链霉菌(S.diastatochromogenes, YA2)和纯白链霉菌(S.candidus, YA5)在菌剂与腐植酸钾配施T20处理中的数量较腐植酸钾T0处理的减少43.2%—100.0%。
腐植酸钾T0、菌剂与腐植酸钾配施T20处理均使砖红链霉菌(S.lateritius, YA3)和陕西链霉菌(S.shaanxiensis, YA4)较对照CK增加20.0%—85.7%;肿痂链霉菌(S.turgidiscabies, YA1)、淀粉酶产色链霉菌(S.diastatochromogenes, YA2)和纯白链霉菌(S.candidus, YA5)在菌剂与腐植酸钾配施T20处理中的数量较对照CK减少47.5%—100.0%;卡伍尔链霉菌(S.cavourensis, YA6)仅在菌剂与腐植酸钾配施T20处理丹参根表土壤中检测到,且其数量高达15.2×105cfu/g。
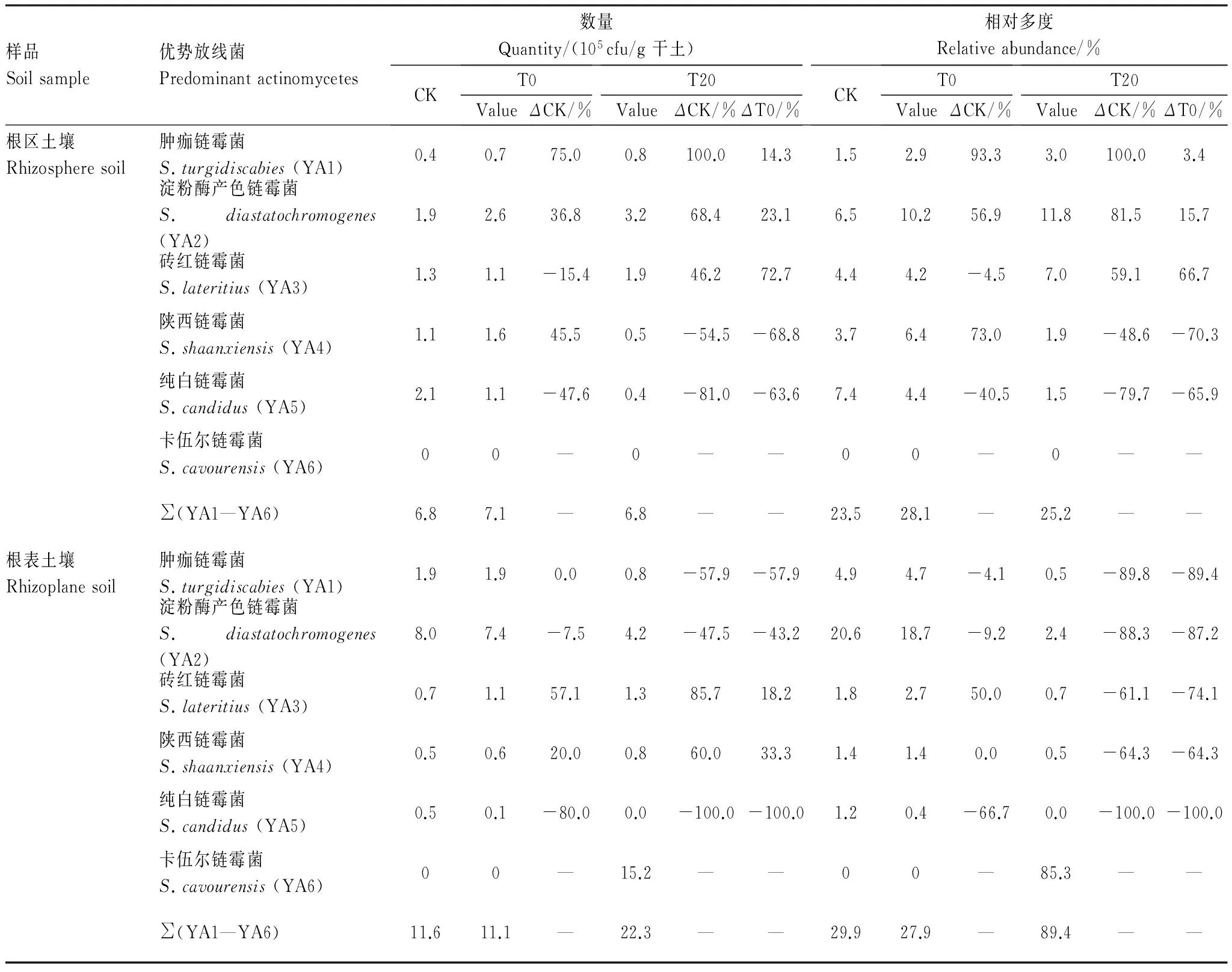
表7 丹参根区、根表土壤中优势放线菌数量及相对多度RATable 7 Predominant actinomycetes quantity and relative abundance in S. miltiorrhiza rhizosphere and rhizoplane soils
3 小结与讨论
根域土壤微生物对作物根系发育及健康生长影响很大,故在植物水分、养分吸收过程中起着非常重要的作用。因此植物能否健康生长与根域微生态系统中的微生物区系结构密切相关。接种生防放线菌可通过增加有益微生物抑制有害微生物改善植株根域土壤微生物区系,调整微生态平衡,形成有利于作物根系健康生长的环境,从而维持或促进植株正常生长。
在利用防病促生活菌制剂防治土传根系病害的研究中,单施菌剂的研究较多,探索菌剂与肥料配合施用效果及机理的研究较少。申光辉研究发现,硅肥与放线菌剂配施可有效改善草莓土壤微生物群落结构,增加土壤细菌、放线菌数量及微生物总数,减少土壤真菌数量,同时提高B/F和A/F值,通过恢复微生物区系平衡,刺激根系生长、增加养分吸收等途径促进草莓生长,提高草莓产量及品质[19]。
腐植酸是一种含有羧基、酚羟基、醌基等多种活性基团的高分子物质,具有改良土壤,提高肥料利用率,促进植物生长的作用[20-22]。研究表明,施用肥料对土壤理化性质以及微生物类群数量有很大影响[23]。施用腐植酸复合肥可以提高细菌、真菌和放线菌数量[24],增加土壤活跃微生物量[25],腐植酸生物活性肥料能够促进土壤有益微生物繁衍,维持其长时间的旺盛生命活动,还能提高多种土壤酶活性,改良培肥土壤,为植物根系营造健康生长的营养环境[26]。曹书苗等发现施入适量的腐植酸钠能显著促进土壤中接入生防放线菌的繁殖,但是用量过大会有一定抑制作用[27]。
本研究结果表明,生防放线菌Act12菌剂与腐植酸钾配施(1∶19)对丹参根结线虫侵染的抑制作用及生物量和产量的增产效应明显优于腐植酸钾单施。其可能的作用机制是:腐植酸钾除了能促进丹参生长外,还可作为接入放线菌的碳源能源物质,促进该菌大量繁殖[27],增加了丹参根区与根表土壤中的有益放线菌数量,强化了有益放线菌的促生防病作用及对根区与根表土壤中微生物区系的调节作用,提高了A/F值,形成了有利于丹参根系健康生长的土壤微生物群落结构。其中,接种放线菌对丹参根区、根表土壤及根系中的优势微生物种类和数量影响很大,其中3株优势细菌硝基愈疮木胶节杆菌(A.nitroguajacolicus, YB1)、放射型根瘤菌(R.radiobacter, YB2)、弗雷德里克斯堡假单胞菌(P.frederiksbergensis, YB3),3株优势放线菌淀粉酶产色链霉菌(S.diastatochromogenes, YA2)、砖红链霉菌(S.lateritius, YA3)和卡伍尔链霉菌(S.cavourensis, YA6)在放线菌处理下数量较多,可能是促进丹参生长的有益微生物。
有研究表明,硝基愈疮木胶节杆菌(A.nitroguajacolicus)可作为油松幼苗菌根围的高效解有机磷细菌[28]。放射型根瘤菌(R.radiobacter)可以合成对多种疾病都有显著疗效的辅酶Q10[29]。弗雷德里克斯堡假单胞菌(P.frederiksbergensis)是一种菲降解菌,具有抗氧化功能,以及有效降解石油污染物的能力[30]。并且后2株细菌都可以定殖于丹参根系内,通过产生活性代谢产物促进植株生长[31]。砖红链霉菌(S.lateritius)对金黄色葡萄球菌(Staphyloccocusaureus)和枯草芽孢杆菌(Bacillussubtilis)有显著抑制作用[32],其代谢产物对革兰氏阳性和阴性菌具有抗菌活性[33]。淀粉酶产色链霉菌(S.diastatochromogenes)是一株可以抑制马铃薯疮痂病以及其他根茎类作物黑星病的链霉菌[34]。卡伍尔链霉菌(S.cavourensis)及其代谢产物对植物病原真菌有明显的抑制作用[35]。由此可知,生防放线菌处理下这3株细菌和3株链霉菌数量的增加,说明它们可能通过抑制部分有害微生物生长,改善微生态环境,促进丹参生长。
在放线菌接种处理中,数量减少的优势细菌耐寒短杆菌(B.frigoritolerans, YB5)和优势放线菌肿痂链霉菌(S.turgidiscabies, YA1)有可能是潜在的有害微生物。研究表明,耐寒短杆菌(B.frigoritolerans)是一种迄今鲜为人知的昆虫病原菌[36]。肿痂链霉菌(S.turgidiscabies)是Miyajima等(1998)发现的一株马铃薯疮痂病新致病种,它可以产生一类特有的植物性毒素(Thaxtomins),对马铃薯等作物危害很大[37]。因此,这2株优势微生物数量的减少表明放线菌剂处理可以抑制有害微生物生长,净化土壤微生态环境,有效减少丹参根系病害发生的风险。
此外,郑晓慧等研究发现四川西昌市发生的石榴叶霉病致病病原为极细枝孢(C.tenuissimum)[38],何平勋和赵连书发现该菌可引起落叶松芽枯病,但对杨树等锈病有一定的防治作用[39]。枝孢芽枝菌(C.cladosporioides)是一种可以侵染小麦的植物病原菌[40],但是该菌还被发现可以与枸杞根系形成共生关系,有效地促进枸杞根系发育,通过提高枸杞叶片气孔导度和光合速率来减轻干旱胁迫的毒害作用[41]。因此,这2株真菌不能简单的对其评价是否有害或有益,需要进一步研究证明。
目前对于有机肥与生防放线菌剂配施促进丹参生长鲜有研究报道。本试验较为系统的研究了腐植酸钾与放线菌剂配施对丹参生长及根域微生态体系的影响,发现菌剂与腐植酸钾配施对丹参具有较为明显的抗病促生作用,特别对降低根结线虫侵染率效果显著;可有效改变丹参根区土壤微生物群落结构。表明腐植酸钾与生防菌剂配施是值得重视和深入研究的菌剂施用方法。值得注意的是,由于丹参个体差异大,尽管腐植酸钾单施及其与菌剂混合施用时丹参根系的干、鲜质量、根结线虫侵染率及成活率等指标与CK差异达到显著水平,但其余指标在统计上仍未达到显著水平,且菌剂效应ΔT0仍较小,表明仍要继续进行更大面积的试验以确认其效果。同时,对腐植酸钾与菌剂配施引起的微生物区系变化的生态效应及有益微生物的促生机理尚需进一步研究。
[1] 冯玲玲, 周吉源. 丹参的研究现状与应用前景. 中国野生植物资源, 2004, 23(2): 4-7.
[2] 段春梅, 薛泉宏, 赵娟, 呼世斌, 陈秦, 王玲娜, 申光辉, 薛磊. 放线菌剂对黄瓜幼苗生长及叶片PPO活性的影响. 西北农业学报, 2010, 19(9): 48-54.
[3] 赵娟, 杜军志, 薛泉宏, 段春梅, 王玲娜, 申光辉, 陈秦, 薛磊. 3株放线菌对甜瓜幼苗的促生与抗性诱导作用. 西北农林科技大学学报: 自然科学版, 2010, 38(2): 110-116.
[4] 段佳丽, 舒志明, 孙群, 魏良柱, 傅亮亮, 薛泉宏, 于妍华. 放线菌剂对丹参生长及有效成分的影响. 西北农林科技大学学报: 自然科学版, 2012, 40(2): 195-200.
[5] 曹书苗. 草莓连作障碍生物防治研究 [D]. 杨凌: 西北农林科技大学, 2009.
[6] 赵娟. 连作甜瓜蔓根真菌病害发生与放线菌生物防治研究 [D]. 杨凌: 西北农林科技大学, 2012.
[7] 申光辉, 薛泉宏, 陈秦, 王玲娜, 赵娟, 薛磊. 硅酸钾与密旋链霉菌Act12菌剂配施对连作草莓生长、果实产量及品质的影响. 中国生态农业学报, 2012, 20(3): 315-321.
[8] 赵娟, 薛泉宏, 王玲娜, 段春梅, 薛磊, 毛宁. 多功能放线菌Act12对土传病原真菌的拮抗性及其鉴定. 中国生态农业学报, 2011, 19(2): 394-398.
[9] 程丽娟, 薛泉宏, 韦革宏, 来航线. 微生物学实验技术 (第二版). 北京: 科学出版社, 2012.
[10] 周永强, 薛泉宏, 杨斌, 张晓鹿, 许英俊, 郭志英, 林超峰. 生防放线菌对西瓜根域微生态的调整效应. 西北农林科技大学学报: 自然科学版, 2008, 36(4): 143-150.
[11] Saito H, Miura K I. Preparation of transforming deoxyribonucleic acid by phenol treatment. Biochimica et Biophysica Acta (BBA)-Specialized Section on Nucleic Acids and Related Subjects, 1963, 72: 619-629.
[12] Moran M A, Torsvik V L, Torsvik T, Hodson R E. Direct extraction and purification of rRNA for ecological studies. Applied and Environment Microbiology, 1993, 59(3): 915-918.
[13] 徐丽华, 李文均, 刘志恒, 姜成林. 放线菌系统学: 原理、方法及实践. 北京: 科学出版社, 2007.
[14] Saghai-Maroof M A, Soliman K M, Jorgensen R A, Allard RW. Ribosomal DNA spacer-length polymorphism in barley: mendelian inheritance, chromosomal location and population dynamics. Proceedings of the National Academy of Sciences of the United States of America, 1984, 81(24): 8014-8018.
[15] 孙广宇, 张雅梅, 张荣. 突脐孢属Brn1基因核苷酸序列比较及系统发育研究. 菌物学报, 2004, 23(4): 480-486.
[16] 刘少华, 陆金萍, 朱瑞良, 戴富明. 一种快速简便的植物病原真菌基因组DNA提取方法. 植物病理学报, 2005, 35(4): 362-365.
[17] Pryce T M, Palladino S, Kay I D, Coombs G W. Rapid identification of fungi by sequencing the ITS1 and ITS2 regions using an automated capillary electrophoresis system. Medical Mycology, 2003, 41(5): 369-381.
[18] 张美庆, 王幼珊, 邢礼军. 我国东、南沿海地区AM真菌群落生态分布研究. 菌物学报, 1998, 17(3): 274-277.
[19] 申光辉. 草莓连作根腐病发生机制与微生物及化学修复研究 [D]. 杨凌: 西北农林科技大学, 2012.
[20] 梁太波, 王振林, 王汝娟, 刘兰兰, 史春余. 腐植酸钾对生姜根系生长发育及活性氧代谢的影响. 应用生态学报, 2007, 18(4): 813-817.
[21] 王汝娟, 王振林, 梁太波, 张晓冬, 刘兰兰, 史春余. 腐植酸钾对食用甘薯品种钾吸收、利用和块根产量的影响. 植物营养与肥料学报, 2008, 14(3): 520-526.
[22] 孙焕顷, 苏长青. 腐植酸钾对黄冠梨土壤肥力的影响. 北方园艺, 2009, (7): 100-101.
[23] 张成林, 刘丽丽. 施用不同肥料对土壤状况的影响. 天津师范大学学报: 自然科学版, 2008, 28(2): 5-7, 10-10.
[24] 杨云马, 薛世川, 夏风召, 贾树龙, 孟春香. 腐植酸复合肥对土壤微生物量的影响. 华北农学报, 2007, 22(S2): 187-189.
[25] 刘兰兰, 史春余, 梁太波, 于海静, 刘凤娟. 腐植酸肥料对生姜土壤微生物量和酶活性的影响. 生态学报, 2009, 29(11): 6136-6141.
[26] 毕军, 夏光利, 毕研文, 张萍, 史桂芳, 朱国梁. 腐殖酸生物活性肥料对冬小麦生长及土壤微生物活性的影响. 植物营养与肥料学报, 2005, 11(1): 99-103.
[27] 曹书苗, 薛泉宏, 邢胜利. 施用有机无机养分对生防放线菌数量的影响. 西北农林科技大学学报: 自然科学版, 2010, 38(10): 210-215.
[28] 员子晶. 油松幼苗菌根围优良磷钾细菌的筛选及对油松的促生作用 [D]. 呼和浩特: 内蒙古农业大学, 2011.
[29] 潘春梅, 堵国成, 陈坚. 辅酶Q10高产菌Rhizobiumradiobacter的选育及发酵条件优化. 过程工程学报, 2004, 4(5): 451-456.
[30] Abdel-Megeed A, Mueller R. Degradation of long chain Alkanes by a newly isolatedPseudomonasfrederiksbergensisat low temperature. Bioremediation, Biodiversity and Bioavailability, 2009, 3(1/2): 55-60.
[31] Duan J L, Li X J, Gao J M, Wang D S, Yan Y, Xue Q H. Isolation and identification of endophytic bacteria from root tissues ofSalviamiltiorrhizaBge. and determination of their bioactivities. Annals of Microbiology, 2013, 63(4): 1501-1512.
[32] 丁栋, 王博禅, 陈桂琛, 王启兰, 彭敏, 史萍. 一株抗肿瘤放线菌的鉴定及生物活性. 应用与环境生物学报, 2012, 18(6): 983-987.
[33] Fleck W F, Strauss D G, Prauser H, Fleck H W F. Naphthochinon-antibiotica ausStreptomyceslateritius. I. Fermentation, isolierung und charakterisierung der granatomycine A, C und D. Zeitschrift für Allgemeine Mikrobiologie, 1980, 20(9): 543-551.
[34] Eckwall E C, Schottel J L. Isolation and characterization of an antibiotic produced by the scab disease-suppressiveStreptomycesdiastatochromogenesstrain PonSSII. Journal of Industrial Microbiology & Biotechnology, 1997, 19(3): 220-225.
[35] 苏林涓, 陈丹, 杨民和. 一株茶树内生放线菌的分离鉴定及抗菌活性测定. 福建师范大学学报: 自然科学版, 2012, 28(3): 94-100.
[36] Selvakumar G, Sushil S N, Stanley J, Mohan M, Deol A, Rai D, Ramkewal, Bhatt J C, Gupta H S.Brevibacteriumfrigoritoleransa novel entomopathogen ofAnomaladimidiataandHolotrichialongipennis(Scarabaeidae: Coleoptera). Biocontrol Science and Technology, 2011, 21(7): 821-827.
[37] Miyajima K, Tanaka F, Takeuchi T, Kuninaga S.Streptomycesturgidiscabiessp. nov. International Journal of Systematic and Evolutionary Microbiology, 1998, 48(2): 495-502.
[38] 郑晓慧, 卿贵华, 钟川. 西昌地区石榴叶霉病的病原鉴定. 植物保护, 2010, 36(1): 131-133.
[39] 何平勋, 赵连书. 极细枝孢(CladosporiumtenuiussimumCooke)研究初报. 吉林林业科技, 1987, (1): 24-28.
[40] Jacyno J M, Harwood J S, Cutler G, Lee M K. Isocladosporin, a biologically active isomer of cladosporin from Cladosporium cladosporioides. Journal of Natural Products, 1993, 56(8): 1397-1401.
[41] 张海涵. 黄土高原枸杞根际微生态特征及其共生真菌调控宿主生长与耐旱响应机制 [D]. 杨凌: 西北农林科技大学, 2011.
Effects of combined application of actinomycetes Act12 bio-control agents and potassium humate on growth and microbial flora in rooting zone ofSalviamiltiorrhizaBge
DUAN Jiali1, XUE Quanhong1,*, SHU Zhiming2, WANG Dongsheng1, HE Fei2
1CollegeofNaturalResourcesandEnvironment,NorthwestAgricultureandForestryUniversity,Yangling712100,China2CollegeofLifeSciences,NorthwestAgricultureandForestryUniversity,Yangling712100,China
This study was to investigate the effects of combined application of actinomycetes Act12 bio-control agents and potassium humate on growth and microbial flora in rooting zone ofSalviamiltiorrhizaBge.Taking conventional transplantation treatment as control, we used root dipping with actinomycetes Act12 bio-control agents and potassium humate to evaluate survival rate, biomass and resistance to root-knot nematode ofS.miltiorrhiza; The abundances of soil bacteria (B), fungi (F) and actionmycetes (A) were determined using the dilution plating technique. Predominant microorganisms were identified using 16S rRNA and ITS sequence analysis. Results were used to evaluate the microecological changes in soil microflora ofS.miltiorrhiza root zones with combined application of actinomycetes Act12 bio-control agents and potassium humate.The results showed that: 1)Under Act12 combined with potassium humate treatment (T20), emergence rate increased by 8.7% compared with the control treatment, and mortality rate decreased by 39.0%; Stem-leaf natural weight, root natural weight, root natural weight per plant, root dry weight and root dry weight per plant were 6.1%、28.6%、11.1%、36.3% and 9.0% higher than the control, respectively. 2)Combined application of Act12 agents and potassium humate can adjust soil microecological balance, modify microflora and microbial community composition. In rhizoplane soil, compared with the control treatment, A/F increased by 95.0% under Act12 combined with potassium humate treatment. InS.miltiorrhizaroots, under Act12 combined with potassium humate treatment, the number of bacteria was 195.0% higher than the control. While fungi and actinomyctes were not detected. 3)In rhizosphere and rhizoplane soil with Act12 and potassium humate, 6 predominant microorganisms might be beneficial, which included 3 bacteria isolates namelyA.nitroguajacolicus,R.radiobacterandP.frederiksbergensis, 3 actinomycetes isolates namelyS.diastatochromogenes,S.lateritiusandS.cavourensis; 2 predominant microorganisms were suspected harmful isolates, included 1 bacteria isolateB.frigoritoleransand 1 actinomycetes isolateS.turgidiscabies. 4)Combined application of Act12 agents and potassium humate may control the disease of root-knot nematode. The disease incidence of root-knot nematode inS.miltiorrhizadecreased by 49.3% under using Act12 agents combined with potassium humate.These results suggested that the combined application of Act12 bio-control agents and potassium humate not only promotedS.miltiorrhizagrowth and yield, but also enhanced plant disease resistance and adjusted soil microecological balance in rooting zone.
SalviamiltiorrhizaBge.; actinomycetes agents; potassium humate; soil microflora; predominant microorganism
长江学者和创新团队发展计划(PCSIRT, IRT0748)
2013-05-23;
日期:2014-04-25
10.5846/stxb201305231154
*通讯作者Corresponding author.E-mail: xuequanhong@163.com
段佳丽,薛泉宏,舒志明,王东胜,何斐.放线菌Act12与腐植酸钾配施对丹参生长及其根域微生态的影响.生态学报,2015,35(6):1807-1819.
Duan J L, Xue Q H, Shu Z M, Wang D S, He F.Effects of combined application of actinomycetes Act12 bio-control agents and potassium humate on growth and microbial flora in rooting zone ofSalviamiltiorrhizaBge.Acta Ecologica Sinica,2015,35(6):1807-1819.

