高寒沙地乌柳防护林碳库随林龄的变化
于 洋, 贾志清,2,*, 朱雅娟,2, 刘艳书,2, 刘海涛, 李清雪
1 中国林业科学研究院荒漠化研究所, 北京 100091 2 青海共和荒漠生态系统定位观测研究站, 海南藏族自治州 813000
高寒沙地乌柳防护林碳库随林龄的变化
于 洋1, 贾志清1,2,*, 朱雅娟1,2, 刘艳书1,2, 刘海涛1, 李清雪1
1 中国林业科学研究院荒漠化研究所, 北京 100091 2 青海共和荒漠生态系统定位观测研究站, 海南藏族自治州 813000
植被恢复是改善脆弱生态系统的有效方式。长期的植被恢复能够提高沙地生态系统的服务功能。以青海共和高寒沙地不同林龄乌柳(Salixcheilophila)防护林生态系统为研究对象,研究植被恢复过程中植被碳库与土壤碳库的动态变化,探讨乌柳防护林生态系统的碳汇功能。结果表明:随林龄增加,乌柳各组分碳浓度变化规律并不显著(P>0.05),而碳贮量显著增加(P<0.05),且不同林龄乌柳各组分碳库的分配比例不同,树干碳贮量占林分碳贮量的百分比最高。各林龄(6、11、16、21a)乌柳林碳贮量分别为4.95、9.93、14.67 t/hm2和21.99 t/hm2。土壤碳库随植被恢复时间的增加而增加,各林龄土壤碳库(0—200cm)分别为9.54、13.03、17.18和19.05 t/hm2。较之6、11a土壤碳库增加26.78%,16a较之11a提高24.16%,21a较16a提高9.82%。地被物层(植被残体)固碳量分别为0.27、0.29、0.33、0.43 t/hm2。不同林龄乌柳林生态系统碳库分别为14.76、23.25、32.18 t/hm2和41.48 t/hm2。各林龄乌柳植被层碳库分别占该林龄总碳库的33.54%、42.71%、45.59%和53.01%,土壤碳库分别占该林龄总碳库的64.63%、56.04%、53.39%和45.93%,而地被物层分别占该林龄总碳库的1.83%、1.25%、1.03%和1.03%。较之恢复前的,各林龄碳库依次增加57.05%、36.52%、27.75%和22.42%。植被恢复各阶段年净碳累积速率分别为1.41、1.70、1.79、1.86 tC hm-2a-1。乌柳防护林生态系统具有“碳汇”功能。
乌柳; 高寒沙地; 碳浓度; 碳贮量; 年龄系列; 碳汇
植被恢复与重建是防治土地荒漠化的有效方式。人工固沙植被具有多种生态服务功能。其中,固碳功能是生态系统的一个非常重要的服务功能。通过开展治沙造林工程,改善了沙地生态系统恶劣的自然环境,提高了沙地生态系统的服务功能,增强了生态系统的物质循环与能量流动。尤其是在气候变化的背景下,研究干旱区生态系统植被的固碳功能,具有重要意义[1-4]。灌木因其地上多分枝的茎与近地的树冠具有很强防风固沙能力,近些年被广泛用于干旱区与半干旱区植被恢复工程中,在生态系统重建过程中扮演者重要角色。灌木林在我国分布范围较广,占我国陆地总面积的五分之一。1982—1999年中国灌丛(215×106hm2)土壤有机碳年均增加(39.4±9.0)Tg,高于森林、草地和农田,可见灌丛是生态系统中重要的碳汇。同时,在陆地生态系统中,灌丛恢复被认为是对碳汇最不确定的因素[5]。土壤是大气二氧化碳的主要碳源,其每年释放近75亿t碳到大气中,所以有效的管理土壤碳库对减少大气中二氧化碳含量有着至关重要的作用。而在生态环境脆弱地区,合理开展防护林建设与植被恢复工程,通过植被实现固碳,是减少碳损耗的有效方式[6]。近些年,减缓并防止生态系统退化,恢复脆弱的生态系统,提高生态系统的服务功能,受到学者们的高度关注。尤其是在脆弱的沙地生态系统,通过植被恢复后,生态系统的固碳功能是如何变化的?生态系统的服务功能是如何改善的?还需开展更为全面的研究。在高寒沙地,通过植被恢复与重建,不仅能够有效的防止沙化的蔓延,更能够提高沙地生态系统的固碳功能。当前,诸多学者分别以中间锦鸡儿(Caraganaintermedia)、黄柳(Salixgordejevii)、小叶锦鸡儿(Caraganamicrophylla)、榆树(Ulmuspumila)疏林、油蒿(Artemisiaordosica)为研究对象,对科尔沁、毛乌素、浑善达克沙地植被恢复过程中生物量与生产力的变化进行了研究[7-10],但围绕海拔高、气温低的高寒沙地,针对典型固沙树种固碳方面的报道较少。
乌柳(SalixcheilophilaSchneid.)为杨柳科柳属多年生落叶灌木或小乔木,是我国特有种,其生命力较强且耐旱抗寒,主要分布于甘肃、西藏、青海、宁夏等地,尤其在环境恶劣的西部地区,发挥着重要的水土保持、防风固沙的功能。当前针对乌柳的报道主要围绕在其群落特征以及水分生理特性等方面[11-12],从生态服务角度出发,对其固碳功能的研究却鲜有报道。在青海省海南州共和盆地,乌柳已成为该地区开展植被恢复的典型树种,表现出较强的适应性,对该地区生态环境的改善发挥着重要作用。在沙地生态系统中,至今未有相关报道。本文以高寒沙地植被恢复区不同林龄乌柳为研究对象,深入研究乌柳防护林生态系统碳库特征,旨在探讨高寒沙地开展植被恢复过程中植被碳库与土壤碳库的变化,为系统评价沙地生态系统的固碳功能提供依据。
1 研究区概况
研究区位于青海省海南州共和县沙珠玉乡,地处共和盆地中西部(100°45′—100°30′E,36°03′—36°30′N),海拔2871—3870 m。属高原温带半干旱草原和干旱荒漠草原的过渡带,干旱、大风、寒冷是其主要的气候特点。年均温2.4 ℃;年均降水量246.3 mm,且季节分配不均,干湿季明显,降水主要集中在5—9月,年均潜在蒸发量1716.7 mm,年均大风日数(风速大于17 m/s)为50.6 d,沙尘暴平均为20.7 d,气候异常干燥;其海拔高气温低的气候条件决定了该地区高寒干旱的自然特征。在植被恢复区内沙丘与丘间地交错分布,主要地貌类型为流动沙丘、半流动沙丘、固定沙丘、丘间低地。该区地带性土壤类型有栗钙土、棕钙土,非地带性土壤有风沙土、草甸土等。
2 研究方法
野外取样及样地设置均在国家林业局青海共和荒漠生态定位观测研究站植被恢复区内进行,选择位于丘间低地的4个林龄(6、11、16、21a)乌柳林样地进行取样,样地特征见表1,同时选择一块造林前的丘间低地(ck,20m×20m)进行对照研究。
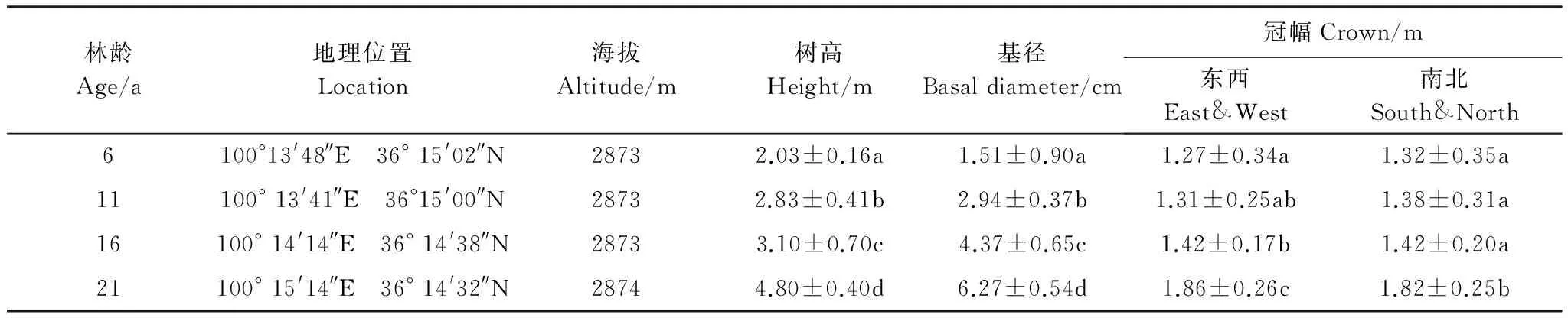
表1 试验地基本特征Table 1 General situation of the experimental site
数值表现为平均值±标准差(每个样方标准株为4株), 同列不同小写字母表示差异显著(P< 0.05)
2.1 不同林龄乌柳人工林生物量的测定
分别在各林龄乌柳林内设置固定样地,样地面积均为20 m×20 m,同时在样地内设置3个10 m×10 m的样方,在每木检尺的基础上,根据树高、基径和冠幅等测树因子,在每个样方内分别选取生长良好且与林分平均测树因子相近的标准木4株。基径(B)范围包括了各林龄样地内所有样木的大小。实测标准株不同组分(树干、树枝、树叶、树皮)的鲜重,带回实验室置于烘箱内,80 ℃烘干至恒重,计算标准株树干、树枝、树叶、树皮不同组分的含水率,进而换算成相应的生物量(同时按不同组分获得烘干样品,进行含碳率的测定)。在此基础上,利用标准木的基径(B)和生物量(W)建立相对生长方程。
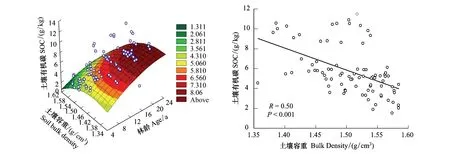
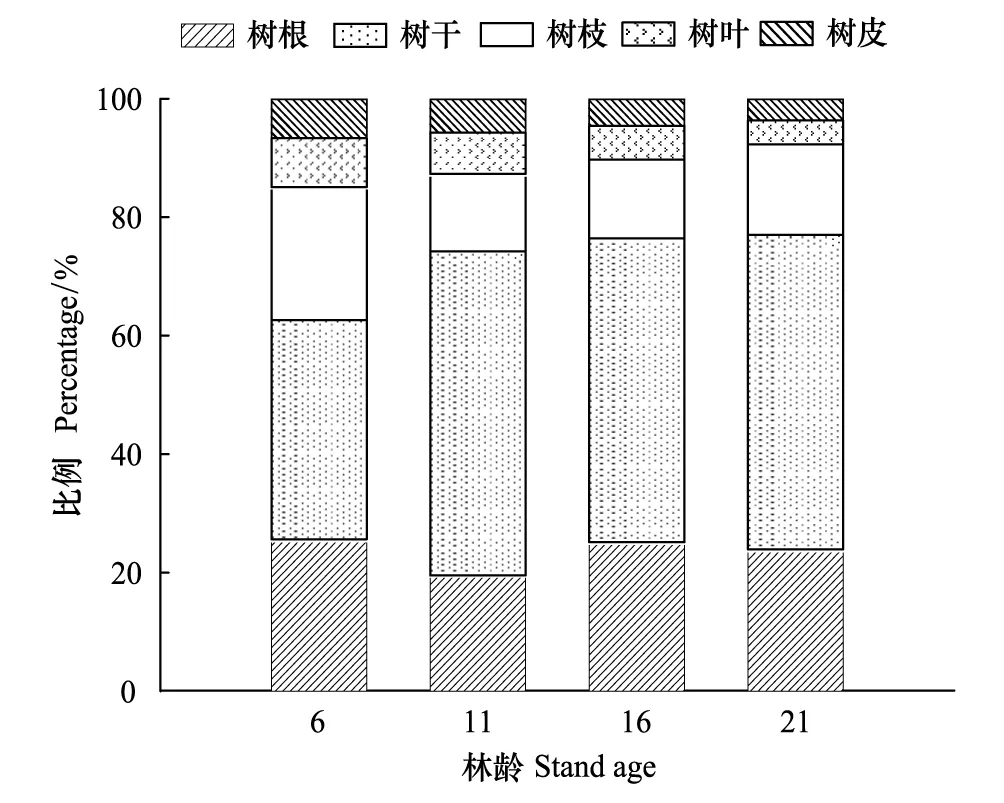
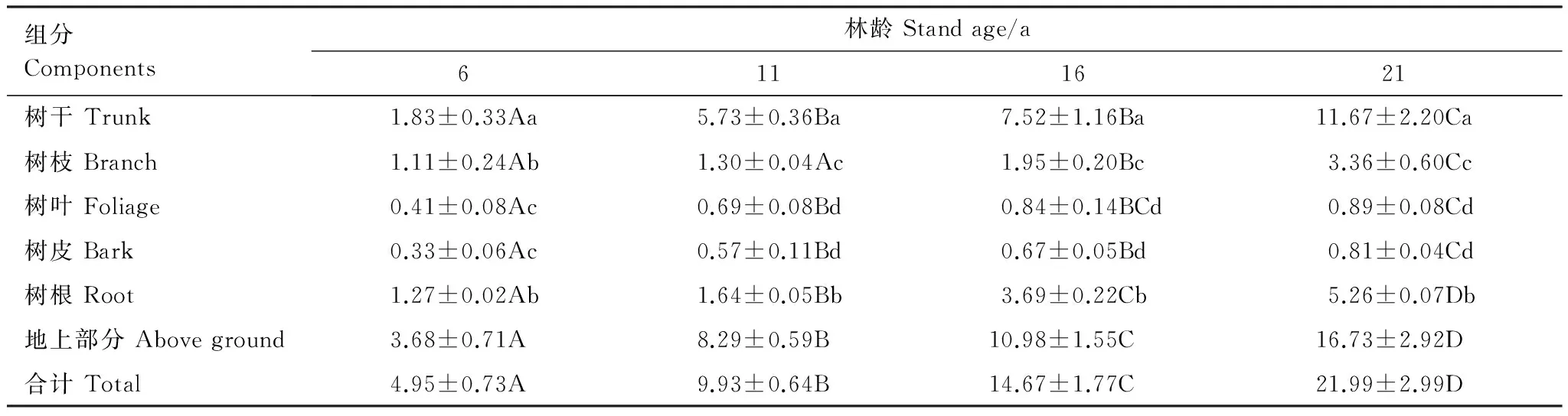
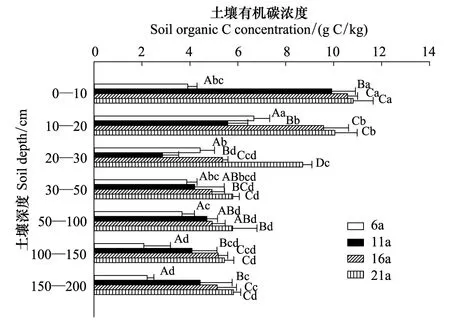
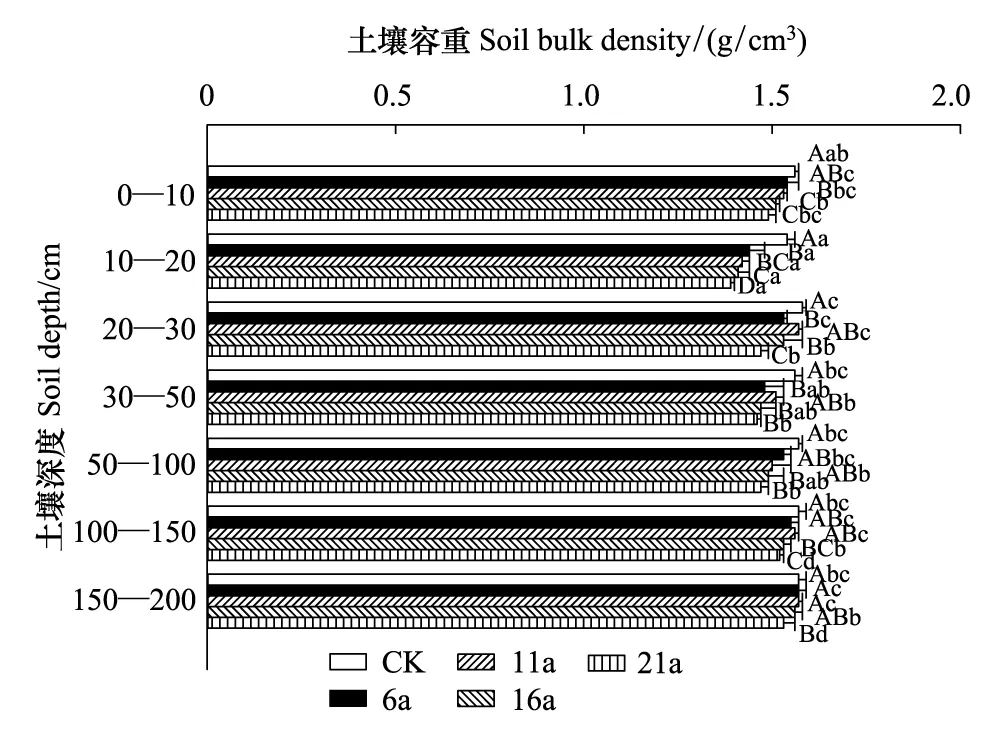
采用分层挖掘法进行根系生物量的测定,当前由于不同树种根系在形态大小上都不同,甚至同一树种在不同立地条件下也不同,对于细根划分还并不明确,长期以来大多数根系研究者按直径大小将根系直径小于或等于2 mm的根系划为细根[13-15]。所以本文结合乌柳林根系剖面分布特征,记录粗根(直径d≥ 5.0 mm)、中根(2.0 mm 乌柳林生物量与基径的相对生长方程为: W干=335.484B0.964(R2=0.9772);W枝=88.156B1.094(R2=0.9413) W叶=88.039B0.434(R2=0.9391);W皮=68.273B0.518(R2=0.9182) W根=131.875B1.173(R2=0.9767) 2.2 不同林龄乌柳人工林林下草本生物量测定 在每个样地的对角线上离4个角各1 m处设置5个1 m×1 m 的记名样方,进行样方调查。记录每个小样方内草本植物的种类、高度、盖度和密度,并统计各草本植物的科、属、种。采用全挖实测法,分地上和地下部分测定其鲜重,同种植物相同器官取混合样品,带回实验室80℃烘干至恒重。 2.3 土壤样品的采集 在各标准株冠幅南缘用土钻采集土壤样品,每个样点分0—10 cm、10—20 cm、20—30 cm、30—50 cm、50—100 cm、100—150 cm及150—200 cm七层进行取样。同一层土壤样品四次重复,四分法取出足够样品,土壤样品去除残留的枯落物后,过0.25 mm筛(研磨后),用于进行土壤碳浓度的测定[18]。 2.4 各组分碳密度的测定以及碳库的计算方法 不同林龄乌柳林各组分碳浓度采用重铬酸钾-水合加热法进行测定,各组分碳密度计算公式如下: 式中,pcd是植被碳密度,Bi是第i组分植被生物量(t/hm2),ci是i组分的植被含碳率。 不同林龄乌柳林土壤有机碳密度计算公式如下[19]: 式中,SOC是土壤有机碳密度(t/hm2),ECi是第i层的土壤有机碳含量,BDi是第i层的土壤容重(g/cm3),Ti是第i层的土壤厚度(cm) 采用SAS9.2软件PROC MIXED(混合线性模型)程序进行数据处理与分析,混合线性模型可不依赖方差分析表计算均方,而直接估算各项随机效应的方差分量。相关数据采用平均值±标准差(Mean ± SD)来表示,同一因素不同水平间差异显著性采用最小显著差数法(LSD)进行检验(显著性水平P< 0.05),采用Sigmaplot12.5软件绘图。 3.1 乌柳器官碳浓度 各林龄乌柳林各组分碳浓度变化情况如图1所示。方差分析说明不同林龄乌柳林同一组分碳浓度差异未达到显著水平(P> 0.05)。6、11、16a和21a各器官碳浓度变化依次为:0.4105—0.5087 gC/g、0.4523—0.5342 gC/g、0.4514—0.5485 gC/g和0.4704—0.5992 gC/g。不同林龄粗根、中根、细根碳浓度变化规律不一致。各林龄根系含碳率变化范围依次为0.4334—0.4690 gC/g、0.4328—0.4717 gC/g、0.4211—0.5030 gC/g和0.4563—0.4784 gC/g。 3.2 植被碳库 乌柳林各组分碳贮量特征见表2。随植被恢复时间的增加,乌柳林各组分碳贮量呈增加趋势。各林龄乌柳碳贮量分别为4.95、9.93、14.67 t/hm2和21.99 t/hm2。各组分碳库分配比例情况见图2。虽然乌柳林各组分碳贮量变化随植被恢复时间的增长而增加,但是各林龄不同组分碳库的分配比例并不一致。6a乌柳树干、树根、树枝、树叶、树皮各组分碳库所占比例分别为36.96%、25.66%、22.42%、8.28%和6.66%。其他3个林龄,树干碳贮量所占比例在50%左右,树根碳贮量所占比例在20%上下,树枝则占10%左右,树皮和树叶碳贮量所占林分碳贮量的百分比则不足10%。各林龄树干碳贮量占林分碳贮量的百分比最高。 图1 不同林龄乌柳人工林各组分碳浓度变化 Fig.1 Variation of carbon concentration of different components in different stand ages of S.cheilophila plantation 图2 不同林龄乌柳人工林各组分碳库分配比例 Fig.2 Carbon storage proportion of different stand ages in S.cheilophila plantation 表2 不同林龄乌柳人工林各组分碳库特征 (t/hm2)Table 2 Carbon storage of different components in different stand ages of S.cheilophila plantation 不同大写字母表示同一组分不同林龄差异显著, 不同小写字母表示同一林龄不同组分差异显著 (P<0.05) 3.3 土壤有机碳浓度 各林龄乌柳林土壤有机碳浓度差异显著(P< 0.05),且同一林龄不同深度变化不同(图3)。具体来说,土壤表层随植被恢复时间的增加,16a与21a之间无显著差异(P> 0.05),但是两林龄显著高于6a和11a(P< 0.05),而11a与6a之间差异显著(P< 0.05),这也与10— 20 cm深度变化相同。20—30 cm各林龄之间差异显著(P< 0.05),21a乌柳林土壤有机碳浓度显著高于其他林龄(P< 0.05)。30—50 cm,21a与16a之间无显著差异(P> 0.05),但是显著高于6a和11a(P< 0.05),16a与6a之间差异亦显著(P< 0.05),但是与11a之间无显著差异。50—100 cm,21a显著高于6a(P< 0.05)但是与11a和16a之间无显著差异(P> 0.05),而6、11a和16a之间差异亦不显著(P> 0.05)。100—150 cm,16a与21a显著高于6a和11a(P< 0.05),但是两者之间无显著差异(P> 0.05),而11a亦显著高于6a(P< 0.05),这也与150—200 cm深度变化相同。 3.4 土壤碳库 不同林龄乌柳土壤容重随深度变化差异显著(P< 0.05),且同一林龄不同深度表现不同(图4)。21a乌柳各深度土壤容重均低于其他林龄。随植被恢复时间的增长,土壤容重逐渐降低。 乌柳林土壤有机碳分布特征见表4。总体来说,土壤碳库随植被恢复时间的增加而增加,较之6、11a土壤碳库增加26.78%,16a较之11a提高24.16%,21a较16a提高9.82%。同一深度不同林龄土壤有机碳密度总体差异显著(P< 0.05)。由于在计算土壤有机碳库时,50 cm以下土层每隔50 cm进行取样,故深层碳密度因取样深度的增加有机碳的含量较高,但若平均到单层,土壤有机碳密度是很小的。具体来说,在0—10 cm,21a显著高于6a和11a(P< 0.05),但是与16a无显著差异(P> 0.05),而16a亦高于6a和11a(P< 0.05),这也与10—20 cm变化相同。20—30 cm,随植被恢复时间的增加,各林龄土壤碳库均差异显著(P< 0.05)。30—50 cm由于取样深度达200 cm,所以整体有机碳库有所增加,21a显著高于6a和11a(P< 0.05)但是与16a无显著差异(P> 0.05),而16a、11a和6a之间亦无显著差异(P> 0.05)。深层土壤有机碳库也有显著差异,50—100 cm,21a显著高于6a(P< 0.05),但是与11a和16a之间无显著差异(P> 0.05),而6a、11a和16a之间亦无显著差异(P>0.05)。100—150 cm,21a显著高于6a和11a(P< 0.05)但是与16a无显著差异(P> 0.05),而6a与11a之间差异亦显著(P< 0.05),这也与150—200 cm深度变化相同。 图3 不同林龄乌柳人工林土壤有机碳浓度特征 (g C/kg)Fig.3 Carbon concentration of different depth in different stand ages of S.cheilophila plantation 图4 不同林龄乌柳人工林土壤容重 (g/cm3)Fig.4 Soil bulk density of different depth in different stand ages at different soil depth 表4 不同林龄乌柳人工林土壤有机碳库特征Table 4 Carbon storage of different depth in different stand ages of S.cheilophila plantation 不同大写字母表示同一深度不同林龄之间差异显著(P<0.05) 3.5 生态系统碳库分配与净生态系统生产力 随植被恢复时间的增加,不同林龄乌柳林碳库变化特征见表5,各林龄碳库分别为14.76、23.25、32.18 t/hm2和41.48 t/hm2。其中乌柳植被层碳库分别为4.95、9.93、14.67 t/hm2和21.99 t/hm2;林下草本层碳库分别为0.27、0.29、0.33、0.43 t/hm2;土壤层(0—200 cm)碳库分别为9.54、13.03、17.18 t/hm2和19.05 t/hm2。各林龄植被层碳库分别占该林龄总碳库的33.54%、42.71%、45.59%和53.01%,各林龄土壤碳库分别占该林龄总碳库的64.63%、56.04%、53.39%和45.93%。而地被物层分别占该林龄碳库的1.83%、1.25%、1.03%和1.03%。较之恢复前(ck),各林龄碳库分别增加57.05%、36.52%、27.75%和22.42%。乌柳林生态系统具有“碳汇”功能。据青海省治沙实验站的记载,植被恢复区乌柳造林总面积为223.2 hm2,按照各林龄生物量碳库的平均值12.795 t/hm2进行计算,则植被恢复区乌柳林固碳量为2855.844 Mg C。 6a、11a、16a和21a乌柳人工林生态系统碳贮量随林龄逐渐增加,各林龄净生态系统生产力分别为2.46、2.11、2.01、1.98 tC hm-2a-1。植被恢复各阶段年净碳累积速率分别为1.41、1.70、1.79、1.86 tC hm-2a-1。各林龄生态系统碳贮量与植被恢复各阶段的净碳累积速率均逐渐增加。 表5 不同林龄乌柳人工林碳贮量的空间分布及变化(t/hm2)Table 5 Spatial distribution of carbon storage and variation in different stand ages of S.cheilophila 灌木是世界上分布最广的植被类型之一,作为陆地生态系统的重要组成部分,尤其是在高寒沙地,灌木是开展生态恢复与防风固沙的首选植被类型。植被的固碳功能是植物能量消耗与累积的主要体现之一,在各器官中的分配方式不仅仅受外界环境影响,同时也与林龄关系密切。不同林龄乌柳林各组分碳贮量不同,说明在高寒沙地,乌柳在不同生长阶段能量积累能力不同,随林龄的增加,能量在乌柳各器官的积累逐渐增加。 随着乌柳林林龄的增加,各组分碳密度变化规律并不明显。各器官碳浓度变化依次为:0.4105—0.5087 gC/g、0.4523—0.5342 gC/g、0.4514—0.5485 gC/g和0.4704—0.5992 gC/g。研究结果与相关学者对我国南方不同乔木类型各器官的碳密度变化范围一致,大都在0.45—0.55 gC/g之间[20]。此外,不同林龄粗根、中根和细根碳浓度变化并不一致。对6a来说,粗根含碳率较高,而11a细根碳密度较大,16a根系含碳率粗根>中根>细根,而21a中根>细根>粗根。可见植被恢复的不同阶段,根系碳密度的变化并不一致。不同林龄根系生物量的置信区间分别为(2.82 ± 0.15)t/hm2、(3.63 ± 0.11)t/hm2、(8.12 ± 0.62)t/hm2和(11.21 ± 0.55)t/hm2,根系的周转会导致植被地下部分碳密度的变化[21]。随生物量的增加,地下部分碳贮量亦逐渐增加。 再来看土壤有机碳的变化,不同林龄乌柳土壤有机碳浓度差异显著(P< 0.05),且同一林龄不同深度变化不同。土壤碳库随植被恢复时间的增加而增加。在干旱半干旱区通过造林以及后续的改进,辅以当年凋落物的分解能够使生态系统碳贮量增加,已经得到广泛的共识[22-23]。本文的研究与Su等人在半干旱区研究固沙灌木锦鸡儿使土壤有机碳显著增加的结果一致,也与Li等学者在科尔沁沙地对蒙古利亚松人工防护林进行的研究一致[24-25]。而对于因土地利用方式改变而造成的土壤有机碳库的变化,不同地区不同学者也开展了相应的研究,人们在阿根廷半干旱区发现土壤有机碳不受造林影响[26],而还有学者在科尔沁沙地研究发现在沙质草地进行小叶杨造林后,土壤有机碳先减小并在15a以后才回到之前草地的水平[27]。此外,人们还发现的当沙地草场转化为森林后并不会导致土壤有机碳的显著增加,直到森林成熟时,才会发生变化[28]。所以不同地区土壤有机碳的变化与不同的生态系统以及所营建的植被类型都密切相关。相关结果表明,土壤有机碳的积累在造林后前几年会逐渐增加,而后增速逐渐减慢,并最终达到平衡[29], 由于本文只选择4个林龄,对乌柳老龄林土壤有机碳库特征需在今后的实验中展开。 在海拔高气温低的高寒沙地,不仅仅在土壤表层,而在深层土壤,土壤有机碳随着植被恢复时间的增长,也发生着相应的改变。这是根系与土壤交互作用的体现。在土壤异质性较强的高寒沙地,土壤容重能够影响土壤入渗、土壤环境以及植株的生长,通过改变土壤结构和机械组成来影响土壤有机质和土壤有机碳含量的改变[30]。由于不同林龄乌柳林的根系随植被恢复时间的增加呈深根性发展,而根系的生长改变了土壤的结构,进而导致了土壤容重发生了改变,而土壤容重对土壤有机碳和有机质含量都会产生影响。以土壤容重作为解释变量,土壤有机碳作为响应变量,进行线性回归,土壤容重的变化显著影响土壤有机碳含量,土壤有机碳含量与土壤容重之间呈显著负相关关系,回归方程可表示为: y=39.129-22.187x(R2=0.247,P<0.001) 不同林龄乌柳林地上部分与地下部分碳库随植被恢复时间的增长而增加。Woodwell对全球2.65×109hm2灌木林以及沙漠灌丛的植被碳贮量的估算结果为27.9 Pg C,平均碳密度为10.5 Mg C/hm2[31]。胡会峰等人对我国主要六种灌丛类型平均碳密度估算结果为10.88 Mg C/hm2[32]。不同灌丛类型之间碳密度差异较大,亚热带、热带酸性土常绿落叶阔叶灌丛碳密度达到17.00 Mg C/hm2,而热带海滨硬叶常绿阔叶灌丛碳密度为5.92 Mg C/hm2。本文对高寒沙地乌柳林生态系统平均碳密度计算结果为12.795 Mg C/hm2,略高于全球灌木林的平均值。较之我国六种典型灌木类型,沙地乌柳林的平均碳密度介于亚热带、热带酸性土常绿落叶阔叶灌丛和热带海滨硬叶常绿阔叶灌丛之间。各林龄乌柳林生态系统碳库分别为14.76、23.25、32.18 t/hm2和41.48 t/hm2,主要由植被层、植被残体以及土壤层组成。植被恢复各阶段年净碳累积速率分别为1.41、1.70、1.79、1.86 tC hm-2a-1。各林龄生态系统碳贮量与植被恢复各阶段的净碳累积速率均逐渐增加。乌柳林具有“碳汇”功能。 图5 不同林龄不同深度乌柳人工林土壤有机碳与土壤容重的关系Fig.5 Relationship between SOC and BD of different stand ages of S.cheilophila plantation 在高寒沙地开展植被恢复与重建,一方面有效的防止了沙化,另一方面增强了沙地生态系统的固碳功能。干旱、半干旱地区沙地生态系统的碳汇功能对未来气候变化影响重大。而灌木是开展植被恢复的主要植被类型,在碳循环过程中,灌木也被认为是不确定的碳汇[33],因此,对干旱半干旱地区灌丛植被的固碳功能进行研究具有重要的意义。在高寒沙地开展植被恢复与重建,有助于提高该地区的碳汇功能,同时为揭示沙地生态系统典型植被类型生物量和生产力,准确的评估沙地生态系统碳源、碳汇以及固碳潜力提供科学依据。 [1〗 Vågen T G, Lal R, Singh B R. Soil carbon sequestration in sub-Saharan Africa: a review. Land Degradation & Development, 2005, 16(1): 53-71. [2] Preger A C, Kösters R, Preez Du C, Brodowsk S, Amelung W. Carbon sequestration in secondary pasture soils: a chronosequence study in the South African Highveld. European Journal of Soil Science, 2010, 61(4): 551-562. [3] Lal R. Carbon sequestration in dryland ecosystems of West Asia and North Africa. Land Degradation & Development, 2002, 13(1): 45-59. [4] Lal R. Carbon sequestration in dryland ecosystems. Environmental Management, 2004, 33(4): 528-544. [5] Piao S L, Fang J Y, Ciais. P, Peylin. P, Huang Y, Sitch S, Wang T. The carbon balance of terrestrial ecosystems in China. Nature, 2009, 458(7241): 1009-1013. [6] 李清河, 江泽平, 张景波, 赵英铭. 灌木的生态特性与生态效能的研究与进展. 干旱区资源与环境, 2006, 20(2): 159-164. [7] Zhao H L, Zhou R L, Su Y Z. Shrub facilitation of desert land restoration in the Horqin Sand Land of Inner Mongolia. Ecological Engineering, 2007, 31(1): 1-8. [8] 李刚, 李永庚, 刘美珍, 蒋高明. 浑善达克沙地稀树疏林草地植被生物量及净初级生产力. 科技导报, 2011, 29(25): 29-37. [9] Shi L, Zhang Z J, Zhang C Y, Zhang J Z. Effects of sand burial on survival, growth, gas exchange and biomass allocation ofUlmuspumilaseedlings in the Hunshandak Sandland, China. Annals of Botany, 2004, 94(4): 553-560. [10] 蒋德明, 唐毅, 李晓兰, 押田敏雄, 李明. 科尔沁沙地灌丛改造的工程措施及效果. 辽宁工程技术大学学报(自然科学版), 2009, 4(1): 131-133. [11] 朱雪林, 黄清麟, 张超, 普布顿珠, 旦增. 西藏乌柳群落特征. 山地学报, 2011, 29(1): 116-122. [12] Liu H T, Jia Z Q, Zhu Y J, Yu Y, Li Q X. Water physiological characteristics and leaf traits of different agedSalixcheilophilaon alpine sandy land. Chinese Journal of Applied Ecology, 2012, 23(9): 2370-2376. [13] Jackson R B, Canadell J, Ehleringer J R, Mooney H A, Sala O E, Schulze E D. A global analysis of root distributions for terrestrial biomes. Oecologia, 1996, 108(3): 389-411. [14] O′grady A P, Worledge D, Battaglia M. Temporal and spatial changes in fine root distributions in a youngEucalyptusglobulusstand in southern Tasmania. Forest Ecology and Management, 2005, 214(1/3): 373-383. [15] 阿尤普木巴热克, 陈亚宁, 李卫红, 郝兴明, 马建新, 苏芮. 极端干旱环境下的胡杨细根分布与土壤特征. 中国沙漠, 2011, 31(6): 1449-1458. [16] 崔秀萍, 刘果厚. 浑善达克沙地黄柳更新特点与规律研究. 中国沙漠, 2012, 32(1): 60-64. [17] 伯姆. 根系研究法. 薛德榕, 谭协麟译. 北京: 科学出版社, 1985. [18] 刘丽颖. 共和盆地两种人工灌木林水分利用策略和生长适应性研究[D]. 北京: 中国林业科学研究院, 2011. [19] Wang Q, Zhang L, Li L, Bai Y, Cao J, Han X. Changes in carbon and nitrogen of Chernozem soil along a cultivation chronosequence in a semi-arid grassland. European Journal of Soil Science, 2009, 60(6): 916-923. [20] 田大伦, 尹刚强, 方晰, 项文化, 闫文德. 湖南会同不同退耕还林模式初期碳密度、碳贮量及其空间分布特征. 生态学报, 2010, 30(22): 6297-6308. [21] 黄建辉, 韩兴国, 陈灵芝. 森林生态系统根系生物量研究进展. 生态学报, 1999, 19(2): 270-277. [22] Grünzweig J M, Lin T, Rotenberg E, Schwartz A, Yakir D. Carbon sequestration in arid-land forest. Global Change Biology, 2003, 9(5): 791-799. [23] Laclau P. Biomass and carbon sequestration of ponderosa pine plantations and native cypress forests in northwest Patagonia. Forest Ecology and Management, 2003, 180(1/3): 317-333. [24] Li Y Q, Awada T, Zhou X H, Shang W, Chen Y P, Zuo X A, Wang S K, Liu X P, Feng J. Mongolian pine plantations enhance soil physico-chemical properties and carbon and nitrogen capacities in semi-arid degraded sandy land in China. Applied Soil Ecology, 2012, 56: 1-9. [25] Su Y Z, Zhang T H, Li Y L, Wang F. Changes in soil properties after establishment ofArtemisiahalodendronandCaraganamicrophyllaon shifting sand dunes in semiarid Horqin Sandy Land, northern China. Environmental Management, 2005, 36(2): 272-281. [26] Nosetto M D, Jobbágy E G, Paruelo J M. Carbon sequestration in semi-arid rangelands: Comparison ofPinusponderosaplantations and grazing exclusion in NW Patagonia. Journal of Arid Environments, 2006, 67(1): 142-156. [27] Hu Y L, Zeng D H, Fan Z P, Chen G S, Zhao Q, Pepper D. Changes in ecosystem carbon stocks following grassland afforestation of semiarid sandy soil in the southeastern Keerqin Sandy Lands, China. Journal of Arid Environments, 2008, 72(12): 2193-2200. [28] Chen F S, Zeng D H, Fahey T J, Liao P F. Organic carbon in soil physical fractions under different-aged plantations of Mongolian pine in semi-arid region of Northeast China. Applied Soil Ecology, 2010, 44(1): 42-48. [29] 田大伦, 李雄华, 罗赵慧, 闫文德. 湘潭锰矿废弃地不同林龄栾树人工林碳储量变化趋势. 生态学报, 2014, doi: 10.5846/stxb201308022009. [30] Throop H L, Archer S R, Monger H C, Waltman S. When bulk density methods matter: Implications for estimating soil organic carbon pools in rocky soils. Journal of Arid Environments, 2012, 77: 66-71. [31] Woodwell G M, Whitaker R, Reiners W A, Likens G E, Delwiche C C, Botkin D B. The biota and the world carbon budget. Science, 1978, 199 (4325): 141-146. [32] 胡会峰, 王志恒, 刘国华, 傅伯杰. 中国主要灌丛植被碳储量. 植物生态学报, 2006, 30(4): 539-544. [33] Goodale C L, Davidson E A. Carbon cycle: Uncertain sinks in the shrubs. Nature, 2002, 418(6898): 593-594. Changes of carbon pools of alpine sandySalixcheilophilashelterbelts with stand age YU Yang1, JIA Zhiqing1,2,*, ZHU Yajuan1,2, LIU Yanshu1,2, LIU Haitao1, LI Qingxue1 1InsitituteofDesertificationStudies,ChineseAcademyofForestry,Beijing100091,China2QinghaiGongheDesertEcosystemResearchStation,HainanTibetanAutonomousPrefecture813000,China Re-vegetation is an effective way to eliminate the fragile ecosystems. Long-term vegetation restoration can promote the ecosystem services of the sandy land. In the present study,Salixcheilophila, a typical sand-fixing shrub species in the Gonghe Basin, Qinghai Province, was used to investigate the variations of biomass and carbon concentrations in different plant organs and soil depth. Meanwhile, the changes of carbon pools with different stand age (6-,11-,16-,and 21-year old,) were calculated during the re-vegetation process. Characteristics of carbon sequestration ofSalixcheilophilaplantation ecosystem were discussed. The results indicated that: (1) The total tree biomass increased with the increasing of stand ages. The carbon concentrations among each component showed no significant difference with the increment of restoration time (P>0.05), while the carbon storage increased significantly with stand ages (P<0.05). The proportions of carbon pools of different components varied in different stand ages. The carbon storage in the trunk took up the highest percentage compared with all the other components. The carbon storage of 6-, 11-, 16-, and 21-year old stand were 4.95, 9.93, 14.67 and 21.99 t/hm2, respectively. The variation of carbon density in different organs ranged from 0.4105 to 0.5087 gC/g for 6-year old stand, from 0.4523 to 0.5342 gC/g for11-year old stand, from 0.4514 to 0.5485gC/g for 16-year old stand, and from 0.4704 to 0.5992 gC/g for 21-year old plantation. The variations of carbon density among the coarse root, middle root and fine root were different in different stand ages. The root biomass of each stands was 2.82, 3.63, 8.12 and 11.21 t/hm2, respectively. The carbon storage underground also increased gradually with the increasing of biomass. (2) The soil organic carbon pools exhibited significant difference in the same depth of different ages (P<0.05). The soil carbon pools were 9.54, 13.03, 17.18 and 19.05 t/hm2, increased with the restoration time. The soil carbon pools of 11-year old stand increased 26.78% compared to the 6-year old stand; the 16-year old stand increased 24.16% compared to the 11-year old stand; and the 21-year old stand increased 9.82% compared to the 16-year old stand. The carbon storage of litter layers were 0.27, 0.29, 0.33 and 0.43 t/hm2for each stands, respectively. The ecosystem carbon pools were 14.76, 23.25, 32.18 and 41.48 t/hm2for each stands. (3) The vegetation layer accounted for 33.54%, 42.71%, 45.59% and 53.01% of the total carbon pools; the soil layer accounted for 64.63%, 56.04%, 53.39% and 45.93% and the litter layer accounted 1.83%, 1.25%, 1.03% and 1.03%, respectively. (4) The carbon pools increased 57.05%, 36.52%, 27.75% and 22.42% compared with those before re-vegetation. The net carbon accumulation rates were 1.41, 1.70, 1.79 and 1.86 tC hm-2a-1. As a result, the artificial shelterbelt ofS.cheilophilaplantation could be considered as a “carbon sink”. The study may provide scientific references for sustainable shelterbelts resource management and carbon sink shrubland development during vegetation restoration in the fragile alpine sandy ecosystem. Salixcheilophila; alpine sandy; carbon concentration; carbon storage; stand age; carbon sink 国家林业公益性行业科研专项(201204203) 2013-05-27; 日期:2014-07-18 10.5846/stxb201305271202 *通讯作者Corresponding author.E-mail: Jiazq@caf.ac.cn 于洋, 贾志清, 朱雅娟, 刘艳书, 刘海涛, 李清雪.高寒沙地乌柳防护林碳库随林龄的变化.生态学报,2015,35(6):1752-1760. Yu Y, Jia Z Q, Zhu Y J, Liu Y S, Liu H T, Li Q X.Changes of carbon pools of alpine sandySalixcheilophilashelterbelts with stand age.Acta Ecologica Sinica,2015,35(6):1752-1760.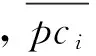
3 结果与分析
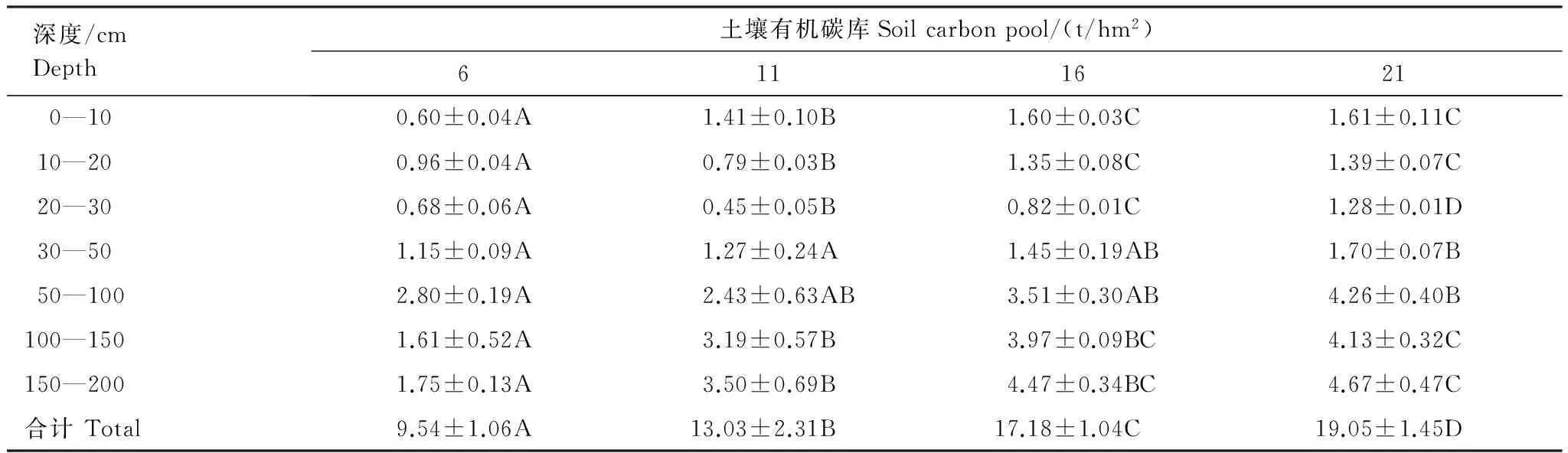
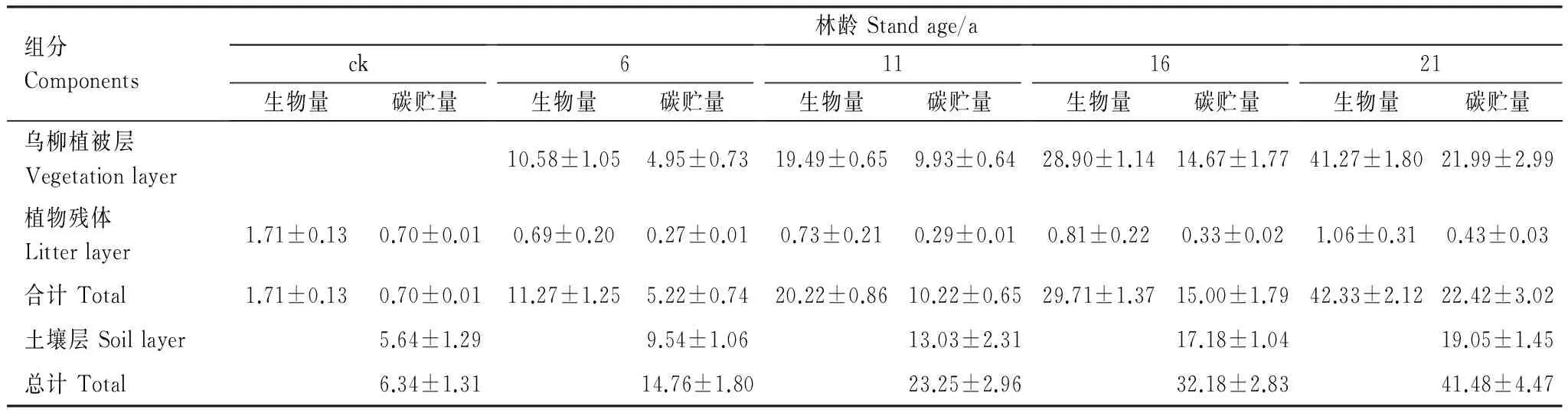
4 结论与讨论