林木分化对兴安落叶松异速生长方程和生物量分配的影响
李 巍, 王传宽, 张全智
东北林业大学生态研究中心, 哈尔滨 150040
林木分化对兴安落叶松异速生长方程和生物量分配的影响
李 巍, 王传宽*, 张全智
东北林业大学生态研究中心, 哈尔滨 150040
林木因对资源竞争而产生分化,从而影响林木的异速生长方程和生物量分配,但其影响程度还不清楚。采用林木相对直径法将38株兴安落叶松(Larixgmelinii)样木在林分中的分化等级分为优势木、中等木和被压木,量化林木分化对林木异速生长方程和生物量分配的影响。结果显示:生物量组分异速生长方程多以胸径(DBH)为自变量为好,但以枝下高处的树干直径为自变量估测其枝、叶生物量时更精确。在一定的胸径范围内,同一胸径下不同林木分化等级的地下部分各组分生物量没有显著差异(P>0.05),但优势木分配更多的生物量给枝和叶,中等木比优势木分配更多的生物量给树干,中等木比被压木分配更多的生物量给地上部分,而且被压木和中等木的树高显著高于优势木。除根茎生物量之外,不同林木分化等级的生物量组分(包括枝、叶、树干和根系)的相对分配比例无显著差异(P>0.05),根冠比保持相对稳定。这些结果表明,主要由竞争而引起的林木分化改变了兴安落叶松地上生物量组分的异速生长和分配,但其相对分配格局较为保守。
林木分化; 异速生长方程; 生物量分配; 竞争; 优势木; 被压木
森林拥有陆地生态系统最大的碳库,储存了约80%的地表碳[1]和40%的地下碳[2]。森林生物量占全球陆地植被生物量的73%,其总初级生产力约占全球陆地生态系统总量的一半[3]。因此,森林在全球碳循环中起着重要的作用,而森林生物量的精确估测是森林固碳效应正确评价的基础[4]。目前,森林生物量的估测方法包括皆伐法、标准木法、异速生长方程法、生物量转换因子法、遥感估测法等,各有其优缺点[5]。其中,异速生长方程法通过建立相对容易测量的变量(如胸径、树高)与树木生物量的关系估测生物量组分以及森林生产力[6],不但精确度较高,而且能有效地降低对森林植被的破坏性取样[7],因而成为应用最为广泛的森林生物量测定方法。例如,Ter-Mikaelian和Korzukhin综合了北美66种温带树种的异速生长方程[8];Wang建立了包括兴安落叶松在内的10种中国温带森林主要树种的异速生长方程[9]。
树木的生长及其生物量分配受许多因素的影响,如林龄、样地特征、林木密度、林木分化等级等[10-11]。在郁闭林分内,由于林木对有限的光、水、养分等资源的竞争而产生了分化[12],其相对大小或冠层位置常用优势木、中等木、被压木等林木等级来描述[13]。优势木处于林冠上层,因光照充足而光合作用强,同时也因干燥风大而耗水量大[14];相反,被压木位于林冠下层,主要受光照限制而生长衰退,最终死亡而产生林分自然稀疏现象[15-16]。因此,不同等级的林木,其异速生长、木材密度、树木结构等均有差异[17],最终影响林木的异速生长方程和生物量分配[18]。例如,Naidu[19]研究发现,直径相同的火炬松(Pinustaeda)的被压木分配到树干的生物量比优势木多,而分配到枝、叶的生物量比优势木少。Peri[10]研究报道,中等立地上160年生假山毛榉(Nothofagusantartica)优势木的整株生物量为336 kg/株,而被压木仅为47 kg/株。Wang[9]分析量化了采用异速生长方程法估算中国温带森林主要树种生物量的一些误差来源,诸如自变量选取、特定树种与混合树种模型、不同组分生物量估测误差等,但尚未量化林木分化对树木异速生长方程及生物量分配格局的影响。
兴安落叶松(Larixgmelinii)是寒温带针叶林的建群种,也是东北地区速生造林树种,其林分面积和蓄积分别占我国寒温带有林地面积和蓄积量的55%和75%[20],因此在我国森林碳汇研究中有重要意义。为此,本研究运用全树收获法将38株兴安落叶松全部收获,测定其地上和地下生物量组分,同时采用林木相对直径法[21]将样木分为优势木、中等木和被压木,旨在比较建立不同林木等级的兴安落叶松生物量异速生长方程,量化林木等级对生物量分配格局的影响,为东北森林群区的碳计量提供数据基础和理论依据。
1 研究方法
1.1 研究区概况和样地设置
研究区位于黑龙江帽儿山森林生态定位研究站(45°24′N, 127°40′E)。平均海拔400 m,平均坡度10°—15°。地带性土壤为暗棕色森林土。该地区气候属于大陆性温带季风气候,四季分明,夏季短促而湿热,冬季寒冷干燥;年均降水量629 mm,年均蒸发量864 mm,年平均温度3.1℃。1月份、7月份的平均气温分别为-18.5℃和+22.0℃。早霜出现在8月末,晚霜出现在5月末,无霜期为120—140d。植被属于长白山植物区系,现有植被是原地带性植被(阔叶红松林)受到多次人为干扰(采伐、火烧、开垦等)后演替成的天然次生林和人工林,代表了东北东部山区典型的森林类型[9]。
1.2 生物量测定
本研究选择15 m × 20 m的兴安落叶松人工林,将样地内31株兴安落叶松全部收获,用林木相对直径方法确定样木的林木分化等级[21]。与此同时,在相同立地条件下,用林木相对直径方法选取小径级的优势木和大径级的被压木(共7株)。每木检尺后,将38株样木分成优势木、中等木、被压木3个等级(表1),采用全树收获法测定林木各组分生物量。
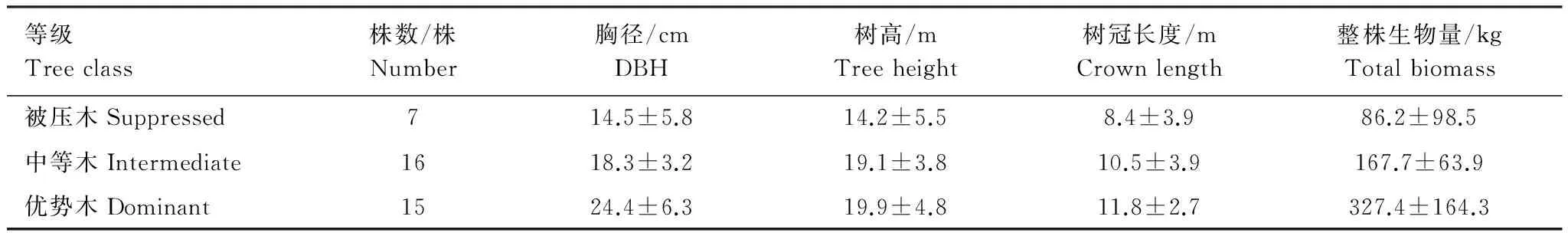
表1 样木基本特征值Table 1 Basic characteristics of the sampled trees
数值为平均值±标准差The numbers are mean±SD
样木伐倒前,测量其冠幅(分成8个方位:东、南、西、北、东南、东北、西南、西北)、胸径(DBH)和距基部10cm处直径(DH10);样木伐倒后,测量其树高(H)、枝下高(HB)、枝下高处直径(DHB)以及树高10%处直径(DH10%)。
将整个树冠分成冠上、冠中、冠下三层测定枝、叶生物量。 将树枝从树干分离后,按长枝、短枝、长枝叶、短枝叶分开后分别测定鲜重,其中短枝、短枝叶、长枝叶分别取样500—1000g,长枝取样1000—2000g。每个冠层、每个组分取样3个重复;样品4 h内放入65℃[22]恒温箱中烘干至恒重,测定样品含水率以计算枝、叶生物量干重。
将树干按1m区分段截取,测定其鲜重,并在一端截取5cm厚圆盘1个,测定圆盘鲜重后在65℃恒温下烘干至恒重,测定样品含水率以计算树干生物量干重。
采用滑轮装置和手动挖掘相结合的方法将样木的粗根(>5mm)和细根(<5mm)全部挖出[9],测定粗根和细根总鲜重,分别取样500—1000g,3个重复;将样品置于65℃恒温下烘干至恒重,测定样品含水率以计算根系生物量干重。
1.3 数据分析
以往有关树木异速生长研究中采用的异速生长方程形式有多种,其中幂函数关系最常见[23]。为了满足齐差性,常将幂函数取对数作线性化[8,24-25]。许多树木异速生长方程包括直径和树高两个自变量,但我们前期研究表明,林木树高测定难度大、精度较低,而且与DBH有极显著的相关性;虽然在异速生长方程添加树高对生物量变异性的解释率达到显著水平(P<0.05),但其贡献率通常低于4%[9]。为此,本文建立异速生长方程:
log10W=a+b(log10D)
式中,W为各组分生物量,D为直径,并根据R2和SEE[9, 25]来选择最佳方程。采用协方差分析(ANCOVA)比较分析不同林木分化等级的异速生长方程的斜率和截距的显著性差异[19]。统计分析采用SPSS 18.0统计软件完成。
2 结果
2.1 生物量异速生长方程的自变量选择
以胸径、距基部10cm处直径、枝下高处直径、树高10%处直径为自变量,分别拟合各组分生物量异速生长方程,R2波动在0.589—0.959之间,而SEE波动在0.085—0.246之间(图1)。基于胸径的整株生物量方程最优,基于距基部10cm处直径的叶生物量方程最差。树干生物量、根茎生物量、细根生物量、整株生物量均以基于胸径的生长方程的拟合精度最高;枝、叶生物量以基于枝下高处直径的生长方程的拟合精度最高。
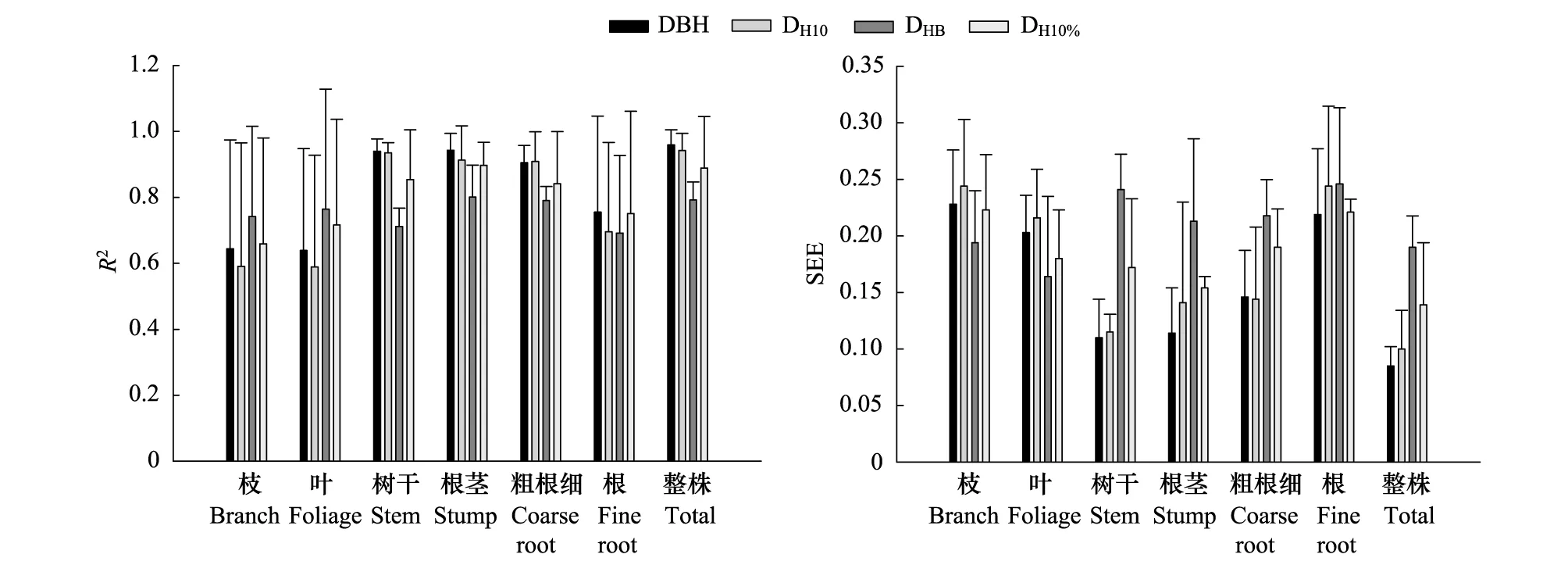
图1 基于不同高度树干直径拟合各组分生物量异速生长方程的决定系数(R2)和标准估计误差 (SEE)Fig.1 Coefficients of determination and standard error of estimate in models log10W= a +b(log10D) for each component biomass (W) with stem diameters at different tree heights (D)
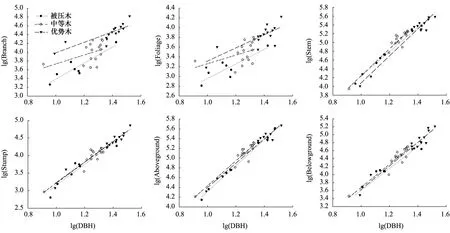
图2 不同林木分化等级的树干直径与各组分生物量之间的关系Fig.2 Relationships between each component biomass and stem diameters for different tree differentiation classes
2.2 林木分化等级对生物量异速生长方程的影响
林木分化等级对兴安落叶松根茎、地下部分生物量与DBH之间的异速生长方程的斜率和截距均无显著影响(图2,P>0.05),但对其枝、叶、树干、地上部分生物量与DBH之间的异速生长方程的截距有显著影响(P<0.05)。在样木DBH范围内,对某一特定DBH的林木的枝、叶生物量而言,均存在优势木>中等木>被压木的趋势;对树干生物量而言,被压木与中等木,被压木与优势木均无显著差异(P>0.05),中等木与被压木有显著差异(P<0.05;中等木>优势木),中等木比优势木分配更多的生物量给树干;对地上部分生物量而言,优势木与被压木,优势木与中等木均无显著差异(P>0.05),中等木与被压木有显著差异(P<0.05;中等木>被压木),中等木比被压木分配更多的生物量给地上部分。
不同林木分化等级的总根生物量与整株生物量,地上部分生物量与地下部分生物量之间的相对生长方程斜率和截距均无显著差异(P>0.05;图3)。
不同林木分化等级的胸径与树高相对生长方程,优势木与被压木,优势木与中等木的斜率存在显著差异(P<0.05),被压木与中等木无显著差异(P>0.05)。对某一特定DBH林木,被压木和中等木的树高显著高于优势木。枝生物量与整株生物量相对生长方程,被压木与优势木,中等木与优势木的截距存在显著差异(P<0.05)。被压木与中等木无显著差异(P>0.05),对某一特定整株生物量的林木,优势木比被压木和中等木分配更多的生物量给枝。叶生物量与整株生物量相对生长方程,被压木与优势木,中等木与优势木的斜率存在显著差异(P<0.05),被压木与中等木无显著差异(P>0.05),对某一特定整株生物量的林木,优势木比被压木和中等木分配更多的生物量给叶。被压木与优势木的树干生物量与整株生物量相对生长方程的斜率和截距均有显著差异(P<0.05),中等木与被压木,中等木与优势木的斜率和截距均无显著差异(P>0.05)。在整株生物量小时,被压木比优势木分配更多的生物量给树干;达到一定整株生物量时,优势木比被压木分配更多的生物量给树干。叶生物量与总根生物量相对生长方程,被压木与中等木截距无显著差异(P>0.05),优势木与被压木和中等木截距有显著差异(P<0.05)。对某一特定总根生物量林木,优势木比被压木和中等木分配更多的生物量给叶。短枝生物量与枝生物量相对生长方程,被压木与中等木和优势木截距均有显著差异(P<0.05),中等木与优势木无显著差异(P>0.05)。对某一特定枝生物量林木,被压木与中等木和优势木相比,分配更少的生物量给短枝。
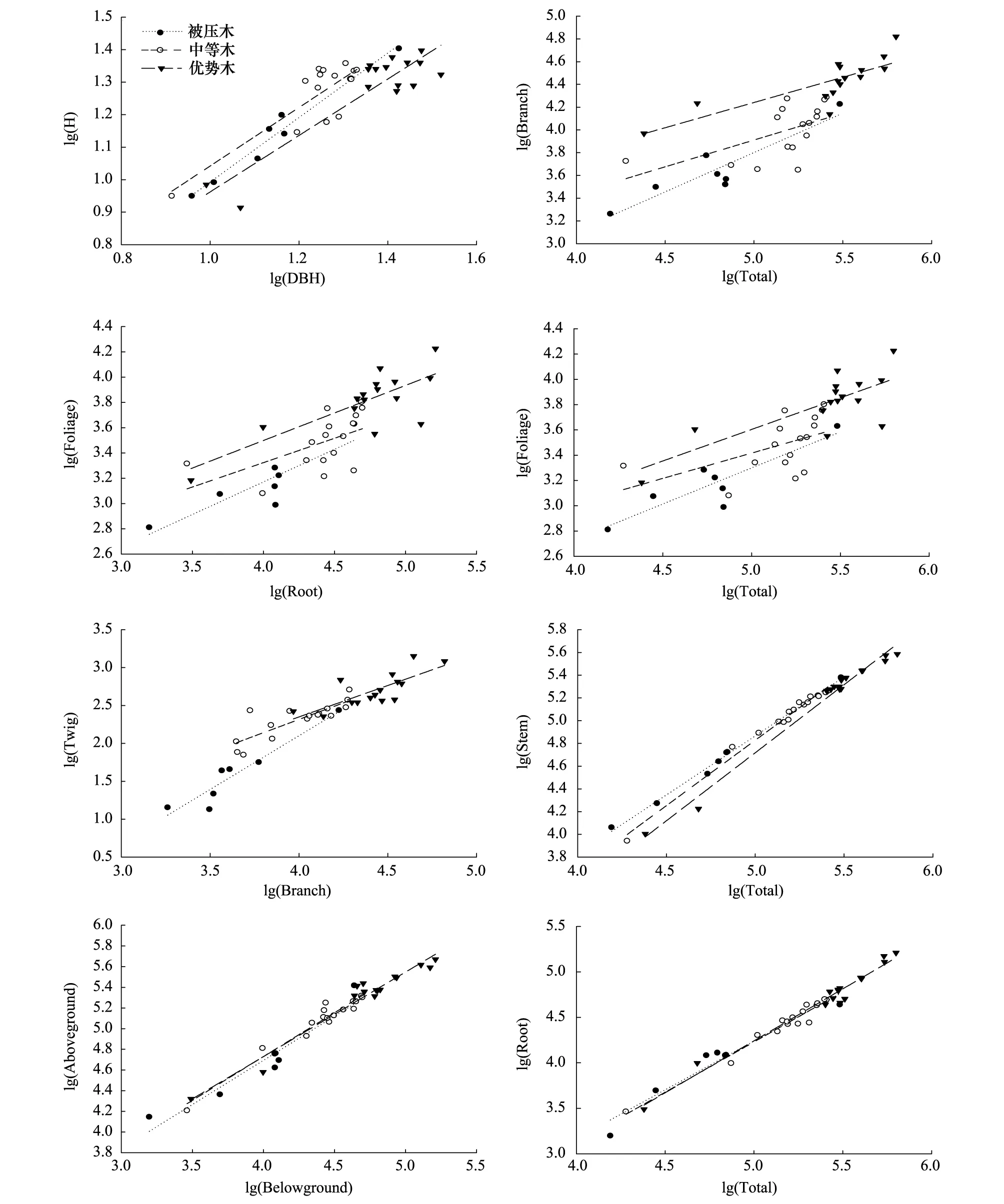
图3 不同林木分化等级各组分生物量的关系Fig.3 Relationships between each component biomass for different tree differentiation classes
2.3 林木分化等级对生物量分配的影响
将所有样木(不分等级共38株)综合分析:枝生物量、叶生物量、树干生物量、根茎生物量、根系生物量(包括粗根和细根)占整株生物量的相对百分比分别为:(9.7±7.8)%、(2.7±2.0)%、(68.9±9.7)%、(7.1±1.7)%和(11.7±2.8)%,其中树干生物量占的比例最大、叶生物量占的比例最小(图4)。采用Duncan检验比较表明:优势木与中等木和被压木的根茎生物量相对分配比例存在显著差异(P<0.05),而中等木与被压木的根茎生物量无显著差异(P>0.05)。不同等级的枝生物量、叶生物量、树干生物量和根系生物量相对分配比例无显著差异(P>0.05)。
将被压木和优势木胸径均标准化为9cm左右比较,整株生物量分别为15546、24015g;其中比例差异最显著的组分是树枝和树干(图5)。优势木的枝生物量占整株生物量的38.7%,而被压木仅为11.7%;优势木的树干生物量占整株生物量的42.1%,而被压木却达73.0%。
3 讨论
3.1 生物量异速生长方程的自变量选择
虽然有学者建议采用不同高度的树干直径作为自变量建立树木生物量异速生长方程,如0.3m处树干直径[26]、10%树高处的树干直径[27],但绝大多数文献报道的异速生长方程是建立在DBH基础上的[8-9]。本研究采用4个不同高度的树干直径作为自变量(即DBH、距树干基部10cm处直径、枝下高处直径、树高10%处的直径)拟合不同生物量组分的异速生长方程。结果发现,除了枝、叶和粗根之外的其他组分均以DBH作为自变量的拟合效果最好(图1),这与前人研究结果一致[28-29]。而枝、叶生物量的异速生长方程不但R2最低,而且变异性最大(图1),反映了枝、叶受生物和非生物因子(如林龄、光照、水分、温度、营养及土壤条件)的影响可能较大[30]。Shipley[31]在建立22种不同树种异速生长关系也发现,叶、根与外界的营养和光照条件有显著相关性。采用枝下高处的直径作为枝、叶生物量异速生长方程的自变量时的拟合效果最好。这一结果支持了Shinozaki[32]提出的管道模型理论,即树干内单位数量的管道支持树冠内单位数量的叶子,使树木的叶量或叶面积与树干的边材面积成正比。枝下高处直径是距树冠最近树干直径,因此拟合枝叶生物量的效果优于DBH。
3.2 林木分化等级对生物量异速生长方程及其分配的影响
林木生物量分配格局并不是固定不变的,而是随个体年龄、生长环境、植物特性、竞争分化等不断调节各组分的生物量以获得受限资源的最大化[33-35]。在弱光环境下, 树木可通过增加树高、树干生物量和叶生物量来增加光合面积、弥补林下光照不足, 以维持树木正常的光合代谢及其他生命活动[36]。IIomäki[37]研究报道,与优势木相比,被压木生物量更多地分配到树干和叶,以便获取更多的光。然而,本研究发现,在一定范围内,特定胸径林木的枝、叶生物量的分配大小顺序为:优势木>中等木>被压木(图2),即被压木分配给枝、叶的生物量少于优势木(图5)。这个结果似乎与上述研究结果相悖,但兴安落叶松是一个强阳性树种,一旦处于弱光条件下就会产生自然整枝现象,从而使得处于林冠上层的优势木比处于弱光条件下的被压木会将更多的生物量分配到枝、叶上[38]。本文中等木与优势木相比,分配更多的生物量给树干,这与IIomäki研究结果一致;然而,同一DBH下被压木和中等木的树高均显著高于优势木(图3),反映了兴安落叶松通过增加高生长来获取更多的光照、弥补弱光限制的另一种策略[39]。
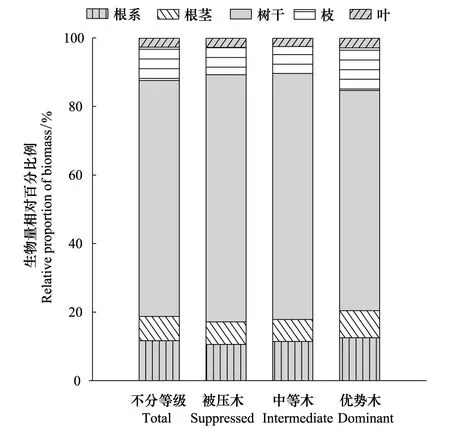
图4 不同林木分化等级的生物量相对分配Fig.4 Relative allocation of biomass components for different tree differentiation classes
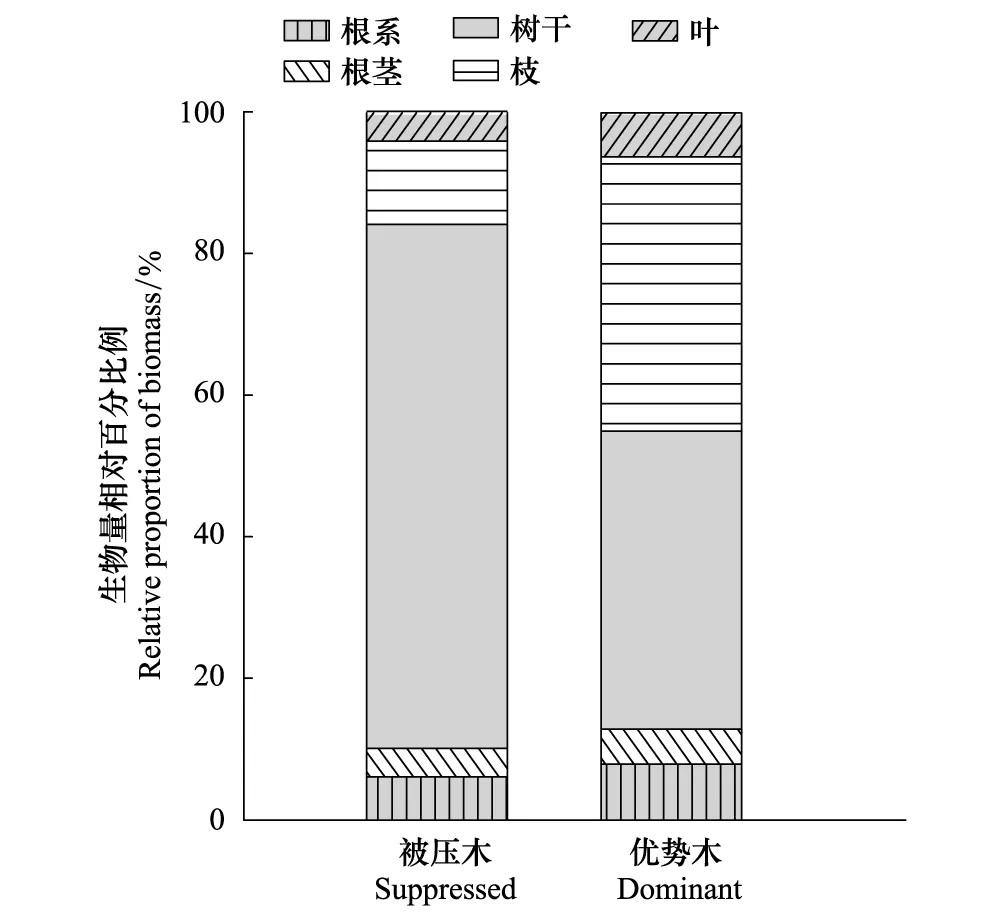
图5 将胸径标准化为9cm时被压木与优势木的生物量相对分配Fig.5 Relative allocation of biomass components between dominant and suppressed trees normalized to DBH of 9 cm
根冠比通常用于反映植物为了获取资源最大化而采取的生物量最优分配策略[35]。我们发现林木分化等级对林木的根冠比影响不显著(图3),与一些以往研究相符[39-40]。但Poorter[33]报道,植物处于弱光状态下时会将更多的光合产物分配到地上部分。这可能与树种本身及生长环境的差异有关。Gargaglione[41]研究报道,被压木要在获取更多光的同时,也要建立强大的地下系统以稳固林木。在无竞争存在时,植物因光限制而增加地上部分生物量分配;但当竞争存在时,资源分配是否仍符合上述的最优分配策略尚需更多的研究证实[40]。
4 结论
从拟合效果和实用性角度看,兴安落叶松生物量异速生长方程多以胸径为自变量为好,但以枝下高处的树干直径为自变量估测其枝、叶生物量时更精确。在一定的胸径范围内,同一胸径下,优势木将更多的生物量分配到枝和叶上,中等木比优势木分配更多的生物量给树干,中等木比被压木分配更多的生物量给地上部分,被压木和中等木的树高显著高于优势木。除根茎生物量之外,不同林木分化等级的生物量组分(包括枝、叶、树干和根系)的相对分配比例无显著差异,并保持根冠比相对稳定,反映了兴安落叶松生物量分配在应对林木竞争分化时所采取的一种相对保守的特殊方式。
致谢:帽儿山森林生态站提供了野外基础支持。
[1] Waring R H, Running S W. Forest Ecosystems: Analysis at Multiple Scales. San Diego, California: Academic Press, 1998.
[2] Goodale C L, Apps M J, Birdsey R A, Field C B, Heath L S, Houghton R A, Jenkins J C, Kohlmaier G H, Kurz W, Liu S R, Nabuurs G J, Nilsson S, Shvidenko A Z. Forest carbon sinks in the northern hemisphere. Ecological Applications, 2002, 12(3): 891-899.
[3] Pan Y, Birdsey R A, Fang J, Houghton R, Kauppi P E, Kurz W A, Phillips O L, Shvidenko A, Lewis S L, Canadell J G, Ciais P, Jackson R B, Pacala S W, McGuire A D, Piao S, Rautiainen A, Sitch S, Hayes D. A large and persistent carbon sink in the world′s forests. Science, 2011, 333(6045):988-993.
[4] Rizvi R H, Dhyani S K, Yadav R S, Singh R. Biomass production and carbon stock of poplar agroforestry systems in Yamunanagar and Saharanpur districts of northwestern India. Current Science, 2011, 100(5): 736-742.
[5] 于贵瑞. 全球变化与陆地生态系统碳循环和碳蓄积. 北京: 气象出版社, 2003: 157-158.
[6] Niklas K J. Plant Allometry: the Scaling of Form and Process. Chicago: The University of Chicago Press, 1994.
[7] St Clair J B. Family differences in equations for predicting biomass and leaf area in Douglas -Fir (Pseudotsugamenziesiivar.menziesii). Forest Science, 1993, 39(4): 743-755.
[8] Ter-Mikaelian M T, Korzukhin M D. Biomass equations for sixty-five North American tree species. Forest Ecology and Management, 1997, 97(1): 1-24.
[9] Wang C K. Biomass allometric equations for 10 co-occurring tree species in Chinese temperate forests. Forest Ecology and Management, 2006, 222(1/3): 9-16.
[10] Peri P L, Gargaglione V, Pastur G M. Dynamics of above-and below-ground biomass and nutrient accumulation in an age sequence ofNothofagusantarticaforest of southern Patagonia. Forest Ecology and Management, 2006, 233(1): 85-99.
[11] de Castilho C V, Magnusson W E, de Araújo R N, Luizão R C C, Luizão F J, Lima A P, Higuchi N. Variation in aboveground tree live biomass in a central Amazonian Forest: Effects of soil and topography. Forest Ecology and Management, 2006, 234(1/3): 85-96.
[12] Nilsson U, Albrektson A. Growth and self-thinning in two young Scots pine stands planted at different initial densities. Forest Ecology and Management, 1994, 68(2): 209-215.
[13] Barnes B V, Zak D R, Denton S R, Spurr S H. Forest Ecology. New York: John Wiley and Sons, 1997.
[14] Kimmins J P. Forest Ecology: A Foundation for Sustainable Management. 2nd ed. New Jersey: Prentice-Hall Inc, 1997.
[15] Weiner J, Thomas S C. Size variability and competition in plant monocultures. Oikos, 1986, 47(2): 211-222.
[16] Peet R K, Christensen N L. Competition and tree death. BioScience, 1987, 37(8): 586-595.
[17] Chave J, Condit R, Lao S, Caspersen J P, Foster R B, Hubbell S P. Spatial and temporal variation of biomass in a tropical forest: results from a large census plot in Panama. Journal of Ecology, 2003, 91(2): 240-252.
[18] Cannell M G R, Dewar R C. Carbon allocation in trees: a review of concepts for modelling. Advances in Ecological Research, 1994, 25: 60-140.
[19] Naidu S L, DeLucia E H, Thomas R B. Contrasting patterns of biomass allocation in dominant and suppressed loblolly pine. Canadian Journal of Forest Research, 1998, 28(8): 1116-1124.
[20] 那冬晨, 杨传平, 姜静, 夏德安, 王会仁. 兴安落叶松种源区划及优良种源选择. 林业科技, 2005, 30(4): 1-4.
[21] 玉宝, 乌吉斯古楞, 王百田, 王立明. 大兴安岭兴安落叶松(Larixgmelinii)天然林分级木转换特征. 生态学报, 2008, 28(11): 5750-5757.
[22] Peichl M, Arain M A. Allometry and partitioning of above-and belowground tree biomass in an age-sequence of white pine forests. Forest Ecology and Management, 2007, 253(1/3): 68-80.
[23] Niklas K J, Enquist B J. Canonical rules for plant organ biomass partitioning and annual allocation. American Journal of Botany, 2002, 89(5): 812-819.
[24] Gower S T, Kucharik C J, Norman J M. Direct and indirect estimation of leaf area index,fAPAR, and net primary production of terrestrial ecosystems. Remote Sensing of Environment, 1999, 70(1): 29-51.
[25] Sprugel D G. Correcting for bias in log-transformed allometric equations. Ecology, 1983, 64(1): 209-210.
[26] Cuc N T K, Ninomiya I. Allometric relations for youngKandeliacandel(L.) Blanco plantation in Northern Vietnam. Journal of Biological Sciences, 2007, 7(3): 539-543.
[27] Suwa R, Analuddin K, Khan M N I, Hagihara A. Structure and productivity along a tree height gradient in aKandeliaobovatamangrove forest in the Manko Wetland, Okinawa Island, Japan. Wetlands Ecology and Management, 2008, 16(4): 331-343.
[28] Zianis D, Mencuccini M. On simplifying allometric analyses of forest biomass. Forest Ecology and Management, 2004, 187(2/3): 311-332.
[29] 汪金松, 范秀华, 范娟, 张春雨, 夏富才. 林木竞争对臭冷杉生物量分配的影响. 林业科学, 2012, 48(4): 14-20.
[30] Bond-Lamberty B, Wang C, Gower S T. Aboveground and belowground biomass and sapwood area allometric equations for six boreal tree species of northern Manitoba. Canadian Journal of Forest Research, 2002, 32(8): 1441-1450.
[31] Shipley B, Meziane D. The balanced-growth hypothesis and the allometry of leaf and root biomass allocation. Functional Ecology, 2002, 16(3): 326-331.
[32] Shinozaki K, Yoda K, Hozumi K, Kira T. A quantitative analysis of plant form---the pipe model theory I. Basic analyses. Japanese Journal of Ecology, 1964, 14(3): 97-105.
[33] Poorter H, Niklas K J, Reich P B, Oleksyn J, Poot P, Mommer L. Biomass allocation to leaves, stems and roots: meta-analyses of interspecific variation and environmental control. New Phytologist, 2012, 193(1): 30-50.
[34] Xiao C W, Ceulemans R. Allometric relationships for below-and aboveground biomass of young Scots pines. Forest Ecology and Management, 2004, 203(1/3): 177-186.
[35] 王平, 王天慧, 周道玮, 张红香. 植物地上竞争与地下竞争研究进展. 生态学报, 2007, 27(8): 3489-3499.
[36] Poorter H, Nagel O. The role of biomass allocation in the growth response of plants to different levels of light, CO2, nutrients and water: a quantitative review. Australian Journal of Plant Physiology, 2000, 27(6): 595-607.
[37] IIomäki S, Nikinmaa E, Mäkelä A. Crown rise due to competition drives biomass allocation in silver birch. Canadian Journal of Forest Research, 2003, 33(12): 2395-2404.
[38] Roberts S D, Long J N. Production efficiency ofAbieslasiocarpa: influence of vertical distribution of leaf area. Canadian Journal of Forest Research, 1992, 22(9): 1230-1234.
[39] 汪金松, 范秀华, 范娟, 张春雨, 夏富才. 地上竞争对林下红松生物量分配的影响. 生态学报, 2012, 32(8): 2447-2457.
[40] Casper B B, Cahill J F, Hyatt L A. Above-ground competition does not alter biomass allocated to roots inAbutilontheophrasti. New Phytologist, 1998, 140(2): 231-238.
[41] Gargaglione V, Peri P L, Rubio G. Allometric relations for biomass partitioning ofNothofagusantarcticatrees of different crown classes over a site quality gradient. Forest Ecology and Management, 2010, 259(6): 1118-1126.
Differentiation of stand individuals impacts allometry and biomass allocation ofLarixgmeliniitrees
LI Wei, WANG Chuankuan*, ZHANG Quanzhi
CenterforEcologicalResearch,NortheastForestryUniversity,Harbin150040,China
Differentiation of stand individuals results from the competition of limited resources and thus affects allometry and allocation of tree biomass, but the extent to its impact has rarely been quantified. In this study, 38Larixgmeliniitrees, including 15 dominant, 16 intermediate, and 7 suppressed trees that were classified using a relative diameter method, were harvested for quantifying the effect of tree differentiation in the stand on the allometry and allocation of biomass. The results showed that the diameter at crown base was the most reliable predictor for branch and foliage biomass, whereas the diameter at breast height (DBH) was the best predictor for the other biomass components. For a specific value within a certain range of the DBH, the allometric models for belowground biomass components did not differ significantly among the tree differentiation classes (P>0.05). However, the dominant trees allocated more biomass to branch and foliage components, whereas the intermediate trees allocated more biomass to stem component than the dominant, and more biomass to aboveground component than the suppressed. The tree height of the suppressed and intermediate trees was significantly greater than the dominant for a given DBH. The proportions of all the components except for stump to the total biomass did not differ significantly (P>0.05) among the tree differentiation classes. The root shoot ratio was relatively constant for all the tree-differentiation classes. These results suggest that the differentiation of stand individuals in the larch trees mainly caused by resource competition diverts the allometry and allocation of the aboveground biomass components, but the relative allocation pattern is conservative.
differentiation of stand individuals; allometry; biomass allocation; competition; dominant tree; suppressed tree
林业公益性行业专项(201104009-05); 国家“十二五”科技支撑项目(2011BAD37B01); 教育部长江学者和创新团队发展计划(IRT1054)
2013-03-17;
日期:2014-07-18
10.5846/stxb201403170466
*通讯作者Corresponding author.E-mail: wangck-cf@nefu.edu.cn
李巍, 王传宽, 张全智.林木分化对兴安落叶松异速生长方程和生物量分配的影响.生态学报,2015,35(6):1679-1687.
Li W, Wang C K, Zhang Q Z.Differentiation of stand individuals impacts allometry and biomass allocation ofLarixgmeliniitrees.Acta Ecologica Sinica,2015,35(6):1679-1687.

