塞北荒漠草原柠条锦鸡儿AM真菌的空间分布
许 伟,贺学礼,孙 茜,王晓乾,刘春卯,张 娟,赵丽莉
河北大学生命科学学院,保定 071002
塞北荒漠草原柠条锦鸡儿AM真菌的空间分布
许 伟,贺学礼*,孙 茜,王晓乾,刘春卯,张 娟,赵丽莉
河北大学生命科学学院,保定 071002
为了探明塞北荒漠草原AM真菌生态分布规律,于2013年6月选取河北沽源县二牛点、内蒙古上都镇和青格勒图嘎查3个样地,按照0—10 cm、10—20 cm、20—30 cm、30—40 cm、40—50 cm 5个土层分别采集柠条锦鸡儿(Caraganakorshinskii)根围土壤样品,研究了AM真菌空间分布特征及其与土壤因子的相关性。结果表明,柠条锦鸡儿根系能与AM真菌共生形成疆南星型丛枝菌根,AM真菌孢子密度和定殖率与样地和采样深度密切相关。二牛点孢子密度最大,3个样地孢子密度最大值均在0—10 cm土层,并随土层加深而减少;3个样地菌丝定殖率依次为上都镇>青格勒图嘎查>二牛点,峰值均在0—10 cm土层;泡囊定殖率青格勒图嘎查显著低于其他样地,但土层间无规律性变化;丛枝样地间定殖状况差异明显,变化趋势为青格勒图嘎查>上都镇>二牛点;AM真菌总定殖率和定殖强度最大值在上都镇。孢子密度与土壤有机C、全N、易提取球囊霉素和总球囊霉素极显著正相关,与pH值显著正相关,与速效P显著负相关;菌丝定殖率与土壤pH值、速效P、全N和酸性磷酸酶显著负相关;泡囊和丛枝定殖率与土壤碱解N和碱性磷酸酶具有极显著相关性;总球囊霉素和易提取球囊霉素与脲酶显著正相关,与碱解N、全N、碱性磷酸酶和酸性磷酸酶极显著正相关。主成分分析表明,酸性磷酸酶、总球囊霉素、全N、碱性磷酸酶、有机C是影响荒漠土壤营养状况的主要因子。总球囊霉素和易提取球囊霉素平均含量分别为3.19 mg/g和1.17 mg/g,占土壤有机C平均含量比为7.77%和3.83%,占土壤全N平均含量比为20.81%和9.57%。多元线性回归表明,总球囊霉素和易提取球囊霉素与土壤有机C和全N具有显著线性相关关系。研究球囊霉素与土壤有机C和N的比例关系可进一步明确AM真菌的生态功能,对荒漠土壤C库和N库研究具有重要意义。
AM真菌;球囊霉素;土壤因子;柠条锦鸡儿;塞北荒漠草原
AM(arbuscular mycorrhiza)真菌是一类在陆地生态系统中普遍存在的有益土壤微生物,能与大多数高等植物形成互惠共生体,其根外菌丝在土壤中形成菌丝网络系统以及分泌的球囊霉素等代谢产物,将不同植物根系连接起来,对生态系统不同组分之间的物质交换,能量、信息传递,生物演化与分布,保持荒漠植物多样性和稳定性具有重要意义[1]。球囊霉素(Glomalin)是一类含金属离子的糖蛋白,难溶于水,难分解,在自然状态下极为稳定[2],随菌丝和孢子降解进入土壤后,成为土壤有机物质来源,参与土壤C、N 循环。对球囊霉素的研究可进一步明确AM真菌在维持土壤结构、促进营养物质循环中的地位和作用[3]。目前国内外对球囊霉素已有研究报道[4- 5],但有关荒漠植物AM真菌和球囊霉素的功能报道较少。
柠条锦鸡儿(Caraganakorshinskii)为豆科强旱生灌木,大多分布在我国北方荒漠地区,生长旺盛、根系发达、适应性广、抗逆性强、是水土保持、防风固沙的优良树种,在荒漠植被建立和生态恢复中起重要作用。吴艳清等[6- 7]研究了内蒙古鄂尔多斯、宁夏等地柠条锦鸡儿AM真菌生态分布,认为菌根不同定殖结构和孢子密度可作为评价土壤状况的指标之一。但对于荒漠柠条锦鸡儿球囊霉素研究甚少,尤其缺乏对AM真菌生态过程中主要土壤因子筛选和AM 真菌与土壤 C、N 关系的研究。本试验以塞北荒漠草原为样地,系统研究了柠条锦鸡儿根围土壤AM真菌空间分布以及土壤因子的生态作用,阐明AM真菌在改善荒漠环境中的重要作用,为荒漠植被恢复和生态重建提供依据。
1 材料方法
1.1 研究样地概况
试验样地位于冀蒙交界的荒漠草原地区,共计选择3个地点开展相关研究,包括河北省沽源县二牛点(41°51′N,115°47′E;海拔1403 m),土壤类型为栗钙土;内蒙古上都镇(42°13′N,115°57′E;海拔1331 m),土壤类型为风沙土;内蒙古青格勒图嘎查(42°09′N,115°55′E;海拔1325 m),土壤类型为风沙土。该区域属于温带大陆干旱性气候,冬季严寒、夏季温暖,年均气温0 ℃—3 ℃,全年降水主要集中在夏季,年均降水量200—400 mm。
2013年6月在3个样地分别随机选取4株长势良好的柠条锦鸡儿,由于其主根发达,侧根向四周延伸,根量主要分布在50 cm土层内,垂直0—30 cm范围内有大量毛根[8],所以贴近植株根颈部去其枯枝落叶层挖土壤剖面,按0—10 cm、10—20 cm、20—30 cm、30—40 cm、40—50 cm 5个土层采集土样和根样,用土壤温湿度计实地测定土壤温度和湿度,将样品装入隔热性能良好的自封袋中带回实验室自然风干,土样过2 mm筛后,用于土壤因子和球囊霉素测定,根样用于菌根结构和定殖率观测。
1.2 研究方法
1.2.1 土壤因子
土壤有机C用马弗炉烘干法;pH值用酸度计测定;速效P用碳酸氢钠-钼锑抗比色法[9];碱解N用碱解扩散法;全N用半微量开氏法;土壤脲酶用改进的Hoffmann和Teicher[10]比色法,活性以1 g风干土1 h催化尿素分解生成NH3-N的质量(μg)表示;酸性磷酸酶和碱性磷酸酶用改进的Brimner和Tabatabai方法[3]测定, 活性以1 g风干土培养1 h酸性磷酸酶或碱性磷酸酶转化对硝基苯磷酸二钠(pNPP)的量(μg/g)表示;蔗糖酶用3,5-二硝基水杨酸比色法测定[10]。
1.2.2 球囊霉素
球囊霉素用Wright[2]和David[11]的方法测定,易提取球囊霉素(EEG,easily extractable glomain)提取方法:取1 g风干土在试管中,加入8 mL、20 mmol/L(pH 7.0)柠檬酸钠浸提剂,在103 kPa、121 ℃条件下连续提取90 min后,在6000r/min下离心15 min,收集上清液;总球囊霉素(TG,total extractable glomalin)提取方法:取1 g风干土于试管中,加入8 mL、50 mmol/L(pH 8.0)柠檬酸钠浸提剂,在103 kPa、121 ℃条件下连续提取60 min,再重复提取2次;6000 × g下离心15 min,收集上清液。分别吸取上清液0.5 mL加入5 mL考马斯亮蓝G- 250染色剂,在595 nm波长下比色。用牛血清蛋白作为标准液,考马斯亮蓝法显色,绘制标准曲线,求出球囊霉素含量。
1.2.3 AM真菌指标
AM真菌定殖率按Phillips和Hayman,Zhao和He[12- 13]的方法测定。根样用清水冲洗2—3次后,于10% KOH溶液中90 ℃下漂洗60 min,用0.5%酸性品红在90 ℃下染色30 min,随机选取50根1 cm长的根段,镜检。按照定殖率=(AM真菌侵染根段数/检查总根段数)×100% 计算菌根不同结构(丛枝、泡囊、菌丝)定殖率及总定殖率。
从每份土样中取20 g风干土,用湿筛倾析-蔗糖离心法分离AM真菌孢子[14],在体视显微镜下记录孢子数量,以每100 g风干土含孢子数量计为孢子密度。
1.2.4 数据处理
使用SPSS 19.0统计软件进行单因素方差分析、相关性分析、主成分分析和回归分析,用Excel 2003作图。
2 结果
2.1 菌根共生结构特征
研究发现,柠条锦鸡儿根系能被AM真菌侵染形成典型的疆南星型丛枝菌根(图版Ⅰ:1),菌丝在根组织中延伸生长,形成大量胞间菌丝,多为无隔菌丝,偶见有隔菌丝(图版Ⅰ:2—3),细胞内有菌丝圈(图版Ⅰ:4—5),胞内菌丝顶端膨大形成泡囊,多为圆形、椭圆形、杆状,偶见不规则形(图版Ⅰ:6—9),分支后在细胞内形成典型的花椰菜状和树枝状丛枝(图版Ⅰ:10—11),皮层内亦能发现大量孢子侵染(图版Ⅰ:12)
2.2 AM真菌空间分布
由图1可知,3个样地孢子密度差异显著,最大值均在0—10 cm土层;同一样地不同土层,二牛点孢子密度随土层加深而减少,0—10 cm土层显著高于10—50 cm土层;上都镇孢子密度随土壤加深而下降(除30—40 cm土层),0—30 cm土层显著高于30—50 cm土层;青格勒图嘎查0—10 cm土层显著高于10—50 cm土层。不同样地同一土层,0—20 cm土层,二牛点孢子密度显著高于上都镇和青格勒图嘎查;20—50 cm土层,上都镇孢子密度显著高于青格勒图嘎查。
同一样地不同土层,青格勒图嘎查0—20 cm土层菌丝定殖率明显高于20—50 cm土层;上都镇仅10—20 cm土层菌丝定殖率明显低于其他土层;二牛点菌丝定殖率10—30 cm土层明显低于其他土层。不同样地同一土层,0—20 cm土层菌丝定殖率变化规律为青格勒图嘎查>上都镇>二牛点,20—50 cm土层菌丝定殖率上都镇显著高于二牛点和青格勒图嘎查;3样地平均定殖率依次为上都镇>青格勒图嘎查>二牛点。
青格勒图嘎查平均泡囊定殖率明显低于二牛点和上都镇。同一样地不同土层,上都镇泡囊定殖率土层间差异显著,最大值在0—10 cm土层;二牛点40—50 cm土层高于其他土层;青格勒图嘎查最小值在20—30 cm土层,低于其他土层。不同样地同一土层,0—10 cm土层,上都镇泡囊定殖率显著大于二牛点和青格勒图嘎查;10—50 cm土层,二牛点泡囊定殖率显著高于其他样地。
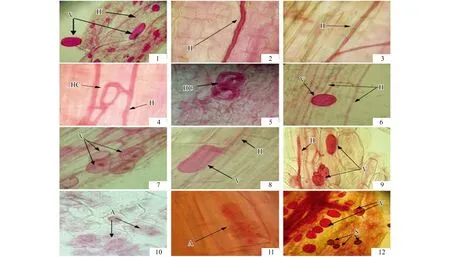
图版Ⅰ 柠条锦鸡儿丛枝菌根结构(×400)Plate Ⅰ Arbuscular mycorrhizal structures of C. korshinskii1: 泡囊 V(Vesicule)、胞间菌丝 H(Hypha); 2: 无隔菌丝 H(Hypha); 3: 有隔菌丝 H(Hypha); 4、5: 菌丝圈 HC(Hyphal Coil); 6: 圆形泡囊 V (Vesicule); 7: 椭圆形泡囊 V (Vesicule 有内含物); 8: 杆状泡囊 V (Vesicule);9: 不规则泡囊 V (Vesicule); 10. 花椰菜状丛枝 A (Arbuscule); 11: 树枝状丛枝 A (Arbuscule); 12: 孢子 S(Spore)
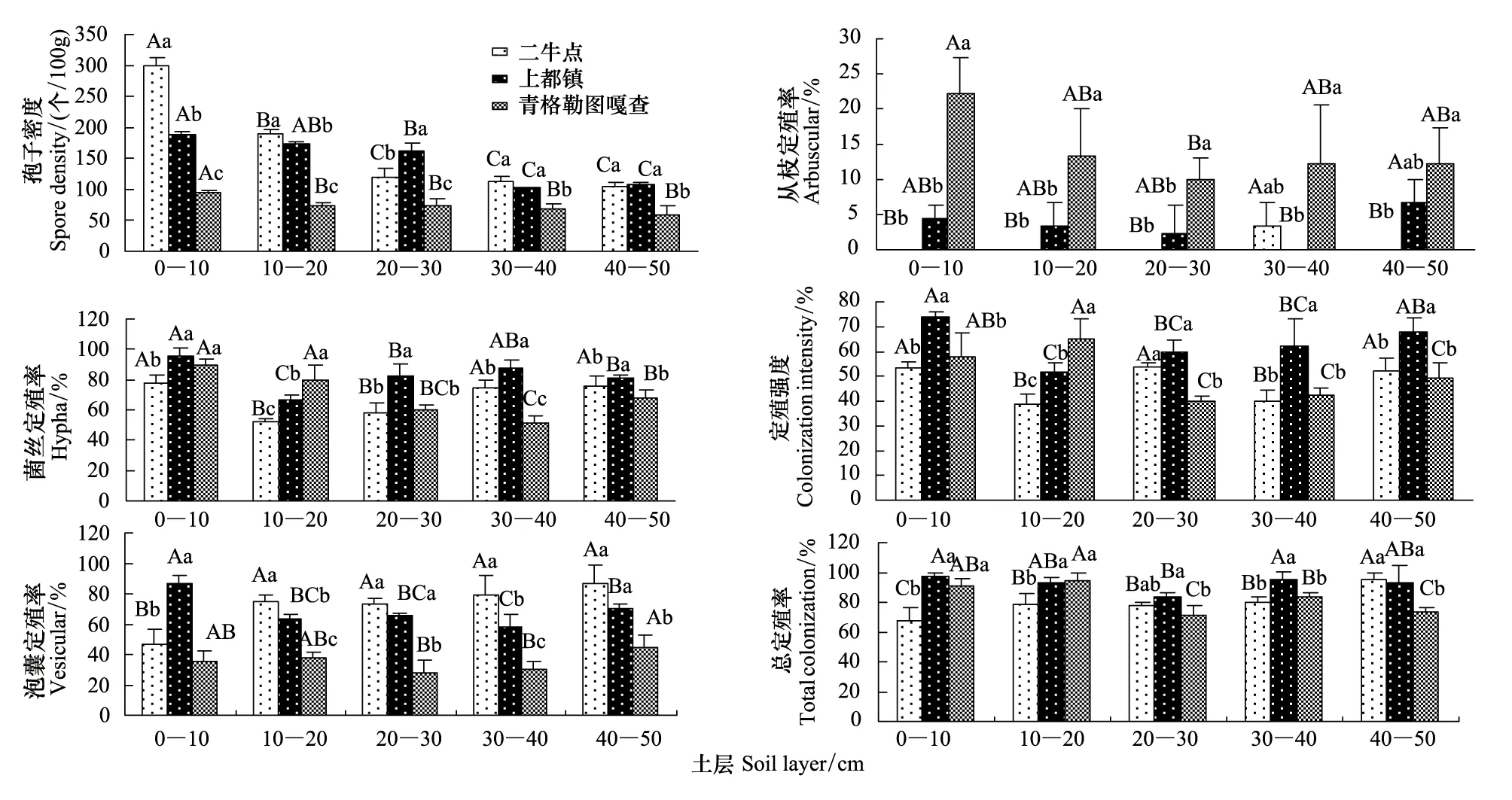
图1 柠条锦鸡儿AM真菌空间分布Fig.1 The spatial distribution of AM fungi in the rhizosphere of C.korshinskii不同小写字母表示不同样地同一土层差异显著(P<0.05)
不同样地,丛枝定殖率差异显著,为青格勒图嘎查>上都镇>二牛点。同一样地不同土层,二牛点丛枝定殖率30—40 cm土层显著高于其他土层;上都镇30—40 cm土层无丛枝定殖;青格勒图嘎查20—30 cm土层显著低于其他土层。不同样地同一土层,青格勒图嘎查丛枝定殖率显著高于上都镇和二牛点。
不同样地平均总定殖率无显著变化,二牛点总定殖率随土层加深逐渐升高(除20—30 cm外),上都镇最大值在0—10 cm土层,青格勒图嘎查最大值在10—20 cm土层。不同样地同一土层,上都镇20—50 cm土层的总定殖率显著高于青格勒图嘎查,而二牛点0—20 cm土层的总定殖率显著低于其他样地。
AM真菌定殖强度在不同样地间无显著差异。各土层波动明显,二牛点和上都镇最小值在10—20 cm土层,显著低于其他土层,青格勒图嘎查0—20 cm土层显著大于20—50 cm土层。
2.3 土壤因子和球囊霉素空间分布
由图2所示,二牛点土壤有机C显著高于上都镇和青格勒图嘎查;同一样地不同土层,有机C随土层加深变化明显,仅二牛点0—50 cm土层有机C显著高于上都镇和青格勒图嘎查,3样地最大值均在0—10 cm土层。不同样地pH在7.69—8.16之间,二牛点0—10 cm土层显著高于其他土层。
不同样地,二牛点碱解N显著高于上都镇和青格勒图嘎查;同一样地不同土层,二牛点和上都镇40—50 cm土层碱解N显著高于0—40 cm土层;青格勒图嘎查30—50 cm土层显著高于10—30 cm土层,3样地最大值均在40—50 cm土层。全N变化规律与碱解N相似,二牛点最高,上都镇最低;同一样地不同土层,二牛点全N随土层加深而降低,上都镇和青格勒图嘎查土层间先降后升,上都镇0—10 cm土层高于10—50 cm土层,青格勒图嘎查最大值在40—50 cm土层。速效P二牛点和上都镇最大值均在40—50 cm土层,青格勒图嘎查随土层加深而增加(除40—50 cm土层外)。不同样地同一土层,速效P无显著变化。
不同样地之间,易提取球囊霉素二牛点显著高于上都镇和青格勒图嘎查;二牛点和上都镇0—20 cm土层显著高于20—50 cm土层,青格勒图嘎查土层间先降后升,20—30 cm土层显著低于其他土层。不同样地同一土层,0—10 cm土层二牛点和青格勒图嘎查显著高于上都镇。总球囊霉素含量变化与易提取球囊霉素变化规律相似,为二牛点>青格勒图嘎查>上都镇,同一样地不同土层,青格勒图嘎查0—10 cm土层显著高于10—50 cm土层,二牛点和上都镇土层间无显著差异。
酸性磷酸酶二牛点显著大于其他样地。同一样地不同土层,仅上都镇0—20 cm土层显著大于20—50 cm土层。碱性磷酸酶不同样地间的变化规律与酸性磷酸酶相似,但各土层间无显著变化。
二牛点和上都镇 30—40 cm土层的脲酶显著高于其他土层,青格勒图嘎查30—40 cm土层显著低于其他土层。二牛点和青格勒图嘎查10—30 cm土层的蔗糖酶显著低于其他土层,上都镇土层间无显著变化。
2.4 AM真菌与土壤因子相关性分析
相关性分析表明(表1),孢子密度与土壤有机C、全N、易提取球囊霉素和总球囊霉素极显著正相关,与pH值、酸性磷酸酶和碱性磷酸酶显著正相关,与速效P显著负相关,与脲酶极显著负相关。菌丝定殖率与pH值、速效P、全N和酸性磷酸酶显著负相关。泡囊定殖率和碱解N、碱性磷酸酶极显著正相关,与蔗糖酶极显著负相关,与有机C、全N和酸性磷酸酶显著正相关。丛枝定殖率与碱解N、全N、碱性磷酸酶、酸性磷酸酶、易提取球囊霉素极显著负相关,与有机C、pH值和总球囊霉素显著负相关。总定殖率与pH极显著负相关,与全N显著负相关。定殖强度与pH值、全N 、酸性磷酸酶极显著负相关,与总球囊霉素显著负相关。总球囊霉素和易提取球囊霉素与脲酶显著正相关,与有机C、碱解N、全N、碱性磷酸酶和酸性磷酸酶极显著正相关。总球囊霉素与蔗糖酶显著正相关。
2.5 土壤因子主成分分析
利用SPSS 19.0软件对3个样地11个土壤因子进行主成分分析,根据相关矩阵特征值大于1,方差累积贡献率大于75%的原则,选择3个主成分。结果表明(表2),选择的3个主成分累积方差贡献率为78.889%,能基本反映土壤因子的指标信息。第一主成分中,酸性磷酸酶、总球囊霉素、全N、碱性磷酸酶、有机C具有较高载荷(权重为0.906—0.952),第二主成分中,速效P具有较高载荷(权重为0.893),第三主成分中蔗糖酶具有较高载荷(权重为0.793),但第一主成分所占信息量大,所以酸性磷酸酶、总球囊霉素、全N、碱性磷酸酶、有机C是主要因子,这些因子能够反映荒漠环境宿主植物的营养状况。

图2 柠条锦鸡儿根围土壤因子与球囊霉素空间分布Fig.2 The spatial distribution of soil factors and glomalin in the rhizosphere of C.korshinskii
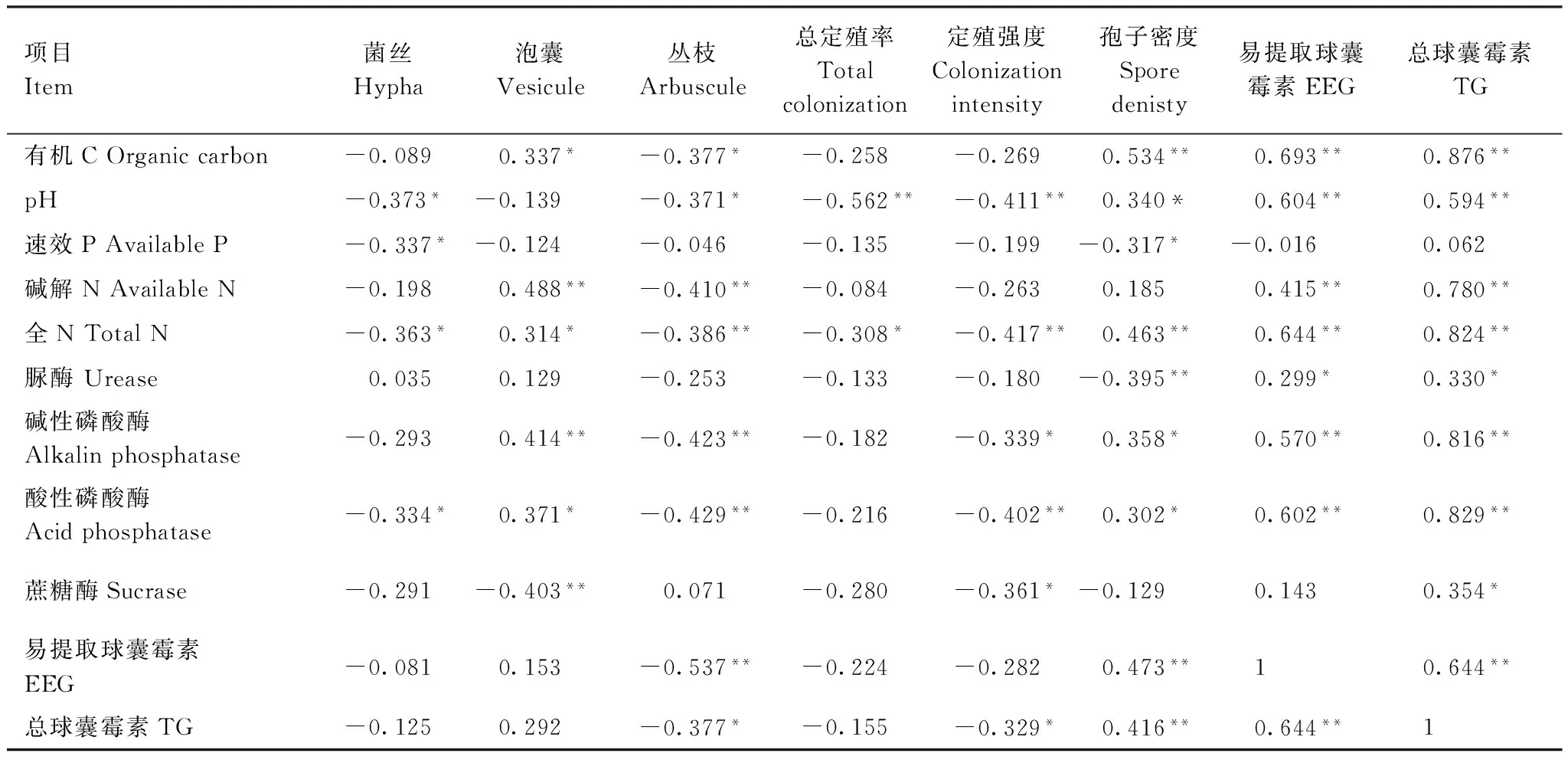
表1 AM真菌与土壤因子相关性Table 1 Relativity analysis between AM fungi and soil factors
*表示两者之间在P< 0.05水平上有显著相关性; **表示两者之间在P< 0.01水平上有极显著相关性; EEG: easily extractable glomain; TG: total extractable glomalin
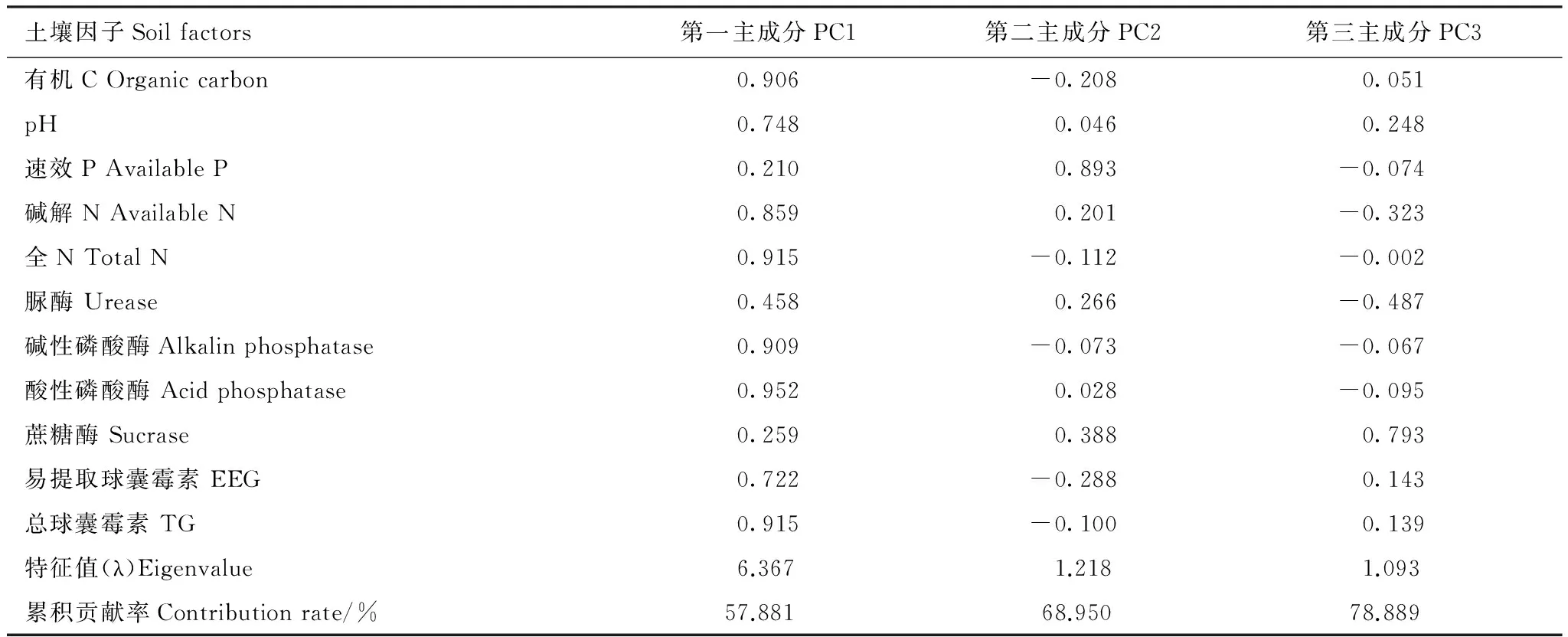
表2 主成分载荷矩阵、特征值和贡献率Table 2 Principle component loading matrix,eigenvalue and contribution rate
2.6 球囊霉素与土壤有机C和全N比例及回归分析
由表1可知,球囊霉素与土壤有机C和全N极显著正相关,由表3可知,总球囊霉素和易提取球囊霉素碳含量占土壤有机C平均含量比为7.77%和3.83%,3个样地中,总球囊霉素氮含量占土壤全N平均含量比为20.81%,大小依次为青格勒图嘎查>上都镇>二牛点,易提取球囊霉素氮含量占土壤全N平均含量比为9.57%,最小值在二牛点。
根据多元回归原理,分别以总球囊霉素和易提取球囊霉素为因变量,以土壤有机C和全N为自变量,进行多元线性回归分析,利用最小二乘法原理估计参数,同时利用stepwise 法剔除不显著因子和有相关关系的因子,最终确定对球囊霉素具有明显影响的因子,得到标准回归方程。
球囊霉素与土壤有机C和全N多元线性回归方程:
方程ⅠY1= 0.822+6.218X1+0.283X2(F= 20.386)
方程ⅡY2= 1.208+33.663X1+1.803X2(F= 80.424)
式中,Y1为易提取球囊霉素;Y2为总球囊霉素;X1有机C;X2为全N。经检验,上述方程相伴概率值均小于0.001,说明自变量与因变量之间存在显著线性相关关系。对上述方程各系数进行t检验, 各系数显著性水平都小于0.05, 说明自变量对因变量的影响显著。
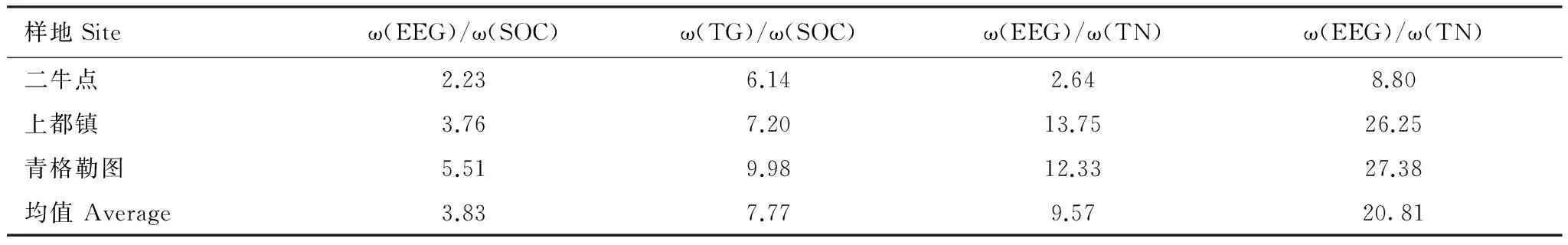
表3 不同样地球囊霉素占土壤有机C和全N的比例/%Table 3 Percentage of C of glomalin in soil organic C and total N of glomalin in soil total N in different sample sites
SOC: 土壤有机碳Soil organic carbon; TN: 全氮Total nitrogen
3 讨论
3.1 AM真菌共生关系和空间异质性
本研究表明,柠条锦鸡儿根系能被AM真菌侵染形成疆南星型菌根,即宿主植物被侵染根段中形成大量胞间菌丝,侧生的二叉状分支直接穿过皮层细胞壁,形成丛枝结构。疆南星型丛枝菌根中AM真菌侵染速度明显快于重楼型,AM真菌侵染可以使宿主营养状况迅速得到改善,有利于在干旱环境中生长[15]。柠条锦鸡儿根系为垂直根系,主根上有多层侧根,由于AM真菌菌丝最先侵染幼嫩细根,所以柠条根系特征对AM真菌侵染极为有利。二牛点、上都镇和青格勒图嘎查平均总定殖率分别为80.0%、92.7%和82.7%,平均孢子密度分别为165 个/100 g、160 个/100 g和74 个/100 g,说明荒漠草原柠条锦鸡儿能与AM真菌形成良好共生关系,而丛枝菌根的形成可能是柠条锦鸡儿适应贫瘠干旱荒漠环境的有效对策之一[3]。
AM真菌定殖和孢子密度具有明显空间异质性,最大值多在0—20 cm土层,可能是AM真菌为好气性真菌,孢子和菌丝生长及菌根发育都需要氧气和适宜土壤湿度,而浅层土壤通气性和土壤湿度都比深土层高,对菌丝定殖和产孢有利[3,16]。本试验中,AM真菌不同结构定殖状况差异明显,变化趋势为菌丝>泡囊>丛枝,可能与AM真菌定殖过程以及AM真菌不同结构本身特性密切相关。AM真菌定殖率并不伴随有最大孢子密度,二牛点孢子密度最高,上都镇总定殖率最大,说明孢子密度与定殖率之间没有严格的对应关系,可能是因为在自然环境中,相邻植物的根经常交错生长,因而宿主根围的孢子也可能来自其他伴生植物,导致孢子密度与定殖情况不对应。
3.2 AM真菌与土壤因子的关系
研究表明,AM真菌分布和活动与土壤因子关系密切[17]。本试验中,pH在7.69—8.16之间,且与孢子密度显著正相关,与菌丝显著负相关,说明AM真菌与柠条锦鸡儿在微碱环境中亦能形成良好共生关系。这与Riling等[18]提出的土壤pH直接影响AM真菌产孢,AM有效性因pH不同而变化的结论一致。孢子密度与土壤有机C、全N、易提取球囊霉素和总球囊霉素极显著正相关,与速效P负显著相关,与前人研究结果一致[3,19]。一定程度上,土壤碳氮含量增加对AM真菌孢子繁殖具有促进作用,土壤中过高的P会降低根细胞膜通透性,影响根系分泌活动,抑制AM真菌产孢[19]。
本试验中,3个样地土壤有机C最大值均在0—10 cm土层,可能是因为土壤表层累积了较多枯枝落叶和腐殖质,土壤养分肥沃,有机C的提高对菌丝生长和菌根发育都有促进作用,同时,AM真菌侵染植物可在短时间内提高土壤有机质含量,改善土壤结构,AM真菌、宿主植物和根围环境三者之间构成一个平衡体系,相互联系、相互作用[20- 21]。AM真菌侵染宿主植物后,能够吸收大量无机氮,这些无机氮可参与孢子形成过程[22]。本试验中,土壤碱解N和全N最大值均在40—50 cm土层,可能是由于柠条锦鸡儿属于豆科植物,产生根瘤,主根系较深,对土壤硝态氮和氨态氮利用充分,且豆科植物还可把固定的氮通过菌丝网络运输到邻近植物上,使土壤更加肥沃[23]。
土壤酶是土壤成分中最活跃的有机成分之一,可以和土壤微生物一起推动土壤代谢过程,其活性反映了土壤中各种生化过程的强度和方向[10]。白春明等[24]研究认为,脲酶参与的酶促反应可产生一种能被植物有效利用的氮源—氨,其活性亦反映了土壤转化有机态氮为有效态氮和土壤供应无机氮的能力。本试验脲酶变化规律与样地和采样深度密切相关,活性大小依次是二牛点>青格勒图嘎查>上都镇。磷酸酶是催化土壤磷酸单酯和磷酸二酯水解的酶,能将有机磷酸酯水解为无机态磷,被植物吸收利用。本试验样地属于低P环境,丛枝菌根根外菌丝不但可以分泌酸性磷酸酶,而且根外菌丝作为细根的延伸,增加了根系表面积,可以辅助根系吸收土壤P[24]。
3.3 球囊霉素与土壤有机碳和全氮的关系
球囊霉素是AM真菌随宿主根系生长分泌产生的一类含金属离子的糖蛋白,随菌丝壁和孢子降解释放到土壤中[2]。Rilling等[20]认为,球囊霉素是土壤C库和N库的重要来源,其黏附力有利于稳定土壤结构,是AM真菌对植物生长环境的调整与适应,是微生物活动的一种积极应答机制[25- 26]。农牧交错区沙棘根围土壤易提取球囊霉素和总球囊霉素平均含量为0.87 mg/g和1.61 mg/g, 占有机C平均百分比分别为12.61%和21.45%[3];黄土高原狼牙刺根围土壤易提取球囊霉素和总球囊霉素平均含量为和0.56 mg/g和 2.32 mg/g,占土壤有机C平均含量分别为9.17%和36.46%[27]。本研究中,易提取球囊霉素和总球囊霉素平均含量分别为1.17 mg/g和3.19 mg/g,占土壤有机C平均含量比的3.83%和7.77%,易提取球囊霉素和总球囊霉素含量高于沙棘和狼牙刺根围土壤,但对有机C贡献低于其他生态系统,同时总球囊霉素氮含量占土壤全氮平均含量比为20.81%,易提取球囊霉氮含量占土壤全氮平均含量比为9.57%,说明塞北荒漠草原受干扰程度和土壤退化程度较低,也可能与宿主植物种类和土壤环境不同有关。多元回归方程表明,总球囊霉素和易提取球囊霉素与土壤有机碳和全氮具显著线性相关关系,说明球囊霉素是土壤有机碳和氮的重要来源和组成部分[28]。
塞北荒漠草原柠条锦鸡儿根系能与AM真菌形成良好共生关系,AM真菌活动和分布具有明显空间异质性,球囊霉素对荒漠土壤碳库和氮库具有重要贡献。
[1] Smith S E, Read D J. Mycorrhizal Symbiosis. Cambridge, UK: Academic Press, 2008.
[2] Wright S F, Upadhyaya A. A survey of soils for aggregate stability and glomalin, a glycoprotein produced by hyphae of arbuscular mycorrhizal fungi. Plant and Soil, 1998, 198(1): 97- 107.
[3] 贺学礼, 陈程, 何博. 北方两省农牧交错带沙棘根围AM真菌与球囊霉素空间分布. 生态学报, 2011, 31(6): 1653- 1661.
[4] 谢靖, 唐明. 黄土高原紫穗槐丛枝菌根真菌与土壤因子和球囊霉素空间分布的关系. 西北植物学报, 2012, 32(7): 1440- 1447.
[5] 黄艺, 王东伟, 蔡佳亮, 郑维爽. 球囊霉素相关土壤蛋白根际环境功能研究进展. 植物生态学报, 2011, 35(2): 232- 236.
[6] 吴艳清, 贺学礼, 刘沺沺. 荒漠环境柠条锦鸡儿AM真菌空间分布. 河北农业大学学报, 2008, 31(4): 36- 40.
[7] 贺学礼, 陈烝, 郭辉娟, 陈程. 荒漠柠条锦鸡儿AM真菌多样性. 生态学报, 2012, 32(10): 3041- 3049.
[8] 吴钦孝, 丁汉福, 刘克俭. 黄土丘陵半干旱地区柠条根系的研究. 水土保持通报, 1989, 9(3): 45- 49.
[9] 鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科学技术出版社, 1999: 271- 272.
[10] 周礼恺. 土壤酶学. 北京: 科技出版社, 1987: 275- 276.
[11] David P J, Sara G, Bray B. Glomalin extraction and measurement. Soil Biology and Biochemistry, 2008, 40(3): 728- 739.
[12] Phillips J M, Hayman D S. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Transactions of the British Mycological Society, 1970, 55(1): 158- 161.
[13] Zhao J L, He X L. Arbuscular mycorrhizal fungi associated with the clonal plants in Mu Us sandland of China. Progress in Natural Science, 2007, 17(11): 1296- 1302.
[14] Gerdemann J W, Nicolson T H. Spores of mycorrhizal endogone species extracted from soil by wet sieving and decanting. Transactions of the British Mycological Society, 1963, 46(2): 235- 244.
[15] Brundrett M, Kendrick B. The roots and mycorrhizas of herbaceous woodland plants II. Structural aspects of morphology. New Phytologist, 1990, 114(3): 469- 479.
[16] 贺学礼, 刘雪伟, 李英鹏. 沙坡头地区沙冬青AM真菌的时空分布. 生态学报, 2010, 30(2): 370- 376.
[17] 盛敏, 唐明, 张峰峰, 黄艳辉. 土壤因子对甘肃、宁夏和内蒙古盐碱土中 AM 真菌的影响. 生物多样性, 2011, 19(1): 85- 92.
[18] Rillig M C, Allen M F. What is the role of arbuscular mycorrhizal fungi in plant-to-ecosystem responses to elevated atmospheric CO2. Mycorrhiza, 1999, 9(1): 1- 8.
[19] 贺学礼, 杨静, 赵丽莉. 荒漠沙柳根围AM真菌的空间分布. 生态学报, 2011, 31(8): 2159- 2168.
[20] Hamel C. Impact of arbuscular mycorrhizal fungi on N and P cycling in the root zone. Canadian Journal of Soil Science, 2004, 84(4): 383- 395.
[21] Panwar J, Tarafdar J C. Arbuscular mycorrhizal fungal dynamics underMitragynaparvifolia(Roxb.) Korth. in Thar Desert. Applied Soil Ecology, 2006, 34(2/3): 200- 208.
[22] Hodge A, Helgason T, Fitter A H. Nutritional ecology of arbuscular mycorrhizal fungi. Fungal Ecology, 2010, 3(4): 267- 273.
[23] Jalonen R, Nygren P, Sierra J. Transfer of nitrogen from a tropical legume tree to an associated fodder grass via root exudation and common mycelial networks. Plant, Cell and Environment, 2009, 32(10): 1366- 1376.
[24] Bai C M, He X L, Tang H L, Shan B Q, Zhao L L. Spatial distribution of arbuscular mycorrhizal fungi, glomalin and soil enzymes under the canopy ofAstragalusadsurgensPall. in the Mu Us sandland, China. Soil Biology and Biochemistry, 2009, 41(5): 941- 947.
[25] Driver J D, Holben W E, Rillig M C. Characterization of glomalin as a hyphal wall component of arbuscular mycorrhizal fungi. Soil Biology and Biochemistry, 2005, 37(1): 101- 106.
[26] 郭良栋, 田春杰. 菌根真菌的碳氮循环功能研究进展. 微生物学通报, 2013, 40(1): 158- 171.
[27] 冯欣欣, 唐 明, 龚明贵, 余红霞. 黄土高原狼牙刺丛枝菌根与球囊霉素的空间分布. 西北农林科技大学学报: 自然科学版, 2011, 39(6): 96- 102.
[28] 王诚煜, 冯海艳, 杨忠芳, 夏学齐, 余涛, 李淼, 江丽珍. 内蒙古中北部球囊霉素相关土壤蛋白的分布及其环境影响. 干旱区研究, 2013, 30(1): 22- 28.
The spatial distribution of arbuscular mycorrhizal fungi in the rhizosphere ofCaraganakorshinskiiin Saibei desert steppe
XU Wei, HE Xueli*,SUN Qian, WANG Xiaoqian,LIU Chunmao,ZHANG Juan, ZHAO Lili
CollegeofLifeSciences,HebeiUniversity,Baoding071002 ,China
In order to elucidate the activity and ecological distribution of arbuscular mycorrhizal (AM) fungi in Saibei desert steppe, we sampled soil from three different sites at Erniudian,Shangduzhen and Qinggeletu in Saibei desert steppe in June 2013. Roots ofCaraganakorshinskiiand rhizosphere soil were collected from each site at five depths in the soil profile: 0—10, 10—20, 20—30, 30—40 and 40—50 cm, respectively. The results indicated thatC.korshinskiiformed strong symbiotic relationship with AM fungi. AM fungal spore density and colonization rates were significantly affected by sampling sites and soil depths. The highest spore density occurred at the 0—10cm layer and gradually decreased with soil depths. Hyphal colonization rate was the highest in samples collected at Shangduzhen among the three sites. However, vesicular colonization was the lowest in samples from Qinggeletu, and there were no significant differences among soil layers. Arbuscular colonization differed among the three sites. Both the total colonization rates and colonization intensity of AM fungi in root samples from Shangduzhen were the highest compared to the other two sites, respectively. Spore density strongly correlated with soil organic C, total N, easily extractable glomain (EEG) and total extractable glomalin (TG) (allP<0.01), soil pH (P<0.05), and negatively correlated with available P (P<0.01). Hyphal colonization rate had negative correlation with soil pH, available P, total N and acid phosphatase (allP<0.05). Vesicular and arbuscular colonization rates were strongly correlated with available N and alkaline phosphatase (allP<0.01). EEG and TG had significant positive correlation with available N, total N, alkaline phosphatase and acid phosphatase (allP<0.01), urease (P<0.05), but had no significant correlation with available P. Principal component analysis showed that acid and alkaline phosphatase, TG, total N and organic carbon were the key factors affecting soil nutrient status. The average contents of TG and EEG were 3.19 mg/g and 1.17 mg/g accounting for 7.77% and 3.83% of the total soil organic carbon, and 20.81% and 9.57% of the total soil nitrogen, respectively. Multiple linear regression analysis showed significant linear correlation between TG or EEG and soil organic C and total N, respectively. The results suggest that AM fungal colonization and glomalin are useful indicators for evaluating soil quality and function of desert ecosystem on the basis of its relationship with AM fungal distribution, soil nutrient dynamics, carbon and nitrogen cycle.
arbuscular mycorrhizal (AM) fungi; glomalin; soil factor;Caraganakorshinskii; saibei desert steppe
国家自然科学基金资助项目(31270460)
2014- 01- 16;
2014- 08- 19
10.5846/stxb201401060045
*通讯作者Corresponding author.E-mail: xuelh1256@aliyun.com
许伟,贺学礼,孙茜,王晓乾,刘春卯,张娟,赵丽莉.塞北荒漠草原柠条锦鸡儿AM真菌的空间分布.生态学报,2015,35(4):1124- 1133.
Xu W, He X L, Sun Q, Wang X Q, Liu C M,Zhang J, Zhao L L.The spatial distribution of arbuscular mycorrhizal fungi in the rhizosphere ofCaraganakorshinskiiin Saibei desert steppe.Acta Ecologica Sinica,2015,35(4):1124- 1133.

