澄黄滨珊瑚、大管孔珊瑚和丛生盔形珊瑚排卵前后小穗生长特征
申玉春,杨小东,刘 丽,金 磊
广东海洋大学水产学院,南海水产经济动物增养殖广东普通高校重点实验室,湛江 524025
澄黄滨珊瑚、大管孔珊瑚和丛生盔形珊瑚排卵前后小穗生长特征
申玉春*,杨小东,刘 丽,金 磊
广东海洋大学水产学院,南海水产经济动物增养殖广东普通高校重点实验室,湛江 524025
澄黄滨珊瑚、大管孔珊瑚和丛生盔形珊瑚排卵前后分别采集珊瑚小穗,在实验室条件下进行为期60 d的养殖,观察其生长特性,结果表明:3种珊瑚排卵前后骨骼密度变化在1.541—2.137 g/cm3之间,差异不显著。3种珊瑚小穗的生长率表现出相对一致的变化趋势,同一规格珊瑚小穗排卵前期生长率明显高于排卵后期;同一时期大规格珊瑚小穗生长率明显高于小规格珊瑚小穗,而且养殖中后期生长较快,养殖前期生长较慢,差异显著(P<0.05)。澄黄滨珊瑚小穗边缘组织延伸度排卵后期大于排卵前期,大管孔珊瑚小穗边缘组织延伸度排卵前期大于排卵后期,以上两种珊瑚的小规格珊瑚小穗与大规格珊瑚小穗组织延伸度相当。随着养殖时间的持续,丛生盔形珊瑚小穗螅体增殖速率加快,各养殖阶段螅体数差异显著(P<0.05),珊瑚小穗规格和养殖季节对其小穗螅体增殖数量没有显著影响。3种珊瑚小穗生长指标间多呈显著正相关,仅大管孔珊瑚小穗初始直径、初始重量与组织延伸度间,以及丛生盔形珊瑚小穗初始重量与初始螅体数量、生长率间相关性不明显。
生长率;组织延伸度;排卵期;珊瑚小穗
珊瑚礁是海洋生态系统的重要组成部分,在海洋生物资源增殖、海洋环境保护、海洋减灾和降低大气温室效应等方面,均发挥着重要的作用。然而,长期以来由于人们对珊瑚的生物特性和生态价值认识不足,公众的保护意识淡薄,珊瑚礁面临着严重的生态危机。因此,研究珊瑚的生物学特性、阐明其在海洋生态系统中的作用,对海洋生态系统的保护,以及退化珊瑚礁的修复和重建有重要的指导意义。珊瑚小穗(nubbins)是来源于单个珊瑚螅体且遗传结构上相同的同株系珊瑚片段。珊瑚小穗可以从珊瑚礁上凿取分离,作为珊瑚生物学研究和珊瑚移植的材料。早期研究者凿取的珊瑚小穗直径较大,超过10 cm[1- 2],对供体珊瑚礁造成较大的生态压力[3- 4]。关于珊瑚生物学的研究,主要集中在珊瑚礁生态毒理学分析[5],温度与珊瑚光合作用和呼吸作用的关系[6],饲料和光照对造礁石珊瑚氨吸收的影响[2],珊瑚钙化对海水酸化的响应生理机制[7],甾体类雌激素对珊瑚生长和繁殖的影响[8]等方面。本文以广东徐闻海域滨珊瑚科(Poritidae)的澄黄滨珊瑚(Poriteslutea)、大管孔珊瑚(Gonioporadjiboutiensis)和枇杷珊瑚科(Oculinidae)的丛生盔形珊瑚(Galaxeafascicularis)为研究对象,研究其繁殖期前后的生长特性,为确定珊瑚小穗材料的合理采样规格和移植培育期提供理论依据。
1 材料与方法
1.1 材料
2012年3月份和7月份分别在徐闻珊瑚礁国家级自然保护区采集澄黄滨珊瑚、大管孔珊瑚和丛生盔形珊瑚活体样本,运回实验室,暂养在规格为(180 cm×45 cm×60 cm)的玻璃水簇箱中,暂养水温27.5 ℃,盐度32,水族用300 W荧光灯提供光源,每天6:00—18:00给予12 h光照,循环水流速度2000 L/h,每2 d换水1次,换水量50%,投喂丰年虾幼体1次/d,每周添加浓度为200 mg/L氯化钙4 mL。根据对徐闻珊瑚礁保护区海域珊瑚性腺发育与繁殖周期的观察,3月份珊瑚生殖腺发育至中后期,排卵期集中在5—6月份,7月份已经排卵完毕[9]。因此3月份样品为排卵前期,7月份样品为排卵后期。
1.2 方法
1.2.1 珊瑚小穗的分解与养殖
珊瑚暂养1周后,用铁钳子将珊瑚分解为厚度0.8—1.2 cm的珊瑚小穗,确保每个小穗形状规则,底部平整,含有一定数量的完整螅体。珊瑚小穗按直径大小或螅体数量不同划分为两种规格,澄黄滨珊瑚小穗直径为A小于2 cm和B大于等于2 cm;大管孔珊瑚小穗直径为C小于3 cm和D大于等于3 cm;丛生盔形珊瑚小穗螅体数为E小于等于4个和F:大于4个。分解获得每种规格珊瑚小穗各24块。用新鲜海水轻微淋洗珊瑚小穗边缘分散的组织,用防水胶带纸将其附着于白瓷板上,置于规格为50cm×40cm×50cm的玻璃水簇缸驯养。整个操作过程保持珊瑚浸没于海水中或短时间暴露于空气中,尽可能减少操作对珊瑚的伤害。
驯养1周后开始正式养殖实验,驯养、养殖实验条件与暂养一致,养殖时间为60 d。养殖实验第12天随机抽取每种规格珊瑚小穗8个,用洗牙器冲洗去除软体组织,测定珊瑚小穗骨骼密度。同时测定剩余16个珊瑚小穗浮重和边缘组织延伸度,以后分别在实验第24、36、48和60天测定珊瑚小穗浮重和边缘组织延伸度。用520M-01A-便携式多参数水质分析仪监测水体温度、溶氧、pH、盐度变化。
1.2.2 珊瑚小穗生长指标测定
(1) 骨骼密度
根据公式[10]计算珊瑚骨骼密度:
Dcoral=Dwater/〔1-(Wtin water/Wtin air)〕
式中,Dcoral为珊瑚骨骼密度(g/cm3);Dwater为养殖海水密度(g/cm3);Wtin water为珊瑚骨骼在海水中重量(g);Wtin air为珊瑚骨骼在空气中重量(g)。
(2) 组织延伸度
澄黄滨珊瑚和大管孔珊瑚因珊瑚杯相对较小、螅体密度较大,组织延伸度以边缘组织延伸的长度衡量(分解后的珊瑚小穗骨骼壁上没有组织覆盖,组织延伸度的衡量以小穗组织未覆盖的骨骼边缘作为起点进行测量)。丛生盔形珊瑚珊瑚杯相对较大、螅体密度较小,组织延伸度以螅体增殖数衡量。
(3) 珊瑚生长率
用经改造AL204型半微量电子天平[11]测定珊瑚小块浮重,根据公式[10]换算成空气中的实际重量:
Wtin air=Wtin water/〔1-(Dwater/Dcoral)〕
式中,Wtin air为珊瑚小穗在空气中重量(mg);Wtin water为珊瑚小穗在海水中重量(mg);Dwater为养殖海水密度(g/cm3);Dcoral为珊瑚骨骼密度(g/cm3)(珊瑚组织生长对骨骼密度的影响忽略不计[6])。
用公式[7]计算珊瑚生长率:
V=(W2-W1)/T
式中,V为珊瑚生长率(mg /d);W2和W1为分别为珊瑚小穗培养给定时间段前后的重量(mg);T为珊瑚小穗的培养时间段为12 d。
1.2.3 数据分析
采用SPSS 13.0 for Windows统计软件进行单因素方差分析、相关性分析和Duncan多重比较,以α=0.05和α=0.01作为差异显著水平,描述性统计值采用平均值±标准误(Mean±S.D)表示。
2 结果与分析
2.1 珊瑚骨骼密度
澄黄滨珊瑚、大管孔珊瑚和丛生盔形珊瑚排卵前后骨骼密度变化在1.541—2.137 g/cm3之间(表1),统计分析同种珊瑚排卵前后骨骼密度差异不显著。澄黄滨珊瑚排卵前后骨骼密度分别为1.541 g/cm3和1.563 g/cm3;大管孔珊瑚分别为2.105g/cm3和2.088 g/cm3,丛生盔形珊瑚分别为2.117g/cm3和2.137 g/cm3。

表1 3种珊瑚排卵前后骨骼密度的变化(g/cm3)Table 1 The skeleton density of three pre-spawn and post-spawn coral species nubbins
同一列数值标有不同字母表示达到显著差异(P< 0.05)
2.2 珊瑚小穗生长率
澄黄滨珊瑚、大管孔珊瑚和丛生盔形珊瑚小穗的生长率表现出相对一致的变化趋势(表2),同一规格珊瑚小穗排卵前期生长率明显高于排卵后期,同一时期大规格珊瑚小穗生长率明显高于小规格珊瑚小穗,而且养殖中期后期生长较快,养殖前期生长较慢,统计分析差异显著(P<0.05)。
澄黄滨珊瑚直径小于2 cm和大于等于2 cm两种规格珊瑚小穗生长率,排卵前生长率最大值出现在37—48 d,分别达到(7.85±1.95)和(15.18±2.07) mg/d,排卵后最大值出现在25—36 d,分别为(6.76±1.03)和(9.45±4.46) mg/d。
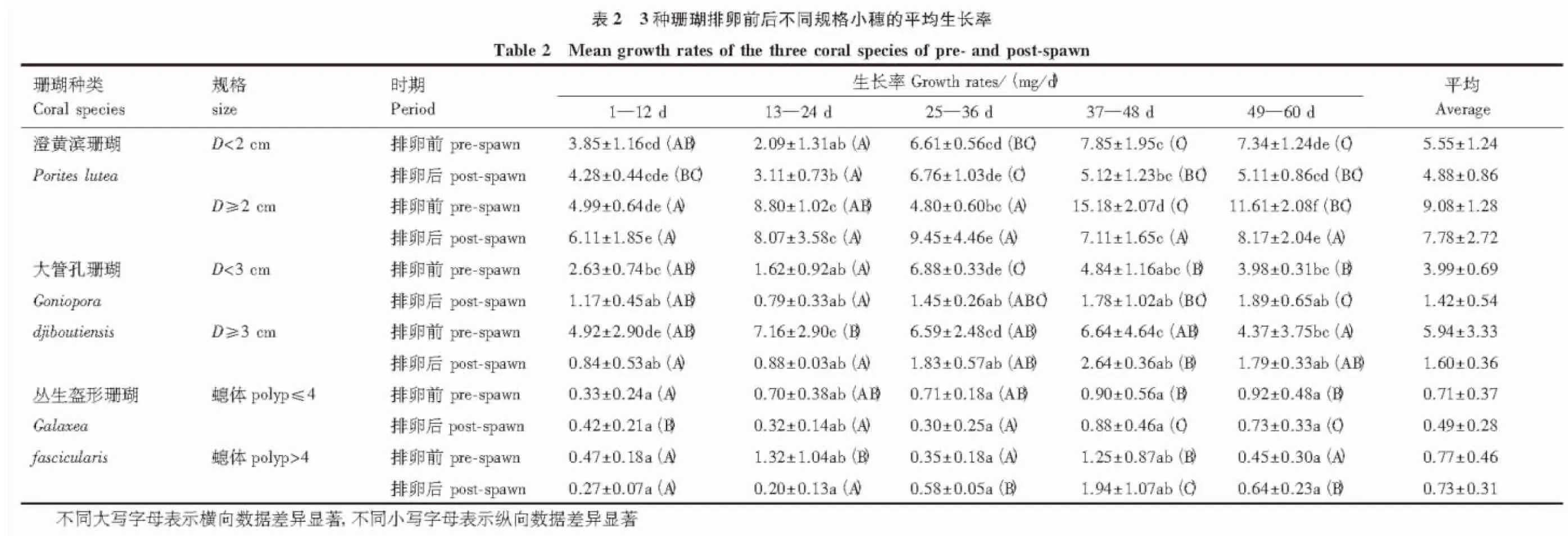
大管孔珊瑚直径小于3 cm和大于等于3 cm两种规格珊瑚小穗生长率,排卵前生长率最大值出现在25—36 d和13—24 d,分别为(6.87±0.33)和(7.16±2.90) mg/d,排卵后最大值出现在49—60 d和37—48 d,分别为(1.887±0.65)和(2.639±0.36) mg/d。
丛生盔形珊瑚螅体数为小于等于4个和大于4个两种规格珊瑚小穗生长率,排卵前生长率最大值出现在49—60 d和13—24 d,分别为(0.92±0.48)和(1.32±1.04) mg/d,排卵后最大值出现在49—60 d和37—48 d,分别为(0.73±0.33)和(1.94±1.07) mg/d。
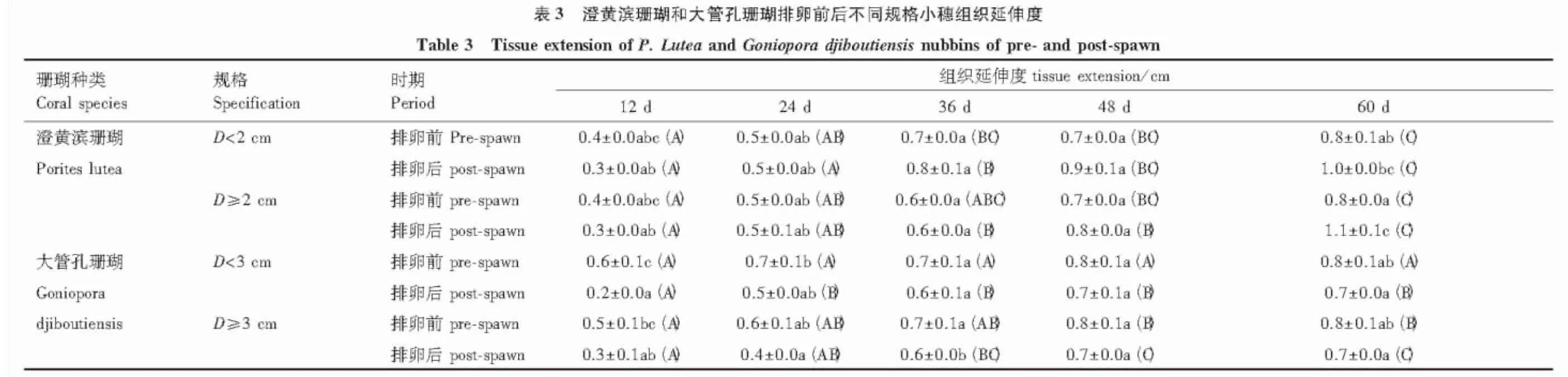
2.3 珊瑚小穗组织延伸度
澄黄滨珊瑚和大管孔珊瑚小穗边缘组织延伸度,随着养殖时间的延长而加大,各养殖阶段组织延伸度相差显著(P<0.05)(表3)。澄黄滨珊瑚小穗边缘组织延伸度排卵后期大于排卵前期,小规格珊瑚小穗与大规格珊瑚小穗组织延伸度相当。大管孔珊瑚小穗边缘组织延伸度排卵前期大于排卵后期,小规格珊瑚小穗与大规格珊瑚小穗组织延伸度相当。
丛生盔形珊瑚小穗螅体随着养殖时间的延长而不断增殖,各养殖阶段小穗螅体数量相差显著(P<0.05)(表4)。排卵期和珊瑚小穗规格对丛生盔形珊瑚小穗螅体增殖数量没有显著影响。
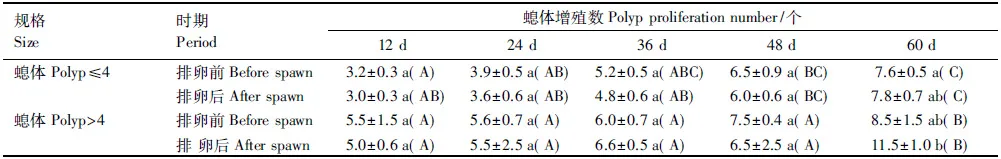
表4 丛生盔形珊瑚排卵前后不同规格小穗螅体增殖数量的变化Table 4 Polyp proliferation number of Galaxea fascicularis nubbins of pre- and post-spawn
2.4 珊瑚小穗生长指标间的相关性
2.4.1 珊瑚小穗初始直径与初始重量、生长率、组织延伸度间的相关性
澄黄滨珊瑚小穗初始直径与初始重量、生长率之间呈极显著正相关,相关系数分别为0.755和0.711,与组织延伸度间呈显著正相关(0.845);大管孔珊瑚小穗初始直径与初始重量、生长率之间呈极显著正相关,相关系数分别为0.885和0.944,与组织延伸度间相关性不显著(0.354)(表5);丛生盔形珊瑚小穗初始螅体数量与生长率、最后螅体数之间有显著正相关,相关系数分别为0.786和0.747,与初始重量间相关性不明显(0.138)(表6)。
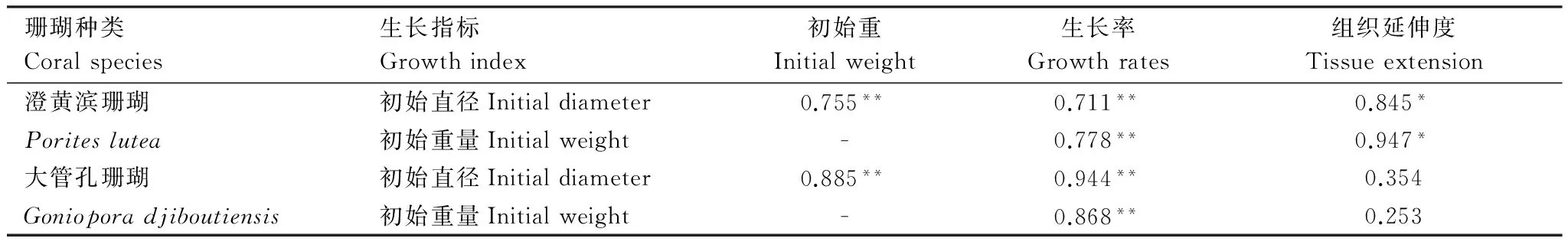
表5 珊瑚小穗初始直径、初始重量、生长率、组织延伸度间的相关系数(n=8)Table 5 Correlation coefficient of initial diameter, initial weight, growth rates and tissue extension of coral nubbins
*表示差异显著(P<0.05),**表示差异极显著(P<0.01)
表6 丛生盔形珊瑚小穗初始螅体数、初始重量、生长率、最终螅体数间的相关系数(n=8)
Table 6 Correlation coefficient of initial number of polyp, initial weight, growth rates and final number of polyp ofGalaxeafascicularisnubbins

生长指标Growthindex初始重量Initialweight生长率Growthrates最终螅体数Finalnumberofpolyp初始螅体数Initialnumberofpolyp0.1380.786*0.747*初始重量Initialweight-0.1010.948**
2.4.2 珊瑚小穗初始重量与生长率、组织延伸度间的相关性
澄黄滨珊瑚小穗初始重量与生长率之间具有极显著正相关(0.778),与组织延伸度间呈显著正相关(0.947);大管孔珊瑚小穗初始重量与生长率之间具有极显著正相关(0.885),与组织延伸度间相关性不显著(0.253)(表5);丛生盔形珊瑚小穗初始重量与最终螅体数之间有极显著正相关(0.948),与生长率间相关性不明显(0.101)(表6)。
3 讨论
3.1 珊瑚性腺发育对生长的影响
澄黄滨珊瑚、大管孔珊瑚和丛生盔形珊瑚小穗的生长率随养殖时间延长而加快,多在养殖中后期37—48d和49—60d时间段获得最大的生长率,这与Tarrant 等[8]在实验室条件下研究的Montiporacapitata珊瑚生长率从40 d开始明显加快,第60天达到最大值研究结果相似。而且Shafir等[12]在红海海域悬浮式抚育床养殖珊瑚小穗144—200 d,体积相比于原来增加了13—46倍,高度增加了3.5倍,306 d后,体积增加了147—163倍,高度为原来的6倍,开始养殖的5—10个月,1.67%的日生长率,也表现出这种生长规律。这主要是因为珊瑚小穗养殖初期组织、骨骼损伤严重,光合作用得到的能量主要用于修复自身,生长率较低。当这一修复过程完成,珊瑚小穗状态恢复到正常状态,光合作用得到的能量主要用于组织生长和骨骼钙化,从而生长率加快。
生态系统中生物可获得的物质和能量是有限的,生物必须在用于生长和繁殖间进行分配[13]。Tradeoffs等[14]提出用于当前繁殖活动能量分配高,伴随未来生存能力和繁殖力的下降。Crisp and Patel等[15]抑制藤壶繁殖发现其比未抑制繁殖的个体生长更快,个体更大。珊瑚能量输入主要通过虫黄藻进行光合作用和自身触手过滤、捕捉海水中的食物,而能量分配主要用于自身生长与繁殖[16- 17]。本研究中3种珊瑚在排卵季节前的平均生长率明显高于排卵季节后,组织延伸度则相反,这可能是珊瑚将有限资源用于新陈代谢、配子的发育等繁殖过程是以消耗用于维持自身活动过程和自身结构的能量为代价。珊瑚体内的脂质含量占自身组织的30%—40%[18],由虫黄藻合成并转移到珊瑚虫体内[19]。这些脂质分布在珊瑚组织结构间,小部分存在于珊瑚粘液中[20],大部分存在于繁殖细胞和卵子中,作为珊瑚体的能量储备,有利于提高排卵后受精成功率、其后胚胎的发育及排卵后珊瑚体自身恢复正常生长状态[21],而珊瑚排卵过程中排出大量卵子的同时伴随粘液的释放。Ward等[22]指出珊瑚繁殖是一个耗能过程,珊瑚繁殖输出量越大,珊瑚组织内储存的脂质含量越少,生长越慢,并且发现孵卵珊瑚P.damicornis排出幼虫前生长较排出幼虫后快。
3.2 珊瑚小穗生长指标间的相关性分析
澄黄滨珊瑚和大管孔珊瑚小穗初始直径大小与初始重量极显著相关,丛生盔形珊瑚小穗初始螅体数量与初始重量不相关。这可能是澄黄滨珊瑚和大管孔珊瑚各自螅体大小差异较小,表面相对平坦,骨骼密度较为均匀,而丛生盔形珊瑚杯状突起,螅体间大小差异较大,骨骼密度不均匀造成的。澄黄滨珊瑚重量变化与组织延伸度显著相关,大管孔珊瑚重量变化与组织延伸度不相关,丛生盔形珊瑚重量变化与螅体增加数显著相关。说明澄黄滨珊瑚和丛生盔形珊瑚在生长前期能量主要分配用于组织延伸或螅体增殖,生长后期能量主要分配用于骨骼钙化,大管孔珊瑚则相反。
澄黄滨珊瑚和大管孔珊瑚小穗初始直径、初始重量与生长率显著或极显著相关,丛生盔形珊瑚小穗初始螅体数量与螅体增加数量显著相关,澄黄滨珊瑚和丛生盔形珊瑚小穗初始直径、初始重量与组织延伸度显著或极显著相关。而Shafir等[23]在非原位养殖条件下,也研究发现珊瑚Stylophorapistillata片段存活率和边缘生长率较高,3个月内螅体数增加了5—6倍,组织表面积和螅体数呈正相关关系。说明珊瑚小穗初始直径、初始重量等对珊瑚的生长有影响。同种珊瑚小穗初始直径、重量越大螅体数越多,这就意味着更多地螅体通过群生系统可共享能量,更有利于快速适应变化着的环境,促进珊瑚的生长。
排卵季节前后澄黄滨珊瑚、大管孔珊瑚、丛生盔形珊瑚最大生长率依次减小,表现出明显的差异,养殖结束时澄黄滨珊瑚小穗组织延伸度相比于大管孔珊瑚较大。而3种珊瑚骨骼密度、组织厚度、螅体大小恰恰相反,依次增加,这可能是骨骼密度越小,钙化速率越快,同时组织延伸速率越快的原因。Scoffin等[24]在普吉岛11个裙礁研究也发现珊瑚平均密度和延伸率成反比,但其原因仍需进一步研究。
[1] Fox H E, Pet J S, Dahuri R, Caldwell R L. Recovery in rubble fields: long-term impacts of blast fishing. Marine Pollution Bulletin, 2003, 46(8): 1024- 1031.
[2] Grover R, Maguer J F, Reynaud-Vaganay S, Ferrier-Pages C. Uptake of ammonium by the scleractinian coralStylophorapistillata: effect of feeding, light, and ammonium concentrations. Limnology and Oceanography, 2002, 47(3): 782- 790.
[3] Rinkevich B. Conservation of coral reefs through active restoration measures: recent approaches and last decade progress. Environmental Science and Technology, 2005, 39(12): 4333- 4342.
[4] Mbijea N E J, Spanier E, Rinkevich B. Testing the first phase of the ‘gardening concept’ as an applicable tool in restoring denuded reefs in Tanzania. Ecological Engineering, 2010, 36(5): 713- 721.
[5] Shafir S, Van Rijin J, Rinkevich B. The use of coral nubbins in coral reef ecotoxicology testing. Biomolecular Engineering, 2003, 20(4/6): 401- 406.
[6] Coles S L, Jokiel P L. Effects of temperature on photosynthesis and respiration in hermatypic corals. Marine Biology, 1977, 43(3):209- 216.
[7] Marubini F, Ferrier-Pagès C, Furla P, Allemand D. Coral calcification responds to seawater acidification: a working hypothesis towards a physiological mechanism. Coral Reefs, 2008, 27(3):491- 499.
[8] Tarrant A M, Atkinson M J, Atkinson S. Effects of steroidal estrogens on coral growth and reproduction. Marine Ecology Progress Series, 2004, 269: 121- 129.
[9] Shen Y C, Yang X D, Liu L, Li Z P. Study of gonadal development and fecundity ofPoriteslutea,GonioporadjiboutiensisandGalaxeafascicularis. Oceanologia et Limnologia Sinica, 2014, 45(2): 314- 321.
[10] Jokiel R L, Maragos J E, Franzisket L. Coral growth: buoyant weight technique // Stoddart D R, Johannes R E, eds. Coral Reefs: Research Methods. Monographs on Oceanographic Methodology, 1978, 5: 529- 542.
[11] Davies P S. Short-term growth measurements of corals using an accurate buoyant weighing technique. Marine Biology, 1989, 101(3): 389- 395.
[12] Shafir S, Van Rijin J, Rinkevich B. Steps in the construction of underwater coral nursery, an essential component in reef restoration acts. Marine Biology, 2006, 149(3): 679- 687.
[13] Antonovics J. Concepts of resource allocation and partitioning in plants // Staddon J E R, ed. Limits to Action: The Allocation of Individual Behaviour. New York: Academic Press, 1980: 1- 35.
[14] Calow P. Adaptive aspects of energy allocation // Tytler P, Calow P, eds. Fish Energetics. Netherlands: Springer Netherlands, 1985: 13- 31.
[15] Crisp D J, Patel B. The interaction between breeding and growth rate in the barnacle Elminius modestus Darwin. Limnology and Oceanography, 1961, 6(2): 105- 115.
[16] Stoddart J A. Asexual production of planulae in the coralPocilloporadamicornis. Marine Biology, 1983, 76(3): 279- 284.
[17] Stoddart J A. Genetical structure within populations of the coralPocilloporadamicornis. Marine Biology, 1984, 81(1): 19- 30.
[18] Stimson J S. Location, quantity and rate of change in quantity of lipids in tissue of Hawaiian hermatypic corals. Bulletin of Marine Science, 1987, 41(3): 889- 904.
[19] Harland A D, Navarro J C, Davies P S, Fixter L M. Lipids of some Caribbean and Red Sea corals: total lipid, wax esters, triglycerides and fatty acids. Marine Biology, 1993, 117(1): 113- 117.
[20] Meikle P, Richards G N, Yellowlees D. Structural investigations on the mucus from six species of coral. Marine Biology, 1988, 99(2): 187- 193.
[21] Stimson J S. Mode and timing of reproduction in some common hermatypic corals of Hawaii and Enewetak. Marine Biology, 1978, 48(2): 173- 184.
[22] Ward S. Two patterns of energy allocation for growth, reproduction and lipid storage in the scleractinian coralPocilloporadamicornis. Coral Reefs, 1995, 14(2): 87- 90.
[23] Shafir S, Jaap V R, Rinkevich B. Nubbing of coral colonies: a novel approach for the development of inland broodstocks. Aquarium Sciences and Conservation, 2001, 3(3): 183- 190.
[24] Scoffin T P, Tudhope A W, Brown B E, Chansang H, Cheeney R F. Patterns and possible environmental controls of skeletogenesis ofPoriteslutea, South Thailand. Coral Reefs, 1992, 11(1): 1- 11.
Study of nubbins growth onPoriteslutea,GonioporadjiboutiensisandGalaxeafascicularisduring pre-spawn and post-spawn
SHEN Yuchun*, YANG Xiaodong, LIU Li, JIN Lei
KeyLaboratoryofAquacultureinSouthChinaSeaforAquaticEconomicAnimalofGuangdongHigherEducationInstitutes,GuangdongOceanUniversity,Zhanjiang524025,China
In the present study,Poriteslutea,GonioporadjiboutiensisandGalaxeafasciculariswere collected to evaulate the nubbins growth performance before and after ovulation under laboratory condition for period of 60 d. The results of present study indicated that there were no significant differences were observed among all treatments, and the skeleton density of coral nubbins ranged from 1.541 to 2.137 g/cm3during pre-spawn and post-spawn. Three kinds of coral growth rate exhibited relatively consistent trend, and the growth rate had significantly higher in corals of pre-spawn than those of post-spawn. The growth rate of large-sized coral spikelets was significantly higher than the small size of coral spikelets during the same period, especially, there were significant difference that the growth rate of the late breeding had more significantly rapid than those in the early breeding. ForPoriteslutea, the marginal tissue elongation of pre-spawn phase had greater than those of post-spawn phase, moreover, forGonioporadjiboutiensis, spikelets marginal tissue elongation greater than preovulatory late ovulation. Tissue extension of pre-spawnGonioporadjiboutiensisnubbins was higher than that of the post-spawn nubbins and that of the small nubbins was slightly higher than that of the big nubbins, but there were no significant differences. With the culture time increasing, polyp proliferation rates ofGalaxeafascicularisnubbins became faster and there were significant differences in polyp proliferation numbers of different stages (P<0.05). However, there were no significant differences between polyp size of proliferation numbe and culture season. Significant positive correlations of all growth index of nubbins among three coral species were obtained, however, there were no correlations between initial diameter and / or weight and tissue extension ofGonioporadjiboutiensisnubbins, and there were no correlation between initial weight/polyp number and growth rates ofGalaxeafascicularis.
growth rate; tissue extension; spawn period; coral nubbins
国家海洋公益性行业科研专项(201105012); 广东省自然科学基金项目(10152408801000005,S2011010000269); 广东省科技计划项目(2011B031100012,2012A020602050)
2013- 04- 07;
日期:2014- 03- 25
10.5846/stxb201304070617
*通讯作者Corresponding author.E-mail: shenyuchun@163.com
申玉春,杨小东,刘丽,金磊.澄黄滨珊瑚、大管孔珊瑚和丛生盔形珊瑚排卵前后小穗生长特征.生态学报,2015,35(2):306- 312.
Shen Y C, Yang X D, Liu L, Jin L.Study of nubbins growth onPoriteslutea,GonioporadjiboutiensisandGalaxeafascicularisduring pre-spawn and post-spawn .Acta Ecologica Sinica,2015,35(2):306- 312.

