不同糖耐量孕妇胰岛素抵抗和胰岛β细胞功能的变化
王崇丹,王淑仪,马影,张丽,许玉凤,王志刚
(1天津市滨海新区塘沽妇产医院,天津300451)
2011年7月,我国卫生部行业标准新的妊娠期糖尿病(GDM)诊断标准实施,新标准下有关GDM患者及无糖耐量受损孕妇在孕早期和孕中晚期的胰岛素抵抗(IR)程度和胰岛β细胞分泌功能的变化报道较少,本研究拟对此进行观察。现报告如下。
1 资料与方法
1.1 临床资料 选择2013年1~6月在天津市滨海新区塘沽妇产医院建卡、排除妊娠前患有代谢性疾病、心血管疾病和肝肾疾病史的单胎初产妇366例,于中晚期(孕24~32周)行OGTT试验,符合GDM诊断标准者为GDM组,不符合者为无糖耐量受损(NGT)组。对GDM组先予饮食、运动指导,饮食控制3~5 d后测定末梢血糖,如血糖控制理想则继续饮食治疗;如果控制不理想,则给予胰岛素治疗,治疗期间仍监测血糖,根据血糖情况调节胰岛素用量。最后至孕足月住院分娩且资料完整的孕妇共248例,其中GDM组30例,NGT组218例。
1.2 方法
1.2.1 一般资料收集 收集受试者年龄、孕次、身高、孕前体质量及既往病史等,计算BMI;定期对孕妇进行产检,监测胎儿生长发育情况,记录新生儿体质量及巨大儿发生情况。
1.2.2 观察指标检测与计算 于孕早期(孕5~12周)和孕中晚期采用葡萄糖氧化酶法检测空腹血糖(FPG),化学发光法检测空腹胰岛素(FINS),计算稳态模型胰岛素抵抗指数(HOMA-IR)及胰岛β细胞分泌指数(HOMA-β)。HOMA-IR=FPG×FINS/ 22.5;HOMA-β=FINS×20/(FPG-3.5)。
1.2.3 统计学方法 采用SPSS17.0统计软件。计量资料采用s表示,组间比较采用t检验;计数资料采用率表示,组间比较采用χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 两组一般情况比较 两组年龄、采血孕周、孕前BMI、新生儿体质量比较,见表1。GDM组出生巨大儿5例(16.67%),NGT组为14例(6.42%),P>0.05。
2.2 两组FPG、FINS、HOMA-IR、HOMA-β比较见表2。
3 讨论
GDM是妊娠期的常见代谢性疾病,严重威胁母婴健康[1]。研究显示,GDM的发病机制与IR及胰岛β细胞功能受损有关[2],而目前评价胰岛β细胞功能的简便方法仍是HOMA模型[3]。本研究结果显示,GDM组BMI高于NGT组,说明孕前肥胖者易发生GDM,与以往研究结果相似[4],有研究证实,肥胖妇女FINS和IR高于非肥胖妇女,易发生糖耐量异常[5]。因此,备孕妇女将体质量控制在正常范围内后再妊娠可能会预防GDM的发生。
表1 两组年龄、采血孕周、孕前BMI、新生儿体质量比较(s)
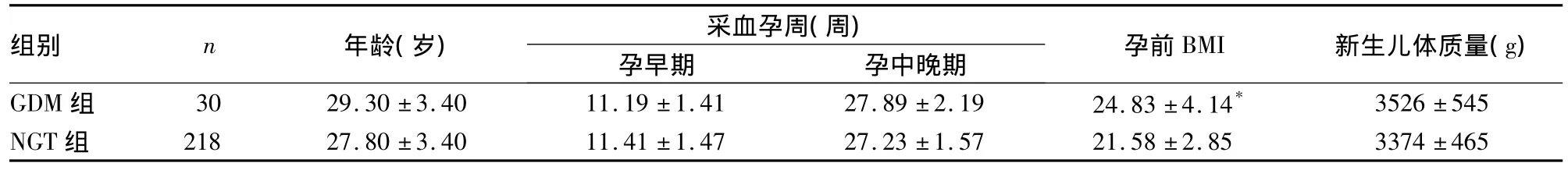
表1 两组年龄、采血孕周、孕前BMI、新生儿体质量比较(s)
注:与NGT组比较,*P<0.05。
组别 n 年龄(岁) 采血孕周(周)孕早期 孕中晚期 孕前BMI 新生儿体质量(g) GDM组 30 29.30±3.40 11.19±1.41 27.89±2.19 24.83±4.14*3526±545 NGT组 218 27.80±3.40 11.41±1.47 27.23±1.57 21.58±2.85 3374±465
表2 两组FPG、FINS、HOMA-IR、HOMA-β比较(s)
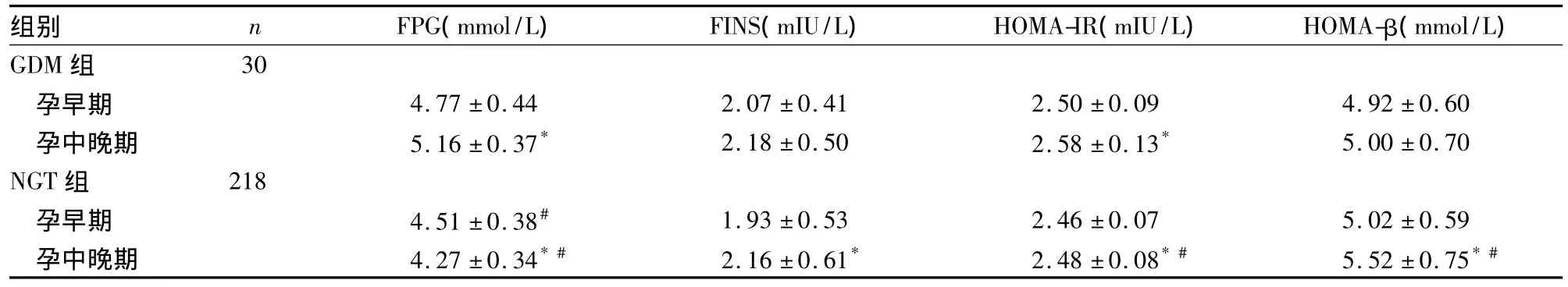
表2 两组FPG、FINS、HOMA-IR、HOMA-β比较(s)
注:与同组孕早期比较,*P<0.05;与NGT组同时点比较,#P<0.05。
组别 n FPG(mmol/L) FINS(mIU/L) HOMA-IR(mIU/L) HOMA-β(mmol/L) GDM组30孕早期 4.77±0.44 2.07±0.41 2.50±0.09 4.92±0.60孕中晚期 5.16±0.37* 2.18±0.50 2.58±0.13* 5.00±0.70 NGT组 218孕早期 4.51±0.38# 1.93±0.53 2.46±0.07 5.02±0.59孕中晚期 4.27±0.34*# 2.16±0.61* 2.48±0.08*# 5.52±0.75*#
妊娠期胎儿主要通过胎盘从母体获取葡萄糖来获取能量,因此孕妇血浆葡萄糖水平随妊娠进展而降低[6],故空腹时孕妇清除葡萄糖能力较非妊娠期增强。本研究结果显示,NGT组FPG在孕中晚期较孕早期降低,符合孕期糖代谢特点;而GDM组不降反升,且FPG在孕中晚期、孕早期均高于NGT组,提示GDM患者孕前即有慢性IR[7]。在孕中晚期时,GDM患者妊娠期生理性的IR与孕前的慢性IR叠加[8],无法降低FPG,最终导致GDM。因此,可寻找一个合理的界值作为孕早期GDM的诊断标准,以尽早干预改善预后。
本研究结果显示,两组孕中晚期HOMA-IR与孕早期比较,差异均有统计学意义,说明妊娠期妇女普遍存在生理性IR,与相关研究结果相似[9],但机制尚不十分清楚[10]。另外,两组孕早期HOMA-IR无明显差异,而GDM组孕中晚期明显高于NGT组,与某些学者研究相似[11]。这说明随着妊娠进展,GDM患者可能表现出更明显的IR。另外,本研究结果显示,两组孕早期HOMA-β无明显差异,而孕中晚期GDM组明显低于NGT组。这说明随着妊娠的进展,GDM患者虽然IR增加,但胰岛β细胞分泌功能并未增加;NGT孕妇虽然HOMA-IR增加,但HOMA-β也增加。所以,NGT孕妇能将FPG控制在正常水平,而GDM患者则不能[12]。两组孕中晚期HOMA-β与孕早期比较,GDM组无明显差异,而NGT组明显增高,可进一步证明GDM患者在孕中晚期β细胞分泌功能存在缺陷。本研究结果还显示,两组新生儿体质量及巨大儿发生率差异均无统计学意义,与相关报道一致[13,14],可能与GDM患者严格控制血糖有关。
[1]赖丽萍,陆泽元,邵豪.妊娠糖尿病筛查与诊断的现状[J].国际内分泌代谢杂志,2010,30(3):180-182.
[2]张宏秀,陈文玮,孙丽洲.妊娠期糖尿病胰岛素抵抗的研究进展[J].中国妇产科临床杂志,2011,12(2):154-156.
[3]张志坤,陈叙,常颖.血糖筛查异常的妊娠妇女胰岛β细胞功能评价[J].国际妇产科学杂志,2011,38(2):308-160.
[4]欧阳凤秀,沈福民,江峰,等.妊娠期糖尿病的危险因素研究[J].中华预防医学杂志,2002,36(6):378-381.
[5]李林霞,席晓薇,严沁,等.妊娠期糖耐量异常妇女胰岛功能与胰岛素抵抗的相关研究[J].现代妇产科进展,2006,15(7): 522-524.
[6]谢幸,苟文丽.妇产科学[M].8版.北京:人民卫生出版社,2013:77.
[7]耿蔷,肖小敏,潘观玉.妊娠期糖尿病患者孕中期至孕足月胰岛素抵抗变化的临床分析[J].重庆医学,2010,39(14): 1860-1862.
[8]吴惠华,王蕴慧,李焱,等.妊娠期糖尿病患者与正常孕妇妊娠中晚期胰岛素抵抗及胰岛B细胞功能观察[J].中国实用妇科与产科杂志,2012,28(7):504-508.
[9]牛健民,郭晓玲,梁海英,等.妊娠期糖尿病与胰岛素抵抗和胰岛β细胞功能关系的研究[J].广东医学,2004,25(9): 1029-1030.
[10]万惠,姚伟峰,钱铁镛,等.妊娠糖尿病胰岛素抵抗和胰岛β细胞分泌功能的变化[J].江苏医药,2013,39(3):337-339.
[11]吴仁仁.妊娠期糖尿病妇女胰岛素抵抗的相关性研究[J].中国妇幼保健,2011,26(20),3079-3081.
[12]武冬娜,周勇,唐招平,等.妊娠期糖代谢异常患者胰岛素抵抗和胰岛β细胞功能的研究[J].中国优生与遗传杂志,2012,20 (9),56-57.
[13]张宏秀,赵冬梅,陈文玮.妊娠期糖耐量异常孕妇胰岛素抵抗与不良妊娠结局的关系[J].中国妇幼保健,2013,28(30): 4942-4945.
[14]杨桂华,罗卓颖.妊娠期糖尿病孕妇体质量管理与巨大儿和剖宫产的相关性分析[J].临床合理用药,2013,6(8):123-124.

