高脂饮食联合链脲佐菌素诱导2型糖尿病大鼠模型的研究进展
祁秀茹 王红杰
高脂饮食联合链脲佐菌素诱导2型糖尿病大鼠模型的研究进展
祁秀茹 王红杰
2型糖尿病;高脂饮食;链脲佐菌素;大鼠
随着人们生活水平的提高,2型糖尿病发病率和患病率在全球范围内逐年攀升[1,2],据 WHO 统计,2011年全世界患2型糖尿病人口已达到3.46亿,预计在2030年人数将翻倍[3],2型糖尿病严重威胁人类健康。为进一步研究2型糖尿病的病因、发病机制,探讨更有效的治疗方法,需要大量的2型糖尿病动物模型进行基础研究。本文简要综述2型糖尿病动物模型的特点和制备方法,重点分析高脂饮食(HFD)/链脲佐菌素(STZ)诱导的2型糖尿病大鼠模型的影响因素。
1 2型糖尿病动物模型的特点
2型糖尿病的主要病理生理特点为肥胖、胰岛素抵抗[4,5]以及胰岛 β 细胞数量下降和功能缺失[6,7]。发病初期表现为胰岛素调节血糖、脂质以及蛋白质代谢的功能逐渐下降,发展成不同程度的2型糖尿病。2型糖尿病早期以血糖、血脂代谢紊乱以及胰岛素抵抗为主,晚期以胰岛功能相对缺乏而依赖胰岛素维持代谢平衡[8,9]。因此,理想的2型糖尿病大鼠模型需具备以上特点。目前,2型糖尿病动物模型多选用大鼠或小鼠,其生命周期短,环境条件及遗传因素容易控制,来源广泛,是比较理想的试验动物。
2 2型糖尿病动物模型制备方法
目前,2型糖尿病动物模型制备方法主要有以下三种:
2.1 自发性2型糖尿病动物模型的制备:自发性2型糖尿病动物模型是指自然发生的,或通过遗传培育而保留下来的动物疾病模型。虽然其胰岛素抵抗症状明显,但未能体现出环境因素如饮食、肥胖等在2型糖尿病发病中的作用[10,11]。此外,自发性2型糖尿病动物模型来源极少,对饲养和繁殖条件要求高,需一定时间发病,且价格昂贵,使其难以得到广泛应用,很少作为科研首选。
2.2 转基因2型糖尿病动物模型的制备:转基因动物是通过改变某种特定基因而得到该动物特定的遗传表现。敲除特定的糖尿病相关基因可以得到2型糖尿病动物模型:胰岛素受体底物-1(IRS-1)和β细胞葡萄糖激酶(GK)双基因敲除杂合体小鼠[12,13];单基因 IRS-2敲除小鼠[14]。此外,有美国国立卫生研究院建立的骨骼肌特异性胰岛素样生长因子1受体基因显性位点失活突变的转基因小鼠(MKR小鼠),其新生MKR小鼠的糖尿病性状能稳定遗传[15]。虽然转基因糖尿病动物模型的病理生理状态接近人2型糖尿病,但其造价昂贵,技术复杂,目前国内仅有少数研究采用,很难在基础研究中大规模普及应用。
2.3 HFD/STZ诱导2型糖尿病动物模型的制备:目前应用最广的2型糖尿病动物模型是HFD/STZ诱导的2型糖尿病大鼠模型。这种模型制作前期利用HFD喂养,诱导大鼠肥胖、脂质代谢紊乱、胰岛素抵抗[16,17],后期再联合 STZ 静脉或腹腔注射,造成胰岛损伤、胰岛细胞功能相对缺乏[18,19],使血糖升高,二者有效结合,制备2型糖尿病大鼠模型[20-22]。这种模型制备方法成本低、所需时间较短、操作方法简便易于掌握,而且制备的大鼠模型糖尿病症状稳定,接近人2型糖尿病,比较适合更多的2型糖尿病基础研究。
3 HFD/STZ诱导2型糖尿病大鼠模型的影响因素
3.1 年龄2型糖尿病患者多以老年人为主[23],表现为胰岛素抵抗,胰岛素相对缺乏。以往研究多选用6个月龄以下的大鼠制备2型糖尿病模型,但随着时间延长,糖尿病症状逐渐减轻。其原因可能与大鼠月龄小,胰岛β细胞再生能力强,胰岛功能恢复有关[24]。而老龄啮齿类动物(年龄大于1年),胰岛β细胞破坏以后无再生能力[25]。因此,2型糖尿病大鼠模型制备时必须考虑大鼠的年龄,选用6个月龄以下的大鼠制备的2型糖尿病模型时应注意其胰岛β细胞的再生。
3.2 HFDHFD是通过改变饮食结构引起大鼠肥胖、高血脂,进一步诱发胰岛素抵抗的重要手段。高脂饮食可导致体内糖脂代谢紊乱,通过糖脂肪酸循环、胰岛素信号转导等多个途径抑制糖储存,降低胰岛素敏感性,进而导致胰岛素抵抗的发生。此外,治疗肥胖可以减轻胰岛素抵抗,缓解糖尿病症状[26-28],可见肥胖是胰岛素抵抗主要诱发因素之一[29]。HFD喂养时间,HFD中脂肪、碳水化合物比例,对于诱导2型糖尿病大鼠胰岛素抵抗有一定程度影响,如表1所示:Khan等[30-32]的实验中,HFD时间均设计为2周,但Hussein等将HFD脂肪、碳水化合物比例分别设计为23%、3%,与Khan设计的HFD饮食结构相比降低了碳水化合物比例,同时提高了脂肪比例,结果提高了大鼠的胰岛素抵抗指数,由此推断脂肪比例的高低会影响大鼠胰岛素抵抗程度;而Islam等将HFD脂肪、碳水化合物比例分别设计为 20%、47%[32],与 Hussein 等[31]设计的HFD饮食结构相比极大提高了HFD碳水化合物比例,略降低了脂肪比例,结果进一步提高了大鼠的胰岛素抵抗指数,由此推断碳水化合物比例的高低也会影响大鼠胰岛素抵抗程度。此外,笔者未见HFD脂肪比例>60%的报道,推测饲料脂肪比例过高影响大鼠食欲和进食量,反而不利于造模成功。由此可见,HFD脂肪、碳水化合物比例都可能影响大鼠胰岛素抵抗的形成。此外,文献报道HFD 2个月与HFD 1个月诱导大鼠2型糖尿病,均联合小剂量STZ 15 mg/kg尾静脉注射1次,结果HFD 1个月组大鼠未成模,平均血糖只有5.63 mmol/L,而HFD 2个月组大鼠平均血糖高达23.4 mmol/L,并且在STZ注射2个月之后,大鼠空腹血糖稳定在16.92 mmol/L,K-value值显著低于正常对照组大鼠,胰岛素不敏感,胰岛素抵抗明显,可见HFD时间也会影响大鼠2型糖尿病的诱导[33]。综上所述,2型糖尿病大鼠模型制备时须要综合考虑HFD脂肪、碳水化合物比例和时间长短,可在一定范围内适当调整。见表1。
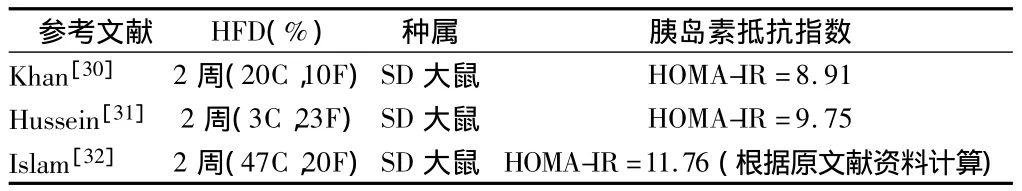
表1 HFD/STZ 2型糖尿病大鼠模型HFD脂肪比例归纳总结
3.3 STZSTZ具有细胞毒性,可优先进入并积聚在胰岛β细胞内,对大鼠胰岛β细胞高选择性破坏,造成胰岛素合成和分泌下降,血糖紊乱,诱发糖尿病[34,35]。并且已有研究显示,1型糖尿病患者胰岛细胞损伤多达60% ~80%[36],2型糖尿病患者(5年病史)胰岛细胞损伤大约在24%[37]。因此,有人对2型糖尿病大鼠模型制备时STZ的使用剂量及次数做了探讨[22],发现STZ 30 mg/kg腹腔注射1次,2型糖尿病大鼠成模率仅为35%,且平均空腹血糖为7.92 mmol/L;加大STZ剂量至45 mg/kg腹腔注射1次,大鼠平均空腹血糖水平高达24.5 mmol/L,成模率100%,但糖尿病大鼠胰岛素敏感性与空白对照组大鼠无差异,胰岛素抵抗不明显,其症状更接近人 1型糖尿病;后又以 STZ 30 mg/kg腹腔注射2次(STZ注射1周后空腹血糖低于7.8 mmol/L的再次以相同剂量腹腔注射STZ),结果发现大鼠血糖可以连续4周都稳定在14 mmol/L左右,同时胰岛素敏感性低,胰岛素抵抗明显,症状接近人2型糖尿病,且成模率达85%。可见,STZ的注射剂量以及注射次数影响STZ的毒性,进而影响胰岛β细胞的存活量,最终影响2型糖尿病大鼠成模,并且这一结论与 Islam 等[32,38]的实验结论相一致。因此,在HFD/STZ诱导2型糖尿病大鼠模型时需合理设计STZ的注射剂量以及注射次数。
4 HFD/STZ诱导
2型糖尿病动物模型的判定2型糖尿病的主要病理特点为胰岛素抵抗[4,5],血糖升高是胰岛素分泌相对不足而其自身无法完全代偿时出现的临床症状。2012年世界卫生组织以及美国糖尿病协会2型糖尿病患者诊断标准为[39]:Ⅰ:糖化血红蛋白(HbA1c)≥6.5%,Ⅱ:FPG≥7.0 mmol/L(126 mg/dl),Ⅲ:OGTT 2 h PG≥11.1 mmol/L(200 mg/dl),Ⅳ:有高血糖典型症状或高血糖危症的患者,随机血糖≥11.1 mmol/L(200 mg/dl)。根据人2型糖尿病的诊断标准,HFD/STZ诱导2型糖尿病大鼠模型第一步HFD阶段完成之后,通过血浆胰岛素检测、腹腔葡萄糖耐量实验(IPGTT)和胰岛素耐量实验(ITT)判断大鼠是否存在胰岛素抵抗[20-22],此外,由于血脂升高和肥胖可以加重胰岛素抵抗[26-28],因此将体重和血脂检测作为辅助指标[20-22]。若IPGTT和ITT实验结果显示:HFD组大鼠与NPD组大鼠比较,血糖变化相似但胰岛素却高达NPD组的2倍,可以认为造成了大鼠胰岛素抵抗[20],同时伴有血脂升高、体重增加。第二步腹腔注射STZ之后24 h检测血糖,若大鼠空腹血糖≥14 mmol/L[22]或者随机血糖≥16.7 mmol/L[21],并连续监测4周,大鼠血糖、胰岛素抵抗症状稳定,认为2型糖尿病大鼠造模成功。为明确HFD/STZ2型糖尿病大鼠胰岛损伤状况,有学者对其胰岛组织进行病理学观察,结果胰岛组织病理性无规则增生[33],这符合人2型糖尿病胰岛病理特点。为验证HFD/STZ2型糖尿病大鼠模型的稳定性,有学者进行了短期(4周)2型糖尿病药物干预实验,结果药物干预组糖尿病大鼠糖尿病症状得到明显改善,而对照组糖尿病大鼠血糖一直稳定在14 mmol/L左右[22],证实 HFD/STZ2型糖尿病大鼠模型具有一定的稳定性。
综上所述,HFD/STZ2型糖尿病大鼠模型制备主要受大鼠年龄、HFD中脂肪、碳水化合物比例、HFD喂养时间、STZ注射剂量及次数的影响,通过控制影响因素,可以缩短2型糖尿病大鼠模型的制备时间,提高动物成模率。与自发性2型糖尿病动物模型和转基因2型糖尿病动物模型相比,HFD/STZ2型糖尿病大鼠模型造模耗时短、方法简便易于掌握、重复性好、价格便宜,短期内可大量复制供2型糖尿病基础实验研究,是目前制备2型糖尿病动物模型的最佳选择。
1 Shaw JE,Sicree RA,Zimmet PZ.Global estimates of the prevalence of diabetes for 2010 and 2030.Diabetes Res Clin Pract,2010,87:4-14.
2 Unwin N,Gan D,Whiting D.The IDF diabetes atlas:providing evidence,raising awareness and promoting action.Diabetes Res Clin Pract,2010,87:2-3.
3 World Health Organization and C.D.Bode,Media Centre-Fact Sheets,Diabetes,2011.http://www.who.int/mediacentre/factsheets/fs312/en/index.
4 Guilherme A,Virbasius J,Vishwajeet P,et al.Adipocyte dysfunction linking obesity to insulin resistance and type 2 diabetes.Nat Rev Mol Cell Biol,2008,9:367-377.
5 Yoon KH,Lee JH,Kim JW,et al.Epidemic obesity and type 2 diabetes in Asia.Lancet,2006,368:1681-1688.
6 Bell GI,Polonsky KS.Diabetes mellitus and genetically programmed defects in beta-cell function.Nature,2001,414:788-791.
7 Butler AE,Janson J,Bonner-Weir S,et al.Beta-cell deficit and increased beta-cell apoptosis in humans with type 2 diabetes.Diabetes,2003,52:102-110.
8 Tabak AG,Jokela M,Akbaraly TN,et al.Trajectories of glycemia,insulin sensitivity and insulin secretion preceeding the diagnosis of type 2 diabetes:the whitehall II study.Lancet,2009,373:2215-2221.
9 Prentki M,Nolan CJ.Islet beta cell failure in type 2 diabetes.J Clin Invest,2006,116:1802-1812.
10 Dentin R,Benhamed F,Halnauh I,et al.Liver-specific inhibition of ChREBP improves hepatic steatosis and insulin resistance in ob/ob mice.Diabetes,2006,55:2159-2170.
11 Moran TH.Unraveling the obesity of OLETF rats.Physiol Bnhav,2008,94:71-78.
12 Kadowaki T.Insights into insulin resistance and type 2 diabetes from knockout mouse models.J Clin Invest,2000,106:459-465.
13 Terauchi Y,Iwamoto K,Tamemoto H,et al.Development of non-insulin-dependent diabetes mellitus in the double knockout mice with disruption of in sulin receptor substrate-1 and beta cell glucokinase genes.Clin Invest,1997,99:861-866.
14 Kadowaki T.Insights into insulin resistance and type 2 diabetes from knockout mouse models.J Clin Invest,2000,106:459.
15 Fernandez AM,Kim JK,Yakar S,et al.FunctionaI lnactivation of the IGF-I and insulin receptors in skeletaI musde cause8 type 2 diabetes.Genes Dev,2001,15:1926-1934.
16 Chalkley SM,Hettiarachchi M,Chisholm DJ,et al.Long-term high-fat feeding leads to severe insulin resistance but not diabetes in Wistar rats.Am J Physiol Endocrinol Metab,2002,282:E1231-E1238.
17 Surwit RS,Kuhn CM,Cochrane C,et al.Dietinduced type II diabetes in C57BL/6J mice.Diabetes,1988,37:1163-1167.
18 Lenzen S.The mechanisms of alloxanand streptozotocininduced diabetes.Diabetologia,2008,51:216-226.
19 Szkudelski T.The mechanism of alloxan and streptozotocin action in β cells of the rat pancreas.Physiol Res,2001,50:537-546.
20 Reed MJ,Meszaros K,Entes LJ,et al.A new rat model of type 2 diabetes:the fat-fed,streptozotocin-treated rat.Metabolism,2000,49:1390-1394.
21 Srinivasan K,Viswanad B,Asrat L,et al.Combination of high-fat dietfed and low-dose streptozotocin-treated rat:a model for type 2 diabetes and pharmacological screening.Pharmacol Res,2005,52:313-320.
22 Zhang M,Lv XY,Li J,et al.The characterization of high-fat diet and multiple low-dose streptozotocin induced type 2 diabetes rat model.Exp Diabetes Res,2008,2008:704045.
23 Koopman RJ,Mainous AG III,Diaz VA,et al.Changes in age at diagnosis of type 2 diabetes mellitus in the United States,1988 to 2000.Ann Fam Med,2005,3:60-63.
24 Bluestone JA,Herold K,Eisenbarth G.Genetics,pathogenesis and clinical interventions in type 1 diabetes.Nature,2010,464:1293-1300.
25 Kushner JA.The role of aging upon beta cell turnover.J Clin Invest,2013,123:990-995.
26 Gul Bano.Glucose homeostasis,obesity and diabetes.Best Practice Research Clinical Obstetrics and Gynaecology,2013,27:715-726.
27 李玲.肥胖2型糖尿病的手术治疗.实用糖尿病杂志,2012,3:12-13.
28 雷明生.2型糖尿病肥胖与非肥胖血液流变学和血脂变化.实用糖尿病杂志,2005,6:25-26.
29 Wellen KE,Hotamisligil GS.InⅡammation,stress,and diabetes.J Clin Invest,2005,115:11.
30 Khan HB,Vinayagam KS,Moorthy BT,et al.Antiinflammatory and antihyperlipidemic effect of Semecarpus anacardium in a high fat diet:STZ-induced type 2 diabetic rat model.Inflammo Pharmacology,2013,21:37-46.
31 Hussein AA,Abdel-Aziz A,Gabr M,et al.Myocardial and metabolic dysfunction in type 2 diabetic rats:impact of ghrelin.Can J Physiol Pharmacol,2012,90:99-111.
32 Islam MS,Choi H,Loots DT.Effects of dietary onion(Allium cepa L)in a high-fat diet streptozotocin-induced diabetes rodent model.Ann Nutr Metab,2008,53:6-12.
33 Zhang F,Ye C,Li G,et al.The rat model of type 2 diabetic mellitus and its glycometabolism characters.Exp Anim,2003,52:401-407.
34 Hosokawa M,Dolci W,Thorens B.Differential sensitivity of G.Biochem.Biophys Res Commun,2001,289:1114-1117.
35 Bugger H,Abel ED.Rodent models of diabetic cardiomyopathy.Dis Model Mech,2009,2:454.
36 Di Gialleonardo V,de Vries EF,Di Girolamo M,et al.Imaging of betacell mass and insulitis in insulin-dependent(Type 1)diabetes mellitus.Endocr Rev,2012,33:892-919.
37 Rahier J,Guiot Y,Goebbels RM,et al.Pancreatic beta-cell mass in European subjects with type 2 diabetes.Diabetes Obes Metab,2008,10:32-42.
38 Elizabeth R,Gilbert D,Zhuo F,et al.Development of a nongenetic mouse model of Type 2 diabetes.Experimental Diabetes Research,2011,38:12.
39 World Health Organization and American Diabetes Association.Diabetes diagnosis standard.2012.
R 587.1
A
1002-7386(2015)21-3308-03
10.3969/j.issn.1002-7386.2015.21.039
项目来源:河北省科学技术研究与发展计划项目(编号:12276104D-35)
071000 河北省保定市,河北大学临床医学院(祁秀茹);河北大学附属医院(王红杰)
王红杰,071000 河北省保定市,河北大学附属医院;E-mail:hongjiew68@163.com
2015-04-11)

