一株含油污泥多环芳烃降解菌的分离鉴定和降解特性
牛志刚 王新新 吴亮,3 杨静
(1中海油能源发展采油服务公司 天津 300452 2中海石油环保服务有限公司 天津 300452 3中国海洋大学环境科学与工程学院 山东青岛 266100)
含油污泥是石油生产过程中产生的一种重要的工业污染物,主要是由高浓度的石油烃和泥砂等成分组成的一种极为复杂的危险固体废弃物。特别是其中含有的高浓度多环芳烃等有机烃类污染物具有强烈的致癌致畸致突变的“三致”效应,对生态环境稳定和人体健康构成了巨大威胁[1]。目前多环芳烃已被世界上多个国家和地区列为优先控制污染物,因此急需快速有效的处理技术根治这类污染物。目前,超声冻融法、表面活性剂洗脱和热化学法等物理化学技术已经大量应用于含油污泥的处理[2,3]。尽管物理化学处理技术具有速度快、效果好的优点,但是处理费用过于昂贵并且容易造成生态环境的二次污染。生物处理方法利用生物的代谢活动将污染物逐渐降解,具有费用低廉和环境友好等突出优点,因而受到各国科研人员的重视[4,5]。采用多环芳烃降解菌降解含油污泥中的多环芳烃是治理这一优先控制污染物的有效方法[6],因此有必要对其中含有的多环芳烃降解菌进行深入分析。然而,目前关于含油污泥中多环芳烃降解菌的分离并不多见。目前仅有Bacillus和Pseudomonas等多环芳烃降解菌生存在含油污泥中的报道[7]。因此,急需获得更多的含油污泥多环芳烃降解菌菌株,以丰富降解菌资源。
本研究采用富集培养方法从典型含油污泥样品中分离多环芳烃降解菌,综合采用16SrRNA基因序列和生理生化方法对其进行鉴定,进一步分析其生长特性和降解特性,以期获得含油污泥中多环芳烃降解菌多样性的基本信息,为含油污泥的生物处理提供数据参考。
1 材料与方法
1.1 供试材料
采集某油田的典型含油污泥。采用常规分析方法分析该含油污泥样品的全氮、有机质、含水量、pH值和石油烃等基本理化性质见表1。

表1 供试含油污泥的基本理化性质
1.2 多环芳烃降解菌的富集和分离
取10g含油污泥放入90mL以多环芳烃萘、蒽、菲和芘为唯一碳源的无机盐培养基中。于30℃摇床120r·min-1恒温富集培养10d。吸取10mL富集培养液,接种到90mL新鲜的无机盐培养基中。不断重复上述操作,富集培养3次。从含有以多环芳烃萘、蒽、菲和芘为唯一碳源的无机盐培养基平板上采用稀释平板涂布法分离纯化单菌落[8]。
1.3 多环芳烃降解菌的鉴定
将分离获得的纯菌株接种到TSB培养基上,观察记录菌落形态并进行革兰氏染色。采用Omega细菌DNA提取试剂盒和Omega琼脂糖凝胶回收试剂盒提取纯化菌株基因组DNA。采用细菌16SrRNA通用引物27F和1492R进行PCR扩增,并进一步纯化[9]。采用ABI3730XLDNAanalyzer进行测序。将得到的序列用BLAST程序与GenBank+EMBL+DDBJ+PDB数据库进行比对,手动下载相似性较高的16SrRNA序列,并采用ClustalW程序进行多序列对齐。采用MEGA4.0软件的Neighbor-Joining方法和Jukes-Cantor模型进行系统发育分析,重复取样1000次进行自展值分析[10]。该菌株16SrRNA序列的登录号为:KM525670。采用常规方法进一步进行生理生化鉴定分析。
1.4 多环芳烃降解菌的生长特性和降解特性
分别以10%的接种量将菌液接种到以石油烃、正十六烷、多环芳烃萘、菲、蒽和芘为唯一碳源的无机盐培养基中,30℃摇床120r·min-1恒温培养15d。以不添加碳源的接菌培养基作为空白对照,测定各培养液的OD600,以考察菌株对烃类底物的利用能力。采用气相色谱法测定残留多环芳烃的含量,考察菌株对多环芳烃的降解能力[9]。
1.5 统计分析
采用SPSS13.0统计软件对测试数据进行单因素方差分析。
2 结果与分析
2.1 多环芳烃降解菌的分离
通过富集驯化和分离纯化等步骤,经过初筛复筛,得到一株多环芳烃降解菌W13020。该菌株在TSB培养基上的菌落呈浅黄色,表面湿润,略透明,边缘整齐、菌落圆形,扁平。显微观察革兰氏染色阴性,细胞呈杆状。采用16SrRNA序列分析对其进行鉴定,进行系统发育分析,构建系统发育树,如图1所示。菌株W13020与嗜麦芽寡养单胞菌Stenotrophomonas maltophilia MTCC 434T的同源性高达99.0%,高于其他模式菌株。采用常规方法进一步进行生理生化鉴定分析,结果如表2所示。该菌株可耐受4%NaCl,生长pH值5~9,可以利用土温80、葡萄糖、乳糖、麦芽糖、甘露糖和果糖。产生蛋白酶和DNA酶,而不产生氧化酶和脲酶。具有明胶液化和硝酸盐还原能力,H2S和甲基红实验阴性。结合系统发育分析结果和生理生化分析结果,该菌株可被鉴定为嗜麦芽寡养单胞菌Stenotrophomonas maltophilia。
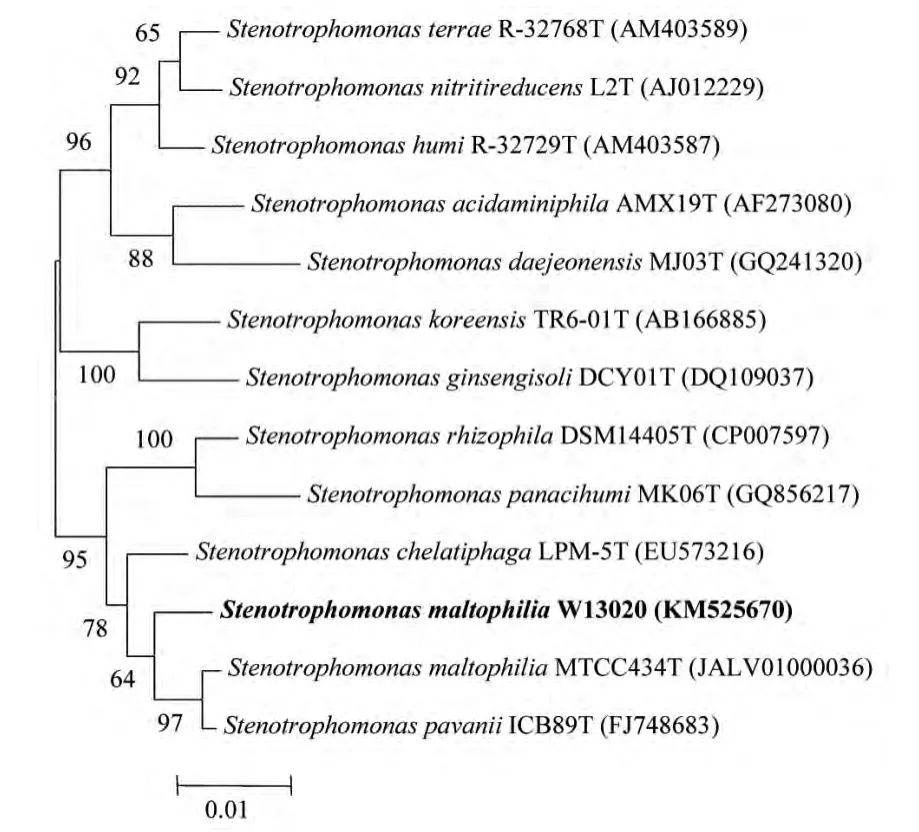
图1 多环芳烃降解菌W 13020 的系统发育树

表2 多环芳烃降解菌W 13020 的生理生化特征
1960年Hugh R等[11]发现并命名了嗜麦芽假单胞菌(Pseudomonasmaltophili)。1983年Swings J等[12]通过表型数据分析又将其命名为嗜麦芽黄单胞菌(Xanthomonasmaltophili)。1993年Palleroni NJ等[13]再一次将其命名为嗜麦芽寡养单胞菌(Stenotrophomonasmaltophilia)。Carmody LA等[14]通过对766株嗜麦芽寡养单胞菌进行详细的生理生化分析,结果发现这种菌的生理生化特征具有明显的多样性,这也印证了对该菌的鉴定具有一定困难。我们通过16S rRNA序列分析发现,菌株W13020与StenotrophomonasmaltophiliaMTCC 434T的同源性高达99.0%,并且生理生化分析结果与模式菌株基本一致。因此,将菌株W13020鉴定为嗜麦芽黄单胞菌Stenotrophomonasmaltophilia是可靠的。
采用气相色谱法分析多环芳烃降解菌W13020对4种多环芳烃的降解率,结果如图2所示。W13020菌株对萘、蒽、菲和芘的15d降解率分别为72.1±3.7%、45.1±15.6%、42.2±5.2%和31.2±9.0%,说明W13020菌株对多环芳烃具有明显的降解能力。其中,该菌对萘的降解率显著(P<0.05)高于其它3种多环芳烃,说明该菌对低分子量多环芳烃的降解能力较强。此外,该菌株不能利用正十六烷,但是可以利用石油烃为唯一碳源和能源生长。这可能是由于该菌利用石油烃里的多环芳烃组分造成的。Stenotrophomonas maltophilia的多环芳烃降解能力多有报道。Gao S等[15]从杂酚油污染土壤中分离得到了一株Stenotropho monasmaltophilia C6,并深入研究了该菌株降解菲的降解途径,识别了22个中间代谢产物。Chen S等[16]发现Stenotropho monasmaltophilia在铜离子存在的情况下仍然可以降解苯并芘。Urszula G等[17]从活性污泥中分离得到了一株Stenotropho monasmaltophilia KB2,可以降解苯酚和儿茶酚等单环芳烃,并具有儿茶酚1,2-双加氧酶活性。然而,具有多环芳烃降解能力的Stenotropho monasmaltophilia并未发现存在于含油污泥中。本研究通过富集培养从含油污泥中分离得到了一株可以降解萘、蒽、菲和芘的Stenotrophomonas maltophilia W13020,证实了Stenotropho monasmaltophilia也生存于含油污泥的环境中。

图2 多环芳烃降解菌W 13020 对4 种多环芳烃的降解率
3 结语
本研究从含油污泥中分离得到一株多环芳烃降解菌W13020。采用16S rRNA基因序列和生理生化方法将其鉴定为嗜麦芽寡养单胞菌Stenotrophomonasmaltophilia。该菌株可以利用石油烃、多环芳烃萘、菲、蒽和芘为唯一碳源和能源生长,对萘、蒽、菲和芘等多环芳烃具有明显的降解能力。
[1]Mesquita SR,van Drooge BL,Reche C,et al.Toxic assessment of urban atmospheric particle-bound PAHs:relevance of composition and particle size in Barcelona (Spain)[J].Environ Pollut,2014,184:555-562.
[2]Zhang J,Li J,Thring RW,et al.Oil recovery from refinery oily sludge via ultrasound and freeze/thaw[J].JHazard Mater,2012,203:195-203.
[3]Jin Y,Zheng X,Chu X,etal.Oil recovery from oil sludge through combined ultrasound and thermochemical cleaning treatment[J].Ind Eng Chem Res,2012,51(27):9213-9217.
[4]Koolivand A,Naddafi K,Nabizadeh R,et al.Biodegradation of petroleum hydrocarbons of bottom sludge from crude oil storage tanks by in-vessel composting[J].Toxico Environ Chem,2013,95(1):101-109.
[5]王新新,韩祯,白志辉,等.含油污泥的堆肥处理对微生物群落结构的影响[J].农业环境科学学报,2011,30(7):1413-1421.
[6]Vitte I,Duran R,Hernandez-RaquetG,etal.Dynamics of metabolically active bacterial communities involved in PAH and toxicity elimination from oil-contaminated sludge during anoxic/oxic oscillations[J].Appl Microbiol Biotechnol,2013,97(9):4199-4211.
[7]Dhote M,Juwarkar A,Kumar A,et al.Biodegradation of chrysene by the bacterial strains isolated from oily sludge[J].World J Microbiol Biotechnol,2010,26(2):329-335.
[8]Wang XX,Li C,Zhao LB,et al.Diversity of culturable hydrocarbons-degrading bacteria in petroleum-contaminated saltern[J].Adv MatRes,2014,1010:29-32.
[9]王新新,白志辉,金德才,等.石油污染盐碱土壤翅碱蓬根围的细菌多样性[J].微生物学通报,2011,38(12):1768-1777.
[10]Tamura K,Dudley J,NeiM,etal.MEGA4:molecular evolutionary genetics analysis(MEGA)software version 4.0[J].Mol Biol Evol,2007,24(8):1596-1599.
[11]Hugh R,Ryschenkow E.Pseudomonas maltophilia,an Alcaligenes-like Species[J].JGen Microbiol1961,26:123-132.
[12]Swings J,De Vos P,den Mooter MV,et al.Transfer of Pseudomonas maltophilia Hugh 1981 to the Genus Xanthomonas as Xanthomonas maltophilia(Hugh 1981)comb.nov[J].Int JSyst Bacteriol,1983,33(2):409-413.
[13]Palleroni NJ,Bradbury JF.Stenotrophomonas,a new bacterial genus for Xanthomonas maltophilia(Hugh 1980)Swingsetal.1983[J].Int J Syst Bacteriol,1993,43(3):606-609.
[14]Carmody LA,SpilkerT,LiPumaJJ.Reassessment of Stenotrophomonas maltophiliaphenotype[J].JClin Microbiol,2011,49(3):1101-1103.
[15]Gao S,Seo J-S,Wang J,et al.Multiple degradation pathways of phenanthrene by Stenotrophomonas maltophilia C6[J].Int Biodeterior Biodegradation,2013,79:98-104.
[16]Chen S,Yin H,Ye J,etal.Effect of copper(II)on biodegradation of benzo[a]pyrene by Stenotrophomonas maltophilia[J].Chemosphere,2013,90(6):1811-1820.
[17]Urszula G,Izabela G,Danuta W,etal.Isolation and characterization of a novel strain of Stenotrophomonas maltophilia possessing various dioxygenases for monocyclic hydrocarbon degradation[J].Braz J Microbiol,2009,40(2):285-291.

