双环醇治疗大鼠慢性酒精性肝病的机制探讨
董 力, 王 建, 贾晨虹, 郭琳娜
(1. 河北省廊坊市人民医院 药学部, 河北 廊坊, 065000;
2. 中国石油天然气总公司中心医院 药剂科, 河北 廊坊, 065000;
3. 河北省廊坊市中医医院 药房, 河北 廊坊, 065000;
4. 河北省廊坊市人民医院 特需病房,河北 廊坊, 065000)
论著
双环醇治疗大鼠慢性酒精性肝病的机制探讨
董力1, 王建2, 贾晨虹3, 郭琳娜4
(1. 河北省廊坊市人民医院 药学部, 河北 廊坊, 065000;
2. 中国石油天然气总公司中心医院 药剂科, 河北 廊坊, 065000;
3. 河北省廊坊市中医医院 药房, 河北 廊坊, 065000;
4. 河北省廊坊市人民医院 特需病房,河北 廊坊, 065000)
摘要:目的探讨双环醇治疗大鼠慢性酒精性肝病(ALD)的可能机制。方法72只SD大鼠随机分为对照组、模型组和干预组,各24只。模型组和干预组分别给予白酒灌胃造模,干预组于第4周开始每日加用双环醇灌胃,200 mg/(kg·d), 连续给药4周;对照组给予等体积的生理盐水。结果模型组肝脏呈进行性肝细胞损伤坏死及脂肪变性,干预组给药后病变程度显著轻于模型组大鼠。模型组第6、8周肝脏谷胱甘肽(GSH)含量及乙醛脱氢酶(ALDH)活性低于对照组(P<0.05或P<0.01)。干预组第6周GSH含量低于对照组,高于模型组(P<0.05), 第8周GSH含量及乙醇脱氢酶(ADH)、ALDH活性均高于模型组(P<0.05)。第6周,模型组大鼠血清谷丙转氨酶(ALT)、胆固醇(TG)、甘油三酯(TC)、低密度脂蛋白胆固醇(LDL-C)含量高于对照组(P<0.05或P<0.01); 干预组大鼠TG低于模型组(P<0.01)。第8周,模型组大鼠血清各指标与对照组差异显著(P<0.05); 干预组上述各指标与模型组差异均有统计学意义(P<0.05或P<0.01)。结论双环醇能有效抑制ALD导致的肝脏脂肪堆积,对酒精引起的肝组织、肝脏细胞结构损伤及肝功能损伤具有良好的保护作用。
关键词:双环醇; 慢性酒精性肝病; 肝细胞; 脂肪变性
慢性酒精性肝病(ALD)是由于长期过度饮酒引起的肝脏中毒性疾病,表现多样,初期通常表现为脂肪肝,可进展为酒精性肝炎、酒精性肝纤维化和酒精性肝硬化[1-3], 严重时可诱发广泛肝细胞坏死甚或肝功能衰竭,目前中国ALD发病率有增多趋势。双环醇对多种实验性肝损伤均有显著保护作用,其作用机制可能为抑制化学毒物引起的肝细胞脂质过氧化,提高肝内谷胱甘肽(GSH)、谷胱甘肽巯基转移酶等自身抗氧化物含量,维持肝细胞线粒体膜流动性,加速毒性物质的代谢清除等[4]。本研究建立了大鼠慢性酒精性肝损伤模型,观察双环醇对ALD大鼠的保护作用,探讨其可能的作用机制。
1材料与方法
1.1 实验动物
6周龄SPF级雄性SD大鼠72只,体质量180~200 g, 购自北京维通利华实验动物技术公司,动物许可证编号NO.SCXK(京)2007-0001。标准饲料,自由饮水。
1.2 实验材料
双环醇(纯度>99%,购自北京协和药厂),市售56°白酒,谷丙转氨酶(ALT)、GSH、乙醇脱氢酶(ADH)、乙醛脱氢酶(ALDH)测定试剂盒购于南京建成生物科技有限公司,胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)及低密度脂蛋白胆固醇(LDL-C)试剂盒购自国药集团化学试剂北京有限公司。
1.3 造模及分组
SD大鼠随机分为正常对照组、模型组和干预组,各24只,每周测定各组大鼠体质量。模型组大鼠每日给予白酒灌胃,剂量为10 mL/kg, 2次/d, 间隔8 h, 持续8周;干预组大鼠每日以相同方式以白酒灌胃,并于第4周开始每日以双环醇灌胃,剂量为200 mg/(kg·d), 连续给药4周;对照组给予等体积的生理盐水,持续8周。
1.4 肝脏组织形态学观察
各组第6、8周最后一次给药后取大鼠12只禁食12 h,取血并进行生化和酶活性检测,断头处死,进行肝脏形态学观察。处死大鼠后,迅速开胸取出完整肝脏,迅速切取适量肝脏组织,5%戊二醛固定,石蜡包埋,常规HE染色,镜下观察。余肝脏置于-4 ℃冰箱保存。
1.5 肝脏GSH含量、ADH、ALDH活性测定
取出肝脏,制备10%肝匀浆。严格按照GSH测定试剂盒操作,于412 nm波长测定吸光度值,按标准曲线计算GSH含量。取200 μL肝匀浆与等体积0.3%脱氧胆酸钠溶液混匀冰浴20 min,4 000 g离心10 min,取上清液。严格按照ADH及ALDH测定试剂盒操作,于37 ℃下340 nm的波长连续测定单位时间内光密度变化值计算ADH活性,于25 ℃下340 nm的波长连续测定单位时间内光密度变化值计算ALDH活性。
1.6 血清相关生化指标检测
严格按照试剂盒操作说明,于第6、8周采用分光光度法分别检测血清ALT、TG、TC、HDL-C及LDL-C含量。
1.7 统计学方法
2结果
2.1 各组大鼠生理状态比较
模型组大鼠均出现饮食减少,体质量增长减缓,毛发无光泽,部分脱落;白酒灌胃10 min后,出现步态不稳、眼球充血、嗜睡等症状,30 min~2 h后可恢复常态。干预组大鼠给药前症状与模型组大鼠相似,给药后体质量增长加快,行动较为敏捷灵活,毛发有光泽;对照组大鼠状态良好,饮食正常,毛发有光泽,反应灵敏。
2.2 肝脏形态观察
对照组大鼠肝窦结构清晰,肝小叶规则,肝细胞以中央静脉为中心呈放射状排列。模型组大鼠酒精灌胃6周后,中央静脉轻度扩张,中央静脉周围肝细胞水肿,不同程度空泡变性,可见小灶坏死和脂肪滴;8周后,中央静脉壁增厚并出现血栓,肝组织胶原纤维增生,空泡变性加重,大量脂肪滴产生,肝小叶可见点状坏死及炎症细胞浸润。干预组大鼠第6周肝细胞轻度水肿,少量空泡变性及脂肪滴;第8周肝组织空泡变性减少,脂肪滴较少,体积减小。
2.3 3组大鼠肝脏GSH、ADH、ALDH活性比较
3组第6、8周组内比较,各指标均无显著变化(P>0.05)。模型组第6、8周GSH含量及ALDH活性低于对照组(P<0.05或P<0.01), ADH活性低于对照组,但差异无统计学意义(P>0.05)。干预组第6周GSH含量低于对照组,高于模型组,差异均有统计学意义(P<0.05),第8周GSH含量及ADH、ALDH活性均高于模型组(P<0.05),与对照组差异均无统计学意义(P>0.05)。见表1。


组别时间/周GSH/(nmol/gprot)ADH/(U/mgprot)ALDH/(U/mgprot)对照组(n=12)66.33±0.527.29±1.268.67±1.0586.29±0.687.33±1.428.58±0.85模型组(n=12)64.51±1.42**6.32±1.267.68±1.21*84.15±2.05**6.01±1.757.21±2.01*干预组(n=12)65.64±1.01*#6.98±1.368.04±1.4185.88±1.30##7.92±1.37##8.85±1.73#
与同一时间对照组比较, *P<0.05, **P<0.01; 与同一时间模型组比较,##P<0.01。
2.4 3组血清ALT、TG、TC、HDL-C及LDL-C水平比较
第6周,模型组大鼠血清ALT、TG、TC、LDL-C含量高于对照组(P<0.05或P<0.01);干预组大鼠ALT高于对照组(P<0.05), TG低于模型组(P<0.01)。第8周,模型组大鼠血清ALT、TG、TC、LDL-C含量显著高于对照组(P<0.01), HDL-C含量显著低于对照组(P<0.05); 干预组大鼠TC含量低于对照组,HDL-C含量高于对照组,ALT、TG、LDL-C含量显著低于模型组, HDL-C含量高于模型组,差异均有统计学意义(P<0.05或P<0.01)。见表2。
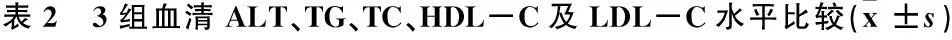

组别时间/周ALT/(U/L)TG/(mmol/L)TC/(mmol/L)HDL-C/(mmol/L)LDL-C/(mmol/L)对照组(n=12)634.67±6.422.64±0.152.71±0.345.52±0.950.92±0.15835.22±5.532.58±0.132.74±0.365.64±1.220.93±0.14模型组(n=12)646.36±10.52**3.27±0.18**3.12±0.57*5.02±1.111.17±0.25**867.82±13.64**3.64±0.22**3.55±0.62**4.35±1.20*1.35±0.34**干预组(n=12)642.76±10.22*2.73±0.21##3.02±0.665.22±0.861.02±0.33838.42±6.74##2.65±0.14##2.67±0.54*##7.34±2.42*##0.95±0.21##
与同一时间对照组比较, *P<0.05, **P<0.01; 与同一时间模型组比较,#P<0.05, ##P<0.01。
3讨论
双环醇对化疗药物性肝损伤、酒精性肝损伤、脂肪肝、肝部分切除及缺血再灌注肝损伤,以及免疫性肝损伤具有保护作用,其机制可能与逆转肝细胞内紊乱的氧化还原平衡体系,抑制炎症物质生成及脂质过氧化、改善肝脂蛋白分泌及转运等有关[5-6]。目前为止,慢性酒精性肝损伤的发生机制未完全阐明。大部分学者认为长期大量饮酒会造成微粒体乙醇氧化系统代谢产物增多,自由基大量生成,体内氧化还原平衡体系被打破,肝细胞氧化损伤[7]。同时体内细胞毒性物质乙醛生成量累积增加,加剧肝细胞膜以及微管损伤[8]。乙醇及乙醛的代谢可产生大量NADHM, 导致脂肪代谢紊乱,无法转运出肝脏,导致脂肪滴在肝细胞积聚形成。
丁光伟等[9]的临床研究显示,双环醇能够显著降低酒精性肝炎患者的ALT、AST、总胆红素(TBIL)、r-谷氨酰转肽酶,有效率达95.2%。双环醇可通过保护肝细胞膜和线粒体、清除氧自由基、使肝细胞核DNA免受损伤及减少凋亡进而起到保肝作用。本研究使用56°白酒进行大鼠灌胃,成功建立了大鼠ALD模型[10]。结果可见,造模后肝细胞组织形态观察见明显肿胀和脂肪变性进行性加重,血清ALT持续升高,小叶中央静脉肝扩张。双环醇给药明显减轻酒精引起的肝细胞损及坏死,血清ALT呈下降趋势,肝脏脂肪变和细胞肿胀等病理改变明显改善[11-12]。
乙醇可动员外周脂肪分解,血液脂肪酸含量升高,使肝脏TG合成大量增加。此外,酒精可诱导对细胞色素P450表达,进而加重酒精代谢产物的肝毒性,导致肝细胞脂肪摄取增多,形成脂肪肝[13-14]。本研究结果显示,模型组大鼠肝脏TG显著升高,给予双环醇后TG水平下降显著。同时,双环醇还可降低血清TC和LDL-C,升高HDL-C增加肝脏脂肪转运,与苏振和[12]的研究一致,表明双环醇可有效抑制ALD导致的肝脏脂肪堆积,而其作用机制需进一步深入研究。
酒精主要经肝脏ADH/ALDH代谢,酒精使ALDH活性降低,乙醛代谢下降[15-16]。GSH是体内重要的抗氧化物,清除体内代谢产生的自由基。本研究中模型组大鼠给予酒精后,肝脏ADH以及ALDH活性进行性降低,GSH水平显著下降。双环醇口服给药可通过诱导肝胞浆ADH及ALDH表达和激活,加速乙醛代谢清除,使GSH恢复至正常水平,与莫成林等[17]研究一致,表明双环醇可促进GSH的再生,增强肝脏自由基的清除能力。
综上所述,双环醇不仅能有效抑制慢性酒精性肝损伤导致的肝脏脂肪堆积,保护肝窦组织、肝脏细胞、肝小叶中央静脉结构等,对酒精引起的GSH含量下降、ALDH活性及ALT活性下降等也具有明显改善作用,可抑制ALD引起的肝脏纤维化变性及坏死[18-19]。
参考文献
[1]Dvorak R D, Pearson M R, Day A M. Ecological momentary assessment of acute alcohol use disorder symptoms: associations with mood, motives, and use on planned drinking days[J]. Exp Clin Psychopharmacol, 2014, 22(4): 285.
[2]王洪岩, 李鑫, 徐有青. 酒精性肝病发病机制研究进展[J]. 实用肝脏病杂志, 2014, 17(1): 5.
[3]Cojocariu C E, Trifan A V, G?rleanu I, et al. Alcoholic liver disease-epidemiology and risk factors[J]. Rev Med Chir Soc Med Nat Iasi, 2014, 118(4): 910.
[4]Li X, Zhou J, Chen S, et al. Role of bicyclol in preventing chemotherapeutic agent-induced liver injury in patients over 60 years of age with cancer[J]. J Int Med Res, 2014, 42(4): 906.
[5]王宇明, 李燕. 双环醇保肝抗炎药理机制研究新进展[J]. 胃肠病学和肝病学杂志, 2010, 19(7): 674.
[6]Han Y, Shi J P, Ma A L, et al. Randomized, vitamin E-controlled trial of bicyclol plus metformin in non-alcoholic fatty liver disease patients with impaired fasting glucose[J]. Clin Drug Investig, 2014, 34(1): 1.
[7]García-Ruiz C, Kaplowitz N, Fernandez-Checa J C. Role of mitochondria in alcoholic liver disease[J]. Curr Pathobiol Rep, 2013, 1(2): 159.
[8]李秀歌, 李慈莉. 乙醇诱导肝损伤作用机制概述[J]. 中国药师, 2008, 11(9): 1114.
[9]丁光伟, 高春耕. 双环醇治疗酒精性肝炎的临床观察[J]. 中国实用医药, 2012, 7(26): 180.
[10]Lieber C S. Alcoholic fatty liver: its pathogenesis and mechanism of progression to inflammation and fibrosis[J]. Alcohol, 2004, 34(1): 9.
[11]王艳春, 沈吉云. 美他多辛联合多烯磷脂酰胆碱治疗酒精性肝病的疗效观察[J]. 实用临床医药杂志, 2014, 18(5): 87.
[12]申苏建, 夏宣平, 闫峻, 等. 乙酰半胱氨酸治疗重症酒精性肝炎的疗效评价[J]. 中华全科医学, 2014, 12(12): 1953.
[13]康晓琳, 薛永志, 武润生, 等. 酒精性肝损伤大鼠细胞色素 P450 CYP2E1 和细胞色素 P450 CYP3A 的代谢活性[J]. 中国药理学与毒理学杂志, 2010, 24, (4): 286.
[14]苏振和. 双环醇治疗酒精性肝病 32 例临床观察[J]. 现代预防医学, 2011, 38(14): 2892.
[15]何震宇, 陈亮明. 酒精代谢关键酶乙醛脱氢酶2基因分型方法研究进展[J]. 广东药学院学报, 2013, 29(6): 682.
[16]Rehm J, Shield K D. Global alcohol-attributable deaths from cancer, liver cirrhosis, and injury in 2010[J]. Alcohol Res, 2013, 35(2): 174.
[17]莫成林, 李烨, 李燕. 双环醇对小鼠慢性酒精性肝损伤的保护作用[J]. 中华医学杂志, 2005, 85(48): 3409.
[18]曾雯洁. 湛江地区1986例健康体检者B超检查结果分析[J]. 海南医学院学报, 2010, 16(1): 99.
[19]张颖, 曾朝阳, 田晓年, 等. 双环醇联合二甲双胍对2型糖尿病伴非酒精性脂肪肝肝功能及糖代谢的影响[J]. 贵阳医学院学报, 2011, 36(6): 598.
Exploration on mechanism of bicyclol in the
treatment of rats with chronic ALD
DONG Li1, WANG Jian2, JIA Chenhong3, GUO Linna4
(1.DepartmentofPharmacy,People′sHospitalofLangfangCity,Langfang,Hebei, 065000;
2.DepartmentofPharmacy,CNPCCentralHospital,Langfang,Hebei, 065000;
3.PharmacyRoom,LangfangTCMHospital,Langfang,Hebei, 065000;
4.SpecialHospitalWard,Peoples′HospitalofLangfangCity,Langfang,Hebei, 065000)
ABSTRACT:ObjectiveTo explore the potential mechanism of bicyclol in the treatment of rats with chronic alcoholic liver disease (ALD). MethodsA total of 72 SD rats with chronic ALD were randomly divided into control group, model group and intervention group, 24 cases for each group. Model group and intervention group were gavaged with white wine to establish ALD models, after which intervention group was gavaged with bicyclol 200 mg/(kg·d) from the fourth week, for continuously 4 weeks, while control group was given isometric normal saline. ResultsLivers in model group showed aggressive hepatocyte injury, necrosis and fatty degeneration, and the severity of liver lesion was less in intervention group after treatment than that in model group. The liver glutathione (GSH) content and acetaldehyde dehydrogenase (ALDH) activity were evidently lower in model group after 6 and 8 weeks than in control group (P<0.05 orP<0.01). Intervention group was markedly lower than control group but higher than model group in GSH content after 6-week treatment (P<0.05), and was obviously higher in GSH content and alcohol dehydrogenase (ADH) and ALDH activities than model group after 8-week treatment (P<0.05). 6 weeks after treatment, model group was markedly higher than control group in serum alanine transaminase (ALT), cholesterol (TG), triglyceride (TC) and low-density lipoprotein cholesterol (LDL-C) levels (P<0.05 orP<0.01), and intervention group was apparently lower than model group in TG level (P<0.01). 8 weeks after treatment, there were significant differences between model group and control group in the levels of all serum indexes (P<0.05), so did the differences between model group and intervention group (P<0.05 orP<0.01). ConclusionBicyclol can effectively inhibit the accumulation of ALD-induced liver fat and has favorable protective function on alcohol-induced injury of hepatic tissues, hepatocyte structure and hepatic function.
KEYWORDS:bicyclol; chronic alcoholic liver disease; hepatocyte; fatty degeneration
基金项目:中国高校医学期刊临床专项资金(11522940)
收稿日期:2015-01-16
中图分类号:R 575
文献标志码:A
文章编号:1672-2353(2015)15-001-04
DOI:10.7619/jcmp.201515001

