N-乙酰半胱氨酸对兔肝缺血/再灌注损伤的保护作用
戴大军 蔡俊赢
1.江西省德安县中医院麻醉科,江西德安 330400;2.南昌大学第二附属医院麻醉科,南昌 330000
肝缺血/再灌注损伤是肝脏外科手术中常见的病理过程,尤其是肝脏移植手术,严重者可导致肝功能衰竭[1]。肝缺血/再灌注损伤的病理机制尚未明确,目前认为是多种因素共同作用的结果,如中性粒细胞和Kupffer 细胞被激活、细胞内钙超载[2]、氧自由基释放[3]、一氧化氮和内皮素水平失衡[4]、肝细胞凋亡等。本研究探讨N-乙酰半胱氨酸(NAC)清除氧自由基的作用[5-6]与缺血/再灌注损伤导致肝细胞凋亡之间的关系,揭示NAC 对肝缺血/再灌注损伤的保护机制。
1 材料与方法
1.1 试剂与仪器
丙二醛(MDA)测定试剂盒(南京建成生物科技有限公司),总超氧化物歧化酶(SOD)测定试剂盒(南京建成生物科技有限公司),凯基原位末端标记法细胞凋亡检测试剂盒(南京凯基生物科技发展有限公司),TKR-200C 小动物麻醉机(江西特力麻醉呼吸设备有限公司),全自动生化分析仪(日本Olympus-AU2700),飞利普G30 多功能监护仪。
1.2 实验动物与分组
选择周龄3~4 周,体重3.5~4.5 kg 的健康实验兔40 只(南昌大学实验动物科学部提供)。全部实验兔术前均禁食8 h,禁饮4 h。将其随机分为两组:肝缺血/再灌注组(I/R 组)和肝缺血/再灌注+N-乙酰半胱氨酸组(I/R+NAC 组)。I/R 组肝缺血30 min 后再灌注7 h;I/R+NAC 组于再灌注前5 min 泵注NAC 150 mg/kg,再灌注7 h 后持续泵注NAC 10 mg/(kg·h),I/R 组同时泵注等容量0.9%氯化钠[7]。两组实验兔在性别、周龄、体重、手术时间、出血量及输液量等方面比较,差异均无统计学意义(P>0.05),具有可比性。
1.3 模型制作
所有实验兔先肌注氯胺酮13 mg/kg 基础麻醉,待麻醉成功后用飞利普G30 多功能监护仪监测兔心电图及血氧饱和度,并建立耳缘静脉通路,随后经静脉注射丙泊酚(2~4 mg/kg),维库溴铵(0.1~0.3 mg/kg)后行气管插管,接小动物麻醉机控制呼吸(潮气量=8 ml/kg,呼吸频率=15 次/min),行右侧股动脉穿刺置管测直接动脉压。术中微量泵持续注入丙泊酚[1~3 mg/(kg·h)],复合吸入异氟醚(1%~4%)维持麻醉。消毒铺巾,采取上腹部正中切口,开腹后暴露肝门部,分离出门静脉,用血管钳夹闭以阻断70%肝血流,30 min 后恢复血供[8]。
1.4 观察指标
两组分别在门静脉阻断前(T0)、门静脉开放即刻(T1)、开放后2 h(T2)、开放后5 h(T3)、开放后7 h(T4)5 个时间点记录心率(HR)、平均动脉压(MAP),经股动脉采血2 ml,检测血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、MDA、SOD 活性,其中ALT、AST 采用日本Olympus-AU2700 全自动生化分析仪检测,MDA 用硫代巴比妥酸化学比色法检测,SOD 用黄嘌呤氧化酶法检测[9-10]。并取肝中叶,用10%甲醛浸泡固定,石腊包埋后切片,检测凋亡肝细胞数(原位缺口末端标记法和琼脂糖凝胶电泳法),在400倍光镜下观察每张切片,随机计算5 个高倍镜视野下的凋亡细胞数[11-13]。
1.5 统计学分析
采用统计软件SPSS 16.0 对实验数据进行分析,计量资料以均数±标准差(±s)表示,采用t 检验。计数资料以率表示,采用χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组不同时点HR、MAP 的比较
两组实验兔T2、T3、T4时HR、MAP 均较T0、T1时明显降低(P<0.05),但两组组间比较,差异无统计学意义(P>0.05)(表1)。
表1 两组不同时点HR、MAP 的比较(±s,n=40)
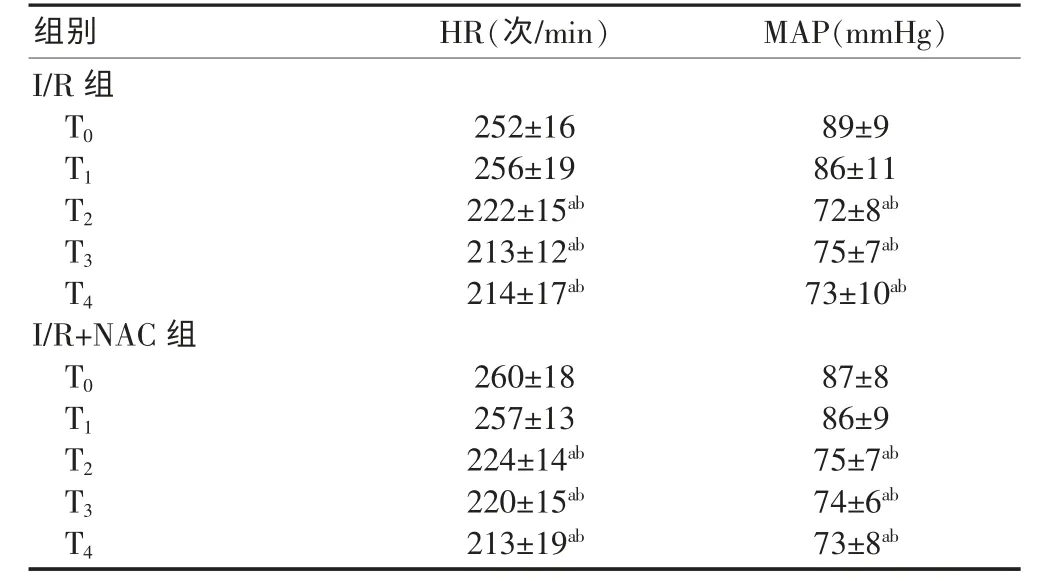
表1 两组不同时点HR、MAP 的比较(±s,n=40)
与同组T0时比较,aP<0.05;与同组T1时比较,bP<0.05
2.2 两组不同时点ALT、AST 的比较
与T0时比较,两组T1、T2、T3、T4各时间点ALT、AST显著升高(P<0.05);与I/R 组比较,I/R+NAC 组T1、T2、T3、T4时ALT、AST 明显下降(P<0.05)(表2)。
表2 两组不同时点ALT、AST 的比较(U/L,±s,n=40)

表2 两组不同时点ALT、AST 的比较(U/L,±s,n=40)
与同组T0时比较,aP<0.05;与I/R 组同时点比较,bP<0.05
2.3 两组不同时点MDA、SOD 的比较
与T0时比较,两组T1、T2、T3、T4各时间点MDA 明显升高(P<0.05),SOD 明显降低(P<0.05);与I/R 组比较,I/R+NAC 组T1、T2、T3、T4时MDA 明 显 下 降(P<0.05),SOD 明显升高(P<0.05)(表3)。
表3 两组不同时点MDA、SOD 的比较(±s,n=40)

表3 两组不同时点MDA、SOD 的比较(±s,n=40)
与同组T0时比较,aP<0.05;与I/R 组同时点比较,bP<0.05
2.4 两组不同时点肝细胞凋亡数的比较
原位缺口末端标记法染色阳性表达在细胞核,呈深浅不一的棕黄色。T0、T1、T2时两组间凋亡细胞数差异无统计学意义(P>0.05);I/R+NAC 组T3、T4时凋亡细胞数较I/R 组明显降低(P<0.05)(表4)。
表4 两组不同时点肝细胞凋亡数的比较(个/5HP,±s)
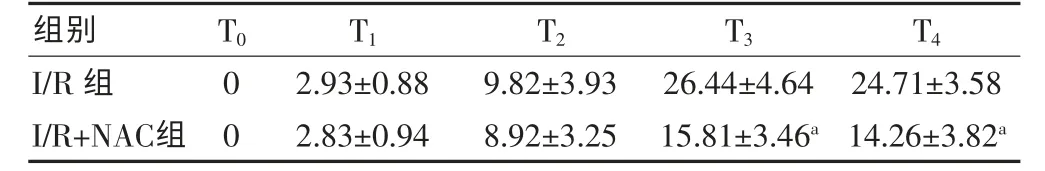
表4 两组不同时点肝细胞凋亡数的比较(个/5HP,±s)
与I/R 组同时点比较,aP<0.05
3 讨论
在肝脏大手术的并发症中,肝缺血/再灌注损伤一直是研究的重要方向,尤其是肝脏移植手术术中都存在肝缺血,肝缺血/再灌注损伤可以导致肝功能障碍甚至衰竭。肝缺血/再灌注损伤的病理机制尚未明确,目前认为是多种因素共同作用的结果,其中氧自由基的致伤机制在肝缺血/再灌注损伤中的作用已成共识[14]。中性粒细胞和Kupffer 细胞激活产生大量氧自由基,主要包括超氧化物自由基、氢氧根离子、过氧化氢等。氧自由基致伤机制主要有:氧化细胞膜磷脂双分子结构中的脂质,改变细胞膜的通透性;损伤肝脏毛细血管内皮细胞,引起粒细胞、血小板聚集,阻碍微循环;抑制线粒体氧化磷酸化,减少肝细胞的ATP合成,肝细胞供能障碍;氧化核酸酶使DNA 双链断裂;激发有关调控基因,导致细胞凋亡等,并使大量炎性因子活跃,炎症反应加剧,进一步加重肝细胞缺血/再灌注后的损伤[15]。
血清ALT、AST 大量存在于肝细胞中,肝细胞损害时释放入血,导致血中ALT、AST 明显升高,对肝损害反应灵敏,是目前临床普遍应用的指标。SOD 是一种能通过歧化反应转化超氧化物为氧气和过氧化氢的抗氧化酶,能够在体内清除超氧化物,保护组织细胞免受氧化损伤,发挥重要的氧化和抗氧化平衡作用[16],测定SOD 活性是判断缺血/再灌注损伤的间接指标。MDA 是氧自由基作用于细胞膜脂质过氧化反应的终产物,能影响线粒体酶活性和呼吸链,MDA 是细胞膜脂质过氧化反应最重要的产物之一,也是最常用的细胞膜脂质过氧化测定指标[17]。细胞凋亡是再灌注早期肝脏细胞死亡的重要机制[18],细胞发生凋亡时会激活一些DNA 内切酶,内切酶使基因组DNA 断裂,暴露出来的3′-OH 经过生物素标记和二氨基联苯胺(DAB)染色后,在普通光学显微镜下可以观察到凋亡细胞的细胞核呈棕黄色,而正常细胞则不染色。
NAC 是一种含巯基(-SH)的化合物,有直接抗氧化的作用是因为可以通过一个自由巯基与亲电子的氧化基团发生作用,NAC 分子中的活性巯基可对抗氧自由基导致的细胞氧化损伤[19-22]。NAC 对体内氧自由基(O2-·、H2O2、·OH 等)具有显著的清除作用。由于NAC 容易透过细胞膜,对能透过细胞膜的氧自由基(H2O2、·OH)具有拮抗和清除作用。张勇等[23]发现NAC 可以抑制大鼠肝脏缺血/再灌注引起的过氧化反应和减少氧自由基的生成。
本研究结果显示,I/R 组肝损害血清学指标ALT、AST 在再灌注5 h 达到顶峰,脂质过氧化指标MDA也在再灌注5 h 达到最高,提示肝缺血/再灌注损伤以再灌注后5 h 最严重。两组血清SOD 值于再灌注初期即开始降低,再灌注后5 h SOD 降到最低值,提示肝缺血/再灌注时有氧自由基的释放和组织细胞的损伤,且I/R 组较I/R+NAC 组SOD 值下降更显著,提示NAC 有一定氧自由基清除和拮抗作用。肝细胞切片用原位缺口末端标记法和琼脂糖凝胶电泳法观察发现两组都有肝细胞凋亡,但I/R 组在再灌注后5 h 凋亡明显比I/R+NAC 组严重,这也提示NAC 对肝缺血/再灌注损伤有保护作用。
综上所述,氧自由基在肝缺血/再灌注损伤中起重要作用,NAC 通过抑制氧自由基释放,清除氧自由基,抑制细胞膜脂质过氧化反应,减缓SOD 消耗,减少肝细胞凋亡,对肝缺血/再灌注损伤起保护作用。
[1]Desai KK,Dikdan GS,Shareef A,et al.Ischemic preconditioning of the liver:a few perspectives from the bench to bedside translation[J].Liver Transpl,2008,14(11):1569-1577.
[2]刘哲,张峰,李丽阳,等.西洋参皂苷对缺血-再灌注诱导乳鼠心肌细胞凋亡及钙浓度的影响[J].中国生物制品学杂志,2014,27(5):661-663,670.
[3]李少伟,刘宗正,刘春霞,等.口服富氢水对小鼠脂肪肝缺血再灌注损伤的保护作用[J].山东大学学报(医学版),2015,53(1):10-15.
[4]王万铁,林丽娜,谢克俭,等.异丙酚对兔肝缺血/再灌注损伤中一氧化氮和内皮素的干预[J].中国急救医学,2004,24(1):7-9.
[5]初巍巍,霍阳,王莉,等.N-乙酰半胱氨酸对慢性阻塞性肺疾病急性加重期患者血清中氧化相关物质的影响[J].解放军医药杂志,2014,26(1):40-42.
[6]谢荣辉,周师洁,殷明,等.N-乙酰半胱氨酸对过氧化氢诱导的骨髓间充质干细胞凋亡的保护及作用机制研究[J].中国药理学通报,2014,31(5):54-59.
[7]虞希冲,陈醒言,周红宇.N-乙酰半胱氨酸和氯胺酮联用对脑缺血再灌注损伤的影响[J].中国临床药理学与治疗学,2005,10(4):428-431.
[8]孙萍萍,陈杰,袁芳,等.大鼠肝缺血再灌注模型建立与评价[J].热带医学杂志,2013,13(4):390-392,525.
[9]颜贵明,戴敏,宣自华.丹皮酚对急性肝细胞损伤的保护作用[J].中成药,2015,37(4):854-858.
[10]李延玲,张怀宏,翟玉峰,等.益生菌对肝硬化大鼠肝细胞凋亡的干预作用[J].中国老年学杂志,2014,34(3):708-710.
[11]庄永敬,曹云飞,薛蓬,等.N-乙酰半胱氨酸预处理对肝脏缺血再灌注损伤的保护作用[J].肝胆胰外科杂志,2011,23(5):360-363.
[12]姜政辰,梁翠宏,王海亮,等.N-乙酰-5-羟色胺对大鼠肝缺血再灌注损伤后细胞凋亡的影响[J].世界华人消化杂志,2015,23(9):652-656.
[13]申新,赵鸽,王瑞,等.异丙酚和白藜芦醇预处理对大鼠肝脏缺血再灌注损伤时细胞凋亡的影响及机制[J].南方医科大学学报,2013,33(1):80-85.
[14]伊雪,崔翔宇.N-乙酰半胱氨酸对大鼠心脏移植缺血再灌注损伤细胞凋亡的影响[J].中国修复重建外科杂志,2013,27(10):1234-1239.
[15]秦双立,官志忠.线粒体损伤和氧化应激的关系[J].国外医学(医学地理分册),2013,34(3):197-201.
[16]蔡俊赢,徐国海.乙酰半胱氨酸对兔肝缺血再灌注损伤的保护机制探讨[J].免疫学杂志,2013,29(1):85-87.
[17]张文婷,李方江,王小元,等.山莨菪碱联合芬太尼后处理对兔心肌缺血再灌注代谢指标的影响[J].中国临床药理学杂志,2014,30(4):337-339.
[18]林群,雷立华,杨锡馨,等.大鼠肝缺血/再灌注后肝细胞凋亡的评价及异丙酚对细胞凋亡的影响[J].中华麻醉学杂志,2003,23(8):32-35.
[19]杨梦洁.N-乙酰半胱氨酸的临床应用进展[J].中国医药指南,2015,13(5):213-215.
[20]李月越,王萍,朱敏立,等.N-乙酰半胱氨酸对模拟失重大鼠肺损伤的防护作用研究[J].解放军医药杂志,2015,27(6):10-13.
[21]梁松岚,梁庆成.N-乙酰半胱氨酸对大鼠局部脑缺血再灌注损伤的保护作用[J].中国临床康复,2006,10(2):117-119.
[22]张川海,陶贵周.N-乙酰半胱氨酸对家兔缺血再灌注损伤心肌细胞凋亡的影响[J].山东医药,2013,53(2):13-15.
[23]张勇,李玺.N-乙酰半胱氨酸对大鼠肝脏缺血再灌注损伤的保护作用[J].山东医药,2009,49(41):31-32.

