缺氧增强胶质瘤干细胞“干性”的初步研究
李鹏程,周 椿,徐伦山,肖华亮 (.第三军医大学大坪医院野战外科研究所神经外科,重庆40004;.第三军医大学大坪医院野战外科研究所病理科,重庆 40004)
缺氧增强胶质瘤干细胞“干性”的初步研究
李鹏程1,周椿1,徐伦山1,肖华亮2(1.第三军医大学大坪医院野战外科研究所神经外科,重庆400042;2.第三军医大学大坪医院野战外科研究所病理科,重庆 400042)
[摘要]目的研究在体外环境下,缺氧与肿瘤干细胞(CSCs)“干性”的关系。方法选择U87细胞和U251细胞以及原代胶质瘤细胞并进行缺氧处理。用透射电子显微镜法来检测这些细胞的超微结构;用MTT法来检测细胞生长;用流式细胞仪来检测细胞周期以及CD133的表达;用transwell法来检测细胞迁移能力;用集落形成分析来分析细胞的集落形成能力;并用实时定量PCR来检测干细胞以及其分化标志物的mRNA表达。结果缺氧使原代胶质瘤细胞维持在一个未分化的状态,减慢处于相对静止阶段的胶质瘤细胞的生长、增加它们的集落形成能力和胶质瘤细胞的转移,而且能提高干细胞标志物的表达水平。肿瘤干细胞的分化标志物在进行缺氧处理后降低。结论缺氧能够使已分化的胶质瘤细胞“去分化”而使其获得“干性”。
[关键词]肿瘤干细胞;干性;缺氧;胶质瘤
胶质瘤是中枢神经系统的主要肿瘤,占成人颅内肿瘤的35%~50%。而且,在胶质瘤中有60%是恶性胶质瘤[1]。目前,手术治疗同时联合放疗、化疗以及生物治疗仍然是胶质瘤的主要治疗手段。然而,这些方法的治疗效果并不理想。标准的治疗方法同时联合放疗和/或化疗能使患者的平均生存时间仅为14.6个月[2]。近些年来,越来越多的证据表明肿瘤干细胞(cancer stem cells,CSCs)参与了癌症的发展过程,且能促进肿瘤的生长,引起肿瘤的侵袭、复发以及转移[3]。由于其在肿瘤发生发展中的重要作用,CSCs可能成为治疗癌症的一个靶点。然而,需要更多的实验来进一步明确肿瘤细胞尤其是CSCs的生长和分化与肿瘤微环境之间的关系。
缺氧是包括胶质瘤在内的几乎所有恶性肿瘤的重要特征。缺氧对于肿瘤血管生成和能量代谢的影响已较为明确,而缺氧对于肿瘤细胞尤其是CSCs的生长和分化的影响有待进一步探索[4]。在这些研究的基础上,本实验的目的是研究CSCs和肿瘤微环境之间的关系,以便更好地理解CSCs分化的机制。在本实验中,我们研究了缺氧和CSCs分化的相关因素,以期为胶质瘤的治疗提供很好的实验基础。
1材料与方法
1.1CSCs的分离、鉴别和培养
根据文献中的免疫磁珠细胞分离方法(MACS)分离CSCs和CD133阳性的肿瘤细胞[5]。首先,取新鲜的肿瘤组织并进行冲洗,同时去除坏死的组织和血液。然后,将肿瘤组织切成1 mm×1 mm×1 mm的组织块,再用胰酶进行消化并离心。收集离心出来的细胞,并在含有bFGF和EGF的无血清培养液里进行培养。收集原代神经球,并用流式细胞仪检测CD133阳性和CD133阴性的肿瘤细胞,再进行进一步的培养。
1.2细胞周期检测
将U87细胞在常氧或者1%O2的环境中培养。然后在不同的时间点收集细胞,并用流式细胞仪检测细胞周期。
1.3免疫磁珠方法分离细胞
磁场能将细胞上结合的标志物和细胞分开。在我们过去的研究中,用这个方法成功地分离了CD133阳性细胞和胶质瘤来源的内皮细胞[5-6]。CD133微球和羊抗鼠IgG微球购自德国的Miltenyi公司。
1.4MTT分析
用MTT来检测胶质瘤细胞的生长,并描绘生长曲线。收集对数期的细胞,并制成细胞悬液,将细胞悬液的浓度调整到5 000/孔(用无菌的PBS溶液加满边缘孔)。将细胞放在37 ℃和5%CO2的培养箱中培养,直到细胞铺满孔底(平底96孔板),然后将细胞放在常氧或者缺氧环境中培养。将20 μl的MTT溶液加入到每一个孔里(5 mg/mL的0.5%MTT溶液),然后继续培养4 h。培养结束后,将上清液弃去,再在每个孔里加入150 μl的二甲基亚砜(DMSO),然后将培养板放在摇床上低速震荡10 min来完全溶解结晶。最后用酶标仪于570 nm处测定吸光度值。
1.5集落形成分析
收集对数生长期的U251细胞,并用0.5%胰酶/0.04% EDTA消化,来制备单细胞悬液。然后,将这些细胞加入到24孔板中(50个细胞/孔),再将其在37 ℃、饱和湿度和5%CO2的环境中培养24 h。未贴壁的细胞被弃去。培养2~3周后,出现了大的集落,然后用0.5%胰酶/0.04% EDTA来消化集落制备单细胞悬液。然后将这些细胞接种在96孔板中,再继续在37 ℃、饱和湿度和5%CO2的环境中培养,观察其集落形成能力以及集落的形态,并测量集落的大小以及计数每个集落中的细胞数。这次,将细胞分成早期传代组以及晚期传代组。在早期传代组中,用0.5%胰酶/0.04%EDTA消化制备单细胞悬液,然后将这些细胞接种到96孔板中。在晚期传代组中,用0.5%胰酶/0.04%EDTA消化制备单细胞悬液,然后将细胞接种到96孔板中。
1.6Transwell细胞迁移实验
将40 μl人工基底膜(matrigel胶+无血清培养基)加入到上室,在37 ℃环境中过夜。然后将细胞(1×106/mL)加入到上室中(100 μl),再将条件培养基(600 μl)加到下室中并继续培养24 h。然后将Transwell小室取出,将上室中的培养液弃去。再用PBS溶液清洗上室。用棉签擦去Matrigel胶和上室内的残余细胞。接下来,用PBS溶液清洗上室,并浸入4%多聚甲醛中30 min来固定上室内的细胞。用PBS溶液清洗2次后,用结晶紫对上室进行染色20 min。用ddH2O清洗上室3次以上并晾干后,置于光学显微镜下观察。每个孔选择3个视野来进行细胞计数。
1.7统计分析

2结果
2.1缺氧对细胞生长和细胞周期的影响
用MTT来检测胶质瘤细胞的生长并描绘细胞生长曲线。图1显示了U87和x02GBM细胞的生长曲线。结果显示缺氧能够轻度抑制肿瘤细胞的生长,但是并不显著。图2显示了细胞周期结果,表明在1% O2中缺氧处理2、12、24 h对细胞周期并没有显著影响。然而,缺氧处理48 h后,在G0/G1期的细胞数量较常氧组显著增加(P<0.05),而且在G2/M期的细胞数显著下降(P<0.01)。细胞周期的变化与上述变化相似。
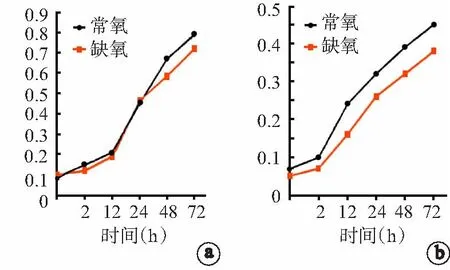
a:U87细胞生长曲线;b:x02GBM细胞生长曲线

缺氧(1%O2)处理2、12、24和48 h后,G0/G1期,G2/M期和S期的U87细胞 (*:P<0.05;#:P<0.01;n=3)
图2缺氧对胶质瘤细胞周期的影响
2.2缺氧对胶质瘤细胞的集落形成能力的影响
集落形成分析显示缺氧对胶质瘤的集落形成能力有显著的影响(图3)。缺氧处理后,U251细胞的集落形成能力显著高于常氧组(P<0.05)。尤其是致密型的集落比例显著增加。在缺氧的条件下,U251细胞的致密型集落的比例显著高于常氧组(P<0.01)。

a:缺氧对U251细胞的集落形成能力的影响;b:在常氧和缺氧条件下,不同类型U251细胞集落之间比较(*:P<0.05;#:P<0.01)
图3缺氧对U251细胞的集落形成能力的影响
2.3缺氧对于胶质瘤细胞迁移的影响
用Transwell法来分析细胞的迁移能力。缺氧处理2 h后,U87细胞的穿膜细胞数与常氧组相近。缺氧处理12 h和24 h后,穿膜的细胞数与常氧组相比显著增加(P<0.05),见图4。

图4 缺氧(1%O2)对细胞迁移的影响(*:P<0.05)
2.4缺氧对于CSCs标志物及其分化标志物的影响
2.4.1缺氧对CD133表达的影响经过1%O2处理48 h后,检测CD133的表达水平。跟常氧组相比,缺氧显著增加了CD133的表达以及CD133阳性细胞数量(图5c)。常氧组中CD133阳性的x01GBM细胞的比例是(4.38±0.95)%(n=3),经过缺氧处理48 h后CD133阳性的x01GBM细胞的比例是(15.90±1.38)%(n=3),两者之间存在显著差异(P<0.01),见图5a~c。
2.4.2缺氧对CSCs标志物及其mRNA表达的影响实时定量PCR被用来检测CSCs标志物(OCT-4,SOX-2)和CSCs的分化标志物(GFAP)。OCT-4的扩增曲线很光滑,具有明显的指数增长期、线性增长期和平台期,表现出特异性的增长。图6显示了不同时间点U87中的OCT-4、SOX-2和GFAP的mRNA表达。在常氧组中,U87细胞中没有OCT-4和SOX-2的mRNA表达。经过缺氧(1%O2)处理2、12和24 h后,OCT-4和SOX-2的mRNA表达增加了;经过缺氧(1%O2)处理48 h和72 h后,OCT-4和SOX-2的mRNA表达跟其他组相比最高(P<0.01)。然而,GFAP的mRNA变化与上述变化相反。经过缺氧(1%O2)处理2 h和12 h后,GFAP的mRNA反而下降了,而且在处理48 h后仍维持在一个低水平。经过缺氧处理48 h和72 h后,U87细胞中GFAP的mRNA水平显著低于常氧组以及缺氧处理2 h组(P<0.01)。如果经过0.5 μg/mL DAPT(一种Notch信号转导通路的特异性抑制剂)预处理,在缺氧治疗72 h后,U87细胞中OCT-4和SOX-2的mRNA表达水平显著低于单用缺氧治疗的U87细胞中的mRNA水平(P<0.01)。然而GFAP的mRNA变化水平表现出相反的规律(P<0.01)。
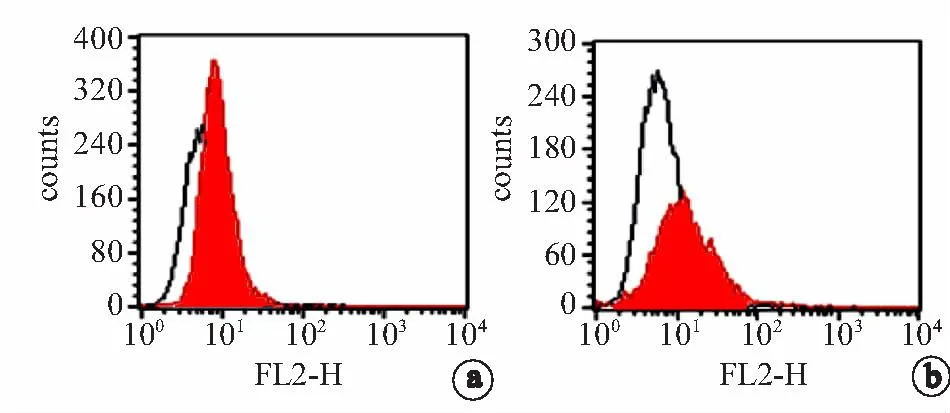

空白峰区为同型对照,红色峰区为CD133表达;a:常氧条件下,x01GBM细胞中CD133的表达水平;b:缺氧处理48 h后,x01GBM细胞中CD133的表达水平;c:缺氧(1%O2)处理后,CD133阳性细胞的比例跟常氧组相比明显增加(*:P<0.05;#:P<0.01)
图5缺氧对CD133表达的影响

a:在U87细胞中OCT-4的mRNA表达;b:在U87细胞中SOX-2的mRNA表达;c:在U87细胞中GFAP的mRNA表达;*与缺氧48 h和72 h比较,P<0.05;#:与缺氧72 h比较,P<0.01
图6缺氧对OCT-4、SOX-2以及GFAP的mRNA的表达的影响
3讨论
缺氧是一种普遍的生理和病理生理现象。发生缺氧时,人的身体会通过复杂的机制来适应缺氧。例如,在缺氧的情况下,机体会增加糖酵解来代偿氧化磷酸化减少而引起的能量不足[7];在缺氧的情况下,机体会增加血管生成来提高血管密度,从而改善血供;系统性缺氧可造成生理性的红细胞生成素增加,从而适应缺氧环境。此外,缺氧同样是一种普遍的病理现象。例如,缺氧在癌症中是一种常见的现象[8]。
过去有实验已证明缺氧能诱导缺氧诱导因子(HIF-1α)的表达,从而调节能影响肿瘤细胞生长和增殖的不同目标基因以及肿瘤的血管生成[9-11]。近年来,很多研究表明缺氧与干细胞的未分化状态有关,并与神经脊和中枢神经系统中的干细胞的增殖和分化有关[12-13]。一些干细胞相关的信号分子参与了缺氧对干细胞的调节。迄今为止,研究发现参与干细胞的正常自我更新和分化的分子包括Wnt、BMP、Notch和Sonic hedgehog (Shh)。近期的研究显示缺氧可能激活HIF-1α从而上调Notch信号通路中的对于维持神经干细胞的未分化状态至关重要的下游分子[14]。Covello等[15]证实了干细胞转录因子OCT-4是HIF-2α的一个目标因子。HIF-2α能够激活OCT-4从而调节干细胞的自我更新和分化。Kaidi等[16]的研究同样显示Wnt/β-catenin能够与HIF-1α相互作用。因此,已有确切的证据显示缺氧与调节正常干细胞的干性的信号通路相关。此外,也有研究发现这些信号通路中的分子参与了CSCs的自我更新和分化[17-18]。Axelson等[19]发现缺氧能够改变神经母细胞瘤细胞和乳腺癌细胞中分化相关基因的表达,能够促进已分化细胞的去分化以及使这些细胞获得干细胞特征。Tavaluc等[20]证明了缺氧能够增加侧群肿瘤细胞。然而,关于缺氧对于胶质瘤细胞以及胶质瘤中CSCs细胞的影响的研究还是很少。
在我们的前期研究中,发现CA IX表达与干细胞的侵袭性和肿瘤的进展相关。基于这些研究结果,我们假设缺氧能够增加胶质瘤中CSCs的干性,并进一步较全面地证明了此假设。首先,检测缺氧对于胶质瘤细胞生长的影响。结果表明缺氧能维持未分化状态,而常氧能促进细胞分化。我们还描绘了细胞生长曲线并检测了细胞周期。结果显示,缺氧能减慢生长速度而且增加静止期的细胞比例。然后,我们检测了缺氧处理后胶质瘤细胞的生物学特性。我们研究了缺氧对胶质瘤细胞的增殖和迁移的影响。结果显示缺氧能够促进这些细胞的自我更新和迁移能力。最后,用PCR来研究缺氧对于胶质瘤中CSCs及其分化标志物的影响。结果显示缺氧能增加CSCs标志物CD133和巢蛋白的表达,但是减少了分化标志物GFAP阳性的细胞比例。基于缺氧对胶质瘤细胞功能、CSCs自我更新和迁移能力和干细胞标志物表达的影响,我们总结出缺氧能够使分化的细胞去分化而且促进这些细胞获得干细胞能力。然而,干性的增加是由于胶质瘤中已分化的细胞去分化导致的CSCs增加,还是由于缺氧导致的CSCs增殖增加仍不清楚,还需要更进一步的实验来验证这个结果。
总而言之,我们的研究全面证明了在体外环境下缺氧能够增加胶质瘤细胞的干性,但是仍需要进行进一步的体内实验来证实这个结果,而且这种影响的具体机制仍不清楚。在我们未来的研究中,我们将进行体内实验并研究这些影响的机制,从而筛选出胶质瘤的治疗靶点。目前,关于CSCs的研究仍处于初级阶段,还需要更进一步的实验来阐明CSCs与其微环境之间的关系。
[参考文献]
[1] Ouyang H,Guo Z,Cheng Z,et al.siRNA-mediated knockdown of JUB expression suppresses the proliferation of glioblastoma cells[J].Cancer Biomark,2015,15(4):477-84.
[2] Thirant C,Galan-Moya EM,Dubois LG,et al.Differential proteomic analysis of human glioblastoma and neural stem cells reveals HDGF as a novel angiogenic secreted factor[J].Stem Cell,2012,30(5):845-853.
[3] Rossi DJ,Jamieson CH,Weissman IL.Stems cells and the pathways to aging and cancer[J].Cell,2008,132(4):681-696.
[4] Keith B,Simon MC.Hypoxia-inducible factors,stem cells,and cancer[J].Cell,2007,29(3):465-472.
[5] Yi L,Zhou ZH,Ping YF,et al.Isolation and characterization of stem cell-like precursor cells from primary human anaplastic oligoastrocyt-oma[J].Modern Pathol,2007,20(10):1061-1068.
[6] Seo SK,Jeong HY,Park SG,et al.Blockade of endogenous B7-H1 suppresses antibacterial protection after primary Listeria monocytogenes infection[J].Immunology,2008,123(1):90-99.
[7] Bruick RK.Oxygen sensing in the hypoxic response pathway:regulation of the hypoxia-inducible transcription factor[J].Genes Dev,2003,17(21):2614-2623.
[8] Semenza GL.Hypoxia-inducible factor 1:oxygen homeostasis and disease pathophysiology[J].Trends Mol Med,2001,7(8):345-350.
[9] Raval RR,Lau KW,Tran MG,et al.Contrasting properties of hypoxia-inducible factor 1(HIF-1) and HIF-2 in von Hippel-Lindau-associated renal cell carcinoma[J].Mol Cell Biol,2005,25(13):5675-5686.
[10] Ryan HE,Lo J,Johnson RS.HIF-1 alpha is required for solid tumor formation and embryonic vascularization[J].EMBO J,1998,17(11):3005-3015.
[11] Carroll VA,Ashcroft M.Role of hypoxia-inducible factor (HIF)-1alpha versus HIF-2alpha in the regulation of HIF target genes in response to hypoxia,insulin-like growth factor-I,or loss of von Hippel-Lindau function:implications for targeting the HIF pathway[J].Cancer Res,2006,66(12):6264-6270.
[12] Morrison SJ,Csete M,Groves AK,et al.Culture in reduced levels of oxygen promotes clonogenic sympathoadrenal differentiation by isolated neural crest stem cells[J].J Neurosci,2000,20(19):7370-7376.
[13] Studer L,Csete M,Lee SH,et al.Enhanced proliferation,survival,and dopaminergic differentiation of CNS precursors in lowered oxygen[J].J Neurosci,2000,20(19):7377-7383.
[14] Gustafsson MV,Zheng X,Pereira T,et al.Hypoxia requires notch signaling to maintain the undifferentiated cell state[J].Dev Cell,2005,9(5):617-628.
[15] Covello KL,Kehler J,Yu H,et al.HIF-2alpha regulates Oct-4:effects of hypoxia on stem cell function,embryonic development,and tumor growth[J].Genes Dev,2006,20(5):557-570.
[16] Kaidi A,Williams AC,Paraskeva C.Interaction between beta-catenin and HIF-1 promotes cellular adaptation to hypoxia[J].Nat Cell Biol,2007,9(2):210-217.
[17] Rossi DJ,Jamieson CHM,Weissman IL.Stems cells and the pathways to aging and cancer[J].Cell,2008,132(4):681-696.
[18] Keith B,Simon MC.Hypoxia-inducible factors,stem cells,and cancer[J].Cell,2007,129(3):465-472.
[19] Axelson H,Fredlund E,Ovenberger M,et al.Hypoxia-induced dedifferentiation of tumor cells-A mechanism behind heterogeneity and aggressiveness of solid tumors[J].Semin Cell Dev Biol,2005,16(4-5):554-563.
[20] Tavaluc RT,Hart LS,Dicker DT,et al.Effects of low confluency,serum starvation and hypoxia on the side population of cancer cell lines[J].Cell Cycle,2007,6(20):2554-2562.
(编辑:周小林)
Hypoxia enhances stemness of cancer stem cells in glioblastoma
LI Peng-cheng1,ZHOU Chun1,XU Lun-shan1,XIAO Hua-liang2(1.Department of Neurosurgery,Institute of Field Surgery,Daping Hospital,Third Military University,Chongqing 400042,China;2.Department of Pathology,Institute of Field Surgery,Daping Hospital,Third Military University,Chongqing 400042,China)
Abstract:ObjectiveTo investigate the relationship between hypoxia and stemness of cancer stem cells (CSCs).MethodsU87 cells,U251 cells and primary glioma cells were experienced hypoxia.Detected the ultrastructure of these cancer cells with transmission electron microscopy; detect the cell growth with MTT assay; cell cycle and CD133 expression were detected by flow cytometry; and the cell migration ablity were detected through transwell chamber assay; the colony-forming efficiency were deteced by colony-forming assay; and real-time quantitative PCR and Western blot were carried out to detect the mRNA and protein expression of markers of stem cells and their differentiation respectively.ResultsHypoxia maintained the undifferentiated state of primary glioma cells, slowed down the growth of glioma cells which were in a relatively quiescent stage, increased the colony forming efficiency and migration of glioma cells, and increased the expression of markers of stem cells, but the expression of markers for stem cell differentiation was reduced after hypoxia treatment.ConclusionHypoxia may induce the “dedifferentiation” of differentiated glioma cells which then acquire the stemness.
Keywords:cancer stem cells;stemness;hypoxia;glioblastoma
[收稿日期]2015-04-28[修回日期] 2015-06-15
[通讯作者]徐伦山,E-mail:xuliu559@163.com;肖华亮,E-mail:xiaoyyuk@163.com
[基金项目]国家自然科学基金(30872649)
doi:10.11659/jjssx.01E015027
[中图分类号]R730.5
[文献标识码]A
[文章编号]1672-5042(2015)05-0479-05

