光照周期对曼氏无针乌贼(Sepiella japonica)繁殖、性类固醇激素系统及生长性能的调控作用*
平洪领 王天明 刘立芹 史会来 胡逍宇 吕振明① 杨静文迟长凤 刘慧慧 黄 伟 顾忠旗 吴常文
(1. 浙江海洋学院 国家海洋设施养殖工程技术研究中心 舟山 316004;2. 浙江省海洋水产研究所 舟山 316004; 3. 浙江省嵊泗县海洋科技研究所 舟山 202450)
曼氏无针乌贼(Sepiella japonica)隶属软体动物门、头足纲、乌贼科、无针乌贼属, 是我国重要的海洋渔业经济种类之一, 曾是我国东海“四大海产”之一,历史上最高年产量仅浙江就达 6万 t以上(董正之,1988)。但20世纪70年代末以来, 由于过度捕捞和水域条件的破坏, 其资源量衰退严重, 自然资源已近枯竭(吴常文等, 2006)。21世纪初, 国内许多学者开始进行曼氏无针乌贼的人工繁育和增养殖工作, 目前已初步突破其人工繁育和增养殖技术, 为今后曼氏无针乌贼资源的修复及增养殖奠定了良好基础(王春琳等, 2010; Wu et al, 2010)。但近年来的养殖实践表明, 人工养殖条件下曼氏无针乌贼普遍存在性早熟、个体小型化等问题, 通常自然海域中生命周期1年体重可达 300—400g的曼氏无针乌贼在养殖条件下仅需 3—4个月, 体重 100g左右即达性成熟(郑小东等,2010), 这大大影响了曼氏无针乌贼的养殖效益和开发潜力。养殖条件下的这种性早熟及个体小型化在商乌贼(Sepia officinalis) (Domingues et al, 2002)、莱氏拟乌贼(Sepioteuthis lessoniana) (Ikeda et al, 2009)、乳光枪乌贼(Loligo opalescens) (Yang et al, 1986)、滑柔鱼(Illex illecebrosus) (Durward et al, 1980)、蓝蛸(Octopus cyanea)、玛雅蛸(O. maya) (Van Heukelem,1976)的养殖实践中也普遍存在。因此迫切需要探明曼氏无针乌贼等头足类在养殖条件下的性早熟、个体小型化原因, 并对其养殖条件进行优化, 以推动养殖产业的发展。
影响水产动物性腺发育及生长的因素很多, 其中光照周期就是其中最重要的因素之一。一般认为光照周期可通过影响水产动物体内激素水平(如褪黑素)进而影响自身的生长发育及繁殖节律(Taylor et al,2005; Zohar et al, 2010)。近年来, 有关光照周期对水产动物性腺发育和生长发育的影响已在鱼类(Unwin et al, 2005; Trippel et al, 2008)、虾、蟹类(Primavera et al, 1992; Crear et al, 2003)、贝类(Strömgren, 1976;Brito-Manzanoa et al, 2013), 甚至其它无脊椎动物(Shpigel et al, 2004)中均得到证实。在海洋头足类中,光照周期对性成熟及生长的影响仅在商乌贼(S.officinalis)有过明确的阐述(Richard, 1967; Forsythe et al, 1994)。Richard(1967)发现短光照(23D:1L)养殖条件下商乌贼性成熟时间比长光照组(6D:18L; 12D:12L)大大提前; Forsythe等(1994)证实24h持续光照养殖会使商乌贼性腺发育受到明显抑制, 从而使养殖周期更长, 商品规格更大。Koueta等(2003)也证实,短光照下(16D:8L)养殖的商乌贼生长速度相对于长光照(12D:12L; 8D:16L)明显降低。部分非直接的证据也表明光照周期可能在真蛸(Octopus vulgaris) (Wells et al, 1959)、蓝蛸(O. cyanea)及玛雅蛸(O. maya)(Van Heukelem, 1976)的性腺发育和生长中也扮演着重要角色。而光照周期对曼氏无针乌贼的繁殖及生长性能方面的影响至今仍未见报道, 本文将采用光周期调控的方法研究不同光照周期下曼氏无针乌贼的性成熟及生长的变化, 为揭示养殖条件下曼氏无针乌贼等头足类的性早熟及个体小型化机制, 进而优化其养殖工艺提供基础。
1 材料与方法

表1 光周期实验所用的乌贼样本数量与规格Tab.1 The size and number of S. japonica samples used in the experiment
1.1 材料
用于光周期调控实验的曼氏无针乌贼幼苗样本由浙江海洋学院乌贼繁育基地浙江大海洋科技有限公司提供, 为 2012年福建漳州自然海区采捕的野生乌贼亲本经驯化繁育后的 F5代苗种, 该苗种在基地经正常培育至孵化后 40日龄, 胴长生长至 3.63—5.00cm, 体重达8.38—10.90g时(表1), 随机挑选健康苗种约300只, 用于后续的光周期调控养殖实验。
1.2 方法
光周期调控实验在浙江大海洋科技有限公司苍南苗种繁育基地进行。实验设置 3种不同的光周期:即长光照组(1D︰23L)、中光照组(12D︰12L)和短光照组(23D︰1L)对乌贼进行养殖实验, 观察不同光周期对乌贼繁殖、性激素系统及生长性能的影响。
具体实验过程为: 将上述乌贼苗种养殖于9个圆形玻璃钢桶(直径1.2m, 高1.2m)中, 每个桶养殖乌贼约30只, 共270只乌贼。随机将9桶乌贼划分为3组, 每组3个平行。将3组乌贼分别置于上述3种不同光周期下进行养殖。光周期调控时光源由 105W LED节能灯提供, 平均光强为水面光照强度 800—1000 lx, 光周期采用定时开关自动控制。乌贼养殖时采用自然水温(29—31°C)养殖, 以冰鲜小杂鱼和小虾为养殖饲料, 每天投喂两次, 投饲量按 20%BW/d计算。每日换水1次, 早晚各吸污1次。每天记录养殖水温、盐度及个体摄食、生长、存活情况。
当乌贼达性成熟后, 观察其交配和产卵情况, 当有一个实验组出现产卵时, 即采集各光照周期组的乌贼样品(每梯度30尾)进行体重(body weight, BW)、体长(body length, BL)、体宽(body width, BWI)等生长指标, 及性腺重(gonad weight, GW), 性成熟指数(gonad somatic index, GSI)等性成熟指标的测量, 同时对乌贼性成熟相关类固醇激素水平: 精巢睾酮(T)和卵巢雌二醇(E2)进行测定, 乌贼性腺重, 性成熟指数、体重、体长、体宽等指标采用ALC-210.3电子天平和电子数显卡尺进行测量, 睾酮和雌二醇等性类固醇激素含量采用放射免疫法(RIA)进行测定, 具体方法为: 乌贼的精巢和卵巢组织以 1︰3(g/mL)的比例加入蒸馏水, 采用Ultra-Turrax I-125型匀浆器匀浆,而后, 匀浆液中加入 10倍体积的乙醚充分萃取, 低温(2—6°C)静置 30—60min, 取上层乙醚相, 用旋转蒸发仪干燥后, 残留液体溶于 1mL甲醇溶液中。取50μL该甲醇溶解液放入试管中50—60°C干燥, 残留液复用0.05 mol/L, pH 7.4的磷酸缓冲液溶解, RIA法进行激素测定, 具体过程参照 D’Aniello等(1996)和Di Cosmo等(2001)的方法进行。未产卵的光周期组剩余乌贼样品则继续养殖, 直至产卵, 统计其产卵起始时间。
1.3 数据分析与处理
统计和比较不同光照周期条件下乌贼体重(BW)、体长(BL)、体宽(BWI)、瞬时生长率(IGR)、肥满度(K)等生长指标, 性腺重(GW)、性成熟指数(GSI)、产卵时间(ST)等繁殖参数及精巢睾酮(T)和卵巢雌二醇(E2)的含量。其中:
瞬时生长率计算公式为IGR = (lnBW2-lnBW1)×100/t; 其中BW1为初始体重, BW2为试验结束时体重,t为实验持续时间(d)。
肥满度计算公式K = (BW/BL3)×100; BW为体重,BL为胴长。
性腺指数计算公式为GSI = GW/BW×100%; 其中GW为性腺重, BW为体重。
胴长、体重、肥满度K和瞬时生长速度IGR等生长指标, 以及性腺重、性成熟指数GSI、产卵时间等繁殖性能指标, 还有精巢睾酮(T)、卵巢雌二醇(E2)等性类固醇激素含量值, 均以平均数±标准差(X±SD)的形式表示, 采用 SPSS17.0软件包对各光周期实验组间是否存在显著性差异进行统计分析。检验时先进行方差齐性分析, 方差齐性则运用 LSD法进行单因素方差多重比较, 方差非齐性则采用Tamhane’ T2法进行单因素方差分析, 显著水平采用 0.05; 然后进行Duncan氏多重比较各实验组间差异的显著性, 显著性水平为P<0.05。

图1 不同光周期下曼氏无针乌贼的性腺重和成熟系数(n=30)Fig.1 The effect of different photoperiod on gonad weight and gonad somatic index GSI of S. japonica (n=30)标有不同小写字母表示组间存在显著性差异(P<0.05), 标有相同字母表示差异不显著(P>0.05)
2 结果与分析
2.1 光照周期对曼氏无针乌贼繁殖性能的影响
对不同光照周期下养殖的曼氏无针乌贼性成熟和繁殖进行比较, 结果表明, 光周期处理并未对曼氏无针乌贼性成熟过程及繁殖时间产生十分明显的影响。孵化后培育了40d的乌贼幼苗, 经过29—35d的光周期处理试验, 所有实验组乌贼几乎同时开始产卵(如表 2所示), 各组间起始产卵时间并无显著性差异(P<0.05)。然而, 光周期处理对乌贼性腺重则有一定的影响, 如图 1所示, 各实验组均呈现短光照组(23D: 1L)>中光照(12D: 12L)>长光照(1D: 23L), 但仅在雌性乌贼中呈现显著影响(P<0.05), 而在雄性中未达到显著性水平(P>0.05)。性腺发育指数则在各光周期组间均无显著差异(P>0.05), 如图 1所示, 各光照周期下雄性曼氏无针平均性腺指数为8.73%—9.81%,而雌性平均性腺指数则达 11.48%—12.49%, 性腺发育指数(性腺重/体重)在各试验组间也未表现出与性腺重相同的变化趋势, 可能与各光周期下乌贼体重不同有关(见2.3)。

表2 光周期处理对曼氏无针乌贼繁殖时间的影响Tab.2 The effect of photoperiod on the spawning time of female S. japonica
2.2 光照周期对曼氏无针乌贼性类固醇激素系统的影响
对不同光照周期下养殖的曼氏无针乌贼性类固醇激素(E2、T)水平进行比较, 结果表明, 光周期处理对乌贼的性激素水平却产生了较为明显的影响, 由图2所示。长光照(1D︰23L)处理下曼氏无针乌贼雌性卵巢雌二醇(E2)、雄性精巢睾酮(T)激素水平分别为575.69pg/g和 2420.23pg/g, 较短光照(23D︰1L)组和中光照(12D︰12L)组明显降低, 且均达到显著水平(P<0.05); 而短光照组与中光照组性腺中 E2、T激素水平则分别达905.26、4001.27和867.40、3907.92 pg/g,两者间并无显著性差异(P>0.05)。
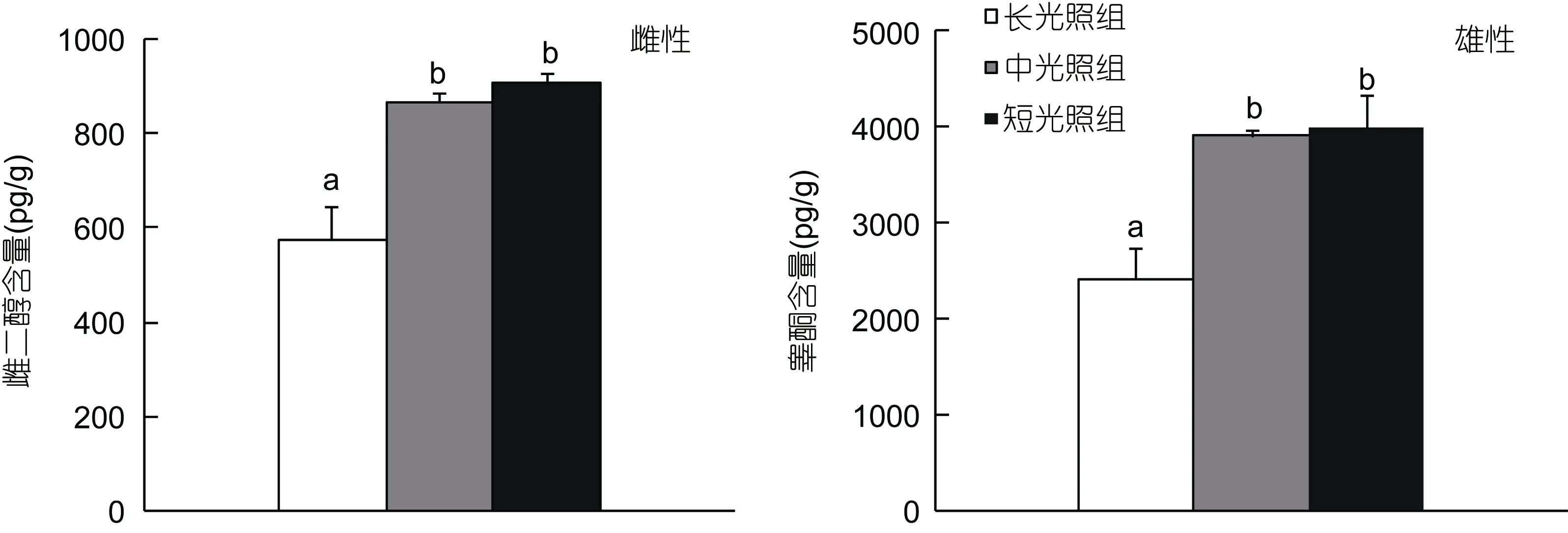
图2 不同光照周期对曼氏无针乌贼E2、T激素含量的影响(n=8)Fig.2 The effect of different photoperiod on the testis testosterone (T) and ovary estradiol (E2) in S. japonica (n=8)标有不同小写字母表示组间存在显著性差异(P<0.05), 标有相同字母表示差异不显著(P>0.05)

表3 光照周期对曼氏无针乌贼生长性能的影响(n=30)Tab.3 Effects of photoperiod on growth performances of S. japonica (n=30)
2.3 光照周期对曼氏无针乌贼生长的影响
对不同光周期组曼氏无针乌贼各生长指标进行比较, 结果表明, 不同光周期条件下, 曼氏无针乌贼均表现出极快的生长速度, 从孵化后40d到性成熟整个过程的瞬时生长率达到 4.92—5.33 BW%/d(如表3所示), 展示出海洋头足类优良的生长特性。光周期处理对曼氏无针乌贼生长性能有较明显的影响。在胴长(BL)、体重(BW)、生长率(IGR)及肥满度(K)等生长指标方面, 除个别数据外, 均呈现出短光照组(23D:1L)>中光照组(12D:12L)>长光照组(1D:23L)。这种生长性能差异在短光照组与其它光照组之间表现的尤为明显。短光照组中的雌乌贼在体重、生长率及肥满度等指标上均显著高于长光照和中光照组(P<0.05);短光照组中的雄乌贼在胴长方面也显著高于长光照组(P<0.05); 而中光照组与长光照组在所测生长指标上均未达到显著差异(P>0.05)。
3 讨论
3.1 光照周期对曼氏无针乌贼繁殖性能的影响
本研究中, 培育了40d的曼氏无针乌贼, 经过近一个月的养殖后即达到了性成熟, 整个养殖周期仅 2个多月, 个体平均规格仅 30—55g, 再次证实了养殖条件下曼氏无针乌贼的性早熟及个体小型化现象(郑小东等, 2010)。光照周期调控试验结果表明, 除部分指标外, 光照周期对曼氏无针乌贼产卵时间和繁殖性能均无明显影响。该结果与商乌贼(S. officinalis)中的研究结果形成了较大的反差, 也与 Wells等(1959)对真蛸(O. vulgaris)视神经切除促进性腺发育的研究结果不符。分析其原因, 一方面可能与不同物种性发育对光照周期的敏感程度不同有关; 如现有的资料表明, 水产动物性成熟对光照周期变化的响应可大致分为三类: (1) 无任何响应(Johnston et al, 2003;Veras et al, 2013); (2) 有响应, 但响应不大(Taranger et al, 2006; Trippel et al, 2008); (3) 响应明显(Duston et al, 2003; Unwin et al, 2005)。另一方面, 可能也与受试动物的年龄、摄食状况、个体大小、营养状况等有关(Oppedal et al, 2006; Taylor et al, 2008; Taranger et al, 2010)。其中, 受试动物年龄与其对光照周期的响应有显著关系, 如 Imsland等(2009)对大西洋大比目鱼(Hippoglossus hippoglossus)的研究中发现, 在性腺发育早期时进行光照处理比在性腺发育晚期时更有效。相似的例子在大西洋鲑(Salmo salar)(Taranger et al, 1998)及虹鳟(Oncorhynchus mykiss)(Randall et al,1998)中也被证实。本研究中曼氏无针乌贼光周期处理的起始时间为孵化后 40d, 体重达(9.64±1.26)g时,光周期处理时间更早些是否能更有效地影响其性成熟和产卵时间还有待进一步证实。当然, 也有研究表明光照周期对水产动物性成熟的影响与实验使用的光强度有密切关系(Dahle et al, 2000; Trippel et al,2008)。Leclercq等(2011)也认为大西洋鲑的性腺发育对光照强度的响应可能存在阈值, 即只有当光强达到0.010W/m2以上的连续光照(24L:0D)才能有效地抑制其性成熟。适当增加光照强度是否能更有效地影响乌贼的性腺发育和繁殖性能, 也值得今后的进一步证实。
3.2 光照周期对曼氏无针乌贼性类固醇激素系统的影响
然而, 值得注意的是, 本研究中光周期调控对曼氏无针乌贼性类固醇激素系统却产生了明显的影响。长光照(1D:23L)处理下曼氏无针乌贼雌性卵巢雌二醇(E2)、雄性精巢睾酮(T)等性类固醇激素水平较短光照组与中光照组显著降低(P<0.05)。这是否说明本实验中光周期的调控尽管未能在表观繁殖性能上产生足够明显的影响, 但在生化层面上已对繁殖性能产生“隐性”的作用?性类固醇激素是影响脊椎动物性发育和繁殖性能的重要分子, 它们对性腺发育起着最直接的调控作用。有关性类固醇激素对海洋软体动物性成熟的作用研究相对较少, 但已有大量实验证据表明, 性类固醇激素对海洋软体动物性腺发育和成熟起着同样重要的作用(Croll et al, 2007)。性类固醇激素在海洋头足类生殖发育中的作用在近年来才得到关注。如Di Cosmo等(2001)发现, 真蛸体内雌二醇(E2)和孕酮(P)的含量随着性腺发育的成熟而快速的升高。Kanda等(2006)发现采用头足类生殖轴核心分子GnRH孵育法可显著提升真蛸体内睾酮、雌二醇和孕酮的含量, 暗示了它们在海洋头足类生殖中的作用。最近, 在头足类中还发现了类固醇激素的结合蛋白及受体(D’Aniello et al, 1996; Di Cosmo et al,1998, 2002), 并发现这些受体在头足类中能驱动与脊柱动物性腺中相似的 CAMP及钙离子内流等信号通路(De Lisa et al, 2012), 进一步证实了性类固醇激素在海洋头足类生殖发育中的作用保守性。因此, 光周期调控对曼氏无针乌贼性类固醇激素系统的影响可能正好说明了其对乌贼繁殖性能的潜在作用, 通过进一步光周期处理方式和水平的调节, 如提早处理时间、提高光照强度、改变光波长度等, 很可能最终能延迟乌贼的性成熟和产卵时间。
3.3 光照周期对曼氏无针乌贼生长的影响
本研究中光照周期对曼氏无针乌贼生长的影响却是显而易见的。由表3可知, 短光照组(23D: 1L)的乌贼在生长速度、性成熟时的胴长、体重、肥满度等生长指标方面明显高于中光照和长光照组, 其中短光照组雌性个体的生长优势在体重、生长速度、肥满度等指标上均达到显著水平(P<0.05); 而短光照组雄性个体的生长优势也在胴长上达到了显著水平(P<0.05)。该结果说明短光照周期对乌贼的生长可能更有利。其实, 光照周期对生长的调控作用已在包括鱼类(Taylor et al, 2005; Trippel et al, 2008)、虾、蟹类(Crear et al, 2003)、贝类(Strömgren, 1976; Brito-Manzanoa et al, 2013)等多种水产动物中得到证实。一般认为,光照周期可通过调控水产动物的摄食活动节律、食物转化效率等影响水产动物的生长(Taylor et al, 2005);近年来, 光照周期引起的褪黑素变化可作用于GH-IGF轴, 从而引起生长的变化也已在硬骨鱼类中得到证实(Suzuki et al, 2002; Taylor et al, 2005)。本研究中光照周期对曼氏无针乌贼生长的调控作用也可能来源于光照对摄食节律的影响。因为光照对摄食的影响已在多种海洋头足类中被证实, 如据研究夏威夷短尾鱿鱼(Eupryma scolopes)(Shears, 1988)和欧洲枪乌贼(L. vulgaris)(Sauer et al, 1991)主要在黑暗环境中进行摄食活动。而相反, 金乌贼、拟目乌贼和商乌贼等头足类的摄食活动却主要在白天进行(Koueta et al, 2003)。Koueta等(2003)发现短光照(长黑暗条件)下商乌贼的摄食和生长受到明显抑制可能就与其喜白天摄食的习性有关。然而, 短光照(长黑暗条件)是否真的更利于曼氏无针乌贼的摄食活动, 从而促进其生长还需要更多摄食行为学方面的深入研究。另外,本研究中短光照对曼氏无针乌贼生长的促进作用还可能与短光照条件下乌贼较弱的领地行为有关。研究中观察发现, 在长光照养殖条件下, 乌贼由于领地习性而产生打斗行为明显加剧, 其结果造成光照实验结束时, 长光照组乌贼存活率明显降低(如表2所示),因此短光照组对乌贼生长的促进作用是否与此有关还有待于进一步的证实。
然而, 本研究结果已明确表明, 光周期调控对人工养殖的曼氏无针乌贼的生长具有显著影响, 因此,可通过光周期调节改善乌贼的生长性能, 改善养殖条件下的个体小型化等现象, 这对今后曼氏无针乌贼等头足类养殖条件的优化, 提高其养殖效果与收益都具有重要意义。
王春琳, 王津伟, 余红卫等, 2010. 曼氏无针乌贼(Sepiella maindroni)副缠卵腺的组织学及超微结构. 海洋与湖沼,41(3): 391—395
吴常文, 赵淑江, 徐蝶娜, 2006. 舟山渔场针乌贼(Sepia andreana)的生物学特性及其渔场分布变迁. 海洋与湖沼,37(3): 231—237
郑小东, 林祥志, 王昭凯等, 2010. 日本无针乌贼全人工养殖条件下生活史研究. 海洋湖沼通报, (3): 24—28
董正之, 1988. 中国动物志——软体动物门, 头足纲. 北京: 科学出版社
Brito-Manzanoa N, Aldana-Aranda D, 2013. Effect of photoperiod and feeding schedule on growth and survival of larvae of the fighting conch Strombus pugilis Linné, 1758 (Mollusca,Gastropoda). Aquaculture, 408—409(15): 47—50
Crear B J, Hart P R, Thomas C W, 2003. The effect of photoperiod on growth, survival, colour and activity of juvenile southern rock lobster, Jasus edwardsii. Aquaculture Research, 34(6): 439—444
Croll R P, Wang C D, 2007. Possible roles of sex steroids in the control of reproduction in bivalve mollusks. Aquaculture,272(1—4): 76—86
D’Aniello A, Cosmo A D, Di Cristo C et al, 1996. Occurrence of sex steroid hormones and their binding proteins in Octopus vulgaris lam. Biochemical and Biophysical Research Communications, 227(3): 782—788
Dahle R, Taranger G L, Norberg B, 2000. Sexual maturation and growth of Atlantic cod (Gadus morhua L) reared at different light intensities. In: Proceedings of the 6thinternational symposium on the reproductive physiology of fish.University of Bergen, 336
De Lisa E, Paolucci M, Di Cosmo A, 2012. Conservative nature of oestradiol signalling pathways in the brain lobes of octopus vulgaris involved in reproduction, learning and motor coordination. Journal of Neuroendocrinology, 24(2):275—284
Di Cosmo A, Di Cristo C, Paolucci M, 2001. Sex steroid hormone fluctuations and morphological changes of the reproductive system of the female of Octopus vulgaris throughout the annual cycle. Journal of Experimental Zoology, 289(1): 33—47
Di Cosmo A, Di Cristo C, Paolucci M, 2002. A estradiol-17β receptor in the reproductive system of the female of Octopus vulgaris: characterization and immunolocalization. Molecular Reproduction and Development, 61(3): 367—375
Di Cosmo A, Paolucci M, Di Cristo C et al, 1998. Progesterone receptor in the reproductive system of the female of Octopus vulgaris: characterization and immunolocalization. Molecular Reproduction and Development, 50(4): 451–460
Domingues P M, Sykes A, Andrade J P, 2002. The effects of temperature in the life cycle of two consecutive generations of the cuttlefish Sepia officinalis (Linnaeus, 1758), cultured in the Algarve (South Portugal). Aquaculture International,10(3): 207—220
Durward R D, Vessey E, O’Dor R K et al, 1980. Reproduction in the squid, Illex illecebrosus: first observations in captivity and implications for the life cycle. International Commission for the Northwest Atlantic Fisheries Selected Papers, 6:7—13
Duston J, Astatkie T, MasIsaac P F, 2003. Long-to-short photoperiod in winter halves the incidence of sexual maturity among Arctic charr. Aquaculture, 221(1—4): 567—580
Forsythe J W, DeRusha R H, Hanlon R T, 1994. Growth,reproduction and life span of Sepia officinalis (Cephalopoda:Mollusca) cultured through seven consecutive generations.Journal of Zoology, 223(2): 175—192
Ikeda Y, Ueta Y, Anderson F E et al, 2009. Reproduction and life span of the oval squid Sepioteuthis lessoniana (Cephalopoda:Loliginidae): comparison between laboratory-cultured and wild-caught squid. Marine Biodiversity Records, 2(1): 1—7
Imsland A K, Roth B, Foss A et al, 2009. Long-term effect of photoperiod manipulation on growth, maturation and flesh quality in Atlantic halibut. Aquaculture Research, 40(11):1260—1269
Johnston I A, Manthri S, Smart A et al, 2003. Plasticity of muscle fibre number in seawater stages of Atlantic salmon in response to photoperiod manipulation. The Journal of Experimental Biology, 206: 3425—3435
Kanda A, Takahashi T, Satake H, et al, 2006. Molecular and functional characterization of a novel gonadotropin-rrleasinghormone receptor isolated from common octopus (Octopus vulgaris). Biochemical Journal, 395(1): 125—135
Koueta N, Boucaud-Camou E, 2003. Combined effects of photoperiod and feeding frequency on survival and growth of juvenile cuttlefish Sepia officinalis L. in experimental rearing. Journal of Experimental Marine Biology and Ecology, 296(2): 215—226
Leclercq E, Taylor J F, Sprague M et al, 2011. The potential of alternative lighting-systems to suppress pre-harvest sexual maturation of 1+ Atlantic salmon (Salmo salar) post-smolts reared in commercial sea-cages. Aquacultural Engineering,44(2): 35—47
Oppedal F, Berg A, Olsen R E et al, 2006. Photoperiod in seawater influence seasonal growth and chemical composition in autumn seatransferred Atlantic salmon (Salmo salar L.)given two vaccines. Aquaculture, 254(1—4): 396—410
Primavera J H, Caballero R M V, 1992. Light color and ovarian maturation in unablated and ablated giant tiger prawn Penaeus monodon (Fabricius). Aquaculture, 108(3—4):247—256
Randall C F, Bromage N R, Duston J et al, 1998. Photoperiod induced phase-shifts of the endogenous clock controlling reproduction in the rainbow trout: a circannual phase–response curve. Journal of Reproduction and Fertility, 112(2): 399—405
Richard A, 1967. Rôle de la photopériode dans le déterminisme de la maturation génitle femelle du Céphalopode Sepia officinalis C R hebd Séanc. Academic sciences, Paris, 263:1315—1318
Sauer W H H, Lipińsky M R, 1991. Food of the squid Loligo vulgaris reynaudii (Cephalopoda Loliginidae) on their spawning grounds off the Eastern Cape, South Africa. South Africa Journal of Marine Science, 10(1): 193—201
Shears J, 1988. The use of a sand-coat in relation to feeding and diel activity in the sepioidae squid Euprymna scolopes.Malacologia, 29(1): 121—133
Shpigel M, McBride S C, Marciano S et al, 2004. The effect of photoperiod and temperature on the reproduction of European sea urchin Paracentrotus lividus. Aquaculture,232(1—4): 343—355
Strömgren T, 1976. Growth rates of Modiolus modiolus (L.) and Cerastoderma edule (L.) (Bivalvia) during different light conditions. Sarsia, 61(1): 41—46
Suzuki N, Hattori A, 2002. Melatonin suppresses osteoclastic and osteo-blastic activities in the scales of goldfish. Journal of Pineal Research, 33(4): 253—258
Taranger G L, Aardal L, Hansen T et al, 2006. Continuous light delays sexual maturation and increases growth of Atlantic cod (Gadus morhua L.) in sea cages. ICES Journal of Marine Science, 63(2): 365—375
Taranger G L, Carrillo M, Schulz R W et al, 2010. Control of puberty in farmed fish. General and Comparative Endocrinology, 165(3):483—515
Taranger G L, Haux C, Stefansson S O et al, 1998. Abrupt changes in photoperiod affect age at maturity, timing of ovulation and plasma testosterone and oestradiol-17ß profiles in Atlantic salmon, Salmo salar. Aquaculture,162(1—2): 85—98
Taylor J F, Migaud H, Porter M J R et al, 2005. Photoperiod influences growth rate and plasma insulin-like growth factor-I levels in juvenile rainbow trout, Oncorhynchus mykiss. General and Comparative Endocrinology, 142(1—2):169—185
Taylor J F, Porter M J R, Bromage N R et al, 2008. Relationships between environmental changes, maturity, growth rate and plasma insulin-like growth factor-I (IGF-I) in female rainbow trout. General and Comparative Endocrinology,155(2): 257—270
Trippel E A, Benfey T J, Neil S R E et al, 2008. Effects of continuous light and triploidy on growth and sexual maturation in Atlantic cod, Gadus morhua. Cybium, 32(2):136—138
Unwin M J, Rowe D K, Poortenaar C W et al, 2005. Boustead N C. Suppression of maturation in 2-year-old Chinook salmon(Oncorhynchus tshawytscha) reared under continuous photoperiod. Aquaculture, 246(1—4): 239—250
Van Heukelem W F, 1976. Growth, bioenergetics and life-span of Octopus cyanea and Octopus maya. Manoa: Dr. Thesis,University of Hawaii, 3—5
Veras G C, Murgas L D S, Rosa P V et al, 2013. Effect of photoperiod on locomotor activity, growth, feed efficiency and gonadal development of Nile tilapia. Revista Brasileira de Zootecnia, 42(12): 844—849
Wells B M, Wells J, 1959. Hormonal control of sexual maturity in Octopus. Journal of Experimental Biology, 36: 1—33
Wu C W, Chi C F, He G Y et al, 2010. Isolation via enrichment and characterization of ten polymorphic microsatellite loci in the cuttlefish, Sepiella maindroni de Rochebruns. Acta Oceanologica Sinica, 29(6): 121—124
Yang W T, Hixon R F, Turk P E et al, 1986. Growth, behavior, and sexual maturation of the market squid, Loligo opalescens,cultured through the life cycle. Fishery Bulletin, 84(4):771—798
Zohar Y, Muñoz-Cueto J A, Elizur A et al, 2010. Neuroendocrinology of reproduction in teleost fi sh. General and Comparative Endocrinology, 165(3): 438—455

