平欧杂种榛优良品种的抗旱性比较1)
宋锋惠 殷传杰 史彦江 陶秀冬 周丽
(新疆林业科学院经济林研究所,乌鲁木齐,830063) (新疆维吾尔自治区林业厅) (新疆林业科学院经济林研究所)
责任编辑:潘 华。
榛子为桦木科(Corylaceae)榛属(Corylus)植物,是世界“四大坚果”树种之一。1993年以来,新疆林业科学院陆续开展了榛子的引种、驯化、选育、栽培等工作,现已形成以伊犁河谷为主的平欧杂种榛(Corylus heterophylla×Corylus avellan)栽植带,并逐渐成为新疆推广示范的新型特色林果树种之一[1-2]。新疆地处亚欧大陆腹地,干燥少雨,为典型的大陆性气候,尤其南疆地区,处于极端干旱地区,环境恶劣,如何筛选出适合当地栽植的杂种榛品种,已成为亟待解决的关键问题之一。目前,有关新疆杂种榛抗旱性的研究报道较少,寇云玲[3]研究了新疆杂种榛叶片解剖结构,发现其具有显著的旱生结构,但未对不同品种的抗旱生理指标做系统研究。植物在干旱胁迫下,各项生理指标发生变化,以抵御或减轻胁迫对自身的伤害,这些生理指标的变化大小在一定程度上反映了植物的抗旱能力,这在杨树[4-7]等植物上已有大量研究报道。
本文以在天山北坡-伊犁河谷经济带种植的优良杂种榛品种为试材,研究干旱胁迫下各品种抗旱生理指标的变化规律,对各品种的抗旱性进行评价,旨在筛选抗旱性强的杂种榛种质资源,为开展杂种榛抗旱性遗传研究、选择适宜栽植区域、选育抗旱品种及建立有效的抗旱评价体系提供理论依据。
1 材料与方法
供试材料采自新疆林业科学院安宁渠试验基地,以新疆良种审定的4 个平欧杂种榛品种:新榛1号(84-254)、新榛2 号(82-11)、新榛3 号(84-310)和新榛4 号(82-15)的1年生盆栽苗为材料,4种供试材料的田间管理基本一致。试验采用盆栽法,花盆规格30 cm×40 cm,土壤为混合土壤(V(腐殖土)∶V(河沙)=3 ∶1)。
处理与采样:干旱胁迫自2013年7月22日开始进行,每个品种取10 盆(每盆1 株)长势一致的的1年生幼苗,采用控水法自然干旱,分成2 组,胁迫组停止浇水,对照组(CK)正常浇水。每5 d 采集植株中上部生长均匀的完整叶片(带叶柄)6~8 片,测定相关指标,各指标测定重复3 次,持续时间为1个月。
抗旱指标的测定:相对含水量测定[8]取叶片组织,称出鲜质量Wf;再在蒸馏水中浸泡24 h 后称其饱和鲜质量Wt;放入烘箱内105 ℃杀死30 min,然后于80 ℃下烘至恒质量,称出干质量Wd。根据下列公式计算相对含水量(RWC):RWC=[(Wf-Wd)/(Wt-Wd)]×100%。
质膜透性测定[9]:取鲜叶0.2 g,放入100 mL 三角瓶中,标记后加入20 mL 去离子水,静止3 h,间隔0.5 h 摇匀一次,用DDS-307 型电导率仪测定浸提液的初电导率(C1);然后将三角瓶置于电热板上煮沸,溶液沸腾后再煮7 min,对浸提液定容至20 mL,待浸提液温度冷却至室温时,摇匀,测定终电导率(C2),相对电导率=(C1/C2)×100%。
游离脯氨酸质量分数测定—采用茚三酮显色法[8];丙二醛(MDA)质量摩尔浓度测定—采用硫代巴比妥酸法[10];超氧化物歧化酶(SOD)活性测定—采用氮蓝四唑(NBT)法[10]。
数据处理:用SPSS19.0 软件进行方差分析及Duncan 新复极差法多重比较,抗旱性评价应用模糊数学中的隶属函数值法[11],以相对含水量、相对电导率、游离脯氨酸质量分数、丙二醛质量摩尔浓度和超氧化物歧化酶活性等指标进行综合评价。
隶属函数值计算公式:R(Xi)=(Xi-Xmin)/(Xmax-Xmin)。如果负相关,则用反隶属函数值计算公式:R(Xi)=1-(Xi-Xmin)/(Xmax-Xmin)。式中,Xi为指标测定值,Xmin、Xmax为所有参试材料某一指标的最小值和最大值。
2 结果与分析
2.1 干旱胁迫对叶片相对含水量的影响
叶片变化是植物对干旱胁迫的综合反应,可作为评价植物抗旱性的直接证据。本试验过程中发现,腔迫1~10 d 各品种叶片差异不是很大;随着胁迫时间的延长,新榛3 号叶片叶缘开始发黄,新榛2号和新榛4 号叶缘稍有发黄,但程度较新榛3 号轻,新榛1 号叶子没有显著变化。由此可知,新榛1 号比其余品种具有更强的干旱适应性。
相对含水量是反映植物水分状况的参数,可作为抗旱性鉴定的指标[12]。由表1可知,对照组(CK)4 个品种间叶片相对含水量,随时间延长变化幅度不大。胁迫组4 个品种的叶片相对含水量均随胁迫时间增加呈降低趋势,新榛1 号的相对含水量在30 d 的干旱胁迫下,始终保持最大;其余3 个品种在胁迫1~15 d,相对含水量较为接近,在89.68%~54%;在胁迫15~30 d,新榛3 号的相对含水量最大,新榛4 号次之,新榛2 号最小。4 个品种在胁迫1~30 d 时的相对含水量的下降幅度也不尽相同,新榛1 号、新榛2 号、新榛3 号和新榛4 号的下降幅度分别为69.21%、80.42%、75.14%和78.07%,说明新榛1 号有较高的含水量且失水速率较慢,新榛2 号的含水量较低且失水速率较快,新榛3 号和新榛4 号的含水量和失水速率居中。
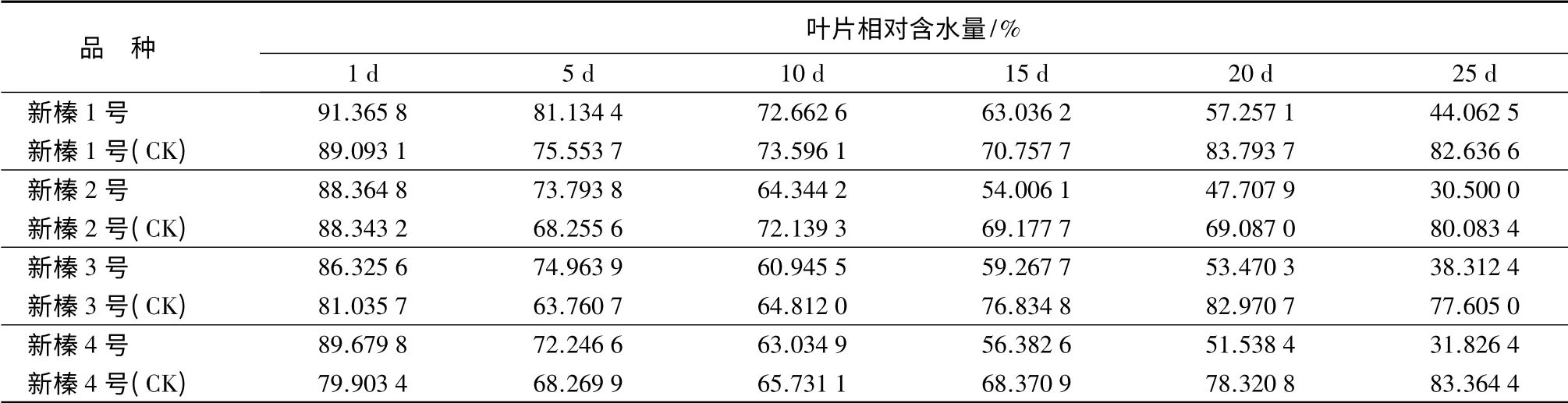
表1 干旱胁迫后不同品种相对含水量的变化
方差分析发现,4 个品种间和胁迫前后的相对含水量变化均达极显著水平(P<0.01),对4 个品种相对含水量进行多重比较(见表2)发现,新榛1 号极显著高于其余3 个品种;新榛3 号显著高于新榛2 号,与新榛4 号差异不显著;新榛2 号和新榛4 号差异不显著。说明抗旱性强的品种相对含水量也较高,流失速度较慢,反之,抗旱性弱的品种,相对含水量较低,流失也较快。
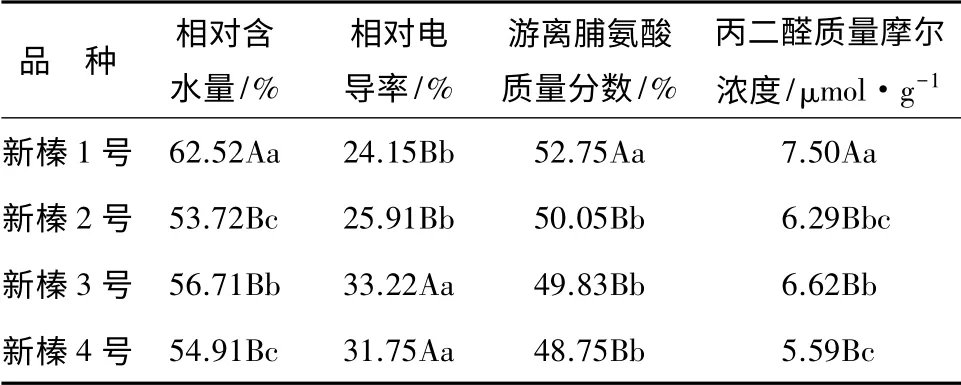
表2 干旱胁迫下杂种榛各生理指标的多重比较
2.2 干旱胁迫对叶片相对电导率的影响
植物在脱水时,常因伤害细胞膜结构而引起细胞膜透性增大,细胞内含物不同程度外渗,使外渗液电导值增大;膜透性变化愈大,电导值愈大,表示受伤越重,抗性越弱。因此,质膜透性常被作为衡量植物受伤害程度的指标之一[13]。从表3可以看出,4个品种的相对电导率(REC)随胁迫时间的延长均呈上升趋势,1~5 d 时,相对电导率缓慢增加;5~25 d 时,相对电导率急速上升,新榛3 号和新榛4 号较大,分别是对照(CK)的2.59 倍和2.28 倍,新榛1 号和新榛2 号分别是对照的2.06 倍和1.89 倍;25~30 d 时,增加相对平缓,趋于稳定,表明细胞组织受到不可逆伤害。随时间的增加相对电导率的变化呈“S”型曲线。在1 至30 d 时,新榛1 号的相对电导率最小,上升了29.03%;新榛3 号和新榛4 号相对电导率相对较大,分别上升了32.88%和40%;新榛2 号相对电导率居中,上升了32.16%。
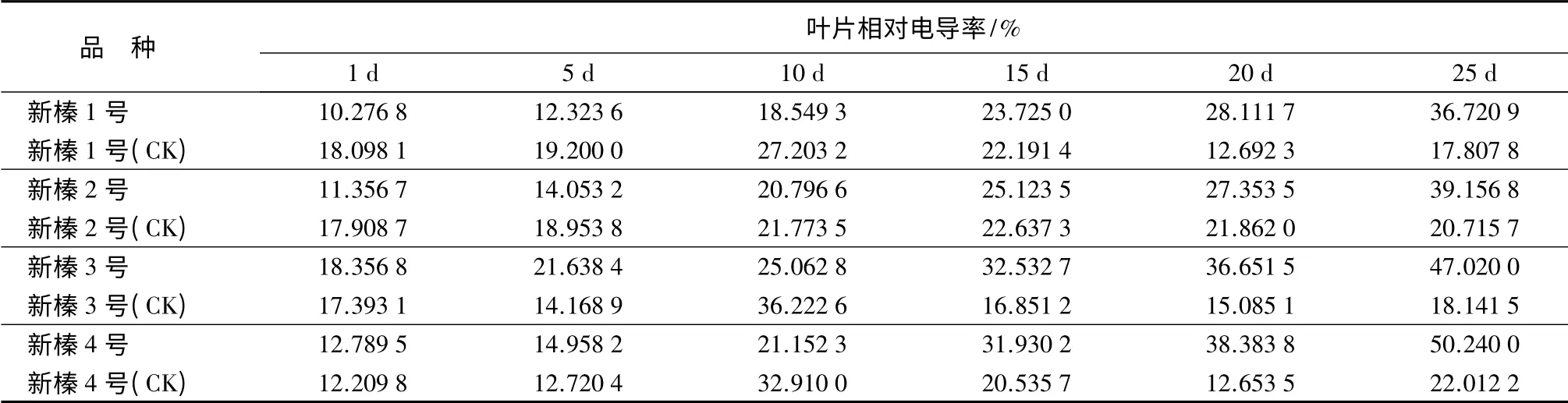
表3 干旱胁迫后不同品种相对电导率的变化
经方差分析可知,4 个品种间和胁迫前后的相对电导率差异性均达极显著水平(P<0.01),多重比较发现(见表2),新榛1 号和新榛2 号差异不显著,但均极显著小于新榛3 号和新榛4 号,且新榛3 号和新榛4 号之间差异不显著。
2.3 干旱胁迫对叶片游离脯氨酸质量分数的影响
游离脯氨酸是最有效的渗透调节物质之一,当植物受到逆境胁迫时,体内脯氨酸开始积累,使植物能通过自身调节逐渐适应干旱环境。脯氨酸作为植物抗旱性鉴定的重要指标,其质量分数与抗旱性呈正相关[14]。由表4可见,4 个品种的游离脯氨酸质量分数随着胁迫时间的增加均呈“先上升后下降”的趋势,在胁迫第1~25 d,游离脯氨酸呈上升趋势,4 个品种的增加幅度不同,新榛1 号、新榛2 号、新榛3 号和新榛4 号的增幅分别为124.82%、157.65%、196.63%和169.69%;在胁迫25 d 后,游离脯氨酸质量分数开始下降,说明植株受到干旱胁迫程度达到饱和,可能是由于植物体内酶受到伤害而失去了活性,阻碍了其合成过程,渗透调节物质不再产生,进而游离脯氨酸逐渐降低。
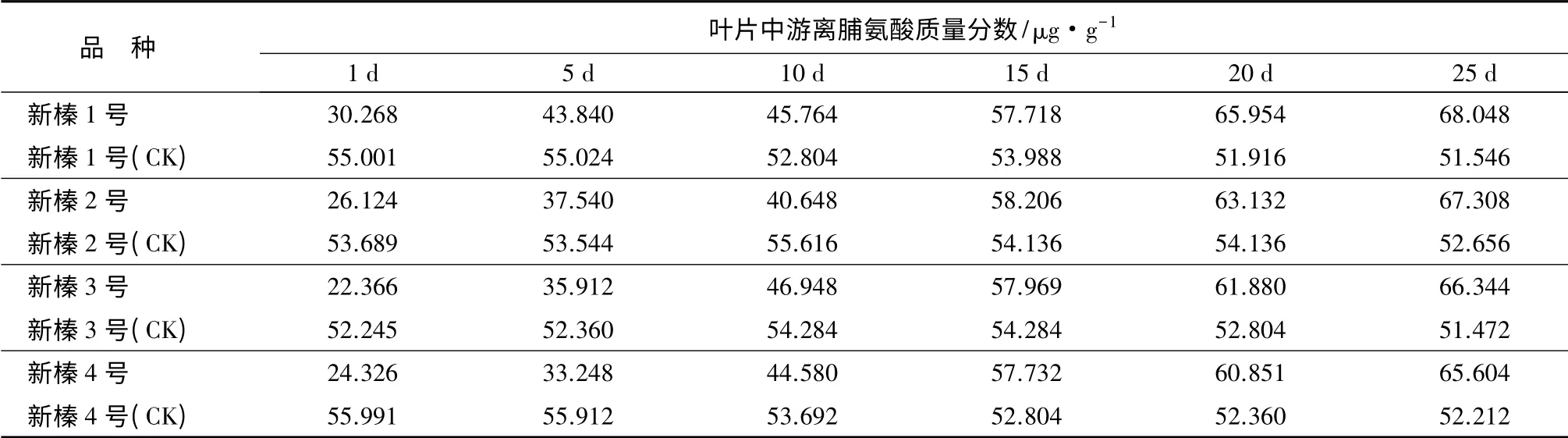
表4 干旱胁迫后不同品种游离脯氨酸质量分数的变化
经方差分析可知,新疆平欧杂种榛各品种间的游离脯氨酸质量分数差异性达显著水平(P<0.05),胁迫前后游离脯氨酸质量分数差异性达极显著水平(P<0.01)。对4 个品种游离脯氨酸质量分数进行多重比较发现(见表2),新榛1 号极显著高于新榛2号、新榛3 号和新榛4 号,其余3 个品种间游离脯氨酸质量分数差异不显著。
2.4 干旱胁迫对叶片丙二醛(MDA)质量摩尔浓度的影响
植物在逆境下发生膜脂过氧化作用,最终产物为丙二醛,其质量摩尔浓度高低与植物受伤害程度呈正相关。丙二醛积累量较小,则植物受伤害程度小[15],抗旱性较强。由图4可知,4 个品种随胁迫时间的延长,丙二醛含量的变化不尽相同,新榛2号、新榛3 号和新榛4 号呈“先升高后降低”的趋势,各自达到峰值时的胁迫时间不同,新榛3 号在胁迫20 d 时丙二醛质量摩尔浓度达到最大值,为9.57 μmol/g;新榛2 号和新榛4 号在胁迫25 d 时丙二醛质量摩尔浓度达到最大值,分别为9.99 和8.4 μmol/g;新榛1 号的丙二醛质量摩尔浓度持续升高,在胁迫30 d 时达到峰值,为9.32 μmol/g。丙二醛质量摩尔浓度较早的达到峰值,说明受害程度较重,膜脂过氧化程度剧烈,组织细胞受害较大,抗逆性能力相对较弱。整体来说,4 个品种丙二醛质量摩尔浓度较胁迫第1 d 时均呈增加趋势,新榛1 号、新榛2 号、新榛3 号和新榛4 号在1~30 d 时的增幅分别为152.52%、242.38%、223.4%和339.79%。
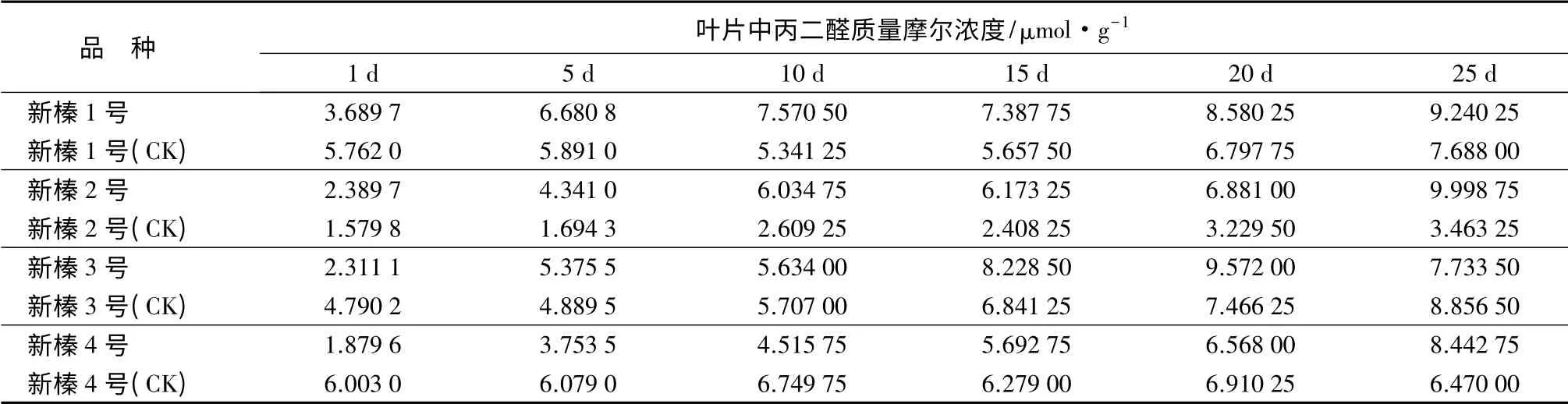
表5 干旱胁迫后不同品种丙二醛质量摩尔浓度的变化
经方差分析可知,新疆杂种榛在品种间和胁迫前后丙二醛质量摩尔浓度的变化均达极显著水平(P<0.01)。多重比较发现(见表2),新榛1 号极显著高于新榛4 号,显著高于新榛2 号,与新榛3 号差异不显著;新榛3 号显著高于新榛4 号。
2.5 干旱胁迫对叶片超氧化物歧化酶活性的影响
自由基引起的膜伤害学说认为,活性氧引起膜脂过氧化,会影响到细胞的正常代谢,而细胞体内的保护性酶会发生变化,维持活性氧的生成与清除之间的动态平衡[16]。超氧化物歧化酶(SOD)的主要功能是清除生物体内超氧离子基团,防御活性氧或其他过氧化物自由基对细胞膜的伤害,因此,SOD活性的变化情况,在一定程度上可反映植物的抗性强弱。由表6可见,干旱胁迫下,植株体内的SOD活性整体呈“先增加后降低”趋势。胁迫初期,4 个品种的SOD 活性均剧烈上升,在10 d 时达到最大值,新榛1 号、新榛2 号、新榛3 号和新榛4 号分别是第1 d 时的2.11 倍、2.76 倍、2.89 倍和2.68 倍。随着干旱胁迫时间延长,SOD 活性下降,4 个品种间下降幅度不尽相同,从胁迫10 d 至30 d 时,新榛1 号、新榛2号、新榛3 号和新榛4 号分别下降了4.28 倍、5.8 倍、57.34 倍和3.79 倍,新榛3 号下降幅度最大。
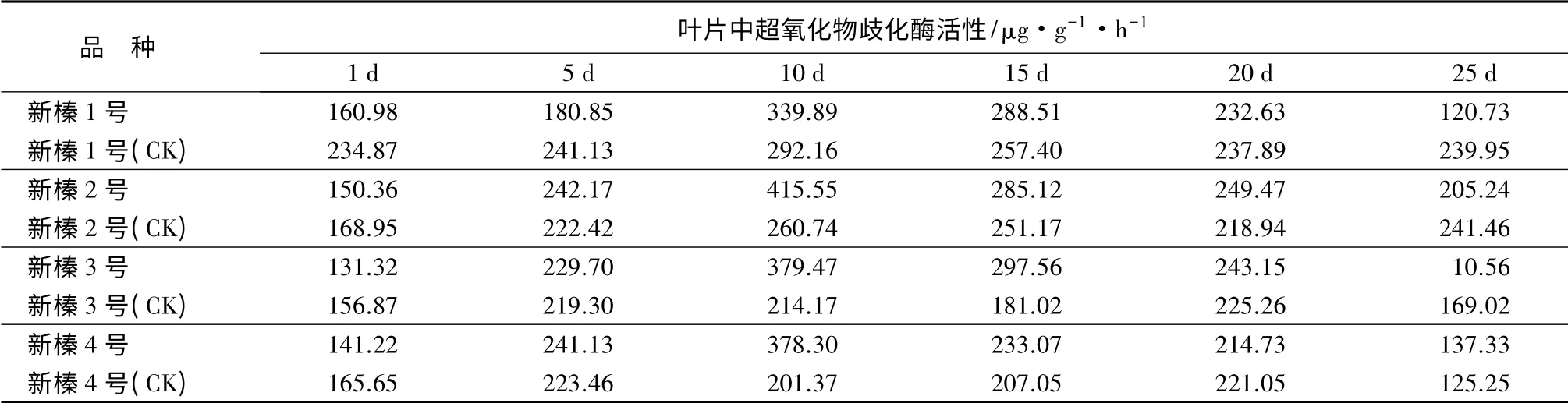
表6 干旱胁迫后不同品种超氧化物歧化酶活性的变化
从4 个品种的SOD 活性变化来看,在干旱胁迫初期,SOD 活性剧烈上升,以抵御或减轻植物所受的伤害;随着胁迫时间延长,水分亏缺加重,SOD 活性下降,只是各品种下降的速度不尽相同。方差分析(表2)可知,在胁迫前后,4 个品种的SOD 活性的变化极显著(P<0.01),品种间差异不显著。
2.6 不同杂种榛品种抗旱性的综合评价
以相对含水量、相对电导率、游离脯氨酸质量分数和丙二醛质量摩尔浓度4 个指标为依据,计算各指标的隶属函数值,并求其平均值进行综合评价(表7),4 个杂种榛品种抗旱性大小排序为:新榛1 号、新榛2 号、新榛4 号、新榛3 号。
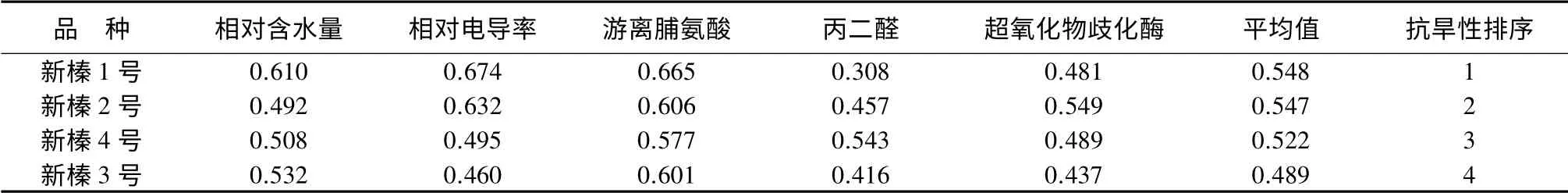
表7 杂种榛抗旱性隶属度的综合评价
3 讨论与结论
植物在生长发育的进程中都会受到温度、盐分、水分等环境因子的胁迫,研究植物对环境胁迫的忍耐和抵抗能力,筛选抗性树种及品种,对林业生产具有重要意义[17]。植物在遭受干旱时,叶片发生萎蔫、失绿等变化,是植物对干旱胁迫的综合响应。本研究发现随着干旱胁迫时间的延长,新榛3 号、新榛2 号和新榛4 号叶缘均有不同程度的发黄现象,新榛1 号叶片没有显著变化,说明新榛1 号具有较强的抗旱性。
叶片组织的相对含水量可以明确显示其水分状况,相对电导率可准确反映其质膜受伤害的程度[12-13],本研究也表明,相对含水量随干旱胁迫时间的延长而降低,4 个品种间的含水量存在差异性,在1~30 d 时,新榛1 号相对含水量的降幅最小,且相对含水量极显著高于其余3 个品种,说明新榛1号的保水能力相对较强,可以较好维持植株正常的生理活动。相对电导率随干旱胁迫时间的延长而增加,新榛1 号的相对电导率极显著低于新榛3 号和新榛4 号,与新榛2 号差异不显著,且新榛1 号和新榛2 号的值较为接近,说明新榛1 号和新榛2 号在干旱胁迫下受损伤较小,抗逆境能力相对较强。
在逆境下,游离脯氨酸、丙二醛(MDA)和超氧化物歧化酶(SOD)的变化,可用作反映植物抗逆性的参考性生理指标。脯氨酸是一种细胞亲和溶质,其水溶性很大,在干旱时具有保水的作用。这种物质有强的亲水性,能稳定胶质体组织内的代谢过程,同时它又可以作为氧化还原过程的活化剂,能消除植物体内氨积累所造成的毒害[18]。杏、桃、梅[19]、苹果[20]等经济树种在水分胁迫时体内都积累大量脯氨酸,而且抗旱力强的树种(品种)比抗旱性弱的增加幅度大。本研究中,4 个品种的游离脯氨酸质量分数随干旱胁迫时间的延长均呈“先升高后下降”的趋势,但各品种的游离脯氨酸质量分数不尽相同,且增幅不同,游离脯氨酸质量分数越大,说明在逆境下产生的渗透调节物质较多,植物耐旱能力较强,这与在杨树[7]上的研究结果较一致。在干旱胁迫1~30 d 时,新榛1 号的游离脯氨酸质量分数最大,且极显著高于其余3 个品种,表明其适应干旱逆境能力较强。
MDA 是膜脂过氧化的最终产物,毒害组织细胞,使植物的抗逆能力下降,MDA 质量摩尔浓度与植物抗逆能力呈负相关[15]。本研究中,各品种叶片MDA 质量摩尔浓度随干旱胁迫时间的延长均呈“先升高后下降”的趋势,这与前人在柿[21]、杜仲[22]、李[23]等树木上的研究结果基本一致。在干旱胁迫1~30 d 时,新榛4 号MDA 质量摩尔浓度始终最低,显著高于新榛1 号和新榛3 号,与新榛2 号差异不显著,说明新榛4 号抵御逆境能力较强。
SOD 的主要功能是清除生物体内超氧离子基团,防御活性氧或其他过氧化物自由基对细胞膜的伤害,SOD 活性越强,抗逆性能力越强;反之,则越弱[5]。在干旱胁迫初始阶段,SOD 活性升高,随着长时间干旱胁迫,SOD 活性降低,表明SOD 对平欧杂交榛抗旱性有一定的贡献,这与银中杨[24]的研究结果一致。4 个品种的SOD 活性在干旱胁迫10 d时达到峰值,随之下降,但各品种的降幅不同,新榛3 号在胁迫30 d 时,下降了57.34 倍,表明干旱胁迫时间越长,其清除自由基的能力越弱,植物受损程度相对较高,抗旱能力低于其余3 个品种。
综上所述,4 个品种对某一具体指标的抗旱性反应不尽相同,由此可知,抗旱性是一种受多种因素影响的复杂的数量遗传性状,用单一指标难以全面准确地反映植物抗旱性的强弱,而隶属函数法提供了一条在多指标测定基础上对杂种榛抗旱性进行综合评价的途径,避免了单一指标的片面性。本研究以相对含水量、相对电导率、游离脯氨酸质量分数、MDA 质量摩尔浓度和SOD 活性5 个指标为依据,计算其隶属函数值,综合评价表明4 个平欧杂种榛品种的抗旱性由强到弱依次为:新榛1 号、新榛2号、新榛4 号、新榛3 号。
[1] 宋锋惠,崔培毅,史彦江.伊犁河谷杂交榛引种栽培及发展前景[J].新疆农业科学,2008,45(S3):69-71.
[2] 宋锋惠,史彦江,卡得尔.大果杂交榛子引种及优良品种的选育[J].东北林业大学学报,2007,35(5):87-89.
[3] 寇云玲,罗青红,宋锋惠,等.新疆杂交榛叶片解剖结构研究[J].果树学报,2012,29(6):1063-1068.
[4] 谭雪红.5 种灌木的生理特性及抗旱性的综合评价[J].东北林业大学学报,2013,41(2):29-34.
[5] 姜慧芳,任小平.干旱胁迫对花生叶片SOD 活性和蛋白质的影响[J].作物学报,2004,30(2):169-174.
[6] 聂华堂,陈竹生,计玉.水分胁迫下柑桔的生理变化与抗旱性的关系[J].中国农业科学,1991,24(4):14-18.
[7] 高建社,王军,周永学,等.5 个杨树无性系抗旱性研究[J].西北农林科技大学学报:自然科学版,2005,33(2):112-116.
[8] 邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000.
[9] 王飞,李嘉瑞.用电导法配合Logistic 方程确定杏花期的抗寒性[J].西北农业大学学报,1997,25(5):59-63.
[10] 赵世杰,史国安,董新纯.植物生理学实验指南[M].北京:中国农业科学技术出版社,2002.
[11] 陶向新.模糊数学在农业科学中的初步应用[J].沈阳农业大学学报,1982(2):96-107.
[12] Levitt A D.Responses of plant to environmental stresses[M].New York:Academic Press,1990.
[13] 赵昕,李玉霖.高温胁迫下冷地型草坪草几项生理指标的变化特征[J].草业学报,2001,10(4):86-88.
[14] Blum A,Ebercon A.Genotypic responses in sorghum to drought stress Ⅲ.Free proline accumulation and drought resistance[J].Crop Science,1976,16(3):428-431.
[15] 白志英,李存东,吴同燕,等.干旱胁迫条件下小麦旗叶酶活性和丙二醛含量的染色体定位[J].植物遗传资源学报,2009,10(2):255-261.
[16] 许凯扬,叶万辉,段学武,等.PEG 诱导水分胁迫下喜旱莲子草的生理适应性[J].浙江大学学报:农业与生命科学版,2004,30(3):271-277.
[17] 徐秀梅,张新华,王汉杰.四翅滨藜抗旱生理特性研究[J].南京林业大学学报:自然科学版,2004,28(5):54-58.
[18] 胡学华,肖千文,蒲光兰,等.经济林抗旱研究进展[J].经济林研究,2004,22(4):82-86.
[19] 陆受华,褚孟源.水分胁迫后梅杏桃脯氨酸脱落的积累及其与抗旱性的关系[J].南京农业大学学报,1989,12(3):29-32.
[20] 杨洪强,黄天栋.水分胁迫对苹果新根多胺和脯氨酸含量的影响[J].园艺学报,1994,21(3):295-296.
[21] 姚允聪,曲泽州,李树仁.土壤干旱与柿树叶片膜脂及膜脂过氧化的关系[J].林业科学,1993,29(6):485-491.
[22] 文建雷,张檀,胡景江.三种杜仲无性系抗旱性比较[J].西北林学院学报,2000,15(3):12-15.
[23] 王有年,张海英,卜庆雁,等.水分胁迫对李叶片抗氧化代谢的影响[J].北京农学院学报,2003,18(2):97-100.
[24] 王晶英,赵雨森,王臻,等.干旱胁迫对银中杨生理生化特性的影响[J].水土保持学报,2006,20(1):197-200.

