镉胁迫下锌对水稻植物螯合肽合成的影响
于莎莎,卞英芳,杨 欢,孙伟华,曹赵云
(中国水稻研究所,农业部稻米及制品质量监督检验测试中心,浙江杭州 311400)
镉胁迫下锌对水稻植物螯合肽合成的影响
于莎莎,卞英芳,杨 欢,孙伟华,曹赵云
(中国水稻研究所,农业部稻米及制品质量监督检验测试中心,浙江杭州 311400)
以水稻品种9311为试验材料,采用水培试验研究了镉(Cd)离子胁迫下水稻幼苗根部和地上部生物量、重金属含量、植物螯合肽(PCs)及谷胱甘肽(GSH)含量的变化,及添加锌(Zn)离子对Cd胁迫作用的调节。结果显示,Cd胁迫降低了水稻生物量,下降幅度达27.6%~37.0%;随Cd处理浓度的增加,水稻根部和地上部PCs含量分别增加了93.7%和84.7%;Zn可以降低Cd胁迫水稻根部PCs和GSH的合成水平以及Cd的含量。一定浓度范围内,Cd⁃Zn高量表达PCs,PCs与重金属Cd结合,缓解了重金属Cd的毒害。
镉;锌;水稻;植物螯合肽;谷胱甘肽
随着工矿业的发展、农业污水灌溉、农药以及化肥的施用,农田土壤镉(Cd)污染日趋严重[1]。水稻是我国主要的粮食作物,也是一种极容易积累镉的作物,受Cd污染严重[2]。
Cd对水稻的毒害是多方面的,相应地,水稻会采取多方面的策略来抵抗或减弱Cd胁迫的程度,如固定化、区域化及合成植物螯合肽、金属硫蛋白等[3]。络合是植物细胞解除Cd毒害的主要方式,它主要通过生物体内有生物活性的配位体与金属离子发生专性较强的生物化学反应,形成螯合物从而缓解重金属的毒害。植物螯合肽(PCs)是在外界重金属诱导胁迫下,细胞质中合成的一类低分子量、富含半胱氨酸的巯基多肽化合物,以GSH为合成前体[4],基本的结构式为(γ⁃Glu⁃Cys)n⁃Gl y,(n=2~11,植物中常为2~4),对重金属离子的螯合能力强,在重金属的累积和解毒过程中发挥重要作用。研究表明,植物螯合肽的生物合成及解毒机制在重金属环境治理污染中具有良好的应用前景[5-6]。
植物在天然环境中具有合成PCs的潜能,但在修复重金属污染过程中需要通过修饰或高量表达植物螯合肽合成酶获得高产PCs,或者借助重金属的激活作用促使植物螯合肽合成酶催化合成PCs[7]。研究表明,Cd是激活植物螯合肽合成酶最有效的金属[8],为了缓解有毒重金属的毒害作用,最有效的方式是通过Cd的激活诱导合成足量的PCs,但Cd通常是有毒的,如何解决上述矛盾已引起广泛的关注。锌(Zn)与Cd具有相同的核外电子构型,化学性质相似,但Zn是植物生长必需的微量元素之一,在体内发挥重要的生理作用,被称为人体的智慧元素[9]。虽然它们对植物的作用相反,但二者之间存在复杂的交互影响关系。目前Cd⁃Zn之间相互作用主要有协同作用、拮抗作用两种观点。He等[10]的田间试验表明施Zn使莴苣中Cd含量显著升高,二者之间为协同作用。Bunluesin等[11]曾经报导了高Zn/Cd比例有助于降低Cd的积累,同样Cd的存在也导致Zn含量的降低。Hart等[12]认为Zn的施用抑制了小麦对Cd的吸收,从而减少了植株各部位Cd的浓度,可能是Zn能诱导PCs的产生,PCs降低了Cd的有效性,从而降低了Cd的毒害。Cd,Zn交互作用对植物的影响是复杂的,能否通过二者的交互作用高量表达PCs从而缓解Cd的毒害尚未有定论。
目前,大田水稻受Cd污染后的评价研究较多,通常以籽粒中的含Cd量作为主要的指标[13],但是对水稻苗期受Cd污染的评价研究较少。本研究采用水培试验,探讨Zn/Cd比例对水稻幼苗的生物量、重金属含量、PCs及GSH含量的影响,为水稻Cd,Zn竞争吸收机理提供理论依据,也为利用Zn缓解Cd污染提供理论指导。
1 材料与方法
1.1 材料与试剂
供试水稻品种为9311。
乙腈、甲醇(色谱纯,德国Merck公司)、甲酸(色谱纯)、GSH(≥97%)、DTT(≥99%)均购自美国Sigma⁃Aldrich公司;PC2,PC3和PC4均购自美国AnaSpec Inc.公司,纯度均≥95%;Bond Elut Plexa PAX(60 mg×3 mL)购自Agilent Technologies公司;试验用水为Milli⁃Q超纯水。
1.2 仪器与设备
Survryor系列液相色谱仪,TSQ Quantum Access Max三重四极杆质谱仪,X⁃series 2电感耦合等离子体质谱仪(ICP⁃MS,美国ThermoFisher公司),MS3 basic漩涡振荡仪(德国IKA公司),KQ⁃800TED型超声波清洗器和台式冷冻离心机Biofuge Primo R(美国Thermo Fisher公司)。
1.3 处理设计
水稻种子于35℃黑暗条件下催芽,露白后播种于沙床,于光照培养箱(白天35℃,夜晚25℃,相对湿度80%)中培养。待水稻长至3叶1心期,选取健壮、长势一致的水稻幼苗转移至容积为6 L、内装有5 L培养液的塑料黑桶中,每桶5穴,每穴3株,以树脂塑料板分隔各穴,海绵固定幼苗。营养液每3 d换1次,调节pH值为5.0~5.3。水培1周后进行单金属以及复合金属处理。各处理编号依次为CK,A,B,C,D,E,F,G,H,I,其中Cd添加浓度依次为0,1,10,50,1,1,1,50,50,50μmol·L-1,Zn添加浓度依次为0,0,0,0,1,10,50,1,10,50μmol·L-1。
1.4 测定指标
1.4.1 生物量的测定
处理10 d后收获水稻幼苗,先用自来水冲洗根表面吸附的杂质,再用去离子水冲洗2遍,用吸水纸将其表面的水分吸干,分为地上部和根部,置于恒温干燥箱中,105℃杀青0.5 h,85℃烘干至恒重,称地上部和根部干物质的质量。
1.4.2 重金属含量的测定
参照许萍等[14]的方法,分别称取地上部和根部0.25 g试样(精确至0.001 g),置于50mL聚丙烯消解管,加入8mL硝酸,于石墨消解炉中65℃缓慢加热使样品与酸完全混合,加热30 min后,将消解仪温度调至120℃,继续消解至消化液约1 mL,取出消解管,加入3 mL双氧水,继续消解至消化液1 mL,取出消解管,冷却后,用高纯水定容至50.0 mL,混匀。用ICP⁃MS分析Cd和Zn的含量。
1.4.3 PCs等巯基化合物的提取和测定
参照Cao等[15]的方法,取水稻鲜样放入研钵中,加入液氮研磨至粉末状,称取0.2 g(精确至0.001 g)于15 m l塑料离心管中,加入2 mL 4℃预冷的水(含100 mmol·L-1 dithiothreitol),涡旋振荡1 min,超声波破碎5 min,4℃8 000 r· min-1离心10 min,收集上清液,过0.22μm滤膜后,采用液质联用仪进行分析测定。
1.5 数据统计
试验数据用Excel进行统计,采用SPSS统计分析软件进行方差分析(P<0.05)。
2 结果与分析
2.1 Cd胁迫对水稻生长的影响
由图1可知,根部和地上部的生物量随着Cd处理水平的提高而减少,在50μmol·L-1 Cd胁迫下,水稻幼苗根系和地上部生长明显受到抑制,干质量明显偏低,分别为对照(CK)的64.5%和61.7%。在低Cd处理下,随着Zn添加浓度的增加,水稻根部和地上部的生物量均表现出先升高后下降的趋势,其中尤其以添加10μmol·L-1 Zn效果最好,根部和地上部干质量明显高于单独Cd处理,分别为单独Cd处理的1.07和1.12倍。在高Cd处理下,添加1μmol·L-1Zn可促进水稻根部和地上部生物量的增加,分别比单独Cd处理增加了13%和15%;与单独Cd处理相比,添加10和50μmol·L-1 Zn,根部和地上部生物量显著下降。表明Cd处理对水稻幼苗产生了一定的生理毒害,Zn在一定程度上能够缓解Cd的毒害,但缓解作用有限。
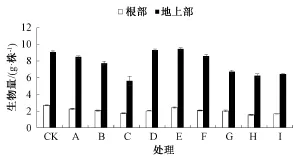
图1 不同Cd离子浓度及Zn/Cd比例对水稻幼苗生物量的影响
2.2 水稻体内Cd和Zn的含量
由表1可知,在重金属Cd胁迫下,水稻根部和地上部Cd的积累随着Cd处理浓度的增加而增大,即Cd处理浓度为1,10和50μmol·L-1时,根系Cd含量分别为对照的236.7,511.6和679.8倍,地上部Cd含量分别是对照的36.9,68.3和122.4倍。低浓度Cd处理下,Zn的添加显著地降低了水稻根部和地上部Cd的含量,且随Zn添加浓度的增加,Cd含量在水稻根部和地上部的水平显著降低,当Zn浓度为50μmol·L-1时,根部Cd含量为22.97mg·kg-1,与未添加Zn相比,Cd含量降低了35.3%,同时地上部分Cd含量降低了14.2%。在高浓度Cd处理下,Zn浓度的增加导致水稻根部和地上部Cd含量的协同增大,根部Cd含量由108.55 mg·kg-1增加到113.71 mg·kg-1,地上部Cd含量由15.67 mg·kg-1增加到23.79 mg·kg-1。不同浓度的Cd也会影响水稻根部和地上部中Zn的积累。结果表明,低浓度的Cd处理有利于Zn的吸收;高浓度Cd处理则抑制Zn的积累。当Zn添加浓度为50μmol·L-1时,1μmol·L-1 Cd胁迫处理的水稻根部中Zn含量为69.04 mg·kg-1,地上部分为36.77 mg·kg-1;当Zn添加浓度为50μmol·L-1,Cd处理浓度为50μmol·L-1时,根部和地上部分的Zn含量分别为46.22和18.11 mg·kg-1。表明一定范围内二者在重金属吸收水平上表现出一定的互作效应,在低Cd胁迫处理时,Zn对Cd的吸收表现出拮抗效应,高Cd胁迫处理时表现出协同效应;而Cd对Zn的吸收表现出协同效应;超过一定范围结果相反。
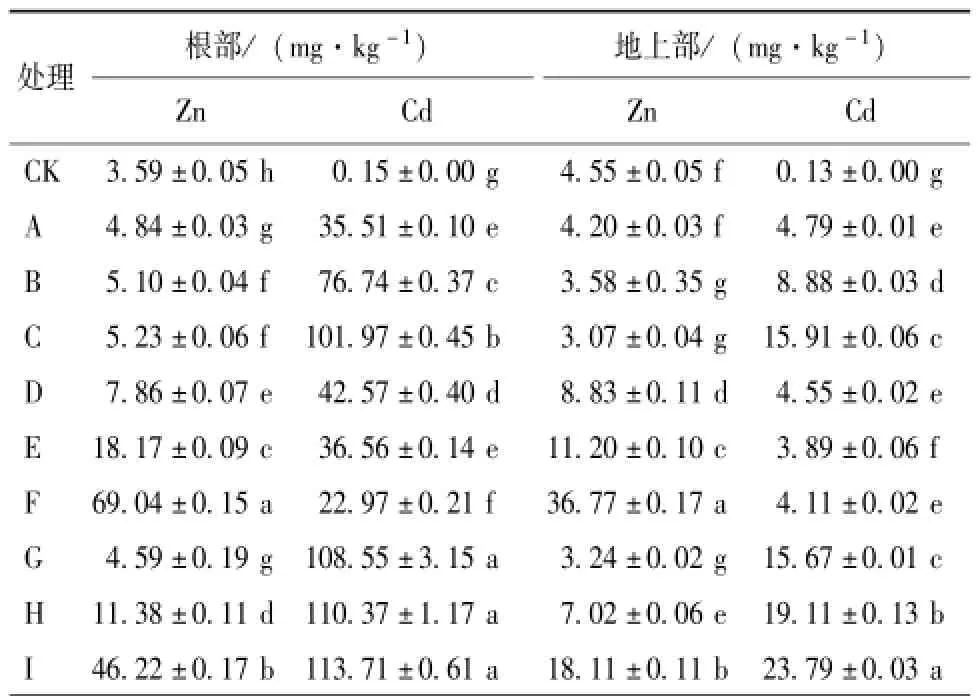
表1 不同浓度的Cd及Cd+Zn处理下水稻根部和地上部重金属的含量
2.3 水稻幼苗植物螯合肽和GSH的含量
2.3.1 Cd胁迫下Zn对水稻幼苗中PCs含量的影响
由图2中A可以看出,随着Cd处理水平的提高,水稻根部PCs总量逐渐增大,由94.33 mg· kg-1增大到256.96 mg·kg-1,其中PC2与PC3增加的尤为显著,分别比对照增加了15.3,15.9倍。与单独Cd处理相比,Zn的添加降低了水稻根部PCs含量,并随Zn添加浓度的增加降低作用更显著,其中,低浓度Cd处理中随Zn添加浓度的增加,水稻根部PCs含量从115.82 mg·kg-1降低到58.26 mg·kg-1;高浓度Cd处理中随Zn添加浓度的增加,水稻根部PCs含量从323.43 mg·kg-1降低到226.15 mg·kg-1。低Cd处理时,随Zn添加浓度的增大,PC3和PC4含量显著降低,分别降低了58.28%和80.21%。高Cd处理时,随Zn添加浓度的增大,PC2和PC3含量显著降低,分别降低了13.95%和33.43%。
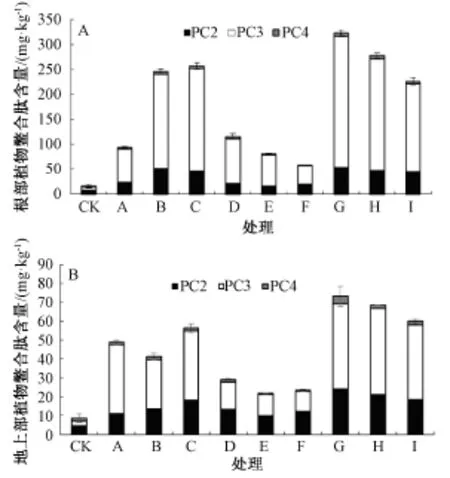
图2 不同Cd离子浓度及Zn/Cd比例对水稻根部和地上部植物螯合肽含量的影响
由图2中B可知,随着Cd处理水平的提高,水稻地上部PCs总量呈先降低后升高的趋势,当Cd处理浓度为10μmol·L-1时,降低尤为明显。低浓度Cd处理中Zn的添加使水稻地上部PCs含量与单独Cd处理相比降低了40.3%~55.6%;高浓度Cd处理中Zn的添加降低了水稻地上部PCs含量,由73.05 mg·kg-1降低到59.88 mg·kg-1,但与单独Cd处理相比,增加了3.52 mg·kg-1。低Cd处理时,随Zn添加浓度的增大,PC3和PC4含量显著降低,分别降低了25.58%和71.94%。高Cd处理时,随Zn添加浓度的增大,PC2,PC3和PC4含量显著降低,分别降低了23.16%,12.14%和54.81%。
由图2可以看出,在Cd胁迫下,地上部PCs的含量低于根部;在Cd胁迫下地上部和根部PC3含量高于其他巯基多肽的含量。以上结果表明,Zn的添加使得Cd与Zn在吸收上出现竞争效应,Zn降低了Cd的吸收,使得水稻根部和地上部PCs的含量降低,表现出抑制效应。
2.3.2 Cd胁迫下Zn对水稻幼苗谷胱甘肽含量的影响
GSH与PCs具有相似的结构,是PCs合成的前体[4],具有很强的氧化还原特性,可有效地清除活性氧及自由基,在植物抗逆境胁迫中起重要作用。由图3可知,在Cd胁迫下,水稻幼苗地上部GSH含量显著高于根部,当Cd胁迫浓度为50μmol· L-1时,地上部GSH含量是根部的5倍;在对照中,水稻幼苗根部和地上部中的GSH含量较高,分别为121.52和202.63 mg·kg-1;水稻幼苗根系在单独Cd胁迫下GSH含量一直低于对照值,最低下降了84.5%,差异显著;在低浓度Cd处理下,添加Zn可促进GSH的合成,且随着Zn浓度的增大GSH的合成呈上升趋势;高浓度Cd处理下,GSH含量随Zn浓度的增大呈先上升后下降的趋势,当Zn浓度为10μmol·L-1时,GSH含量达到最大值。表明Zn可显著增强水稻抗逆境胁迫的能力,一方面水稻幼苗内产生大量的GSH,有效地清除活性氧和自由基,另一方面合成PCs,螯合重金属缓解重金属的毒害。
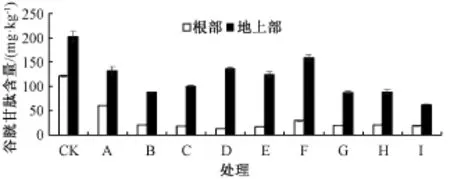
图3 Cd胁迫下各处理对水稻幼苗谷胱甘肽含量的影响
3 小结与讨论
Cd胁迫影响水稻幼苗的正常生长,引起水稻幼苗生物量的下降。随着Cd处理浓度的增加,毒害作用基本呈增强的趋势;Zn对低浓度Cd胁迫的水稻幼苗有缓解效应,这种效应随着Zn浓度的升高呈先升高后下降的趋势,当Zn浓度为10μmol· L-1时,能够极大地减轻Cd胁迫对水稻幼苗生物量的影响,效应最为明显。Zn缓解Cd毒害的效应受Cd浓度的制约,当Cd浓度过高(50μmol· L-1)时,Zn不仅没有缓解Cd对水稻幼苗的毒害效应,还产生协同毒害效应。原海燕等[16]研究也发现单独施加Cd处理导致马蔺生物量降低,Zn的施加一定程度上缓解了Cd的毒害作用。
对于大多数作物而言,根系是重金属积累的主要部位[17]。本研究表明,重金属胁迫下,水稻根部重金属含量明显高于地上部,这与Wang等[18]研究认为的重金属胁迫下PCs以及重金属在根部大量积累相一致。可能是水稻根系直接吸收营养物质,在吸收营养物质的同时也吸收大量的重金属元素,且这些重金属容易在根中积累,导致根中重金属含量高。这对于水稻忍耐Cd的伤害是有利的,可以减少重金属向地上部乃至籽粒的运输,减少其通过食物链危害人类健康的可能性。
谷胱甘肽具有很强的氧化还原特性,在防卫植物细胞免受活性氧攻击方面起着重要作用[19];植物螯合肽是重金属诱导产生的一类多肽,能与重金属结合并在细胞的液泡内形成区室化以减少重金属对细胞的损害[20-22],二者在高等植物耐受重金属胁迫机制中具有重要作用[8]。本试验表明,水稻根部和地上部PCs和GSH对Cd胁迫响应敏感;随胁迫浓度的增大,GSH水平相应下降,PCs诱导量相应增加,此现象说明在根部已受氧化胁迫的情况下,水稻幼苗启动了合成PCs的机制,使Cd在根部细胞内形成区室化阻止对根部的损伤,且GSH和PCs二者表现出相互消长的关系,表明GSH是PCs合成的前体。Cd胁迫对水稻产生了一定的毒害,Zn的添加一定程度上缓解了Cd的毒性并伴随着水稻根内PCs诱导量的降低,Cd含量降低,可能是Cd,Zn在吸收上出现竞争效应,Zn显著降低了Cd的吸收,因Cd对PCs的诱导效果远大于Zn,所以PCs的合成相应地降低。植物体内植物螯合肽的产生与重金属的浓度有关,其合成水平的高低与细胞内胁迫金属的数量存在显著相关关系[23-24],细胞内PCs的诱导量可反映金属的实际毒性,因此PCs和GSH可作为生物标记物用于Cd污染的早期预警和生态风险评价。
综上所述,Zn能够缓解Cd胁迫对水稻的毒害,但这种作用有一定的局限性,当超过一定浓度时,将与重金属Cd一起协同破坏水稻的生长发育,加重对水稻的毒害。只有在掌握Zn浓度的前提下,才能有效发挥Zn元素对有害离子的缓解毒害效应,促进水稻的生长发育。
[1] 黄秋婵,黎晓峰,沈方科,等.硅对水稻幼苗镉的解毒作用及其机制研究[J].农业环境科学学报,2007,26(4):91-94.
[2] Yao W,Sun L,Zhou H,et al.Additive,dominant parental effects control the inheritance of grain cadmium accumulation in hybrid rice[J].Molecular Breeding,2015,35(1):1-10.
[3] 康浩,石贵玉,潘文平,等.镉对植物毒害的研究进展[J].安徽农业科学,2008,36:11200-11201.
[4] Yadav SK.Heavymetals toxicity in plants:an overview on the role of glutathione and phytochelatins in heavy metal stress tolerance of plants[J].South African Journalof Botany,2010,76(2):167-179.
[5] Bhargava P,Srivastava A K,Urmil S,et al.Phytochelatin plays a role in UV⁃B tolerance in N2-fixing cyanobacterium Anabaena doliolum[J].Journal of Plant Physiology,2005,162(11):1220-1225.
[6] Petra J,Gudrun K,Sieglinde M,et al.Cadmium induces a novelmetallothionein and phytochelatin 2 in an aquatic fungus[J].Biochemical and Biophysical Research Communications,2005,333(1):150-155.
[7] 胡朝华,张蕾,朱端卫.植物螯合肽的生物合成与解毒机制及在重金属修复中的应用前景[J].华中农业大学学报:自然科学版,2006,25(5):575-580.
[8] Grill E,Loffler S,Winnacker E L,et al.Phytochelatins,the heavy⁃metal⁃binding peptides of plants,are synthesized from glutathione by a specificγ⁃glutamylcysteine dipeptidyl transpeptidase(phytochelatin synthase)[J].Proceedings of the National Academy of Sciences,1989,86(18):6838-6842.
[9] Dhankhar R,Sainger PA,Sainger M.Phytoextraction of Zinc:physiological and molecularmechanism[J].Soil and Sediment Contamination,2012,21(1):115-133.
[10] He P P,Lv X Z,Wang G Y.Effects of Se and Zn supplementation on the antagonism against Pb and Cd in vegetables[J].Environment International,2004,30(2):167-172.
[11] Bunluesin S,Pokethitiyook P,Lanza G R,et al.Influences of Cadmium and Zinc interaction and humic acid on metal accumulation in Ceratophyllum demersum[J].Water Air and Soil Pollution,2007,180(1/4):225-235.
[12] Hart J J,Welch R M,Norvell W A,et al.Zinc effects on cadmium accumulation and partitioning in near⁃isogenic lines of durum wheat that differ in grain cadmium concentration[J]. New Phytologist,2005,167(2):391-401.
[13] 罗琼,王昆,许靖波,等.我国稻田镉污染现状·危害·来源及其生产措施[J].安徽农业科学,2014(30):10540-10542.
[14] 许萍,陈铭学,牟仁祥,等.ICP⁃MS混合模式测定植物性农产品中的9种痕量元素[J].分析测试学报,2011,30(10):1138-1142.
[15] Cao Z Y,Sun L H,Mou R X,et al.A novelmethod for the simultaneous analysis of seven biothiols in rice(Oryza sativa L.)using hydrophilic interaction chromatography coupled with electrospray tandem mass spectrometry[J].Journal of Chromatography B,2014,976-977:19-26.
[16] 原海燕,黄苏珍,郭智,等.锌对镉胁迫下马蔺生长、镉积累及生理抗性的影响[J].应用生态学报,2007,9(18):2111-2116.
[17] 邵国胜,谢志奎,张国平.杂草稻和栽培稻氮代谢对镉胁迫反应的差异[J].中国水稻科学,2006,20(2):189-193.
[18] Wang H O,Zhong G R,Liu X F,et al.The study on sulfhydryl compound to themechanism of detoxification in wheat under copper and cadmium stress[J].Acta Agriculturae Boreali⁃Sinica,2008,23(3):158-161.
[19] Wójcik M,Tukiendorf A.Phytochelatin synthesisand cadmium localization in wild type of Arabidopsis thaliana[J].Plant Growth Regulation,2004,44(1):71-80.
[20] Ovecˇka M,TakácˇTM.Managing heavymetal toxicity stress in plants:biologicaland biotechnological tools[J].Biotechnology Advances,2014,32(1):73-86.
[21] Luo Z B,Wu C,Zhang C,etal.The role of ectomycorrhizas in heavymetal stress tolerance of host plants[J].Environmental and Experimental Botany,2014,108(12):47-62.
[22] Wood B A,Feldmann J.Quantification of phytochelatins and their metal(loid)complexes:critical assessment of current analytical methodology[J].Analytical and Bioanalytical Chemistry,2012,402(10):3299-3309.
[23] Anjum N A,Ahmad I,Mohmood I,et al.Modulation of glutathione and its related enzymes in plants’responses to toxic metals and metalloids⁃a review[J].Environmental and Experimental Botany,2012,75:307-324.
[24] 丁戈,彭佳师,张国斌,等.植物螯合肽合酶基因AtPCS2的表达调控[J].中国科学:生命科学,2013,43(12):1112-1118.
(责任编辑:侯春晓)
S 511
A
0528⁃9017(2015)11⁃1731⁃05
文献著录格式:于莎莎,卞英芳,杨欢,等.镉胁迫下锌对水稻植物螯合肽合成的影响[J].浙江农业科学,2015,56(11):1731-1735.
DOI 10.16178/j.issn.0528⁃9017.20151111
2015⁃09⁃14
浙江省科技专项重大农业项目(2014C02002⁃1)
于莎莎(1991-),女,山东威海人,在读硕士研究生,研究方向为农产品质量与食物安全。E⁃mail:yushasha91@126.com。

