光化学衍生检测玉米中4种黄曲霉毒素
冯秋月, 刘 滢, 刘媛媛, 杨云霞, 王安如,*
(1.北京大北农科技集团股份有限公司饲用微生物工程国家重点实验室,北京 100192;2.中国农业科学院农业质量标准与检测技术研究所,北京 100081)
光化学衍生检测玉米中4种黄曲霉毒素
冯秋月1, 刘 滢1, 刘媛媛1, 杨云霞2, 王安如1,*
(1.北京大北农科技集团股份有限公司饲用微生物工程国家重点实验室,北京 100192;2.中国农业科学院农业质量标准与检测技术研究所,北京 100081)
建立了HPLC-免疫亲和柱净化,柱后光化学衍生检测玉米中4种黄曲霉毒素B1,B2,G1,G2的分析方法。玉米样品提取、浓缩、过滤后经免疫亲和柱净化,液相色谱分离后采用光化学衍生器对黄曲霉毒素B1,B2,G1,G2进行在线衍生,通过配制荧光检测器的液相色谱同时检测玉米中B1,B2,G1,G2这4种黄曲霉毒素。结果表明,4种黄曲霉毒素B1,B2,G1,G2的色谱分析时间在6~11 min内完成,检测定量限分别为:0.10,0.03,0.10,0.03 μg/kg,完全符合并高于欧盟检测标准定量限,通过光化学衍生器在线衍生将B1、G1的分析定量限提高到2.7倍和3.6倍。玉米基质中B1,B2,G1,G2在添加水平为10,3,10,3 μg/L时其回收率分别为:90.3%,85.6%,93.5%,92.8%。其线性范围分别为0~20 μg/L,0~6 μg/L,0~20 μg/L,0~6 μg/L,RSD分别为2.3%,1.5%,2.7%,3.2%。文章建立了分析玉米中4种黄曲霉毒素B1,B2,G1,G2的分析方法,经验证该方法定性准确,定量灵敏度高,可同时检测出玉米中4种黄曲霉毒素B1,B2,G1,G2含量。
黄曲霉毒素;玉米;高效液相色谱;免疫亲和柱;光化学衍生
黄曲霉毒素(aflatoxins,AFTs)是由曲霉属中的黄曲霉和寄生曲霉所产生的一类含有双呋喃环和一个氧杂萘邻酮结构的理化性质相似的毒性极强的次生代谢产物[1]。目前已经发现黄曲霉毒素B1,B2,G1,G2等20余种,是具有极强致畸、致癌、致突变性的一组化合物。常存在于花生、玉米、牛奶等食物中。玉米不只被人类直接食用,也是主要的饲料原料。玉米在我国作为饲料原料被广泛应用于动物饲养方面。据许力伟等表明饲喂黄曲霉毒素9周的大鼠,在改喂常规饲料两年后即出现肝癌[2-4]。
黄曲霉毒素的检测方法主要有薄层色谱法、酶联免疫吸附法、高效液相色谱法以及质谱检测法等。薄层层析法测定黄曲霉毒素其前处理方法复杂,试剂消耗巨大,极其危害身体健康,且其专一性差,为一种半定量方法。酶联免疫吸附法实验步骤简单,但所需抗体寿命很短并且需要低温保存,检测假阳性率比较高,只适合于大量样品的筛选,并不能精准定量。质谱法虽然灵敏度高,但仪器成本也高,很多实验室不具备[5-8]。
黄曲霉毒素B1,B2,G1,G2在紫外激发下产生荧光,但在水溶液中B1、G1容易发生荧光淬灭,所以需要采用衍生方法增强荧光信号。目前衍生方法主要有三氟乙酸衍生法,碘衍生法等,三氟乙酸衍生法实验步骤复杂,重复性差,且三氟乙酸毒性很强,严重危害身体健康;碘衍生法操作复杂,受衍生剂影响很大,并且其腐蚀性强,容易对仪器造成损耗[9-10]。光化学衍生器内部是一定长度的聚四氟乙烯管固定于254 nm紫外灯照射的不透光的反应池架里,当黄曲霉毒素B1、G1流过时,受到紫外光照射后被衍生成荧光性较强的黄曲霉毒素B2a和G2a,从而提高了检测灵敏度,原理见图1。因此光化学衍生器不需要其他化学试剂,只是连接到色谱柱和检测器之间,其操作简单,重复性好,灵敏度高,所以本研究采用免疫亲和柱对样品进行净化、富集,光化学衍生器在线对黄曲霉毒素B1、G1衍生,液相色谱法荧光检测器检测样品中黄曲霉毒素B1,B2,G1,G2的含量[11-14]。
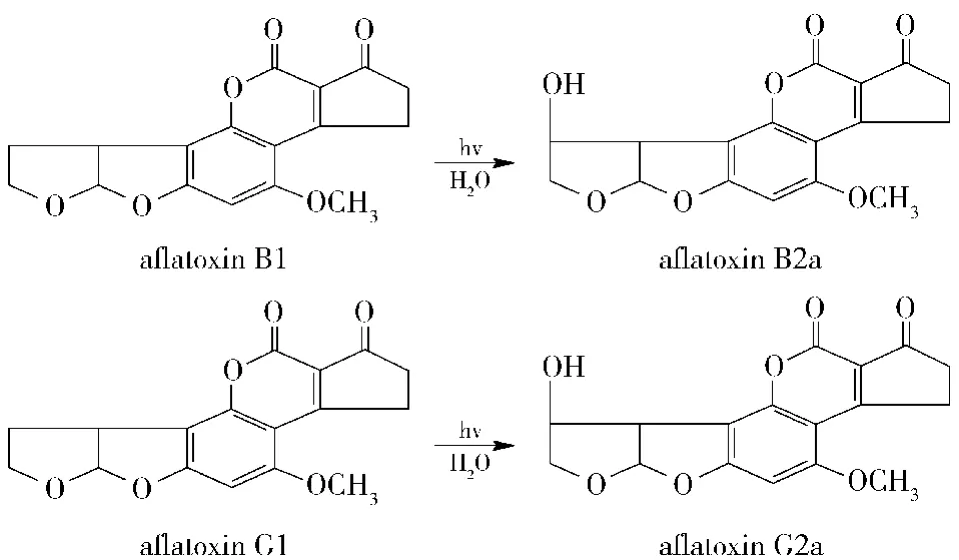
图1 黄曲霉毒素B1及G1紫外光照射原理图Fig.1 UV irradiation schematic of AFT B1 and AFT G1
1 材料与方法
1.1 材料与试剂
Inertsil ODS-3型(4.6 mm×250 mm×5 μm)色谱柱购自岛津公司;黄曲霉毒素免疫亲和柱购自ROMER公司;玻璃纤维滤纸购自WHATMAN公司;甲醇、乙腈均为色谱纯;水为Millipore过滤水;黄曲霉毒素混合标准品(1 g/mL)购自SUPELCO公司。
1.2 仪器与设备
SIL-20AC型高效液相色谱仪,日本岛津公司;Milli-Q型超纯水仪,Millipore公司;Microfuge®18型离心机,美国Beckman公司;光化学衍生器,ROMER公司。
1.3 方法
1.3.1 标准溶液的制备与标准曲线
以甲醇为溶剂,用购买的黄曲霉毒素混合标准品配制成以下混合标准梯度溶液并做梯度浓度曲线:B2和G2梯度浓度分别为:0,0.06,0.30,1.50,3.00,6.00 μg/L,B1和G1梯度浓度分别为:0,0.2,1.0,5.0,10.0,20.0 μg/L。
1.3.2 样品的制备
样品粉碎后,准确称取4 g于50 mL离心管中,加入0.8 g氯化钠和20 mL φ(甲醇)=30%的水溶液,混合后振荡提取15 min,其后4 000 r/min离心5 min。取上清8 mL并加入24 mL水,混匀后用纤维滤纸过滤备用。准确移取20 mL上述样品提取液,以2 mL/min流速缓慢通过免疫亲和柱,以20 mL水淋洗两次后吹干去除水分,准确加入1 mL甲醇进行洗脱,收集洗脱液并过滤于上样瓶中准备上样。
1.3.3 色谱条件
色谱柱:Inertsil ODS-3(4.6 mm×250 mm×5 μm);流动相:V(水)∶V(甲醇)=43∶57;进样量10 μL;流速1 mL/min;柱温35℃;检测器是荧光检测器前连接光化学衍生器,激发波长360 nm,发射波长450 nm。
1.3.4 样品加标回收实验及精密度实验
取阴性对照6份,精确加入黄曲霉毒素B1,B2,G1,G2的浓度为10,3,10,3 μg/kg,按照1.3.2节制备6份平行样品进行实验检测回收率。
1.3.5 实际样本的检测
随机选取16份由某5个公司提供的样品,编号为1~16,按照1.3.2节进行前处理,进行上机检测。
2 结果与分析
2.1 4 种黄曲霉毒素的色谱分析结果
按照本实验方法和色谱条件,4种黄曲霉毒素的色谱分析时间分别为7.1,7.8,8.9,10.1 min,4种黄曲霉毒素标准溶液的色谱图见图2(箭头所指较高色谱峰为光化学衍生后色谱峰)。在连接光化学衍生器后,黄曲霉毒素B1和G1峰面积明显提高,分别是原峰面积的2.7倍和3.6倍,极大地提高了检测的灵敏度。

图2 4种黄曲霉毒素标准溶液衍生前后的HPLC对比>Fig.2 Chromatograms of 4 AFTs before and after deratization
2.2 线性范围和检测定量限
在本实验方法下,按照1.3.1节制备黄曲霉毒素混合物标准品并进行数据分析,实验结果如表1所示。结果表明各组分浓度C与其峰面A积呈良好的线性关系,相关系数>0.999。以S/N=10的信噪比确定最低检测定量限,结果为黄曲霉毒素B1,B2,G1,G2检测定量限分别为0.10,0.03,0.10,0.03 μg/kg。图3为黄曲霉毒素B1标准曲线。
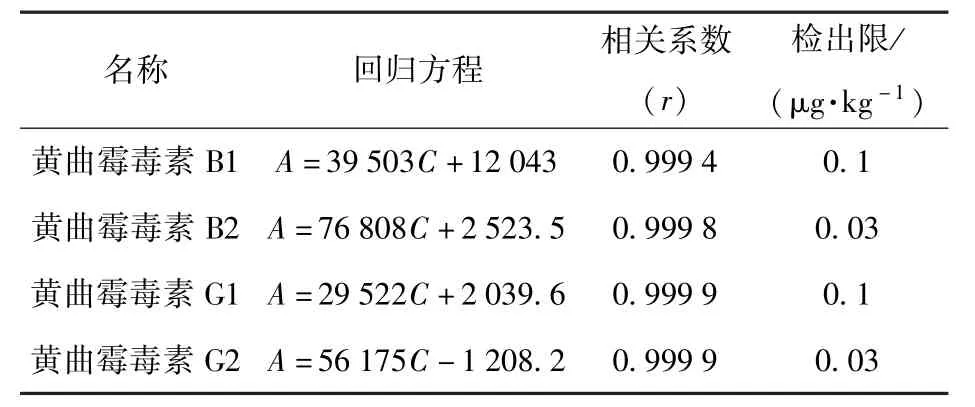
表1 黄曲霉毒素的回归结果及方法定量限Tab.1 Regression results and quantitative limits of AFTs
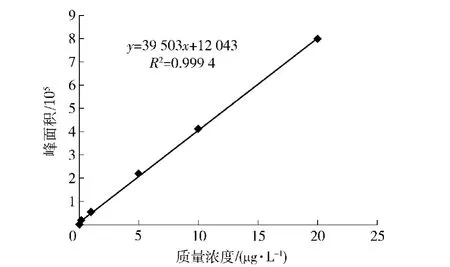
图3 黄曲霉毒素B1标准曲线Fig.3 Standard curve of AFT B1
2.3 样品加标回收试验及精密度实验
在黄曲霉毒素B1,B2,G1,G2添加水平为10, 3,10,3 μg/L时其回收率分别为90.3%,85.6%,93.5%,92.8%。RSD分别为2.3%,1.5%,2.7%,3.2%,均小于5%,如表2所示。

表2 样品加标回收率及RSD试验Tab.2 Recovery and relative standard deviation of samples
2.4 实际样品检测结果
对16份样品进行检测,其中有3份厂址位于南方的公司提供的样品含有黄曲霉毒素,具体结果如表3。图4为样品2的HPLC图谱。因为提供样品时间为5月份,此时南方正是梅雨季节,玉米发霉导致黄曲霉毒素B1超过限量标准,此批样品注意监控,不要流入市场。

表3 样品中黄曲霉毒素含量Tab.3 AFTs concentration of samples
3 结果与讨论
玉米不仅直接供人类食用,还是一种主要的饲料原料,玉米中黄曲霉毒素的污染不仅直接造成人类植源性食品污染还是人类动物源性食品安全的源头。我国对玉米中黄曲霉毒素B1限量最低为5 μg/kg,欧盟规定直接食用花生中黄曲霉毒素B1限量为2 μg/kg,对B1,B2,G1,G2总量为4 μg/kg,GB/T 18979—2003使用柱后碘衍生法进行衍生检测黄曲霉毒素,该方法操作复杂,重现性差,因此本文结合实际应用建立了免疫亲和柱-光化学衍生法对玉米中的黄曲霉毒素B1,B2,G1,G2进行检测。本方法在玉米基质中B1,B2,G1,G2添加水平为10,3,10,3 μg/L时,回收率分别为:90.3%,85.6%,93.5%,92.8%;线性范围分别为0~30 μg/L,0~9 μg/L,0~30 μg/L,0~9 μg/L;RSD分别为2.3%,1.5%,2.7%,3.2%,均小于5%,具有操作简单、灵敏度高、准确度高等特点。
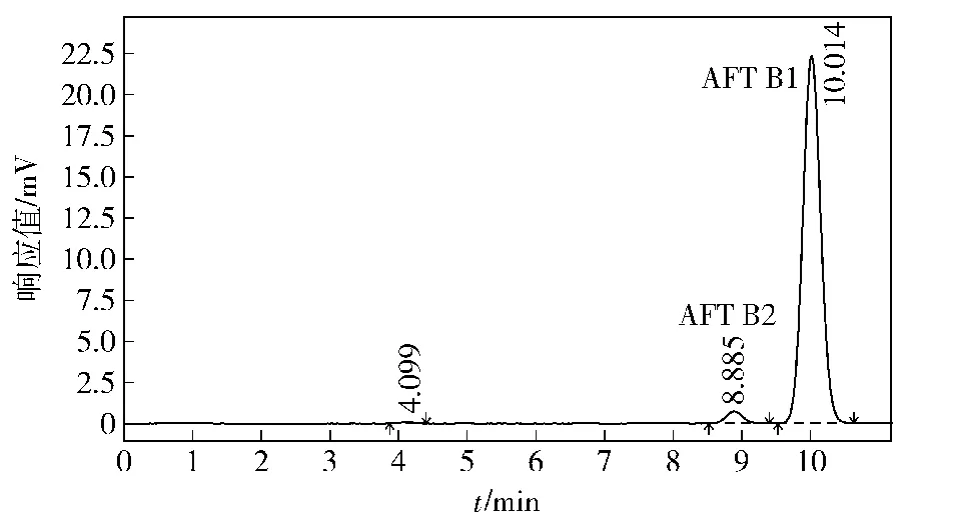
图4 样品2中黄曲霉毒素HPLCFig.4 Chromatogram of AFTs in sample 2
本方法与薄层色谱法[6]、酶联免疫吸附法以及质谱检测法[8]等方法相比,其样品前处理简单,只需在色谱柱及检测器之间连接光化学衍生器即可进行衍生,完成样品的分析检测,仪器成本低,专一性高。与常用的柱后碘衍生法相比,本方法具有节省时间,避免化学试剂的毒害,消除实验操作误差,提高重复性的优势。本方法B1、G1回收率高于文献[11]中报道的三氟乙酸衍生法(81.5%~106.2%)。与目前报道的同类光化学衍生方法相比,本方法的检测定量限分别为:0.1,0.03,0.1,0.03 μg/kg,低于陈冬东等[14](0.12,0.06,0.16,0.11 μg/kg)、王桂苓等[15](0.1,0.05,0.1,0.05 μg/kg)等研究。
本方法采用免疫亲和柱对玉米中的黄曲霉毒素B1,B2,G1,G2进行富集、净化、浓缩,在色谱柱及检测器之间连接光化学衍生器在线对黄曲霉毒素G1、B1衍生提高了荧光检测器对G1、B1的灵敏度从而提高了G1、B1检测限,既可完成样品中并能准确应用于实际样本测量中黄曲霉毒素B1,B2,G1,G2的检测,具有便捷、灵敏、准确、仪器成本低等特点,具有较高的推广应用价值。
[1]Zychowski K E,Hoffmann A R,Ly H J,et al.The effect of aflatoxin-B1 on red drum Sciaenops ocellatus and assessment of dietary supplementation of novasil for the prevention of aflatoxicosis[J].Toxins Basel,2013,5(9):1555-1573.
[2]Edupuganti S R,Edupuganti O P,Hearty S,et al.A highly stable sensitive regenerable and rapid immunoassay for detecting aflatoxin B1 in corn incorporating covalent AFB1 immobilization and a recombinant Fab antibody[J].Talanta,2013,115:329-335.
[3]施琼,陈立忠,王洪礼.饲料中黄曲霉毒素对奶牛的危害及其防治研究进展[J].中国奶牛,2012(19):18-21.
[4]许力伟,钱耕荪,瞿永华,等.苯巴比妥钠对大鼠代谢黄曲霉毒素B1为M1的影响[J].肿瘤,1982,2(5):1 -3,45.
[5]张艺兵,鲍蕾,褚庆华.农产品中真菌毒素的检测分析[M].北京:化学工业出版社,2006.
[6]杨焱,宓晓黎,成恒嵩,等.薄层扫描法测定饲料中黄曲霉毒素B1的含量[J].饲料工业,1996,17(10):36-37.
[7]丁耀魁,邢陆军,程树维,等.高效液相色谱法测定谷物中黄曲霉毒素[J].粮油仓储科技通讯,2012,28(6):34-35.
[8]蔡志斌,张英,郑志伟,等.无需衍生-超高效液相色谱法快速测定食品中黄曲霉毒素[J].中国卫生检验杂志,2013,23(2):312-315.
[9]彭康年,王远兴.液相色谱-串联质谱法测定动物肝脏中黄曲霉毒素[J].分析科学学报,2012,28(3):303-307.
[10]谢刚,王松雪,张艳.超高效液相色谱法快速检测粮食中黄曲霉毒素的含量[J].分析化学,2013,41(2):223-228.
[11]石飞云,靳艺.花生中黄曲霉毒素检测方法的研究[J].中国卫生检验杂志,2012,22(11):2584-2585.
[12]Rahmani A,Jinap S,Soleimany F.Validation of the procedure for the simultaneous determination of aflatoxins ochratoxin A and zearalenone in cereals using HPLC -FLD[J].Food Additives and Contaminants:Part A,2010,27(12):1683-1693.
[13]彭志兵,章烜,蒋建云.液液萃取-高效液相色谱法测定粮食中黄曲霉毒素的研究[J].粮食科技与经济,2013,38(1):26-29.
[14]陈冬东,代汉霞,彭涛,等.免疫亲和净化-光化学衍生-高效液相色谱法检测动物肝脏中六种黄曲霉毒素[J].食品安全质量检测学报,2014,5(3):796-800.
[15]王桂苓,张岩岩,李琳琳,等.坚果中黄曲霉毒素的光化学柱后衍生-高效液相色谱法测定[J].食品安全质量检测学报,2014,5(3):833-839.
Determination of Aflatoxin B1,B2,G1 and G2 in corn by HPLC with Photochemical Derivation
FENG Qiuyue1, LIU Ying1, LIU Yuanyuan1, YANG Yunxia2, WANG Anru1,*
(1.State Key Laboratory of Direct-Fed Microbial Engineering,Beijing Da Bei Nong Science and Technology Group Co.Ltd.,Beijing 100192,China;2.Institute of Quality Standard and Testing Technology for Agro-product of CAAS,Beijing 100081,China)
A method for the determination of aflatoxin B1,B2,G1,and G2 in corn by high performance liquid chromatography(HPLC)with immunoaffinity column and photochemical derivatization was established.Samples were extracted,concentrated,and filtered purified by immunoaffinity column,and aflatoxin B1 and G1 were derivatived using photochemical derivatization unit after the HPLC separation. Then four aflatoxins B1,B2,G1,and G2 were analyzed by HPLC with fluorescence detector.Results showed that the peak elution time of four aflatoxins B1,B2,G1,and G2 were in the range of 6-11 minutes.Meanwhile,the detection limit of quantitation of four aflatoxins were 0.10,0.03,0.10,and 0.03 μg/kg,which was above the limit of quantitation of AFTs in EU regulation,and the detection limit of quantitation of B1 and G1 enhanced to 2.7 times and 3.6 times.The recoveries of four aflatoxins were 90.3%,85.6%,93.5%,and 92.8%when the concentration of B1,B2,G1 and G2 were 10,3,10,3 μg/L.The linearity range of B1,B2,G1,and G2 were 0-20,0-6,0-20,and 0-6 μg/L,and relative standard deviation were 2.3%,1.5%,2.7%,and 3.2%.This method was accurately and sensitively to analysis four aflatoxins B1,B2,G1,G2 in corn.
aflatoxins;corn;high performance liquid chromatography;immunoaffinity column;photochemical derivatization
李 宁)
TS210.7
A
10.3969/j.issn.2095-6002.2015.05.012
2095-6002(2015)05-0069-05
冯秋月,刘滢,刘媛媛,等.光化学衍生检测玉米中4种黄曲霉毒素[J].食品科学技术学报,2015,33(5):69-73.
FENG Qiuyue,LIU Ying,LIU Yuanyuan,et al.Determination of aflatoxin B1,B2,G1 and G2 in corn by HPLC with photochemical derivation[J].Journal of Food Science and Technology,2015,33(5):69-73.
2014-12-09
国家“973”重点基础研究发展计划项目(2012CB723702);国际科技合作项目(2011DFA32330)。
冯秋月,女,硕士,主要从事动物营养与饲料科学研究;*王安如,男,高级工程师,博士,主要从事动物营养与饲料科学研究。通信作者。

