合并高血压和2型糖尿病的老年冠心病患者心率变异性分析
王利敏 程燕 孙尧 宋博毅
冠心病是老年患者的常见病及多发病,严重威胁老年人的身体健康,具有心脑血管并发症发病率高、致残率高、复发率高、病死率高、并发症多等特点。心率变异性(heart rate variability,HRV)及QTc间期是评估心脏交感与副交感神经平衡性的心电图指标,老年患者常常多种基本疾病共存,本研究通过对不同合并症老年冠心病患者进行十二导联心电图和动态心电图检查,观察合并高血压和2型糖尿病的老年冠心病患者HRV改变,探讨及评估高血压及2型糖尿病对老年冠心病自主神经功能及心脏结构功能的影响。
1 资料与方法
1.1 一般资料 依据2007年中华医学会制定的冠心病诊断及治疗指南标准,收集2013年6月至2014年6月华北理工大学附属医院老年病科及心内科住院治疗的年龄>60岁的老年冠心病住院患者143例,男70例,女73例。冠心病未合并高血压及2型糖尿病者(T0组)31例,合并高血压者(T1组)48例,合并2型糖尿病者(T2组)30例,合并高血压及2型糖尿病者(T3组)34例。4组男女比例、年龄、冠心病病程、BMI、服用β受体阻滞剂情况、吸烟史及饮酒史比较,差异无统计学意义(P>0.05)。收缩压及舒张压比较,T1、T3组较T0、T2组明显升高(P<0.05),T1、T3及 T0、T2组间比较差异无统计学意义(P >0.05)。见表1。
表1 4组一般资料比较 ±s
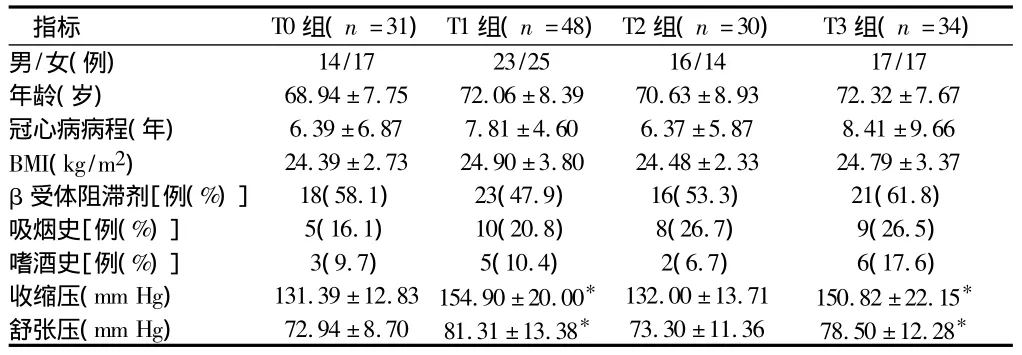
表1 4组一般资料比较 ±s
注:与T0组、T2组比较,*P<0.05
指标 T0组(n=31)T1组(n=48)T2组(n=30) T3组(n=34)男/女(例)14/17 23/25 16/14 17/17年龄(岁) 68.94±7.75 72.06±8.39 70.63±8.93 72.32±7.67冠心病病程(年) 6.39±6.87 7.81±4.60 6.37±5.87 8.41±9.66 BMI(kg/m2) 24.39±2.73 24.90±3.80 24.48±2.33 24.79±3.37 β受体阻滞剂[例(%)] 18(58.1) 23(47.9) 16(53.3) 21(61.8)吸烟史[例(%)] 5(16.1) 10(20.8) 8(26.7) 9(26.5)嗜酒史[例(%)] 3(9.7) 5(10.4) 2(6.7) 6(17.6)收缩压(mm Hg) 131.39±12.83 154.90±20.00* 132.00±13.71 150.82±22.15*舒张压(mm Hg) 72.94±8.70 81.31±13.38* 73.30±11.36 78.50±12.28*
1.2 排除标准 (1)心房颤动、室上性心动过速、心脏起搏器起搏心律者、严重房室传导阻滞等影响HRV结果者;(2)内分泌疾病如甲状腺功能亢进、甲状腺功能减退症等患者;(3)资料不全者。
1.3 研究方法
1.3.1 一般资料:记录入院时患者性别、年龄、SBP、DBP、体重指数(BMI)、冠心病病程、口服药物情况等。取空腹12 h静脉血测定三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、空腹血糖(FBG)等指标。
1.3.2 心电图监测:患者均在安静环境下平卧休息5 min后,用十二导联心电图机记录标准的十二导联心电图,测定QTc间期时间。
1.3.3 动态心电图检查:患者监测前夜及当日禁饮咖啡、茶、酒精等影响心率变异指标的饮品,禁止吸烟及剧烈运动,保持情绪稳定。采用型号为美国Marquette MARS 3000动态心电图行24 h长程采样,检出24 h窦性心搏分析HRV时域指标。检查记录均从上午8∶00至次日上午8∶00,有效信号及窦性心律时间不少于22 h,采用人机对话方式进行分析,去除异位搏动干扰,自动剔除相邻R-R间期超过20%的,检查期间正常活动。心率变异性(HRV)测定指标:24 h内全部正常心动周期的标准差(SDNN,单位ms);5 min窦性RR间期均值标准差(SDANN index,单位ms);5 min窦性R-R间期标准差均值(SDNN index,单位ms);相邻正常心动周期差值的均方根(rMSSD,单位ms);相邻两个正常心动周期差值大于50 ms所占的百分比(PNN50,单位%);HRV三角指数:窦性心搏间期的总个数与窦性心搏间期直方图的高度比值,无量纲;夜间平均心率(单位次/min)。
1.3.4 心脏超声检查:采用心动超声仪进行心脏超声检查,探头频率为1.7~3.4 MHz,测量并记录患者左心房内径(LA)、左心室舒张末期容积(LVEDV)、左心室收缩末期容积(LVESV)、左心室射血分数(LVEF)、E/A比值。
1.4 统计学分析 应用SPSS 20.0统计软件,计数资料采用χ2检验,计量资料以±s表示,非正态或等级资料采用卡方检验(率的比较)或秩和检验,多组间比较用ANVOA单因素方差分析进行检验,相关性分析正态分布资料采用Pearson相关性检验,非正态或等级资料采用Spearman相关性检验,P<0.05为差异有统计学意义。
2 结果
2.1 4组临床资料比较 4组TG、TC、HDL-C、LDLC、Tpo-A、Tpo-B比较,差异无统计学意义(P >0.05)。空腹血糖(FPG)T2、T3组较T0、T1明显升高(P<0.05),T0、T1及T2、T3组间比较差异无统计学意义(P>0.05)。见表2。
表2 4组临床资料比较mmol/L,±s

表2 4组临床资料比较mmol/L,±s
注:与T0组比较,*P<0.05;与T1组比较,#P<0.05
组别TC TG HDL-C LDL-C Tpo-A Tpo-B FPG T0组(n=31) 4.94±0.87 1.50±0.79 1.33±0.42 2.98±0.73 1.29±0.27 0.81±0.23 5.40±0.69 T1组(n=48) 5.13±1.12 1.61±0.88 1.20±0.31 3.19±0.88 1.18±0.23 0.86±0.20 5.48±1.26 T2组(n=30) 5.21±1.18 1.50±0.67 1.27±0.49 3.20±0.93 1.26±0.26 0.84±0.23 8.14±3.21*# T3组(n=34) 5.20±1.34 1.54±0.61 1.29±0.33 3.19±1.07 1.29±0.29 0.92±0.34 7.50±2.47*#
2.2 4组HRV指标及QTc间期比较 4组比较,SDNN、SDNN index、rMSSD、PNN50、HRV三角指数T3组较T0、T1、T2降低(P<0.05),夜间平均心率与QTc间期T3组较T0、T1、T2升高(P<0.05);SDNN、 SDNN index、rMSSD、HRV三角指数T1、T2较T0组降低(P<0.05);SDANN index T1、T3组较T0组降低(P<0.05),QTc间期 T1组较 T3组延长(P<0.05)。见表3。
表3 4组HRV指标及QTc间期比较±s

表3 4组HRV指标及QTc间期比较±s
注:与T0组、T1组、T2组比较,*P<0.05;与T0比较,#P<0.05;与T2比较,△P<0.05
指标 T0组(n=31) T1组(n=48) T2组(n=30) T3组(n=34) SDNN(ms) 136.29±24.17 111.58±20.70# 117.67±24.82# 95.62±26.92* SDANN index(ms) 109.87±26.77 87.96±28.01# 97.37±22.83 79.50±28.11#△SDNN index(ms) 65.10±22.08 54.69±14.98# 53.00±18.84# 44.26±14.50* rMSSD(ms) 81.77±39.12 59.92±15.53# 56.47±16.48# 44.94±13.12* PNN50(%) 11.16±8.08 9.15±9.95 8.33±7.69 4.35±3.48* HRV三角指数 51.42±11.47 41.69±9.20# 44.88±8.70# 37.01±10.69*夜间平均心率(次/min) 59.16±6.49 59.75±6.42 61.03±6.77 64.82±8.38* QTc间期(ms) 404.77±22.78 416.38±20.23# 406.80±31.69 428.47±22.49*
2.3 4组心脏超声检查指标比较 4组比较,LVEF T3组较T0、T1、T2降低(P<0.05),LVEDV、LVESV T3组较T0、T1、T2增大(P<0.05),E/AT3组较T0降低(P<0.05),LA T3组较T0增大(P<0.05)。见表4。
表4 4组心脏超声检查指标比较 ±s

表4 4组心脏超声检查指标比较 ±s
注:与T0组、T1组、T2组比较,*P<0.05;与T0组比较,#P<0.05
指标 T0组(n=31) T1组(n=48) T2组(n=30) T3组(n=34) LA(mm) 35.97±4.27 38.47±5.29 38.62±5.67 40.12±6.42# LVEDV(mm) 46.66±4.54 47.97±4.95 47.94±4.72 51.48±8.60* LVESV(mm) 28.94±4.38 29.64±4.62 30.20±7.13 33.90±9.15* LVEF(%) 68.70±6.45 67.61±7.05 67.67±7.65 62.25±9.54* E/A 0.80±0.24 0.78±0.29 0.80±0.34 0.67±0.16#
2.4 心脏超声与心率变异性各参数及QTc间期单因素相关性分析 SDNN与LA、LVEDV、LVESV呈负相关(P<0.05),与LVEF、E/A呈正相关(P<0.05); rMSSD与LVEF、E/A呈正相关(P<0.05);HRV三角指数与LVEDV呈负相关(P<0.05),与LVEF呈正相关(P<0.05);QTc间期与LVEDV、LVESV呈正相关(P<0.05),与LVEF呈负相关(P<0.05);余参数间相关性检验差异无统计学意义(P>0.05)。见表5。

表5 心脏超声与心率变异性各参数及QTc间期单因素相关性分析
3 讨论
HRV是指逐次窦性心搏间期的微小差异,心率变异性的大小反映神经体液双重因素对窦房结的调节,即反映自主神经系统交感与迷走神经活性及其平衡协调性[1]。HRV能全面、定量、直观、早期反映糖尿病及冠心病患者心血管交感及迷走神经功能状态,成为衡量心脏交感与迷走神经平衡性比较公认的指标[2,3]。
QT间期是评估心脏交感及副交感神经平衡性的心电图指标之一,在交感神经占上风时尤显优势。QT间期是普通心电图易得指标,操作简单且无创,可作为心脏自主神经病变的临床筛查指标。目前临床常用经校正的QT间期即QTc间期,QTc间期延长(P>0.44 s)提示整个心室复极时间延迟,容易导致心律失常甚至猝死。QTc间期延长对于糖尿病或冠心病患者明确是否合并心脏自主神经病变有较高的敏感性和特异性[4,5]。
心血管系统受到心脏自主神经系统的双重调控,在白天活动时,心脏交感神经张力占优势,心率加快、传导加速和心肌收缩力增强;夜间平卧休息时,心脏副交感神经张力占优势,表现心脏交感神经兴奋相反的生理效应:心率减慢、传导及心肌收缩力减弱。当患者合并心脏自主神经病变,心血管系统的自主神经系统即失衡,表现为在夜间或平卧休息时,副交感神经活动不再占主导地位,出现心脏异常电生理活动,表现为心率及血流动力学异常:静息性心动过速、心率变异性减小、夜间平均心率增快、体位性低血压、隐匿性心肌梗死、心功能下降和心源性猝死等[6,7]。临床研究已经证实心脏异常电生理活动可出现与之相关的心电图参数的异常,如QTc间期延长、心率变异性减小等[5]。总之,心率变异性各项指标降低、QTc间期时间延长及夜间平均心率升高,均提示心脏自主神经功能失衡。本研究结果提示同时合并高血压及2型糖尿病的老年冠心病患者心率变异性各项指标明显降低,QTc间期时间较其他组明显延长,说明高血压及2型糖尿病的共同作用对老年冠心病患者自主神经损害更显著。
近年来,多项研究均提示糖尿病及高血压均与心脏自主神经功能紊乱密切相关。多项基础研究表明糖尿病自主神经病变的发生发展机制是持续长期的高血糖导致的蛋白激酶C、蛋白质非酶糖基化及己糖胺代谢通路等的受损,过度激活细胞内的氧化应激反应导致组织细胞的结构和功能异常[8-10]。高血压导致自主神经病变的机制为多方面的,最可能机制为神经体液双重因素作用,高血压患者肾素-血管紧张素激活使交感活性增强,儿茶酚胺释放增加,另一方面,心脏自主神经受损导致迷走神经对心肌的保护作用减弱[11]。
本研究结果提示同时合并高血压及2型糖尿病的老年冠心病患者左心房内径明显增大,心脏收缩及舒张功能明显降低,反映了心脏结构的重构,同时心率变异性某些指标与LA、LVEDV及LVESV呈负相关,与LVEF及E/A呈正相关,即心率变异性降低,则LA、LVEDV及LVESV增大,LVEF及E/A降低。此结果说明心脏自主神经功能与心脏结构重构及心脏收缩及舒张功能的相关性,HRV可以反映心脏结构的重构严重程度及心脏功能的损坏程度,结合糖尿病及高血压自主神经病变的发生机制,考虑过度激活细胞内的氧化应激反应及神经体液因素的双重作用使心肌细胞长期处于慢性炎症状态,从而导致心室或心房的重构及自主神经的重构,由于心脏结构的改变促使心脏收缩及舒张功能降低。
综上所述,同时合并高血压及2型糖尿病的老年冠心病患者心脏自主神经功能明显降低,高血压及2型糖尿病均可加重心脏自主神经及心脏结构的重构。临床上老年患者常常为多种疾病共存,临床情况复杂,对多种合并症共存的老年冠心病患者从心率变异性、夜间平均心率、QTc间期及心脏超声进行综合评估,可以全面了解老年冠心病患者心脏自主神经功能状态,以明确判断患者病情,优化治疗方案。
1 Gang Y,Malik M.Non-invasive risk stratification for implantable cardioverter-defibrillator placement-heart rate variability.Am Heart Hosp J,2009,7:39-44.
2 Thayer JF,Yamamoto SS,Brosschot JF.The relationship of autonomic imbalance,heart rate variability and cardiovascular disease risk factors.Int J Cardiol,2010,141:122-131.
3 肖慧敏,黄美琴,李青.2型糖尿病合并冠心病患者心率变异性分析.中华全科医学,2013,11:1116-1117.
4 吕聪敏.2型糖尿病合并冠心病患者的心电学变化.中国临床研究. 2010,23:114-115.
5 林少达,李碧慧.糖尿病心血管自主神经病变的诊治现状[J/CD].中华临床医师杂志,2010,4:1-4.
6 Pop-Busui R,Evans GW,Gerstein HC,et al.Effects of cardiac autonomic dysfunction on mortality risk in the Action to Control Cardiovascular Risk in Diabetes(ACCORD)trial.Diabetes Care,2010,33:1578-1584.
7 Couderc JP.Measurement and regulation of cardiac ventricular repolarization:from the QT interval to repolarization morphology.Philos Trans A Math Phys Eng Sci,2009,367:1283-1299.
8 Davidson EP,Coppey LJ,Holmes A,et al.Effect of treatment of high fat fed/low dose streptozotocin-diabetic rats with llepatril on vascular and neural complications.Eur J Pharmacol,2011,668:497-506.
9 Siitonen N,Pulkkinen L,Lindstrm J,et al.Association of ADIPOR2 gene variants with cardiovascular disease and type 2 diabetes risk in individuals with impaired glucose tolerance:the Finnish Diabetes Prevention Study.Cardiovasc Diabetol,2011,10:83.
10 Negi G,Kumar A,Joshi RP,et al.Oxidative stress and Nrf2 in the pathophysiology of diabetic neuropathy:old perspective with a new angle.Biochem Biophys Res Commun,2011,408:1-5.
11 Schroeder EB,Liao D,Chamblessl E,et al.Hypertension,blood pressure,and heart rate variability:the Atherosclerosis Risk in Communities (ARIC)study.Hypertension,2003,42:1106-1111.

