急性肝衰竭大鼠肝脏的蛋白质组学研究*
蔡 磊,侯外林,程 远,潘明新△,高 毅
(1.南方医科大学珠江医院肝胆二科,广东广州510280;2.郴州市第一人民医院肝胆外科,湖南郴州423000)
众多研究证实,骨髓干细胞(BMSCs)在肝衰竭环境下能够在肝内分化成具备部分甚至全部肝细胞功能的肝样细胞[1-3],具体分化机制尚不明确[4-5]。比较一致的看法是:在肝衰竭微环境中存在着的某些蛋白分子,通过一定的信号通路传递,选择性地抑制或激活BMSCs的转录因子,从而启动BMSCs向肝样细胞定向分化的相应关键基因,进而出现特定的转录和翻译,导致细胞内特异性蛋白合成并产生相应的生物学效应,从而使BMSCs分化后的细胞在生化、结构和功能上发生变化。在此分化过程中,有启动作用的“关键”蛋白在该过程中可能起到了十分重要的作用。因而,如何筛选出这些“关键”蛋白成为了探讨其分化机制的难点。本研究利用蛋白质组学双向凝胶电泳(2-DE)和质谱分析等技术观察急性药物性肝衰竭模型大鼠和正常大鼠肝脏组织蛋白质的表达变化,试图以微环境为突破口,探讨BMSCs在肝内向肝样细胞定向分化的分子机制。
1 材料与方法
1.1 材料 实验动物:健康雄性SD 大鼠24只,10周龄,体质量200~250g,购自南方医科大学动物实验中心。主要试剂与仪器:D-氨基半乳糖盐酸盐购自南京嘉源医药科技有限公司;十二烷基磺酸钠(SDS)三羧基氨基甲烷(Tris 碱),丙烯酰胺(Arc)均购自美国Sigma公司;ddH2O、无水乙醇和100%乙氰(CAN)均购自广州市化学试剂厂;脱色工作液、酶解工作液、酶解缓冲液和CCA 基质工作液均购自德国SERVA Electrophoreses公司;固相pH 梯度干胶条(IPG dry strip pH 4-7 NL,24cm)、IPG 缓冲液Bio-Lytes+4/7、等电聚焦仪(IPGPhorII)和垂直电泳系统(GE Ettan DALT six,26×20cm)均为美国通用(GE)公司;基质辅助激光解吸附飞行时间质谱(MALDI-TOF-MS)仪为德国Bruker公司。
1.2 方法
1.2.1 实验动物分组及动物模型制作 将24只SD 大鼠分为实验组和对照组,每组12只。实验组大鼠腹腔内注射10g/L的D-氨基半乳糖(0.12L/kg),对照组大鼠腹腔内注射生理盐水(0.12L/kg)。
1.2.2 动物模型的鉴定和肝脏组织标本的采集 两组大鼠腹腔用药48h后,对存活大鼠均用30g/L 戊巴比妥钠腹腔注射麻醉,腹部正中切口打开腹腔,观察肝脏大体形态,迅速行心脏采血,静置2h后离心取上清液检测丙氨酸氨基转移酶(ALT)及天门冬氨酸氨基转移酶(AST)。同时每只大鼠取2个肝脏组织标本(每个标本大小约为1mm3),其中一标本用于病理鉴定,另一标本用于蛋白电泳实验。
1.2.3 标本组织的全蛋白质提取 取-80 ℃保存的各组肝脏组织块,迅速研磨至细粉末状,再分别收集于匀浆器内,分别加入0.5mL裂解液,冰浴中匀浆;1 000r/min离心10min,收集匀浆液于EP 管中,液氮反复冻融3次,每次融开后注意混匀,离心管加入核酸酶,分别加入10 mg/mL 的DNA 酶3.6 μL和RNA 酶1.2μL,放入冰浴裂解20min并间断辅以超声促进裂解;12 000r/min 4 ℃离心60min后收集上清液,Bradford法定量蛋白水平。
1.2.4 2-DE和图像分析 将两组样品分别溶于300μL 重泡涨液中,将IPG 胶条放入槽中液体之上,胶条上覆盖1层矿物油。条件为:恒压50V,15 ℃,持续16h。设置聚焦条件:(1)250V,15 ℃,15 min;(2)从250~10 000 V,15 ℃,5h;(3)10 000V,15 ℃,6h;(4)500V,15 ℃,维持。等电聚焦完成后将IPG 胶条置于-20 ℃冰箱中保存过夜。4%~20%梯度SDS 聚丙烯酰胺凝胶电泳(PAGE),大小为20.0cm ×20.0 cm×0.1cm。将平衡后的IPG 胶条移至凝胶的上方,相对分子质量标记物与胶条平行放置,用0.5%的琼脂糖凝胶封闭。电泳缓冲液为Tris-甘氨酸-SDS,在室温下以恒压100V 开始电泳,直到溴酚蓝条带前沿达到玻璃板下缘为止。以固定液将胶片固定至完全脱色,用兼容质谱银染法染色,将两组2-DE图谱进行匹配。
1.2.5 质谱鉴定 将差异显著的蛋白质点从胶上切下,置于1.5mL 的EP 管中并分别标记位点,加入超纯水振动洗涤3次后,每点加脱色工作液50μL水浴37℃下脱色30min,经完全脱水后每点加酶解工作液5μL并冰上吸涨60min后,加酶解缓冲液30μL,37℃下酶解过夜后取上清置于0.5mL的EP管中,每点加萃取工作液30μL,水浴37 ℃下萃取60min,之后经抽干浓缩至体积为5μL。按先后DDH2O、无水乙醇和100% ACN 乙氰各2次洗板后,每点样孔先均匀点0.5μL 样品,再加0.5μL CCA 基质工作液(CCA 0.001g+5%TFA 20 μL+100% ACN 乙氰500μL+DDH2O 480μL)于靶模板上,室温干燥后用MALDI-TOF-MS进行鉴定。将经反相树脂柱纯化、浓缩后的肽段用内标法校正的MALDI-TOF-MS进行质谱鉴定后,将所得的肽质量指纹谱数据输入网络应用程序(http://prowl.rockefeller.edu/prowl-cgi/profound.exe)进 行 检索,得出蛋白质名称、等电点(pI)、相对分子质量等详细信息。
1.3 统计学处理 采用SPSS13.0统计软件进行分析,以Image Master 2D 软件分别计算实验组与对照组该蛋白质点相对水平的平均值并进行比较,同时进行Student′s检测及Mann-WhitneyU检测(软件自带),计量资料用±s表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠急性药物性肝衰竭模型的鉴定 给药48h 后,实验组SD 大鼠的ALT 及AST 水平均显著高于对照组(P<0.05),见表1。实验组大鼠给药48h后见肝脏肿大,包膜紧张,表面呈颗粒状改变镜下见肝小叶结构破坏,肝细胞大片变性坏死,细胞质疏松、坏死区炎细胞浸润,肝窦扩张,呈网眼状,其内可见淤血及出血。对照组大鼠48h后肝脏组织未见明显异常(图1)。证明SD 大鼠急性药物性肝衰竭模型构建成功。
表1 两组大鼠ALT 及AST 水平比较[±s,n=12,U/L]

表1 两组大鼠ALT 及AST 水平比较[±s,n=12,U/L]
a:P<0.05,与实验组比较。
组别ALT AST实验组1 109.41±79.41 1 120.50±80.38对照组 42.68±7.07a 38.91±5.33 a
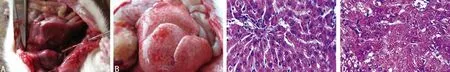
图1 两组大鼠肝脏大体标本和病理组织学观察
2.2 两组大鼠肝脏组织蛋白质2-DE 结果 两组SD 大鼠肝脏组织电泳结果显示,蛋白质在pH 3~10、相对分子质量在16~250×103能被很好地分离。比较两组SD 大鼠肝脏组织蛋白质2-DE结果,发现27个差异蛋白质位点,其中实验组较对照组上调15个(图2A),下调12个(图2B)。在实验组所筛选出的蛋白中,酪蛋白激酶Ⅰα(casein kinaseⅠ,CKⅠα)和增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)较对照组明显上调,酪氨酸蛋白激酶(protein tyrosine kinase,PTK)明显下调。
2.3 肽质量指纹谱数据库的检索 根据检测结果与肽质量指纹谱数据库中现有蛋白质的匹配程度确定所检测点位的蛋白质属性,结合GPMAW 8.00DEMO 蛋白质质谱与序列分析软件分析检索结果中的Protein Score值,得到27个具有意义的蛋白质,见表2。
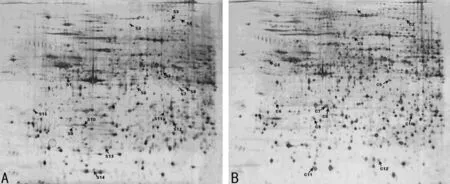
图2 两组大鼠肝脏组织蛋白质2-DE结果图像

表2 27个差异蛋白质位点的相对分子质量和等电点
3 讨 论
BMSCs在肝衰竭微环境中向肝样细胞分化是一个复杂的过程。在此分化过程中,肝衰竭的肝内微环境中某些蛋白质可能起了关键作用。目前,利用蛋白质组学相关技术对脂肪肝、肝纤维化的研究较多[6-7],对肝衰竭的研究鲜有报道[8]。
本研究根据文献[9-10]报道,建立了急性药物性肝衰竭大鼠模型,并通过肝功能检测及病理组织学分析鉴定了模型的可靠性,为本研究利用蛋白质组学技术筛选肝衰竭微环境中的“关键蛋白”奠定了良好的基础。成功建模后,本研究采用蛋白质组学技术检测了实验组与对照组大鼠肝组织内微环境的蛋白质表达差异,并通过蛋白组学相关软件从中筛选出了27个差异蛋白,其中,实验组大鼠肝脏中15种蛋白表达上调,12种表达下调。这些蛋白质根据它们的功能分类,可分为细胞结构重组相关蛋白、细胞新陈代谢相关蛋白。在实验组所筛选出的蛋白中,CKⅠα和PCNA 较对照组明显上调,PTK 明显下调,通过生物信息学分析发现上述3个蛋白与信号转导通路、细胞增殖和组织分化密切相关,因此可推测它们可能在BMSCs定向分化为肝样细胞的过程中起着关键作用。
CKⅠα是一类具有独特理化特性的丝氨酸/苏氨酸蛋白激酶,广泛存在于真核生物中,并主要分布在细胞质、细胞核、细胞膜及细胞骨架等部位[11]。其可参与到包括基因表达、DNA 修复、细胞周期的进行及细胞增殖等多种细胞调节过程中。可以磷酸化底物蛋白质中已被磷酸化的位点,也可作为其他蛋白激酶的底物被磷酸化,从而参与蛋白质的级联磷酸化过程,在信号转导途径中发挥作用[12]。研究证实CKⅠα在经典的Wnt信号通路中是一个重要的调节蛋白,起着双向调节的作用[13]。柯尊富[14]发现在MSCs向肝样细胞分化过程中,Notch信号通路明显下调,而TGF-β和Jak-stat信号通路各基因的表达趋势不规则,同时Wnt信号上调可以抑制MSCs向肝细胞分化,使MSCs保持未分化状。本结果表明,肝脏损伤后CKⅠα表达量上调,推断其可能通过Wnt信号通路诱导BMSCs向肝样细胞分化。PTK 是一类催化ATP上γ-磷酸转移到蛋白酪氨酸残基上的激酶,能催化多种底物蛋白质酪氨酸残基磷酸化,在细胞生长、增殖和分化中具有重要作用。目前与PTK 相关的信号通路中研究较多的是MAPK 和JAKSTAT 信号通路[15-16]。大多数生长因子的受体都有受体酪氨酸激酶活性,而这些因子中的许多如肝细胞生长因子(hepatocyte growth factor,HGF)、成 纤 维 细 胞 生 长 因 子(fibroblast growth factor,FGF)、表皮生长因子(epidermal growth factor,EGF)等均已被证实单独和(或)联合均能诱导BMSCs向肝样细胞分化[17]。PCNA 是DNA 聚合酶δ的辅助蛋白。有研究发现,PCNA 与细胞DNA 合成关系密切,在细胞增殖的启动上起重要作用,检测PCNA 在细胞中的表达,可作为评价细胞增殖状态的一个指标[18]。有报道表明,P21Cip/WAF1的高表达抑制了BMSCs增殖,同时在其向肝样细胞分化过程中起一定调控作用,P27Kip1 可能并不起作用,PCNA 的表达则与P21Cip/WAF1相反,呈逐步减少趋势[19]。本结果显示,PCNA 在肝衰竭肝组织中表达比正常大鼠肝组织高,推测该蛋白可能通过调节干细胞RNA 的转录,促使归巢于肝脏中的干细胞迅速合成大量的核酸和蛋白质,进一步修复受损的肝功能。目前,虽然微环境中各种因子的作用尚未完全确定,但是必要的因子在准确的时间和阶段起作用是BMSCs分化为肝样细胞的关键[20]。因此,对微环境中蛋白分子及其相关信号通路的研究有助于初步阐明BMSCs体内定向分化为肝样细胞的分子机制。本研究利用蛋白质组学2-DE 和质谱分析等技术观察急性药物性肝衰竭模型大鼠和正常大鼠肝脏组织蛋白质的表达变化,并对其中的CKⅠα、PTK、PCNA 等蛋白可能与干细胞的增殖及分化的关系进行了探讨。对进一步研究骨髓干细胞如何在肝衰竭环境下分化成肝样细胞提供了可能的研究方向。
[1] Zhang L,Ye JS,Decot V,et al.Research on stem cells as candidates to be differentiated into hepatocytes[J].Biomed Mater Eng,2012,22(1/2/3):105-111.
[2] Piryaei A,Valojerdi MR,Shahsavani M,et al.Differentiation of bone marrow-derived mesenchymal stem cells into hepatocyte-like cells on nanofibers and their transplantation into a carbon tetrachloride-induced liver fibrosis model[J].Stem Cell Rev,2011,7(1):103-118.
[3] Pournasr B,Mohamadnejad M,Bagheri M,et al.In vitro differentiation of human bone marrow mesenchymal stem cells into hepatocyte-like cells[J].Arch Iran Med,2011,14(4):244-249.
[4] Wu XB,Tao R.Hepatocyte differentiation of mesenchymal stem cells[J].Hepatobiliary Pancreat Dis Int,2012,11(4):360-371.
[5] Puglisi MA,Saulnier N,Piscaglia AC,et al.Adipose tissue-derived mesenchymal stem cells and hepatic differentiation:old concepts and future perspectives[J].Eur Rev Med Pharmacol Sci,2011,15(4):355-364.
[6] Rodriguez-Suarez E,Mato JM,Elortza F.Proteomics analysis of human nonalcoholic fatty liver[J].Methods Mol Biol,2012(909):241-258.
[7] Yamada M,Satoh M,Seimiya M,et al.Combined Pro-teomic Analysis of Liver Tissue and Serum in Chronically Alcohol-Fed Rats[J].Alcohol Clin Exp Res,2012,37 Suppl 1:E79-87.
[8] Cho EH,Koh PO.Proteomic identification of proteins differentially expressed by melatonin in hepatic ischemiareperfusion injury[J].J Pineal Res,2010,49(4):349-255.
[9] Hocher B,Heiden S,von Websky K,et al.Dual endothelin-converting enzyme/neutral endopeptidase blockade in rats with D-galactosamine-induced liver failure[J].Eur J Med Res,2011,16(6):275-279.
[10] Zhang L,Kang W,Lei Y,et al.Granulocyte colony-stimulating factor treatment ameliorates liver injury and improves survival in rats with D-galactosamine-induced acute liver failure[J].Toxicol Lett,2011,204(1):92-99.
[11] Reinhardt J,Ferandin Y,Meijer L.Purification of CK1by affinity chromatography on immobilised axin[J].Protein Expr Purif,2007,54(1):101-109.
[12] Legent K,Steinhauer J,Richard M,et al.A screen for Xlinked mutations affecting Drosophila photoreceptor differentiation identifies Casein kinase 1alpha as an essential negative regulator of wingless signaling[J].Genetics,2012,190(2):601-616.
[13] Kikuchi A,Yamamoto H,Sato A.Selective activation mechanisms of Wnt signaling pathways[J].Trends Cell Biol,2009,19(3):119-129.
[14] 柯尊富.Wnt/Notch/TGF-β/Jak-stat信号通路在BMSC肝向分化过程中的调控机制研究[D].广州:中山大学,2008.
[15] 刘灏,陈景良,向国安.hHGF 调控肝纤维化信号转导途径研究[J].南方医科大学学报,2010,30(3):431-434.
[16] Jiang H,Grenley MO,Bravo MJ,et al.EGFR/Ras/MAPK signaling mediates adult midgut epithelial homeostasis and regeneration in Drosophila[J].Cell Stem Cell,2011,8(1):84-95.
[17] Chivu M,Dima SO,Stancu CI,et al.In vitro hepatic differentiation of human bone marrow mesenchymal stem cells under differential exposure to liver-specific factors[J].Transl Res,2009,154(3):122-132.
[18] Seki T,Yokoyama Y,Nagasaki H,et al.Adipose tissuederived mesenchymal stem cell transplantation promotes hepatic regeneration after hepatic ischemia-reperfusion and subsequent hepatectomy in rats[J].J Surg Res,2012,178(1):63-70.
[19] 汤志华,闵军,陈积圣,等.P21Cip/WAF1及P27Kip1与增殖细胞核抗原在人骨髓间充质干细胞向肝细胞分化过程中的表达[J].中国组织工程研究与临床康复,2009,13(23):4577-4580.
[20] Li Y,Kang X,Guo K,et al.Proteome alteration of earlystage differentiation of mouse embryonic stem cells into hepatocyte-like cells[J].Electrophoresis,2009,30(9):1431-1440.

