T-cadherin蛋白与基因在混合细胞型霍奇金淋巴瘤中表达和临床意义*
任明强,谭天海,苏 俊
(遵义医学院附属医院:1.血液科;2.病理科,贵州遵义563003)
混合细胞型霍奇金淋巴瘤是一种国内最常见的经典型霍奇金淋巴瘤,约占经典型霍奇金淋巴瘤的30%,主要在儿童和老年人中发病[1]。已有报道年龄、性别、TNM 分期、白细胞计数、淋巴细胞计数和结外累及是影响混合细胞型霍奇金淋巴瘤预后因素[2]。但是混合细胞型霍奇金淋巴瘤的诊断和预后分子标记物依旧存在较大争议,缺乏特异相关的预后指标指导治疗。T-cadherin属于细胞黏附分子cadherin超家族的成员之一,因缺失cadherin分子中跨膜区被截短而得名(又称CDH13或H-cadherin),研究发现T-cadherin在肺癌、肝癌、宫颈癌和结直肠癌等中存在显著低表达或表达缺失,并影响肿瘤患者预后[3]。然而国内外尚缺乏T-cadherin对混合细胞型霍奇金淋巴瘤的相关研究。因此,本研究采用免疫组织化学法和RTPCR 检测T-cadherin在混合细胞型霍奇金淋巴瘤患者淋巴结和骨髓细胞中的表达情况,探讨T-cadherin能否成为混合细胞型霍奇金淋巴瘤发生、发展的分子标记物,为指导混合细胞型霍奇金淋巴瘤诊断和预后提供理论依据。
1 资料与方法
1.1 一般资料 选取2002年2月至2010年2月遵义医学院附属医院住院患者,其中混合细胞型霍奇金淋巴瘤45例为实验组,其中男29例,女16例,年龄18~72岁,中位年龄43岁,TNM 分期Ⅰ、Ⅱ期共14例和Ⅲ、Ⅳ期共31例,均为淋巴结内原发病变。另取同时期淋巴结反应性增生的初治患者20例为对照组,男11例,女9例,年龄21~69岁,中位年龄41岁。诊断标准符合《张之南血液病诊断及疗效标准》(第3版),所有患者均活检淋巴结组织,并对标本制作石蜡冰冻切片保存;同时45例患者采集骨髓细胞用于RT-PCR检测。
1.2 方法
1.2.1 免疫组织化学法 将石蜡标本包埋并制作2μm 连续病理切片,按照免疫组化染色说明书中的方法进行染色。DAB试剂盒和SP染色试剂盒均从重庆生物制品有限公司购买,兔抗人T-cadherin单克隆抗体购自上海Aviva Systems Biology公司。由两位病理医生进行双盲阅片,结果取平均值。免疫组织化学结果判定标准:采用半定量对T-cadherin进行分析,按阳性细胞的染色强度记分等级为0分(阴性)、1分(弱阳性)、2分(中度阳性)和3分(强阳性);按染色阳性细胞百分比记分等级为0分(<10%细胞阳性)、1分(10%~25%细胞阳性)、2分(26%~50%细胞 阳 性)、3分(51%~75%细 胞 阳 性)、4 分(>75%细胞阳性);将染色强度和染色百分比相乘得到的分数即为最后染色水平分级:0~3分定义为阴性,4~12分定义为阳性。
1.2.2 RT-PCR法 根据Genbank中报道的人T-cadherin的基因序列,用Primer Pre-mier5.0软件设计T-cadherin基因的引物序列。上游引物为5′-ACCCAGCAGGTTGGCTGAA-3′,下游引物为5′-CCTCCAGGGTTATCAGCAAAGTC-3′,长度174bp。以GAPDH 为内参照,设计特异性序列引物,上游引物为5′-TGGAAATCAATGGGAAGCAGG-3′,下游引物为5′-ATAGGTGAATCAGCAGATGGAGC-3′,长度190bp。引物均由大连宝生物工程公司合成。45例患者取相应骨髓5mL,用肝素抗凝后,使用淋巴细胞分离液分离骨髓单个核细胞,并计数(5~10)×106细胞与Trizol总RNA 提取液1mL 混匀,冻存于-20 ℃环境中。采用Trizol法一步提取骨髓单个核细胞的总RNA。产物用20μL 的DEPC 水溶解。RNA 完整度检测用电泳法,RNA 含量和纯度的计算则用紫外分光光度计测量。提取1μL的总RNA 来构成10μL反应体系,并参照逆转录试剂盒说明书以进行cDNA 合成。将cDNA 用于进一步常规PCR 扩增。条件为:94 ℃预变性1min,94 ℃30s,58 ℃30s,71 ℃40s,共30个循环,最后72 ℃延伸5min。
1.3 研究内容 分析混合细胞型霍奇金淋巴瘤和淋巴结反应性增生患者中T-cadherin表达情况,混合细胞型霍奇金淋巴瘤患者临床病理特征年龄、性别、WBC、PLT、Hb、LDH、TNM 分期和结外累及与T-cadherin表达强度的关系;将年龄、性别、WBC、PLT、Hb、LDH、TNM 分期、结外累及和T-cadherin阳性表达纳入混合细胞型霍奇金淋巴瘤患者结外累及多因素Logistic回归分析;并对混合细胞型霍奇金淋巴瘤患者进行5年随访,分析T-cadherin阳性表达和远期预后的关系。混合细胞型霍奇金淋巴瘤一线方案选ABVD 经4~6个疗程后判断疗效。第1年每3月进行1次随访,第2年以后每6个月进行1次随访,以2、3和5年的总生存率为远期预后评价指标,并绘制两组患者的生存曲线,比较两组患者的远期预后疗效。
1.4 统计学处理 采用SPSS16.0软件进行统计学分析,对计数资料采用χ2检验,多因素Logistic回归分析混合细胞型霍奇金淋巴瘤患者结外累及与临床病理特征的关系。两组生存资料采取Kaplan-Meier方法绘制生存曲线,采用Log-rank检验分析组间差异。以P<0.05为差异有统计学意义。
2 结 果
2.1 T-cadherin在混合细胞型霍奇金淋巴瘤和淋巴结反应性增生患者中的表达 T-cadherin的表达主要定位于细胞膜上,其在混合细胞型霍奇金淋巴瘤和淋巴结反应性增生患者中的阴性表达分别为68.9%和10.0%,阳性表达分别为31.1%和90.0%,两组间差异有统计学意义(P<0.05),见图1、表1。
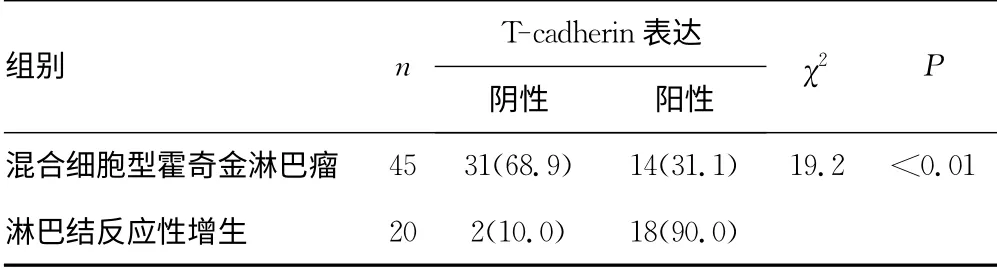
表1 T-cadherin在混合细胞型霍奇金淋巴瘤和淋巴结 反应性增生患者中的表达[n(%)]

图1 T-cadherin在混合细胞型霍奇金淋巴瘤与淋巴结反应性增生中的表达(SP×400)
2.2 T-cadherin mRNA 在混合细胞型霍奇金淋巴瘤和淋巴结反应性增生的相对表达量 T-cadherin mRNA 在混合细胞型霍奇金淋巴瘤中表达显著减少,相对表达量为0.36±0.03,而在淋巴结反应性增生中大量表达,相对表达量为0.87±0.07,二者间差异有统计学意义(t=31.33,P<0.05)。这一结果和免疫组化蛋白表达趋势结果相一致。
2.3 T-cadherin表达与混合细胞型霍奇金淋巴瘤临床特征的关系 混合细胞型霍奇金淋巴瘤中T-cadherin 表达与患者TNM 分期和结外累及有关(P<0.05),与患者年龄、性别、WBC、PLT、Hb、LDH 和IPS评分无相关性(P>0.05),见表2。

表2 T-cadherin表达与混合细胞型霍奇金淋巴 瘤临床特征的关系(n)
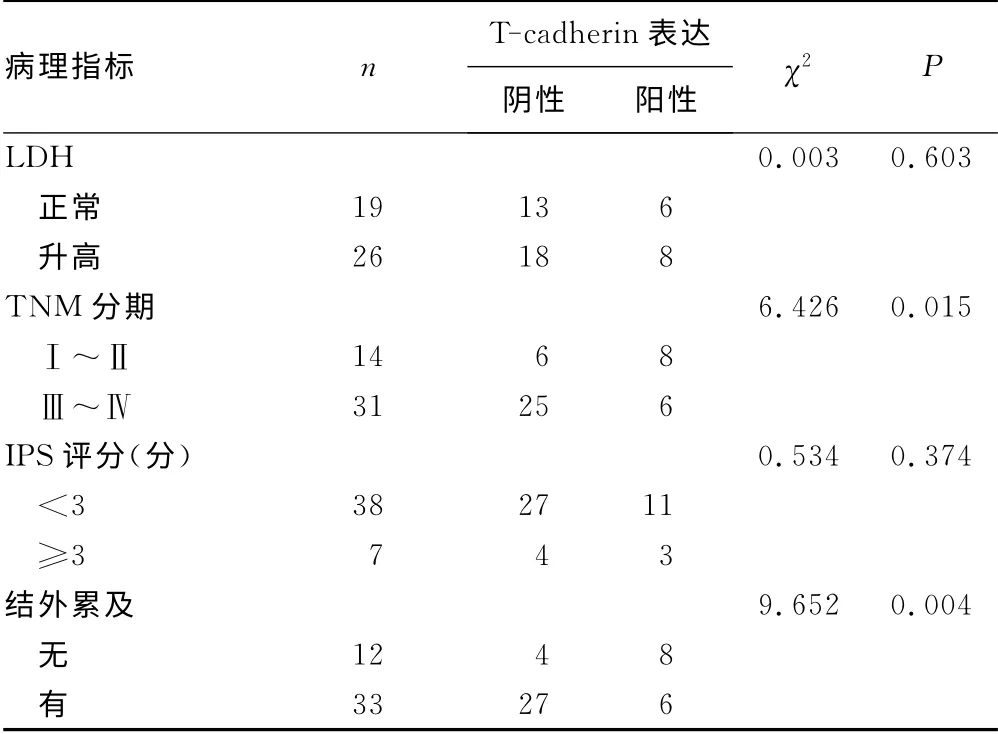
续表2 T-cadherin表达与混合细胞型霍奇金淋巴 瘤临床特征的关系(n)
2.4 混合细胞型霍奇金淋巴瘤患者结外累及与临床病理特征的关系 在混合细胞型霍奇金淋巴瘤患者中,结外累及与年龄、性别、WBC、PLT、Hb和LDH 无关(P>0.05),与TNM 分期和T-cadherin阴性表达有关(P=0.012、0.008)。多因素Logistic回归分析显示,影响混合细胞型霍奇金淋巴瘤患者结外累及OR由大到小依次为T-cadherin阴性表达、TNM 分期、性别、年龄、PLT、WBC、Hb和LDH,见表3。

表3 结外累及与临床病理特征的多因素 Logistic回归分析
2.5 混合细胞型霍奇金淋巴瘤患者T-cadherin表达与生存预后的关系 经过Log-rank检验显示,混合细胞型霍奇金淋巴瘤患者T-cadherin阴性表达和T-cadherin阳性表达的2年生存率分别是83.9%和92.9%(P>0.05);3年生存率分别是71.0%和85.7%(P>0.05);5年生存率分别是41.9%和78.6%(P=0.024),见表4。同时绘制Kaplan-Meier图,显示T-cadherin阴性表达5年生存率明显低于T-cadherin阳性表达(P=0.038),见图3。

表4 T-cadherin表达与混合细胞型霍奇金淋巴 瘤患者生存率[n(%)]

图3 T-cadherin表达与混合细胞型霍奇金淋巴瘤患者生存曲线
3 讨 论
混合细胞型霍奇金淋巴瘤是一种以R-S细胞为主,并伴有嗜酸细胞、淋巴细胞、浆细胞等多种细胞常见的经典型霍奇金淋巴瘤,活检可见以瘤细胞CD30、CD15、PAX-5 染色阳性及IgH、TCR 基因重排为特征[4-5]。混合细胞型霍奇金淋巴瘤存在播散倾向,生存期相对短、易复发等特点,部分患者预后差。目前,霍奇金淋巴瘤治疗及预后相关因素是研究热点,不同的研究中提出了不同的临床预后因素,霍奇金淋巴瘤的预后因素仍未统一[6]。
T-cadherin属于细胞黏附分子cadherin超家族,主要通过调节钙介导的细胞黏附、细胞极性及形态形成、细胞聚集和迁移、细胞识别和信号转导[7]。T-cadherin表达缺失使细胞间黏附力减弱,从而促进肿瘤细胞转移,与肿瘤发展及转移呈负相关[8]。目前,T-cadherin在多种肿瘤(胃癌、鼻咽癌、结直肠癌、肝癌、宫颈癌、乳腺癌等)中呈低表达,并且是不良预后指标[9-11]。而cadherin超家族中,E-cadherin对维持上皮细胞形态和结构完整性有着重要作用,N-cadherin则会促进癌细胞从癌组织脱落并使其与正常内皮或基质黏附。目前暂缺混合细胞型霍奇金淋巴瘤中T-cadherin表达研究的报道,混合细胞型霍奇金淋巴瘤预后与多种因素有关,但多数标志与患者预后的关系仍不十分清楚[12]。在本研究中发现在混合细胞型霍奇金淋巴瘤中T-cadherin呈显著低表达,结果显示T-cadherin在混合细胞型霍奇金淋巴瘤中的阳性表达显著低于淋巴结反应性增生(P<0.05),在国内多项研究发现T-cadherin在鼻咽癌、胃癌等肿瘤中阳性表达也显著降低[13]。同时采用RT-PCR 检测结果显示T-cadherin mRNA 在混合细胞型霍奇金淋巴瘤中相对表达量显著低于淋巴结反应性增生(P<0.05),这一结果和免疫组织化学结果类似。进一步分析T-cadherin表达与临床预后等相关因素间关系,表明混合细胞型霍奇金淋巴瘤患者T-cadherin表达与年龄、性别、WBC、PLT、Hb、LDH 和IPS评分无相关性(P>0.05),与TNM 分期和结外累及相关(P<0.05),表明低表达T-cadherin的混合细胞型霍奇金淋巴瘤侵袭性强、危险度高、病情易进展。结外累及作为独立重要预后因素,在多因素Logistic回归分析中,显示TNM 分期和Tcadherin阴性表达是混合细胞型霍奇金淋巴瘤患者结外累及的独立危险因素,表现T-cadherin阴性表达与结外累及密切关系,提示T-cadherin为判断混合细胞型霍奇金淋巴瘤预后有重要价值。分析其作用机制,主要是T-cadherin基因启动子甲基化导致T-cadherin 蛋白表达显著降低或缺失;同时,Twist、ZEB1、Snail等多种转录因子可直接抑制T-cadherin 转录;PI3K/AKT、Ras/Raf等多种信号转导途径可活化核内转录因子以抑制T-cadherin表达[14];T-cadherin蛋白的缺失使得肿瘤间黏附力减弱,从而导致肿瘤细胞的浸润和转移[15]。此外,随访5年显示混合细胞型霍奇金淋巴瘤患者T-cadherin阴性表达生存率明显低于T-cadherin阳性表达患者,并随着时间的推移两组间生存率的差异逐渐增加,这可能和T-cadherin随着肿瘤的进展而呈进行性丢失有关。
由此可以推断T-cadherin表达减少在混合细胞型霍奇金淋巴瘤中与临床预后密切相关,T-cadherin可能成为混合细胞型霍奇金淋巴瘤预后相关的重要分子标记物,为进一步指导混合细胞型霍奇金淋巴瘤临床治疗提供初步理论依据。
[1] Vardiman JW.The World Health Organization(WHO)classification of tumors of the hematopoietic and lymphoid tissues:an overview with emphasis on the myeloid neoplasms[J].Chem Biol Interact,2010,184(1/2):16-20.
[2] Ansell SM.Hodgkin lymphoma:2014update on diagnosis,risk-stratification,and management[J].Am J Hematol,2014,89(7):771-779.
[3] 吕昊明,曹伟,赵军莉,等.T-cadherin启动子甲基化与胃癌恶性生物学行为及预后关系的研究[J].现代肿瘤医学,2014,7(20):1618-1620.
[4] Anila KR,Nair RA,Prem S,et al.Primary Mixed Cellularity Classical Hodgkin lymphoma of the Lumbar spine-An unusual presentation[J].Gulf J Oncolog,2015,17(1):88-91.
[5] Maraldo MV,Lundemann M,Vogelius IR,et al.A new method to estimate doses to the normal tissues after past extended and involved field radiotherapy for Hodgkin lymphoma[J].Radiother Oncol,2015,114(2):206-211.
[6] 万文丽,田磊,克晓燕.霍奇金淋巴瘤的研究进展[J].白血病·淋巴瘤,2010(5):308-311.
[7] Matsuda K,Fujishima Y,Maeda N,et al.Positive feedback regulation between adiponectin and T-cadherin im-pacts adiponectin levels in tissue and plasma of male mice[J].Endocrinology,2015,156(3):934-946.
[8] Wang Z,Wang B,Guo H,et al.Clinicopathological significance and potential drug target of T-cadherin in NSCLC[J].Drug Des Devel Ther,2015,9(3):207-216.
[9] 肖红燕,庞文燕.T-cadherin在乳腺癌中的表达及其意义[J].哈尔滨医药,2014,20(3):183-185.
[10] Maslova K,Kyriakakis E,Pfaff D,et al.EGFR and IGF-1Rin regulation of prostate cancer cell phenotype and polarity:opposing functions and modulation by T-cadherin[J].FASEB J,2015,29(2):494-507.
[11] Hayano Y,Zhao H,Kobayashi H,et al.The role of Tcadherin in axonal pathway formation in neocortical circuits[J].Development,2014,141(24):4784-4793.
[12] Evens AM,Kostakoglu L.The role of FDG-PET in defining prognosis of Hodgkin lymphoma for early-stage disease[J].Blood,2014,124(23):3356-3364.
[13] 马涛,刘为民,李燕,等.T-cadherin分子在鼻咽癌中表达异常及意义[J].宁夏医学杂志,2014,30(11):1012-1014.
[14] Zhong YH,Peng H,Cheng HZ,et al.Quantitative assessment of the diagnostic role of CDH13promoter methylation in lung cancer[J].Asian Pac J Cancer Prev,2015,16(3):1139-1143.
[15] Caballero JN,Gervasi MG,Veiga MF,et al.Epithelial cadherin is present in bovine oviduct epithelial cells and gametes,and is involved in fertilization-related events[J].Theriogenology,2014,81(9):1189-1206.

