EGF、PAF-AH 对过敏性紫癜肾脏损害的临床诊断意义*
张 静,陆 彪△,刘 静,陈丽君
(1.宁夏医科大学总院儿科,银川750004;2.宁夏医科大学第二附属医院肾内科,银川750004)
过敏性紫癜(HSP)是一种以IgA 介导的全身小血管炎为主要病变的变态反应性疾病。HSP最严重的并发症是肾脏损害。紫癜性肾炎(HSPN)在HSP病程中出现血尿和(或)蛋白尿即可诊[1]。是儿童最常见的继发性肾脏病之一,有无肾脏损害是决定HSP 患儿预后的关键因素[2]。肾活检才是HSPN的早期诊断的金标准,但其为创伤性检查,家属及患儿均难以接受。因此拟通过检测血表皮生长因子(EGF)、血小板活化因子乙酰水解酶(PAF-AH)和尿EGF的表达,探讨与HSP肾脏损害的关联性,判断是否这三者具有临床诊断意义。
1 资料与方法
1.1 一般资料 病例组:收集宁夏医科大学总院儿科2013年9月至2014年1月住院的HSP急性发作期患儿86例,符合诊断标准[3],初次诊断,近十天内未使用过肾上腺皮质激素及免疫抑制剂等药物。确诊后按是否发生肾脏损害分为非HSPN组和HSPN 组。其中非HSPN 组60例,男27例,女33例;汉族42 例,回族17 例,满族1 例;发病年龄3~14 岁,平均(7.17±2.06)岁。HSPN 组26 例,男17 例,女9 例;汉族16例,回族10 例;发病年 龄3~14 岁,平均(9.19±2.62)岁。HSP起病前有明确感染者非HSPN 组17例,HSPN 组21例。住院后给予抗过敏、抗凝、改善血管通透性等治疗2周后症状消失再次采血标本进行复查。健康对照组:为同期体检的健康儿童50例。男27 例,女23 例;汉 族38 例,回 族12 例;年 龄2.9~14.0岁,平均(4.89±2.83)岁。近两周无过敏、肾脏病、风湿及哮喘病史。病例组与健康对照组儿童的性别、年龄、民族差异均无统计学意义(P>0.05)。肺炎对照组:为同期住院确诊的支气管肺炎儿童30例。男19例,女11例;汉族24例,回族6例;年龄0.9~14.0岁,平均(3.71±3.14)岁。近两周无过敏、肾脏病、风湿病史。本研究已征得所有家属同意。
1.2 方法
1.2.1 主要试剂 RNA 分离及抽提试剂、反转录-PCR 试剂盒、实时荧光定量PCR 检测试剂盒(北京中科亚光生物科技公司);ELISA 试剂盒(武汉华美生物工程公司)。
1.2.2 主要仪器 低温冰箱,高速离心机,荧光PCR 仪,酶标仪,电热恒温培养箱。
1.2.3 实验方法
1.2.3.1 留取标本 (1)所有研究对象入院当天分别采静脉血(非空腹)2mL,一份加入无菌采血管(无抗凝剂),室温放置2h,3 000r/min离心10min,取上清液分装,于-80 ℃冰箱备用。另一份加入无菌EDTA-K2采血管,-80 ℃冰箱备用。(2)所有研究对象第2天取晨尿中段尿3mL,离心取上清液,-80 ℃冰箱保存。
1.2.3.2 实时荧光定量PCR 检测血PAF-AH、EGF 水平 (1)总RNA 的提取;(2)紫外线吸收法测定;(3)样品cDNA 合成;(4)按梯度稀释的标准品及待测样品的实时荧光定量PCR检测;(5)制备用于绘制梯度稀释标准曲线的DNA 模板。
1.2.3.3 ELISA 检测血中EGF、PAF-AH 和尿EGF 水平 将-80 ℃冰箱保存的血清和尿标本放置室温溶化。依次按照说明取出酶标板,加入标准品,酶标记溶液,显色剂,终止液。混匀后即在波长450nm 的酶标仪上读取各孔的光密度(OD)值,由标准曲线计算出样品血EGF、PAF-AH 和尿EGF 的实际浓度。
1.3 统计学处理 采用SPSS17.0软件进行分析,计量资料用±s来表示,组间比较用配对t检验,差异比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组血EGF、PAF-AH mRNA 水平比较 病例组较健康对照组明显升高(P<0.05),见表1。HSPN 组血PAF-AH mRNA较非HSPN组明显升高(P<0.05);HSPN组血EGF mRNA较非HSPN 组亦升高,但差异无统计学意义(P>0.05),见表2。
表1 病例组与健康对照组血EGF、PAF-AH mRNA 水平比较(±s)
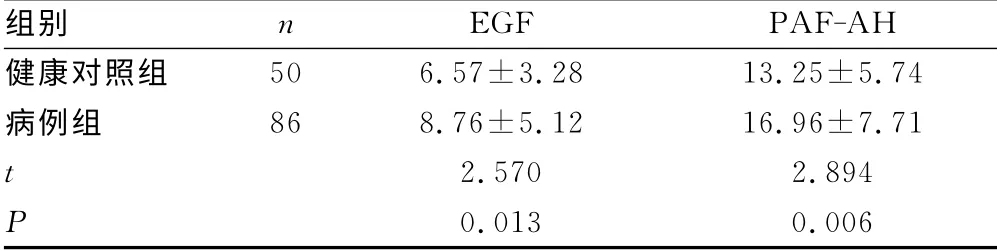
表1 病例组与健康对照组血EGF、PAF-AH mRNA 水平比较(±s)
组别 n EGF PAF-AH健康对照组50 6.57±3.28 13.25±5.74病例组 86 8.76±5.12 16.96±7.71 t 2.570 2.894 P 0.013 0.006
表2 HSPN 组及非HSPN 组血EGF、PAF-AH mRNA 水平比较(±s)
组别 n EGF PAF-AH非HSPN 组60 7.83±4.30 17.05±7.71 HSPN 组 26 11.31±4.21 25.44±10.21 t 1.415 2.199 P 0.169 0.037
2.2 各组血EGF、PAF-AH 及尿EGF 水平比较 恢复期血EGF、PAF-AH 及尿EGF较急性期明显降低(P<0.05),见表3。HSPN 组血EGF、PAF-AH 及尿EGF 较非HSPN 组明显升高(P<0.05),见表4。病例组血EGF、PAF-AH 及尿EGF较健康对照组明显升高(P<0.05),见表5。病例组较肺炎对照组血PAF-AH 明显升高(P<0.05),血、尿EGF 降低,差异无统计学意义(P>0.05),见表6。
表3 HSPN 组及非HSPN 组急性期与恢复期各指标水平比较(±s,ng/L)
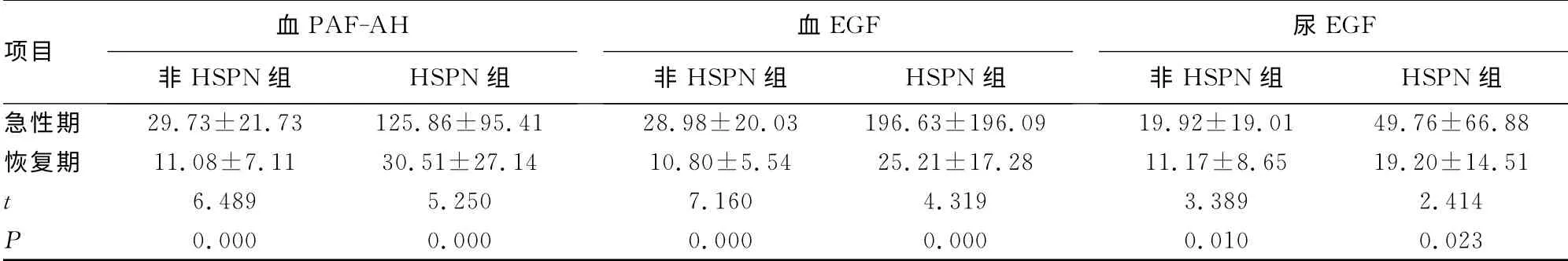
表3 HSPN 组及非HSPN 组急性期与恢复期各指标水平比较(±s,ng/L)
项目血PAF-AH非HSPN 组 HSPN组血EGF非HSPN 组 HSPN组尿EGF非HSPN 组 HSPN组急性期 29.73±21.73 125.86±95.41 28.98±20.03 196.63±196.09 19.92±19.01 49.76±66.88恢复期 11.08±7.11 30.51±27.14 10.80±5.54 25.21±17.28 11.17±8.65 19.20±14.51 t 6.489 5.250 7.160 4.319 3.389 2.414 P 0.000 0.000 0.000 0.000 0.010 0.023
表4 HSPN 组及非HSPN 组儿童血EGF、PAF-AH 及尿EGF水平比较(±s,ng/L)

表4 HSPN 组及非HSPN 组儿童血EGF、PAF-AH 及尿EGF水平比较(±s,ng/L)
组别 n 血PAF-AH 血EGF 尿EGF非HSPN 组60 29.73±21.73 28.98±20.03 19.92±19.01 HSPN 组 26 125.86±95.41 196.63±196.09 49.76±66.88 t 6.173 4.629 3.052 P
表5 病例组及健康对照组儿童血EGF、PAF-AH 及尿EGF水平比较(±s,ng/L)

表5 病例组及健康对照组儿童血EGF、PAF-AH 及尿EGF水平比较(±s,ng/L)
组别 n 血PAF-AH 血EGF 尿EGF健康对照组50 6.35±3.56 5.33±3.20 12.37±6.62病 例 组 86 43.45±51.39 22.02±11.99 21.90±20.25 t 5.228 10.720 3.014 P 0.000 0.000 0.004
表6 病例组及肺炎对照组儿童血EGF、PAF-AH 及尿EGF水平比较(±s,ng/L)
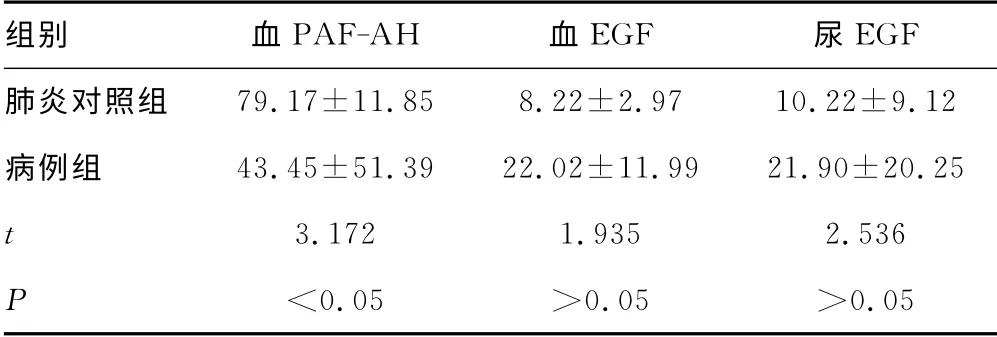
表6 病例组及肺炎对照组儿童血EGF、PAF-AH 及尿EGF水平比较(±s,ng/L)
组别 血PAF-AH 血EGF 尿EGF肺炎对照组79.17±11.85 8.22±2.97 10.22±9.12病例组 43.45±51.39 22.02±11.99 21.90±20.25 3.172 1.935 2.536<0.05 >0.05 >0.05
3 讨 论
HSP是一种由免疫复合物介导以系统性小血管炎为主要病变的变态反应性疾病。其发病机制尚未明确。国内外研究认为HSP患儿体液免疫功能异常,T 细胞功能紊乱和多种促炎症因子失调,而导致免疫复合物通过激活补体而发挥作用[4]。因肾脏有强大的贮备能力,在炎症反应和免疫损伤的早期,难以发现肾脏损害,错过治疗的最佳时期。近几年临床研究重点探讨如何预防肾脏受损和早期判断肾脏受损的实验室指标[5]。
肾脏是人体内合成EGF 的重要器官之一。EGF 在调节肾脏细胞增殖和促进肾小管损伤后修复方面发挥重要作用。可以作为判断肾小球及肾小管损伤的指标之一。目前发现EGF是肾脏远端单位、膀胱上皮和输尿管的保护性因子,能够不同程度上维持泌尿系统上皮细胞的完整性。通过检测EGF,判断肾脏功能,间接地判断肾小管的修复程度。尿EGF主要来自于肾脏,可以通过对血清和尿的EGF测定反映肾脏损伤情况[6]。
本研究表明,病例组较健康对照组,HSPN 组较非HSPN组血EGF mRNA 均明显升高。病例组较健康对照组血、尿EGF明显升高,且病例组恢复期较急性期明显降低。病例组较肺炎对照组血、尿EGF降低。HSP肾脏损害的病理改变以肾小球系膜增生为主,EGF 持续高水平表达可刺激肾小球系膜细胞不断增殖,说明HSP早期尿EGF 水平即可出现升高,且随着病情的进展,患儿尿EGF水平也随之不断增加,进而导致临床症状的出现,这与国内研究一致[7]。检测EGF 具有较高的临床价值,可对患者肾脏水平进行判断,为HSP肾脏损害的临床诊断提供了理论依据。
PAF-AH 是一种具有多种生物学活性的内源性磷脂类介质,在炎症、变态反应、血小板功能等方面具有重要作用,是血管系统及炎症系统中的细胞间调节分子。收缩平滑肌,增加血管通透性,另外还可以活化嗜酸性粒细胞,促其在炎症部位聚集。因此PAF-AH 启动的信号调节或失调都可以导致疾病发生[8]。研究报道[9],我国普通人群中PAF-AH基因突变与HSP的发生无关,但HSPN 患儿的PAF-AH 基因突变与HSP肾脏损害的发生密切相关,具有GT 和TT 型基因患者发生HSPN 的概率增大。
本研究表明,病例组较健康对照组、HSPN 组较非HSPN组血PAF-AH mRNA 均升高。病例组较健康对照组血PAFAH 明显升高,且病例组恢复期较急性期明显降低。病例组较肺炎对照组血PAF-AH 明显升高。这与研究[10]结论相符。PAF-AH 参与了HSP的发病过程,并且与肾脏损害程度呈正相关。PAF-AH 在患者肾小球的损伤上发挥了重要的作用,不仅直接损伤肾小球,降低了肾小球滤过率,而且还损伤血管内皮细胞,加重了肾脏局部的炎性反应,诱发了大量蛋白尿,从而加快了肾小球的硬化[11]。故本课题此次通过检测血EGF、PAF-AH 和尿EGF分别在HSP中的表达明显升高,血EGF、PAF-AH 及尿EGF参与了HSP的发病过程。从而为HSP肾脏损害的临床诊断提供了相关依据,具有临床早期诊断的意义。具体实验室指标还需要扩大样本进一步深入研究。
[1] 中华医学会儿科学分会肾脏病学组.小儿肾小球疾病的临床分类、诊断及治疗[J].中华儿科杂志,2001,39(12):746-749.
[2] 干毅,李祥丽,王会凤,等.早期肾活检在尿检正常型儿童紫癜性肾炎中的临床意义[J].第三军医大学学报,2011,33(15):1647-1648.
[3] 胡亚美,江载芳.诸福棠实用儿科学[M].7版.北京:人民卫生出版社,2002:688-690.
[4] 卢莉敏,崔晓.大剂量环磷酰胺联合甲基泼尼龙冲击治疗过敏性紫癜性肾炎的疗效分析[J].中国社区医师·医学专 业,2012,18(14):186-189.
[5] Qin W,Hongya W,Yongjing C,et al.Increased OX40and soluble OX40ligands in children with Henoch-Schonlein purpura:association with renal involvement[J].Pediatr Allergy Immuuol,2011,22(1Pt 1):54-59.
[6] 张慧玉,田玲,王兰英,等.肾积水尿EGF、MCP-1水平的检测及意义[J].第三军医大学学报,2009,31(12):1227-1229.
[7] 马洪,李旭良,魏光辉,等.尿微量清蛋白、β2微球蛋白及尿表皮生长因子与儿童过敏性紫癜早期肾损伤的相关性研究[J].临床荟萃,2013,11(11):1259-1260.
[8] Howard KM,Abdel-Al M,Ditmyer M,et al.Lipopolysaccharide and platelet-activating factor stimulate expression of platelet-activating factoracetylhydrolase via distinct signaling pathways[J].Inflamn Res,2011,60(8):735-744.
[9] 逯玲.血小板活化指标在重症感染患者监测中的意义[J].医学信息,2011,24(6):136.
[10] 刘静,陆彪.血小板活化因子乙酰水解酶与过敏性紫癜肾脏损害的关联性[J].实用儿科临床杂志,2012,27(5):331-333.
[11] 欧俊,尹友生,韦家智,等.IgA 肾病患者外周血PAF 及PAF-AH 的变化及其意义[J].中国现代医学杂志,2013,3(7):42-45.

