失重对大鼠肾上腺髓质激素分泌及m iRNA-375表达的影响
温丽君,吴继华,宋淑军,王艳茹,刘俊丽,司少艳,崔彦,张建中,周金莲
机体在失重或模拟失重环境下可出现心血管脱适应症[1],主要表现为心动过速、血压下降甚至晕厥。研究表明,失重或模拟失重条件下的心血管脱适应与机体血液循环中肾上腺髓质激素的变化有关,但具体机制尚不明确[2]。肾上腺髓质激素主要包括多巴胺(dopam ine,DA)、去甲肾上腺素(norep inephrine,NE)和肾上腺素(epinephrine,E),机体处于安静状态时,髓质激素分泌量很少,而处于紧急情况时交感神经兴奋,髓质激素分泌可骤然增多,使神经兴奋,反应灵敏,供氧、供血增加,血糖升高,糖和脂肪分解加速,以供给更多的能量,提高机体的应激能力。酪氨酸羟化酶(tyrosine hyd roxy lase,TH)是肾上腺髓质激素合成过程中的限速酶,其活性对NE和E的合成起关键作用。文献报道航天员在航天飞行过程中血浆肾上腺髓质激素水平波动明显且不一致,其在模拟失重条件下的变化亦存在争议[3-5]。我们前期研究发现,m iRNA-375在肾上腺髓质中表达,而在皮质中不表达。因此,本研究探讨模拟失重条件下大鼠血浆肾上腺髓质激素、TH及m iRNA-375表达变化特点,探讨其m iRNA-375表达对肾上腺髓质激素合成与分泌的影响及相关机制。
1 材料与方法
1.1 实验动物与分组 SPF级W istar成年雄性大鼠56只,体重280~350g,购自中国北京华阜康生物科技股份有限公司。饲养条件为人工控制22±2℃,12h昼夜光照,自由进食饮水。适应饲养1周后将大鼠随机分为0h(正常对照组)、6h、12h、1d、3d、5d、7d组(n=8)。采用Morey-Holton尾悬吊法[6]建立模拟失重动物模型,所有操作经医院动物伦理委员会批准后进行。实验步骤参照相关文献报道[7]。实验前后测量体重。除6、12h组外,其余各组选择在9:00am取材。利用眼球摘除法取血标本,摘取肾上腺,剥除脂肪,测重,左侧肾上腺置于1.5m l EP管中–80℃冰箱保存,右侧肾上腺置于pH 7.4多聚甲醛中固定,常规石蜡包埋。
1.2 大鼠血浆肾上腺髓质激素测定 大鼠悬吊结束后,采用10%水合氯醛行腹腔麻醉,利用眼球摘除法取血,置于含20μl 10% EDTA的灭菌EP管中,室温静置30m in,3500r/m in离心10m in,收集上层血浆,–20℃冰箱保存,利用放射免疫分析法测定血浆肾上腺髓质激素含量,所有操作按说明书进行。
1.3 免疫组化检测肾上腺髓质TH蛋白表达 肾上腺石蜡包埋切片后,采用SABC法行免疫组化检测。具体步骤如下:切片脱蜡,高温抗原修复,灭活内源性过氧化物酶,羊血清封闭非特异性抗原,加TH一抗(以PBS为对照),4℃孵育过夜,加二抗GAR-B(生物素标记的山羊抗兔IgG)室温孵育3h,加SP-HR室温孵育2h,DAB试剂盒显色,脱水封固,显微镜下观察并照相。TH阳性为胞质着色,DAB染色为棕黄色或棕褐色。
1.4 Western blotting检测肾上腺髓质TH蛋白表达水平 取冻存肾上腺,加入200μl蛋白裂解液,冰上研磨至糊状,反复冻融6次,每次2m in,4℃条件下12 000r/m in离心60m in,取上清,按BCA蛋白浓度测定试剂盒说明书测其浓度并分装,–80℃保存。SDS-PAGE凝胶电泳,采用半干法将蛋白质转移至PVDF膜,用脱脂奶粉封闭液封闭2h,稀释抗体,室温下与膜孵育2h,TBST快速洗膜6次,稀释二抗并与膜孵育2h,再次用TBST快速洗涤膜6次,AP试剂盒显色并照相。
1.5 RT-PCR检测肾上腺髓质TH m RNA和m iRNA-375表达 根据Gen Bank设计引物序列如下。TH上游引物5'-CCTCCTTGTCTCGGGCTGTA-3',下游引物5'-GGCGAGCACAGTAATCACCTTC-3';GAPDH上游引物5'-GGTTGTCTCCTGCGACTTCA-3',下游引物5'-GGGTGGTCCAGGGTTTCTTA-3';m iRNA-375上游引物5'-AGTGTCGTCAGAAAGAACGAACGGC-3',下游引物5'-CTCAACTGGTGCGTGGAGTC-3';U6上游引物5'-CTCGCTTCGGCAGCACA-3',下游引物5'-AACGCTTCACGAATTTGCGT-3'。m iRNA反转录引物序列:m iRNA-375-RT:CTCAACTGGTGTCGTG GAGTCGGCAATTCAATTCAGTTGAGAGCGCACT;U6-RT:AACGCTTCACGAATTTGCGT。引物由生工生物工程(上海)有限公司合成。提取组织RNA反转录为cDNA,RT-PCR反应体系为15μl,上、下游引物分别为0.3μl。PCR反应条件为95℃ 30s,95℃5s,60℃ 34s,40个循环。反应结束后记录Ct值,根据熔解曲线判断所提取产物的纯度并计算TH和m iRNA-375的相对表达水平。
1.6 统计学处理 采用SPSS 17.0软件进行统计分析,所有数据采用±s表示,正态分布及方差齐性检验后,多个样本比较采用单因素方差分析,多个均数之间两两比较采用LSD-t检验或SNK-q检验,P<0.05为差异有统计学意义。
2 结 果
2.1 血浆肾上腺髓质激素水平测定 尾悬吊模拟失重条件下,大鼠血浆肾上腺髓质激素含量波动明显,6~12h出现一过性下降,随后急剧升高,3d形成峰值,之后呈下降趋势,7d时接近正常对照组水平。E和NE变化趋势基本一致,但前者反应超前。尾悬吊1~5d大鼠E含量及尾悬吊3~5d大鼠的NE含量显著升高,与正常对照(尾悬吊0h)之间的差异具有统计学意义(P<0.05)。DA的波动幅度相对较小,仅3d组的含量与正常对照组之间的差异有统计学意义(P<0.05,图1)。
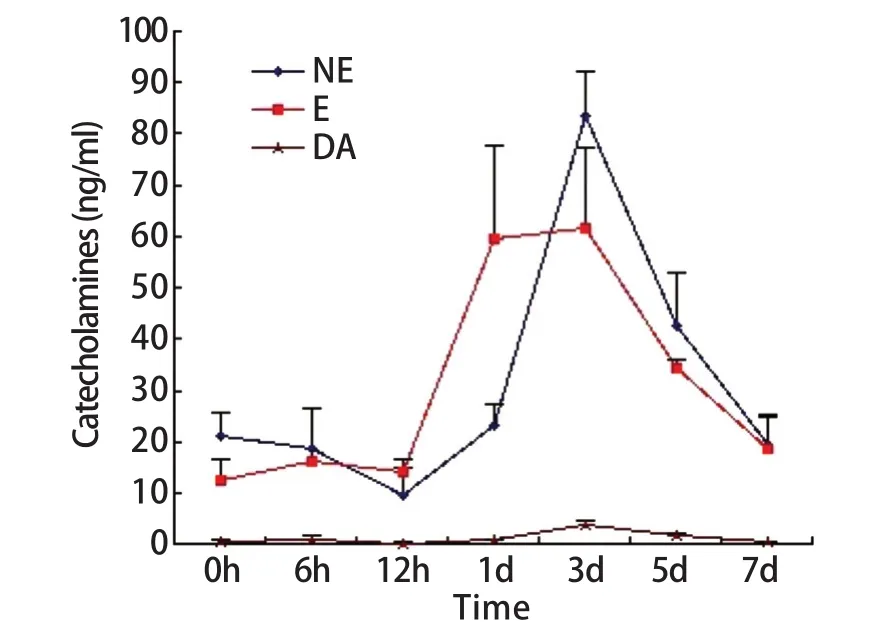
图1 模拟失重情况下各组大鼠血浆肾上腺髓质激素含量变化Fig.1 Effect of sim u la ted nu ll g ravity on p lasm a m edu lliad renal ho rm one of rats
2.2 免疫组化染色观察TH蛋白表达 TH蛋白阳性表达胞质呈棕褐色。正常对照组大鼠肾上腺髓质胞质染色为阳性(图2A、2B),6h~1d各组大鼠肾上腺髓质胞质染色加深(图2C、2D),3d组染色最强(图2E、2F),7d组染色逐渐恢复。阴性对照组肾上腺髓质和皮质的胞核及胞质均未见着色(图2G、2H)。
2.3 大鼠肾上腺髓质TH m RNA和蛋白表达RT-PCR检测结果显示,各组大鼠肾上腺组织TH m RNA表达波动明显,6h时呈现一过性下降,随后即上升,1d到达峰值,与正常对照组比较差异有统计学意义(P<0.05),之后呈下降趋势,5d时形成谷值,与正常对照组比较差异有统计学意义(P<0.05),7d时又有所升高。Western b lotting检测结果显示,3d时TH蛋白表达水平与对照组比较显著升高(P<0.05),其余各组蛋白表达水平与对照组比较差异无统计学意义(P>0.05)。TH m RNA和蛋白表达趋势一致,但TH蛋白表达强度相对滞后(图3)。
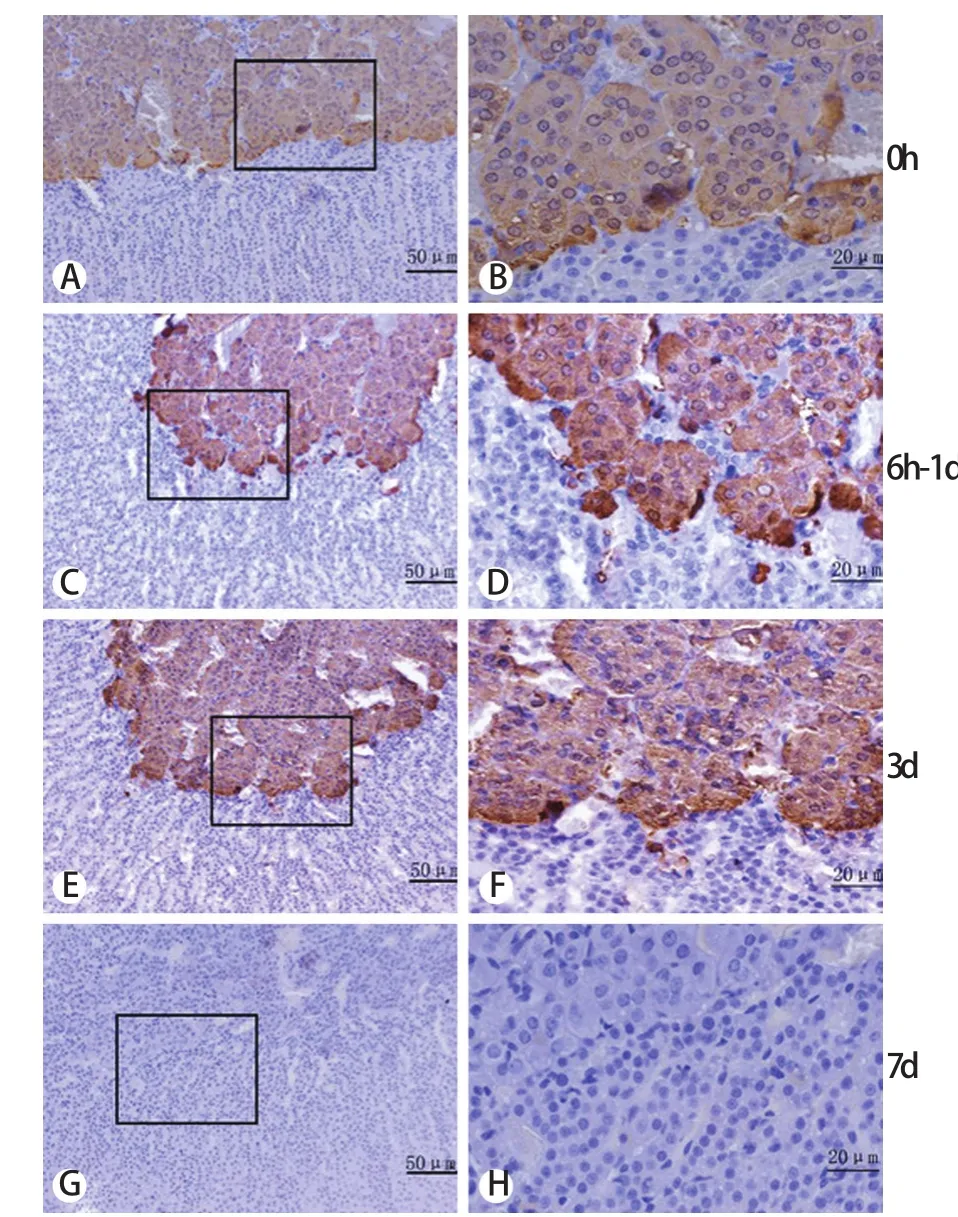
图2 免疫组化染色观察模拟失重大鼠肾上腺髓质内TH蛋白表达(DAB)Fig.2 Exp ression of TH p rotein in ad renal m edulla of rats under simulated null gravity (Immunohistochem istry staining,DAB)
2.4 大鼠肾上腺髓质m iRNA-375表达 各组大鼠肾上腺髓质m iRNA-375表达水平波动明显,表现为尾悬吊早期(6h)呈一过性显著升高,与正常对照组比较,差异有统计学意义(P<0.05);随后快速下降,12h、1d和3d时表达受到明显抑制,与正常对照组比较差异有统计学意义(P<0.05);5d时表达量增加,7d时显著升高(P<0.05,图4)。
3 讨 论
航天员飞行及模拟失重环境中肾上腺髓质功能的变化情况,已受到学术界的关注。相关研究证实,航天员在航天飞行过程中血浆及尿肾上腺髓质激素的检测结果波动明显且不一致,不仅不同飞行任务中航天员体内肾上腺髓质激素的量升降不一,同一飞行乘组中航天员之间的变化也不尽相同[5,8]。在人体模拟失重实验中,研究结果则较为一致,表现为血浆或尿中肾上腺髓质激素量下降[9-10]。
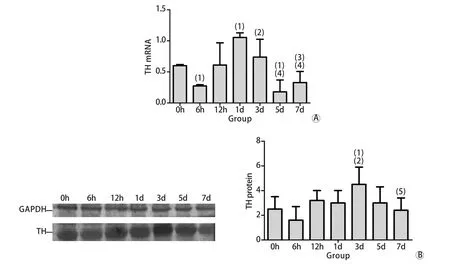
图3 各组大鼠肾上腺髓质TH m RNA(A)和蛋白(B)表达变化Fig. 3 Effect of sim u lated nu ll g ravity on m RNA (A) and p ro tein (B) exp ression of TH in ad renal m edu lla in rats(1)P<0.05 com pared with 0h (control group); (2)P<0.05 com pared with 6h group; (3)P<0.05 com pared with 12h group; (4)P<0.05 com pared with 1d g roup; (5)P<0.05 com pared with 3d g roup
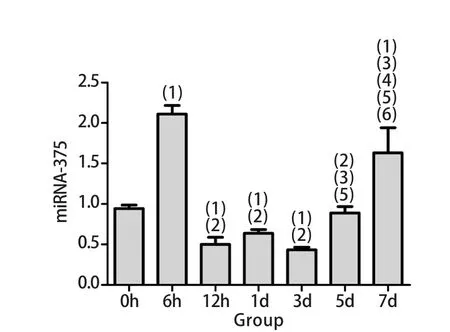
图4 大鼠肾上腺髓质m iRNA-375水平变化Fig.4 Changes of m iRNA-375 exp ression in adrenal medulla of rats(1)P<0.05 com pared with 0h (con tro l group); (2)P<0.05 com pared with 6h group; (3)P<0.05 com pared with 12h group; (4)P<0.05 com pared with 1d group; (5)P<0.05 com pared with 3d group;(5)P<0.05 com pared with 5d g roup
模拟失重条件下大鼠体内肾上腺髓质激素变化的研究结果存在争议。范全春等[11]研究发现,大鼠尾悬吊21d后血清中NE含量明显增加,Macho等[12]也有同样结论,这与陈杰等[13]报道长期尾悬吊大鼠血浆中NE含量明显下降矛盾,可能与实验设计、环境、时相、检测方法等的不同有关。我们的研究结果显示,大鼠血浆中NE、E水平在尾悬吊早期呈现一过性下降,随后急剧升高,3d时达高峰,之后下降,至7d时接近正常对照组水平。这种明显的波动,首先可能与大鼠姿势改变、体液重新分配、头部及上肢血液瞬间增加、刺激心肺压力感受器进而导致交感神经活性暂时受到抑制有关;伴随持续的失重应激状态,机体交感神经活性的一过性抑制解除后,肾上腺髓质细胞活性和肾上腺髓质激素的合成及分泌迅速增加;一旦机体从整体到各系统尤其心血管系统对失重环境逐渐适应后,神经内分泌系统包括肾上腺髓质激素的合成和分泌变化则趋向稳定,这种变化符合机体的正常应激反应过程。
Le lkes等[14]研究发现,SD大鼠搭载太空飞船STS-54飞行6h后,其髓质中肾上腺髓质激素下降的同时伴随TH表达水平的降低,但多巴胺β-羟化酶(dopam ine β hyd roxylase,DBH)及苯乙醇胺N-甲基转移酶(phenylethanolam ine N-m ethyltransferase,PNM T)水平无明显改变。本实验结果表明,大鼠血浆TH m RNA及蛋白在实验过程中波动明显,二者之间及与NE和E的变化趋势基本一致,进一步说明模拟失重早期血浆肾上腺髓质激素的一过性下降和随后的明显升高以及后期的变化趋缓均受到TH的严密调控。
m iRNA-375最初发现于胰腺β细胞[15],随后研究表明其在神经系统、消化系统、呼吸系统、生殖系统、循环系统等组织中均有表达,并通过不同的靶基因抑制下游网状细胞信号转导通路而发挥作用,尤其与肿瘤发生发展关系密切[16]。在机体多系统组织的增殖和分化过程中也有重要作用,包括影响脂肪细胞分化、神经突分化、软骨祖细胞迁移、肺泡上皮细胞转化等[17-20]。早先有研究发现,m iRNA-375的下游靶基因包括14-4-3、SP1、ERK1/2等,而行使信号网络枢纽的14-3-3信号蛋白可与TH蛋白相互作用并增强其活性,促进肾上腺髓质激素的合成[21-22],但m iRNA-375在肾上腺的表达及作用目前尚未见文献报道。
失重应激状态及适应过程中肾上腺髓质激素的合成、分泌和TH调节有待深入探讨。随着对m iRNA广泛作用的认识,结合我们前期实验研究中偶然发现m iRNA-375在肾上腺髓质中存在的特殊表达情况,本实验检测模拟失重条件下大鼠肾上腺髓质中m iRNA-375的表达变化,结果发现实验大鼠肾上腺髓质m iRNA-375表达水平波动明显,表现为尾悬吊早期(6h)呈一过性显著升高,随后受到迅速而明显抑制,在较低水平波动,至实验第5d时表达量增加,7d时显著升高,其变化趋势与TH表达水平呈现明显负相关。结合文献和本实验结果,我们推测肾上腺髓质中m iRNA-375在基因水平上通过14-3-3信号蛋白调节(抑制)TH蛋白的转录和表达,进而影响肾上腺髓质中肾上腺髓质激素的合成和分泌,其作用机制有待进一步深入研究。
[1] Li ZP, Guo B, Li XO, et al. Changes in Cox-2 exp ression in gastric antrum m uscle layer, serum som atostatin and vasoactive intestinal pep tide levels in sim ulated weightlessness in rats[J].Med J Chin PLA, 2014, 39(5): 383-387. [李正鹏, 郭彪, 李晓鸥, 等. 模拟失重大鼠胃窦肌层Cox-2表达和血清SS及VIP水平的变化[J]. 解放军医学杂志, 2014, 39(5): 383-387.]
[2] Wang YC, Wu J, Sun QX, et al. Advances in research about effects of weightlessness or sim ulated weightlessness on cardiovascular system[J]. Acad J Chin PLA Med Sch, 2013, 34(1): 17-19. [王永春, 伍静, 孙庆喜, 等. 失重或模拟失重对机体心血管系统影响的研究进展[J]. 解放军医学院学报, 2013, 34(1): 17-19.]
[3] Blaber E, MarØal H, Burns BP. Bioastronautics: the influence of m icrogravity on astronaut health[J]. Astrobiology, 2010, 10(5):463-473.
[4] No rsk P. Blood p ressu re regu lation IV: adap tive responses to w eightlessness[J]. Eur J App l Physiol, 2014, 114(3): 481-497.
[5] Macho L, Koska J, Ksinantova L, et al. The response of endocrine system to stress loads during space flight in hum an sub ject[J].Ad v Space Res, 2003, 31(6): 1605-1610.
[6] Morey-Holten ER, Globus RK. The hind lim b un loading rodent m odel: technical aspects[J]. J App l Physio l, 2002, 92(4): 1367-1377.
[7] Wang CY, Wu JH, Song SJ, et al. Exp ression of hypoxia inducing factor-1α in rats' ovary under tail-suspension weightlessness[J].Med J Chin PLA, 2012, 37(9): 868-871. [王春雨, 吴继华, 宋淑军, 等. 尾悬吊模拟失重大鼠卵巢组织中缺氧诱导因子-1α表达变化[J]. 解放军医学杂志, 2012, 37(9): 868-871.]
[8] Leach CS, Ram baut PC. Endocrine responses in long-duration m anned space fligh t[J]. Acta Astronautica, 1975, 2(1-2): 115-127.
[9] Sam el A, Wegm ann HM, Velvoda M. Response of the circadian system to 6 deg rees head-dow n tilt bed rest[J]. Aviat Space Environ Med, 1993, 64(1): 50-54.
[10] Zhang GM, Liu KJ. The effect of head low bed (HDT-6) on the secrete rhythm icity of hum an urine catecho lam ine[J]. Space Med Med Eng, 1989, 2(2): 129-132. [张光明, 刘克嘉. 头低位卧床(HDT-6b)对人尿儿茶酚胺分泌昼夜节律的影响[J]. 航天医学与医学工程, 1989, 2(2): 129-132.]
[11] Fan QC, Li YZ, Gao JY, et al. The regulation of space yangxin pill to sim u late cardiovascular system of sim ulated weightlessness rats[J]. Manned Space Fligh t, 2013, 19(1): 64-70. [范全春, 李勇枝, 高建义, 等. 太空养心丸对模拟失重大鼠心血管系统的调节作用[J]. 载人航空, 2013, 19(1): 64-70.]
[12] Macho L, Kvetnansky R, Vigas M, et al. Effect of space flights on p lasm a horm one levels in m an and in experim ental anim al[J].Acta Astronau tica, 1991, 23:117-121.
[13] Chen J, Zhang LF, Ma J. A p re lim inary study on p lasm a catecholam ine responses in rats after 3-m onth tail-suspension[J].Chin J Aerosp Med, 1994, 5(1): 31-33. [陈杰, 张立藩, 马进. 长期尾部悬吊大鼠血浆儿茶酚胺反应性的初步研究[J]. 中华航空医学杂志, 1994, 5(1): 31-33.]
[14] Lelkes PI, Ram os EM, Chick DM, et al. M icrogravity decreases tyrosine hyd roxylase exp ression in rat ad renal[J]. FASEB J,1994, 8(14): 1177-1182.
[15] Poy MN, Eliasson L, Kru tzfeld t J, et al. A pancreatic isletspecific m icroRNA regulates insulin secretion[J]. Nature, 2004,432(11): 226-230.
[16] Yan JW, Lin JS, He XX. The Em erging ro le of m iR-375 in cancer[J]. In t J Cancer, 2014, 135(5): 1011-1108.
[17] Ling HY, Wen GB, Feng SD, et al. M icroRNA-375 p rom otes 3T3-L1 adipocyte differentiation through m odulation of extracellular signal-regu lated kinase signalling[J]. Clin Exp Pharm aco l Physio l, 2011, 38(4): 239-246.
[18] Abdelm ohsen K, Hutchison ER, Lee EK, et al. m iR-375 inhibits differentiation of neurites by lowering HuD levels[J]. Mo l Cell Bio l, 2010, 30(17): 4197-4210.
[19] Song J, Kim D, Chun CH, et al. M icroRNA-375, a new regulator of cadherin-7, supp resses the m ig ration of chond rogen ic p rogen ito rs[J]. Ce ll Signa l, 2013, 25(3): 698-706.
[20] Wang Y, Huang CQ, Reddy Chintagari N, et al. m iR-375 regulates rat alveo lar ep ithelial cell trans-differentiation by inhibiting Wn t/β-catenin pathw ay[J]. Nucleic Acids Res, 2013, 41(6):3833-3844.
[21] Roth D, Burgoyne RD. Stim ulation of catecholam ine secretion from ad renal ch rom affin cells by 14-3-3 p ro teins is due to reorganisation of the cortical actin netw ork[J]. FEBS Lett, 1995,374(1): 77-81.
[22] Skjevik AA, M ilen i M, Baum ann A, et al. The N-term ina l sequence of tyrosine hydroxylase is a con form ationally versatile m otif that binds 14-3-3 p roteinsand m em branes[J]. J Mol Biol,2014, 426(1): 150-168.

