莽草酸合成途径元件库:现状与未来
刘 畅 刘双江(中国科学院微生物研究所,北京 100101)
莽草酸合成途径元件库:现状与未来
刘 畅 刘双江
(中国科学院微生物研究所,北京 100101)
刘畅,中国科学院微生物研究所助理研究员,主要从事Corynebacterium glutamicum莽草酸途径的合成生物学研究。
E-mail:liuc@im.ac.cn
莽草酸广泛存在于自然界中,并在医药、工业、能源领域具有应用价值。莽草酸途径是植物和微生物合成芳香族氨基酸等重要化合物的关键代谢路径。近年来,合成生物学技术迅速发展,莽草酸途径已经成为合成生物学重要的研究对象。生物元件的挖掘、搜集、表征及标准化等一直是合成生物学研究的重要方向之一,文章从传统元件的收集与整理、标准化元件库的批量发掘与表征、通用元件的列举,以及元件组装模块的实例分析等方面讨论了莽草酸途经元件库相关研究工作的现状与未来发展前景。

作者简介
刘双江,博士,中国科学院微生物研究所研究员,中国科学院百人计划、国家杰出青年基金获得者。主要研究领域是环境微生物学,以Corynebacterium glutamicum和Comamonas testorsteroni为材料,围绕芳烃类化合物的代谢途径、代谢调控、趋化机制等方面,开展系统的生理和遗传学研究;近年来围绕Corynebacterium glutamicum莽草酸途径开展合成生物学研究。
E-mail:liusj@im.ac.cn
合成生物学研究中,复杂生命系统的各个单元可以通过分析、归纳、解耦等方法被抽象化为基本的元件,这些基本元件可以进一步改造为标准化生物元件,继而研究人员可以像工程师一样以生物学知识和控制理论为基础,精确设计具有特定功能的标准化生物模块或生物系统,通过工程学的方法进行模块组装和系统构建。在这个层层递进的组装过程中,生物元件作为最基础的“零件”,是合成生物学发展的基材。生物元件的挖掘、搜集、表征及标准化等一直是合成生物学研究的重要方向之一 。2003年,首个标准生物元件注册库(http:// parts.igem.org/Main_Page)在麻省理工学院建立,这为全世界科学家提供了一个交流、开发和存储生物元件的开放平台。通常所说的生物元件包括:①调控元件,如启动子(promoter)、核糖体结合位点(RBS)、终止子(terminator)等;②催化元件,即编码具有催化功能基因的DNA序列;③结构元件,如骨架蛋白和生物大分子支架(scaffold);④操控和感应元件,如基因开关(genetic switch)、生物传感器(sensor)、绝缘子(insulator)等。这些生物元件多数来源于自然界,通过筛选、分离、表征和标准化后获得;亦有一部分是通过对天然生物元件进行合理设计、改造与修饰后获得的新功能的元件。当前,大量基因组数据库的注释与功能验证等数据信息,加之各种生物信息学软件的出现与发展,都为生物元件的收集、鉴定与构建提供了丰富的信息资源;元基因组技术的兴起与发展又使得从占微生物资源99%以上的未知微生物中挖掘更多的生物元件成为可能 。

图1 莽草酸途径化学反应过程
王钱福, 严兴, 魏维, 等. 生物元件的挖掘、改造与标准化. 生命科学, 2011, 23(9): 860-868.
Bochkov D V, Sysolyatin S V, Kalashnikov A I, et al. Shikimic acid: review of its analytical, isolation, and purification techniques from plant and microbial sources. Journal of Chemical Biology, 2012, 5(1): 5-17.
Knop D R, Draths K M, Chandran S S, et al. Hydroaromatic equilibration during biosynthesis of shikimic acid. Journal of the American Chemical Society, 2001, 123(42): 10173-10182.
Herrmann K M. The shikimate pathway: early steps in the biosynthesis of aromatic compounds. The Plant Cell, 1995, 7(7): 907.
Liu D F, Ai G M, Zheng Q X, et al. Metabolic flux responses to genetic modification for shikimic acid production by Bacillus subtilis strains. Microbial Cell Factories, 2014, 13: 40.
Krämer M, Bongaerts J, Bovenberg R, et al. Metabolic engineering for microbial production of shikimic acid. Metabolic Engineering, 2003, 5(4): 277-283.
Shirai M, Miyata R, Sasaki S, et al. Microorganism belonging to the genus Citrobacter and process for producing shikimic acid. European Patent, 2001, 1(092,766).
Zhang B, Zhou N, Liu Y M, et al. Ribosome binding site libraries and pathway modules for shikimic acid synthesis with Corynebacterium glutamicum. Microbial Cell Factories, 2015, 14(1): 71.
Draths K M, Knop D R, Frost J W. Shikimic acid and quinic acid: replacing isolation from plant sources with recombinant microbial biocatalysis. Journal of the American Chemical Society, 1999, 121(7): 1603-1604.
1 莽草酸及莽草酸途径
莽草酸(shikimic acid)在自然界中广泛存在,其不仅是植物和微生物生物合成芳香族氨基酸、叶酸、泛醌、维生素K2等芳香族化合物的重要前体,还是工业生产吲哚衍生物、手性药物(如抗病毒药达菲)的关键合成原料,具有重要的应用价值。 莽草酸的生产主要有植物提取、化学合成和微生物发酵等方法,近几十年来随着生物技术的进步,利用微生物发酵生产莽草酸的方法以环保、高产、不受原材料限制等优势,成为工业化生产莽草酸的优势技术 。莽草酸途径(shikimate pathway)是普遍存在于植物和微生物体内的一条联系中心碳代谢途径与芳香族氨基酸等重要化合物体内合成的关键合成路径 ,由于莽草酸是第一个被鉴定出来的合成途径中间体,故此得名。 如图1所示,该途径起始物是磷酸戊糖途径的中间物4-磷酸赤藓糖(E4P)和糖酵解的中间物磷酸烯醇式丙酮酸(PEP),经4步反应,生成莽草酸,之后经3步反应生成分支酸,分支酸经不同的酶催化,分别生成酪氨酸、色氨酸、苯丙氨酸3种芳香族氨基酸 。莽草酸途经长期备受关注,原因在于一方面莽草酸途径是植物和微生物体内生成芳香族氨基酸及多种功能化合物的重要途径,对该途径进行研究与改造对于芳香族氨基酸及其他衍生物的工业生产具有实际价值;另一方面是由于该途径不存在于人和高等动物体内,因此莽草酸途经常被作为抗菌除草的药物靶点,指导新药的设计与开发。目前,对莽草酸途经的研究主要集中在:①对莽草酸途经中各酶进行发掘鉴定、晶体结构解析以及动力学参数表征等;②针对不同的莽草酸途径酶的结构特点理性设计抗菌除草等药物的特异性靶点;③以提高特定化合物产量(如莽草酸、芳香族氨基酸及其他芳香族化合物等)为目标,对该途径中的催化与调控系统进行理性设计与定向改造。
Iomantas Y A V, Abalakina E G, Polanuer B M, et al. Method for producing shikimic acid, 2002, United State Patent.
Kikuchi Y, Tsujimoto K, Kurahashi O. Mutational analysis of the feedback sites of phenylalanine-sensitive 3-deoxy-d-arabinoheptulosonate-7-phosphate synthase of Escherichia coli. Applied and Environmental Microbiology, 1997, 63: 761-762.
Zou Y K, Zhou J Z, Sun X, et al. Construction of shikimic acid-producing engineered Escherichia coli strains based on ptsHIcrr mutants. Microbiology China, 2011, 38(8): 1186-1192.
Whipp M, Camakaris H, Pittard A. Cloning and analysis of the shiA gene, which encodes the shikimate transport system of Escherichia coli K-12. Gene, 1998, 209(1): 185-192.
Michel G, Roszak A W, Sauve V, et al. Structures of shikimate dehydrogenase AroE and its Paralog YdiB. A common structural framework for different activities. Journal of Biological Chemistry, 2003, 278(21): 19463-19472.
Chandran S S, Yi J, Draths K M, et al. Phosphoenolpyruvate availability and the biosynthesis of shikimic acid. Biotechnology Progress, 2003, 19(3): 808-814.
Arcuri H A, Zafalon G F D, Marucci E A, et al. SKPDB: a structural database of shikimate pathway enzymes. BMC Bioinformatics, 2010, 11(1):12.
Liu C, Liu Y M, Sun Q L, et al. Unraveling the kinetic diversity of microbial 3-dehydroquinate dehydratases of shikimate pathway. AMB Express, 2015, 5(1): 7.
2 莽草酸途径的工程化改造
目前,对莽草酸生产菌株的工程化改造主要集中在大肠杆菌(E. coli)中进行,也有一部分工作是以枯草芽孢杆菌(B. subtilis) 、弗式柠檬酸杆菌(C. freudii) 和谷氨酸帮杆菌(C. glutamicum)为工程菌株进行的。改造的策略主要以基因工程、代谢工程等为手段,通过理性化的设计进行改造,包括以下几个方面:①阻断莽草酸合成的下游途径以积累莽草酸 ;②发现莽草酸合成的限速步骤,并对相应的酶进行过表达,或进行改造以解除反馈抑制 ;③通过对中心碳代谢途径进行改造,或者通过对PTS系统进行敲除和替代 ,使转酮酶基因tktA和磷酸烯醇式丙酮酸合酶ppsA基因过表达以增加莽草酸代谢途径起始底物PEP和E4P的供应量 ;④针对大肠杆菌莽草酸合成过程中会产生较多的副产物如奎尼酸、脱氢莽草酸等,研究者做了诸多尝试将副产物产量降到最低,以保证莽草酸的纯度,包括失活莽草酸转运蛋白ShiA,失活奎尼酸/莽草酸脱氢酶YdiB,以及利用分解代谢物阻遏原理通过增加葡萄糖浓度或使用葡萄糖类似物来抑制副产物的生成 。其中,莽草酸产量提高最为显著的工作是由Chandran等 在2003年完成的,研究人员通过在莽草酸激酶(AroL和AroK)和3-磷酸甘油酸脱氢酶缺失的E. coli工程菌RB791 serA::aroB aroL::Tn10 aroK::CmR的基础上,对PTS转运系统相关基因ptsH 和ptsI进行失活,得到E. coli SP1.1pts,并将运动发酵单胞菌(Zymomonas mobilis)来源的ATP 依赖的葡萄糖转运体系(包括一个葡萄糖协助基因glf和一个葡糖激酶基因glk)在该菌株中进行异源表达以绕过葡萄糖转运过程中对PEP的消耗,此外又过表达编码解除反馈抑制的DAHP合酶基因aroFfbr和编码转酮醇酶I基因tktA。在进行补料分批培养时,莽草酸浓度提升到84g/L,产率达到0.33mol / mol葡萄糖。这是目前在实验室水平利用工程菌生产莽草酸的最高产量,在之后的数年里,利用传统代谢工程手段对莽草酸合成途径进行改造与优化似乎进入了一个瓶颈期。究其原因,笔者认为一方面对如大肠杆菌这类成熟的工程菌的莽草酸途径的研究已经十分透彻,对它的改造与修饰工作也几近极致;另一方面,对于这个普遍存在于细菌中的莽草酸合成途径的催化或者调控元件,缺乏广泛的了解与深层次的挖掘,这大大局限了对该途径进行改造与优化时的思路与策略,特别是在异源途径组装与精细调控方面,取得的进展十分有限。如Knop等将烟草(Nicotiana tabacum)来源的编码奎尼酸脱水酶和莽草酸脱氢酶双功能酶的aroDE基因在大肠杆菌中异源表达以替代大肠杆菌中的aroD和aroE时,并没有如预期有效避免副产物3-脱氢莽草酸的积累。对莽草酸合成途径中各类生物元件缺乏全局性的认识是现阶段工程改造莽草酸合成途径所面临的一个壁垒,近年来合成生物学技术的发展,又让研究者看到了将生物合成莽草酸向前继续发展下去的美好前景。
Lou C, Stanton B, Chen Y J, et al. Ribozymebased insulator parts buffer synthetic circuits from genetic context. Nature Biotechnology, 2012, 30(11): 1137-1142.
Gardner T S, Cantor C R, Collins J J. Construction of a genetic toggle switch in Escherichia coli. Nature, 2000, 403(6767): 339-342.
Elowitz M B, Leibler S. A synthetic oscillatory network of transcriptional regulators. Nature, 2000, 403(6767): 335-338.
Moser F, Horwitz A, Chen J, et al. Genetic sensor for strong methylating compounds. ACS Synthetic Biology, 2013, 2(10): 614-624.
Binder S, Siedler S, Marienhagen J, et al. Recombineering in Corynebacterium glutamicum combined with optical nanosensors: a general strategy for fast producer strain generation. Nucleic Acids Research, 2013:312.
Zhang B, Jiang C Y, Liu Y M, et al. Engineering of a hybrid route to enhance shikimic acid production in Corynebacterium glutamicum. Biotechnology Letters, 2015: 1-8.
Smolke C D. Building outside of the box: iGEM and the BioBricks Foundation. Nature Biotechnology, 2009, 27(12): 1099-1102.
Anderson J C, Dueber J E, Leguia M, et al. BglBricks: a flexible standard for biological part assembly. Journal of Biological Engineering, 2010, 4(1): 1-12.
3 莽草酸途径的元件库
3.1 酶元件库的发掘与收集
如前所述,生物元件是合成生物学的基材。 2010年,Arcuri等 建立了一个专门收集莽草酸途径酶的数据库SKPDB (http://lsbzix.rc.unesp.br/skpdb),该数据库构建之初主要是对莽草酸途径各酶结构特征进行整理,用于设计以莽草酸途径为标靶的药物分子。其记录的各酶元件数据不仅包含酶蛋白分子三维结构,还包括了它们的序列信息、功能以及文献等,为各元件作为合成生物学研究对象,提供了良好的信息基础。目前,该数据库已经包含了8902个莽草酸途径酶的信息,这一数字还在不断增加。2014年,李文均等基于1249个原核生物基因组数据预测的蛋白质组为基础,以Pfam数据库中莽草酸途径中的各酶蛋白质结构域为模版,利用HMMERv.3.0软件对所有可能的参与莽草酸途径的酶进行了挖掘,并在提取了所有在结构域上与已知各酶相似的蛋白氨基酸序列后,又进一步对其中可能包含的非目标序列进行了剔除,获得不同类群微生物中莽草酸合成途径相关酶元件数量,结果如表1所示 ,这为今后可能的莽草酸途径元件库的构建与元件选取奠定了很好的基础。同时,此次序列搜集工作不仅对传统莽草酸途径的全部7个酶进行了充分挖掘,还对古菌中莽草酸合成的另一条变异途径(DKFP途径)所涉及的酶进行一个全面的分析比对,为莽草酸途径的异源组装与改造提供了更为丰富的、潜在的生物元件资源。第一个真正意义上的莽草酸合成途径元件库的构建,由刘双江实验室于近期完成。刘畅等 以来自大肠杆菌的I型脱氢奎尼酸脱水酶和来自谷氨酸棒杆菌的II型脱氢奎尼酸脱水酶的氨基酸序列为模板,以E-value≤10E-10为过滤条件,在NCBI基因组数据库中,对所有原核微生物中可能的脱氢奎尼酸脱水酶进行序列BLAST搜索,得到462个脱氢奎尼酸脱水酶的同源序列。之后,参考文献报道、分类代表性、菌株特殊性、I型与II型酶分布比例等因素,从这462个同源序列中选择了38个基因进行了序列优化和Biobricks标准化处理,并进行了全基因合成。38个人工合成的基因进一步在大肠杆菌中进行异源表达纯化和高通量的酶动力学参数测定,这是第一次批量的对莽草酸合成途径中的催化单元进行系统的表征,构建了第一个脱氢奎尼酸脱水酶标准元件库(统一的限制性酶切接口进行了动力学表征)。如表2所示,该元件库具有很好的动力学多样性,元件酶活参数数值宽阔,为后续利用元件库进行莽草酸合成途径异源组装与替换提供了多种选择可能性 。
除了上述系统鉴定莽草酸合成途径生物元件外,在早期工作中被单独鉴定并表征的各个酶及其同源基因,经过收集整理、统一描述、标准化之后,也可成为酶元件,充实相应酶的元件库。BRENDA网站(http://www. brenda-enzymes.org/index.php)作为一个开放的平台,收集整理了各种已经报道的酶蛋白的各项参数与特性,为元件库的挖掘提供了便捷的条件。表3列出了一部分文献报道过的莽草酸途径酶的信息。生物元件除了从自然界中筛选分离的元件外,通过对生物元件进行合理设计、改造与修饰而获得的人工元件也是酶元件库重要的组成部分。从合成生物学的角度来看,在以往的对莽草酸途径工程化改造的过程中,研究者们就已经开发和构建了很多这样的酶元件,只要在后
表1 莽草酸合成途径中各酶在原核微生物中的分布情况
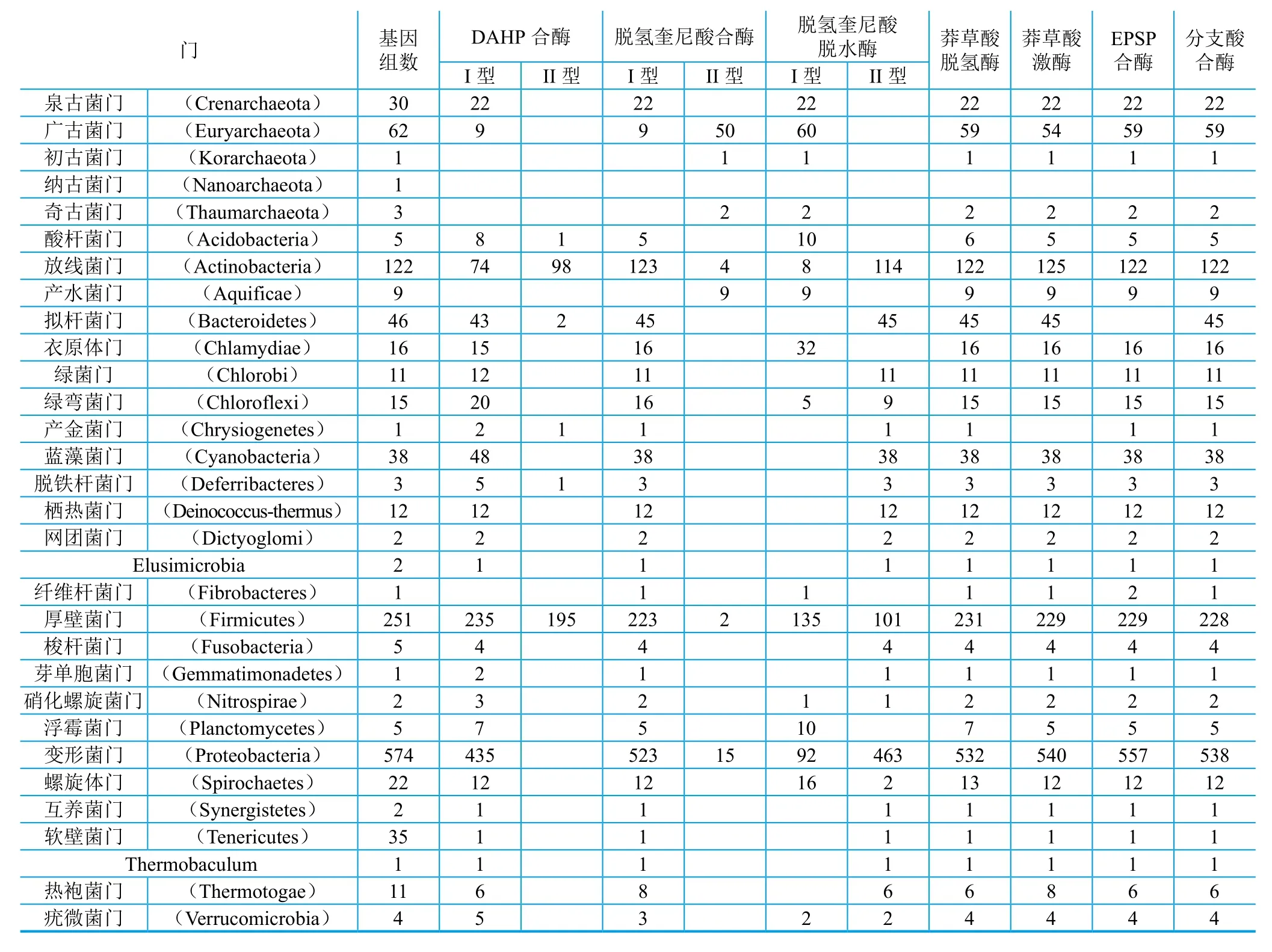
表1 莽草酸合成途径中各酶在原核微生物中的分布情况
?
莽草酸合成途径元件库:现状与未来续的工作中对这些元件进行标准化处理,并将这些元件进行系统地整理,就可以构建一个功能多样、应用价值巨大的酶元件库。如作为莽草酸合成途径起始步骤的催化酶DAHP合酶,其在大肠杆菌中有3个同工酶,分别是AroF、AroG和AroH,3种酶分别受3种芳香族氨基酸的反馈抑制,该酶也因此成为莽草酸合成的一个关键限速步骤。考虑到这点,研究者们通过突变株筛选、氨基酸序列截短以及关键位点突变等方法先后获得了多个解除反馈抑制的DAHP合酶,其中有些酶不仅解除了反馈抑制,酶活参数也得到了一定的提高。同时,利用这些酶元件对莽草酸途径进行改造时,莽草酸产量也得到了有效的提高。这也再一次说明,设计与改造更多有实际应用价值的酶元件,并在合成生物学的准则下构建标准化的元件库,是将合成生物学更好地应用于莽草酸生物合成改造中一个行之有效的策略。
图2 谷氨酸棒杆菌中定向设计aroB、aroD、aroE 和 aroG 4个基因的RBS元件库及相对荧光强度

图2 谷氨酸棒杆菌中定向设计aroB、aroD、aroE 和 aroG 4个基因的RBS元件库及相对荧光强度
?
表2 脱氢奎尼酸脱水酶元件库中各元件的动力学参数
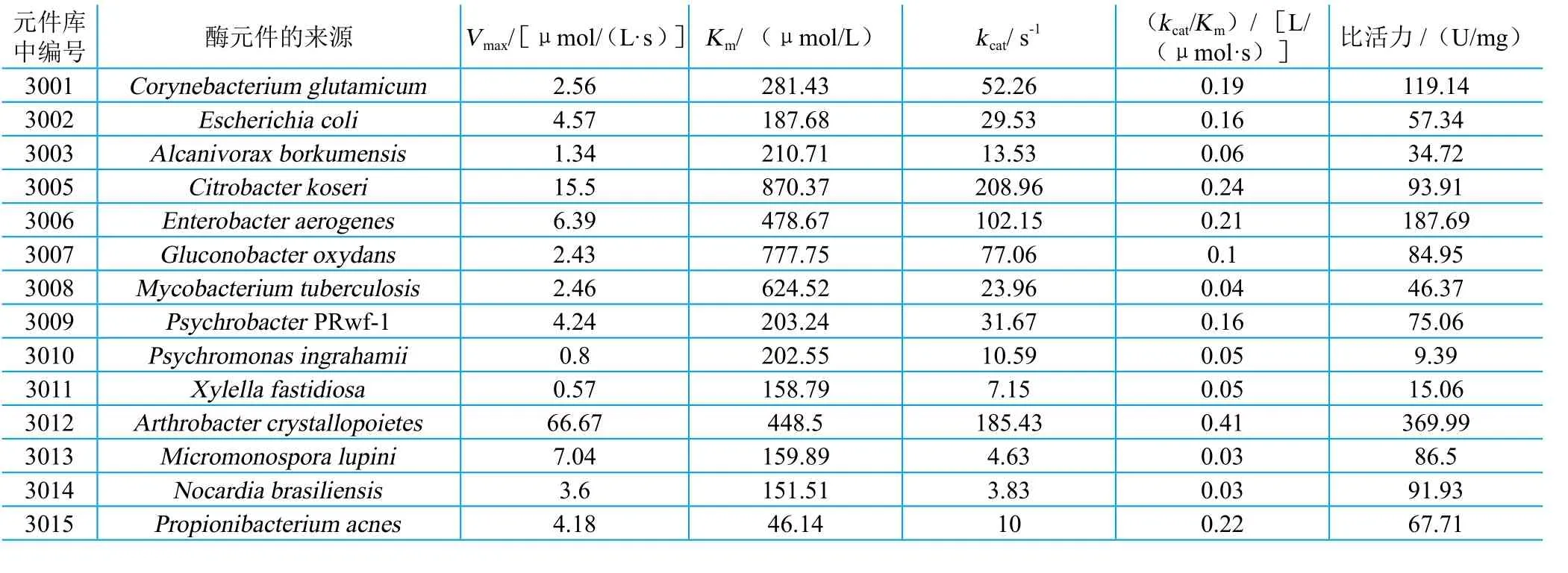
表2 脱氢奎尼酸脱水酶元件库中各元件的动力学参数
?
表2 脱氢奎尼酸脱水酶元件库中各元件的动力学参数(续表)
?
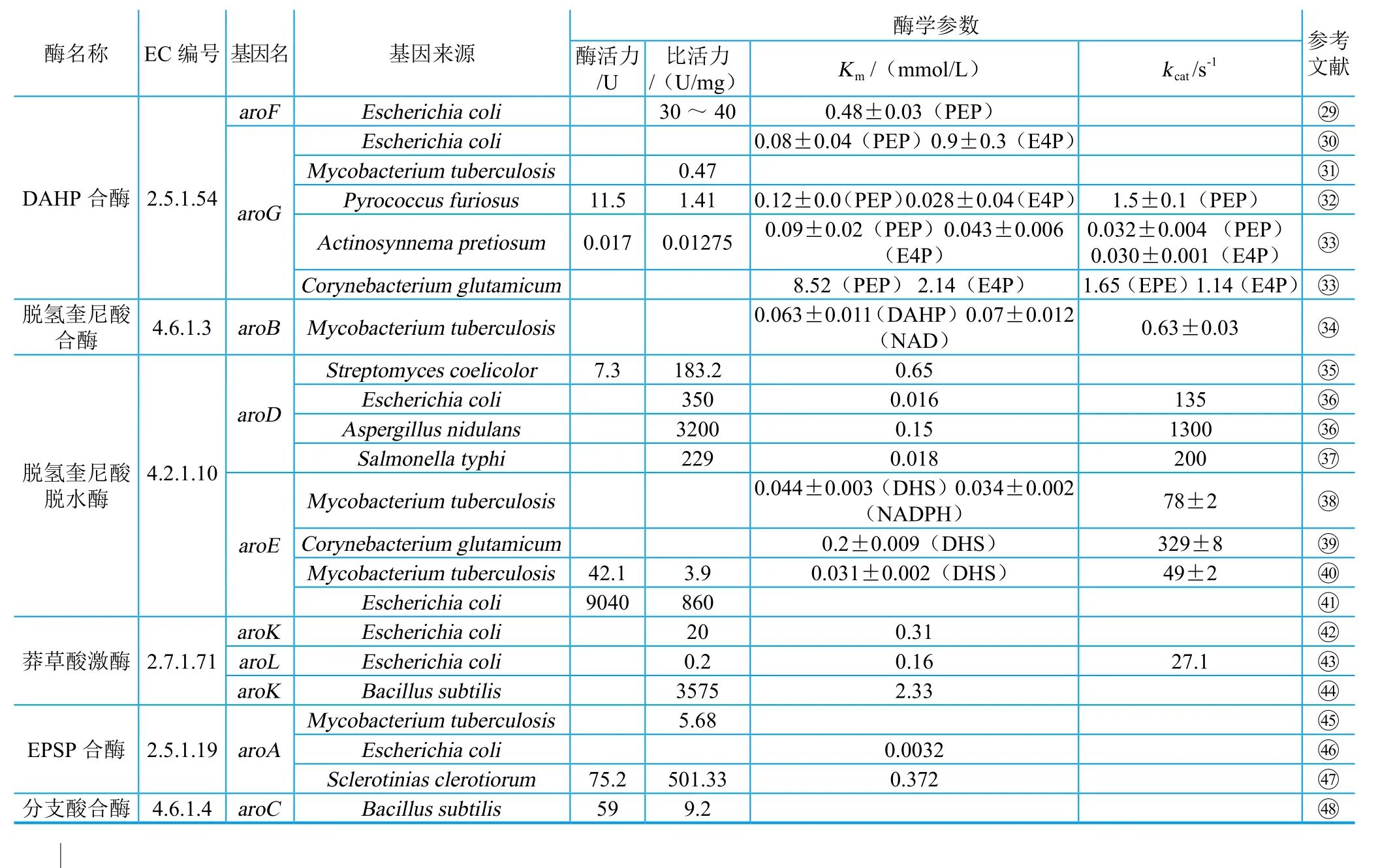
表3 部分报道过的参与莽草酸途径的酶元件的酶活参数
3.2 调控元件库的发掘与收集
在合成生物学研究中,对设计的模块或者系统进行定量调控是主要内容,因而调控元件的挖掘与收集就变得十分重要。刘双江实验室的张博等 在对谷氨酸棒杆菌中的莽草酸合成途径进行合成生物学改造时,发现不同的RBS对酶的产量与表达效率有很大影响,为此构建了针对莽草酸合成中的4个酶AroG、AroB、AroD和AroE的4个RBS元件库。元件库的构建是以谷氨酸棒杆菌中RBS保守序列AAAGG为基础,对其后面的6~9个碱基进行了饱和突变,所得突变RBS序列被分别联入包含AroB-eGFP、AroD-eGFP、AroE-eGFP 和AroG-eGFP融合蛋白的质粒中并转入菌株中进行筛选,并分别随机挑取了146、52、59和54克隆进行测序和荧光强度的测定,最终获得了容量分别为33、43、49和42的aroB、aroD、aroE和aroG的RBS元件库(图2),这些元件库具有很好的多样性,其中的RBS强弱变化显著。通过对这4个元件库中的RBS进行不同的组合优化,最终通过替换4个酶的RBS元件,将谷氨酸棒杆菌中的莽草酸产量提高了近54倍。
除RBS外,启动子作为十分重要的调控元件,一直是对代谢途径进行改造时首要考虑的目标。然而与蛋白质及RBS这些元件不同的是,启动子元件往往是底盘细胞特异性的,而非代谢途经特异性的。也就是说,不同的底盘细胞,同样的启动子序列其强度可能会存在较大差异;相同的底盘细胞,同一个启动子在不同的代谢途径中发挥作用时,其强度差别一般不大。值得庆幸的是,在利用微生物进行莽草酸合成的研究中,所应用的底盘细胞目前主要集中在大肠杆菌、枯草芽孢杆菌、弗式柠檬酸杆菌和谷氨酸帮杆菌。这些菌株在科学研究和工业生产中均有着重要地位,各个菌株都已经有很多的启动子元件库存在 ,这些元件库多数可以直接应用于莽草酸途径的改造。
Yim S S, An S J, Kang M, et al. Isolation of fully synthetic promoters for high‐level gene expression in Corynebacterium glutamicum. Biotechnology and Bioengineering, 2013, 110(11): 2959-2969.
Tan Y Z, Xu D Q, Li Y, et al. Construction of a novel sacB-based system for marker-free gene deletion in Corynebacterium glutamicum. Plasmid, 2012, 67(1): 44-52.
Zhi X Y, Yao J C, Li H W, et al. Genomewide identification, domain architectures and phylogenetic analysis provide new insights into the early evolution of shikimate pathway in prokaryotes. Molecular Phylogenetics and Evolution, 2014, 75: 154-164.
Jossek R, Bongaerts J, Sprenger G A. Characterization of a new feedback-resistant 3-deoxy-D-arabino-heptulosonate 7-phosphate synthase AroF of Escherichia coli. FEMS Microbiology Letters, 2001, 202(1): 145-148.
Ramilo C A, Evans J N. Overexpression, purification, and characterization of tyrosinesensitive 3-deoxy-D-arabino-heptulosonic acid 7-phosphate synthase from Escherichia coli. Protein Expression and Purification, 1997, 9(2):253-261.
Rizzi C, Frazzon J, Ely F, et al. DAHP synthase from Mycobacterium tuberculosis H37Rv: cloning, expression, and purification of functional enzyme. Protein Expression and Purification, 2005, 40(1): 23-30.
Schofield L R, Patchett M L, Parker E J. Expression, purification, and characterization of 3-deoxy-D-arabino-heptulosonate 7-phosphate synthase from Pyrococcus furiosus. Protein Expression and Purification, 2004, 34(1): 17-27.
3.3 通用元件
在上述提到的RBS元件库构建中,娄春波等 于2012年利用了一个基于核酶设计的绝缘子RiboJ,用于消除上游调控序列对蛋白翻译的影响,从而达到定量调控的目的。事实上,类似的通用性很强的合成生物学调控元件还有很多,如基因开关 、基因振荡器 、生物传感器等 ,这些元件大多已经在其他代谢途径改造中得到了广泛的应用,鉴于它们都具有很好的通用性及适配性,因此均可以看成调控元件库的一部分,在未来可以广泛地应用到对莽草酸途径改造的设计中。
Ma N, Wei L, Fan Y, et al. Heterologous expression and characterization of soluble recombinant 3-deoxy-d-arabino-heptulosonate-7-phosphate synthase from Actinosynnema pretiosum ssp. auranticum ATCC31565 through co-expression with Chaperones in Escherichia coli. Protein Expression and Purification, 2012, 82(2): 263-269.
Mendonca J D D, Adachi O, Rosado L A, et al. Kinetic mechanism determination and analysis of metal requirement of dehydroquinate synthase from Mycobacterium tuberculosis H37Rv: an essential step in the function-based rational design of anti-TB drugs. Molecular Biosystems, 2011, 7(1): 119-128.
White P J, Young J, Hunter I S, et al. The purification and characterization of 3-dehydroquinase from Streptomyces-Coelicolor. Biochemical Journal, 1990, 265(3): 735-738.
Kleanthous C, Deka R, Davis K, et al. A comparison of the enzymological and biophysical properties of two distinct classes of dehydroquinase enzymes. Biochemical Journal, 1992, 282 (3): 687-695.
Moore J D, Hawkins A R, Charles I G, et al. Characterization of the type-I dehydroquinase from Salmonella typhi. Biochemical Journal, 1993, 295: 277-285.
Fonseca I O, Silva R G, Fernandes C L, et al. Kinetic and chemical mechanisms of shikimate dehydrogenase from Mycobacterium tuberculosis. Archives of Biochemistry and Biophysics, 2007, 457(2): 123-133.
Kubota T, Tanaka Y, Hiraga K, et al. Characterization of shikimate dehydrogenase homologues of Corynebacterium glutamicum. Applied Microbiology and Biotechnology, 2013, 97(18): 8139-8149.
Fonseca I O, Magalhães M L, Oliveira J S, et al. Functional shikimate dehydrogenase from Mycobacterium tuberculosis H37Rv: purification and characterization. Protein Expression and Purification, 2006, 46(2): 429-437.
4 莽草酸合成途径模块的组装
生物元件库的建设是为了莽草酸途径模块化的组装与应用,生物元件库的应用效果,还需要在实践中进行检验。上述提到的生产莽草酸的大肠杆菌工程菌改造工作已经证实了利用解除反馈抑制的AroF替换原途径中的DAHP合酶可以显著提高莽草酸产量;而将运动发酵单胞菌来源的非PEP依赖的葡萄糖转运体系异源替换大肠杆菌中的PTS系统也可以显著提高莽草酸产量。最近,张博等首次将古菌中特有的莽草酸合成变异途径DKFP(6-deoxy-5-ketofructose 1-phosphate)组装入谷氨酸棒杆菌中,实现了莽草酸产量的提高 。该研究以DKFP合酶、ADTH合酶和DHQ合酶的氨基酸序列为模板,在基因组数据库中进行比对并筛选了多个同源序列,之后通过逐个表征各个元件并根据异源表达情况和酶学特性对酶元件进行筛选,最终确定以1个丙酮醛合酶、2个DKFP合酶(MMP0293、MM0714)、2个ADTH合酶(MMP0686、MM1271)和1个DHQ合酶(MM1272)为元件,以排列组合的方式组装了3组异源模块。将这3组模块分别装配入敲除莽草酸激酶的谷氨酸棒杆菌底盘细胞后,确定效果最好的一组异源途径,对莽草酸的产量提高了59%。该工作虽然对最终莽草酸产量提高效果并非十分显著,但这是首次完全以合成生物学的思路出发,通过一系列的途经设计、元件筛选与模块组装流程,完成了对莽草酸合成途径的异源装配,这在一定程度上验证了异源模块组装对莽草酸途径改造的潜在应用价值与前景。
5 总结与展望
目前,莽草酸途径的合成生物学研究还处于起步阶段,对元件库的搜集与挖掘工作也做得不够完善与精细,标准化程度不高,对元件库的挖掘工作多数还停留在对其生物信息学数据的收集与分析,只有很少的一部分进行了系统的实验表征,而这其中又有相当一部分元件并没有进行标准化的设计,这大大限制了元件的应用性。目前,应用较广泛的标准化方法有Biobricks、Bglbricks等,通用的标准化方法对设计与开发新元件库至关重要。
此外,为了使莽草酸途径元件库得到更好的利用,还需要解决一些元件适配性和通用性的问题。如不同底盘细胞在翻译过程中存在密码子偏好性等情况,不加以注意,同一个蛋白元件在不同的底盘细胞中所表现出来的特性可能会有较大差别。刘畅等 为了增加脱氢奎尼酸脱水酶元件库的适配性,在元件序列进行全化学合成之前,对碱基序列进行了密码子的优化,去除了在大肠杆菌和谷氨酸棒杆菌中存在的稀有密码子,这样该元件库就可以同时应用于大肠杆菌和谷氨酸棒杆菌中的莽草酸途径组装。同时,如果想进一步提高该元件库的通用性,就需要考虑更多底盘细胞的密码子偏好性情况,这在一定程度上也增加了元件库构建的难度。此外,一些调控元件也存在专一性较强或底盘细胞适配性低等问题,影响了元件库的应用范围。除少数一些通用功能元器件(绝缘子、基因开关等),多数调控元件(启动子、RBS、5'-UTR等)的适配性与通用性受较多因素的限制。如RBS的强度与其后面所调控的基因序列密切相关 ,而同样的启动子在不同的底盘细胞中,强度也可能有较大的差别 。再如一些在大肠杆菌中广泛使用的强启动子,在谷氨酸棒杆菌中的强度则低很多;而在谷氨酸棒杆菌中构建的启动子元件库,其在大肠杆菌中的强度则要低几个数量级 。要想解决这些问题,首先需要对这些调控元件的作用原理与调控机理有更透彻更深入的了解,并且需要通过在实际科研中不断探索、设计与改造以获得更多通用性更好的调控元件。总之,不断提高元件库的适配性和通用性是未来莽草酸元件库设计与构建研究中的热点和难点。对于催化元件动力学特性在模块构建和代谢网络的适配性,目前还鲜有研究报道。
莽草酸途径的合成生物学研究的最终目的是以工程学的思想设计莽草酸合成途径,以大量的元件库为基材,通过功能模块进行组装与底盘细胞优化,最终获得高效生产莽草酸或其相关衍生物的微生物菌株。在这一过程中,元件库的构建是基础,如何利用这些元件库进行功能模块的组装与优化则是一项更为复杂和艰巨的任务。目前虽然已经有一些模块组装的工作被报道,但不管是在模块的精确组装与定量控制方面,还是在莽草酸产量的提高方面,与既定目标还相距甚远,还有许多工作有待完成 。
[本研究获得国家重点基础研究发展计划(“973计划”)项目“新功能人造生物器件的构建与集成”(2012CB721100)子课题“功能模块的集成与测试”(2012CB721104)的资助。]
Anton I A, Coggins J R. Sequencing and overexpression of the Escherichia Coli aroE gene encoding shikimate dehydrogenase. Biochemical Journal, 1988, 249(2): 319-326.
Lobner-Olesen A, Marinus M G. Identification of the gene (aroK) encoding shikimic acid kinase I of Escherichia coli. Journal of Bacteriology, 1992, 174(2): 525-529.
Millar G, Lewendon A, Hunter M G, et al. The cloning and expression of the aroL gene from Escherichia coli K12. Purification and complete amino acid sequence of shikimate Kinase , the aroL gene product. Biochemical Journal, 1986, 237(2): 427-437.
Huang L, Montoya L A, Nester E W. Purification and characterization of shikimate kinase enzyme activity in Bacillus subtilis. Journal of Biological Chemistry, 1975, 250(19): 7675-7681.
Oliveira J S, Pinto C A, Basso L A, et al. Cloning and overexpression in soluble form of functional shikimate kinase and 5-enolpyruvylshikimate 3-phosphate synthase enzymes from Mycobacterium tuberculosis. Protein Expression and Purification, 2001, 22(3): 430-435.
Gruys K J, Walker M C, Sikorski J A. Substrate synergism and the steady-state kinetic reaction mechanism for EPSP synthase from Escherichia coli. Biochemistry, 1992, 31(24): 5534-5544.
Yu H Y, Yang Q, Li L. Characterization of 5-enolpyruvylshikimate-3-phosphate synthase from Sclerotinias clerotiorum. Chinese Journal of Biochemistry and Molecular Biology, 2006, 22: 301-307.
Hasan N, Nester E W. Purification and properties of chorismate synthase from Bacillus subtilis. The Journal of Biological Chemistry, 1978, 253(14): 4993-4998.
■ 反馈服务编码 W3614
10.3969/j.issn.1674-0319.2015.06.003


