中国早期食管癌筛查及内镜诊治专家共识意见(2014年,北京)*
中国早期食管癌筛查及内镜诊治专家共识意见(2014年,北京)*
中华医学会消化内镜学分会中国抗癌协会肿瘤内镜专业委员会

一、引言
食管癌(esophageal cancer, EC)是起源于食管黏膜上皮的恶性肿瘤,是临床常见的恶性肿瘤之一。在全球范围内,食管癌的发病率在恶性肿瘤中居第8位,死亡率居第6位[1]。我国是食管癌最高发的国家之一[2],每年食管癌新发病例超过22万例,死亡约20万例,提高我国食管癌诊疗水平是艰巨而紧迫的医学研究难题。
目前,90%以上的食管癌患者确诊时已进展至中晚期,生活质量低,总体5年生存率不足20%。而仅累及黏膜层和黏膜下浅层的早期食管癌通常经内镜下微创治疗即可根治,取得与外科手术相当的疗效[3],且具有创伤小、痛苦少、恢复快的优势,患者5年生存率可>95%[4]。“中国癌症预防与控制规划纲要(2004-2010)”[5]明确指出,癌症的早期发现、早期诊断和早期治疗是降低死亡率、提高生存率的主要策略。在提高早期病变检出率和诊断率的基础上进行内镜下早期治疗,是改善食管癌患者预后、节约国家医疗资源、减轻家庭和社会负担的有效途径。
近年来,国际上关于食管癌的共识意见主要有美国国家综合癌症网络(National Comprehensive Cancer Network, NCCN)的“食管和食管胃连接处癌临床处理指南”[6]、欧洲肿瘤学会(European Society for Medical Oncology, ESMO)的“食管癌诊断、治疗和随访临床实践指南”[7]和日本食道学会(Japan Esophageal Society)的“食管癌诊断和治疗指南”[8]。为指导我国食管癌高发区筛查工作和规范食管癌的临床诊疗,国家卫生部先后颁布了“上消化道癌筛查及早诊早治技术方案”和“食管癌规范化诊治指南(试行)”[9],中国抗癌协会食管癌专业委员会在2013年出版了“食管癌规范化诊治指南”[10]。然而,目前我国仍缺乏针对早期食管癌筛查、内镜诊治等内容的共识意见,因此,中华医学会消化内镜学分会联合中国抗癌协会肿瘤内镜专业委员会,组织我国消化、内镜、外科、肿瘤、病理等多学科专家,共同制订了本共识意见。
二、定义和术语
1. 食管癌前疾病和癌前病变:食管癌前疾病(precancerous diseases)指与食管癌相关并有一定癌变率的良性疾病,包括慢性食管炎、Barrett食管、食管白斑症、食管憩室、贲门失弛缓症、反流性食管炎、各种原因导致的食管良性狭窄等。癌前病变(precancerous lesions)指已证实与食管癌发生密切相关的病理变化,食管鳞状上皮异型增生与鳞状细胞癌(以下简称鳞癌)发生密切相关,属鳞癌的癌前病变[11],Barrett食管相关异型增生则是腺癌的癌前病变[12-13]。
2. 上皮内瘤变和异型增生:世界卫生组织(WHO)肿瘤组织学分类(2000年第3版)将上皮内瘤变的概念引入胃肠道癌前病变和早期癌的诊断,拟代替异型增生(dysplasia)等名词[14]。低级别上皮内瘤变(low-grade intraepithelial neoplasia, LGIN)相当于轻、中度异型增生,高级别上皮内瘤变(high-grade intraepithelial neoplasia, HGIN)则相当于重度异型增生和原位癌。一项随访13.5年的队列研究[11]提示,食管鳞状上皮轻、中度异型增生癌变率分别为25%和50%左右,重度异型增生癌变率约为75%,故部分中国病理学家仍主张使用三级分类方法,将食管鳞癌的癌前病变分为轻、中、重度异型增生,建议病理报告中同时列出两种分级标准的诊断结论。异型增生与既往使用的术语不典型增生为同义词,处理原则相同。
3. Barrett食管:指食管下段的复层鳞状上皮被化生的单层柱状上皮所替代的一种病理现象,可伴有肠上皮化生[15]。
4. 表浅型食管癌(superficial esophageal can-cer):指局限于黏膜层和黏膜下层,有或无淋巴结转移的食管癌(T1a和T1b期食管癌)[16]。
5. 早期食管癌(early esophageal cancer):目前国内较为公认的定义指病灶局限于黏膜层和黏膜下层,不伴有淋巴结转移的食管癌。
6. 食管癌组织病理学分型:常见组织病理学类型为鳞癌和腺癌,鳞癌亚型包括基底细胞样鳞癌、疣状癌、梭形细胞鳞癌(肉瘤样癌)等;其他少见类型包括神经内分泌癌(小细胞癌、大细胞癌)、腺鳞癌、涎腺型癌(腺样囊性癌、黏液表皮样癌等来源于食管腺体)。鳞癌和腺癌根据其分化程度分为高分化、中分化和低分化[17]。
7. 整块切除(en bloc resection):病灶在内镜下被整块切除并获得单块标本。
8. 水平/垂直切缘阳性:内镜下切除的标本固定后每隔2~3 mm垂直切片,标本侧切缘有肿瘤细胞浸润为水平切缘阳性,基底切缘见肿瘤细胞浸润则称为垂直切缘阳性。
9. 完全切除(complete resection/R0 resection):切除标本的水平和垂直切缘均为阴性。
10. 治愈性切除(curative resection):切除标本的水平和垂直切缘均为阴性且无淋巴结转移风险。
11. 残留(residual):指术后6个月以内原切除部位以及周围1 cm内发现肿瘤病灶[18]。
12. 局部复发(local recurrence):指术后6个月以上原切除部位以及周围1 cm内发现肿瘤病灶[18]。
13. 同时性多原发食管癌(synchronous multiple esophageal cancers):指内镜治疗后12个月以内在原切除部位1 cm以外发现的新食管癌病灶,可能源自治疗时遗漏的微小癌灶[19]。
14. 异时性多原发食管癌(metachronous multiple esophageal cancers):指内镜治疗后超过12个月在原切除部位1 cm以外发现的新食管癌病灶[19]。
三、流行病学
据2014年世界癌症报告统计,食管癌发病率居恶性肿瘤的第8位,在2012年约有45.6万新发病例,占全球新发恶性肿瘤病例的3%;食管癌居世界癌症死因第6位,2012年死亡病例约40万,占全球癌症死亡人数的5%[1]。按伤残调整寿命年估计,世界食管癌负荷占所有恶性肿瘤负荷的5%,居恶性肿瘤负荷第8位[20]。非洲东部和南部以及东亚地区发病率最高,非洲中、西部以及中美洲则为低发地区[2]。世界范围内食管癌主要的病理类型为鳞癌和腺癌,鳞癌多位于食管中、上段,腺癌则多位于食管下段。食管癌高发区多属欠发达地区,鳞癌占90%以上;而在北美、西欧等发达国家,腺癌比例超过半数,且呈持续上升趋势[1]。
《中国肿瘤登记年报》2009年数据显示,在我国肿瘤登记地区,食管癌是继胃癌、结直肠癌和肝癌之后最常见的消化道肿瘤,发病率为22.14/10万,同期死亡率为16.77/10万,居恶性肿瘤死亡率的第4位[21]。我国食管癌病理学类型以鳞癌为主,比例超过90%。鉴于我国食管癌多为鳞癌,在本共识正文第四至第九部分中,如未特殊说明,食管癌均指食管鳞癌,只在第十部分对食管腺癌进行简要介绍。GLOBOCAN2012最新数据显示,我国食管鳞癌新发病例数约占世界新发鳞癌总数的53%,腺癌则占18%[22]。我国食管癌发病地区差异明显,高发区与周边相对低发区形成鲜明对比,构成我国食管癌最典型的流行病学特征。高发省份为河北、河南、山西、福建,其次为新疆、江苏、甘肃、安徽等[23]。食管癌最密集区域位于河北、河南、山西三省交界的太行山南侧,尤以磁县为著,在秦岭、大别山、川北、闽粤、苏北、新疆等地也有相对集中的高发区(图1~4)。男性食管癌发病率与死亡率均高于女性,男女比例接近2∶1[24],农村发病率与死亡率较城市约高1.7倍,年龄标化后两者差距超过2倍[21]。在食管癌高发区,患者发病和死亡年龄较非高发区提前10年左右。我国食管癌登记资料和全国第三次死因调查数据显示,近年来食管癌发病率和死亡率总体呈下降趋势[25-26],与国家在食管癌高发区持续推行人群筛查和针对特定危险因素进行干预有关。然而,某些地区食管癌筛查和早诊早治项目的推广力度还有待加强,同时诸如吸烟、饮酒、环境污染等新的危险因素影响日趋增长,食管癌发病率下降非常缓慢,防控形势依然严峻。目前,我国食管癌发病数和死亡数均约占世界同期数据的49%[2]。近期,我国发布了目前国内最大规模的肿瘤5年生存随访 数据,17个肿瘤登记地区超过1.6万例食管癌患者的年龄标化5年相对生存率仅为 20.9%, 男性为 19.9%,女性为23.6%,早期食管癌所占比例低是患者预后不良的重要原因[27]。按伤残调整寿命年计算,我国食管癌负荷沉重,约为世界平均水平的2倍[20]。

图1中国部分省市和地区男性食管癌发病率分布图(2009年)

图2中国部分省市和地区女性食管癌发病率分布图(2009年)
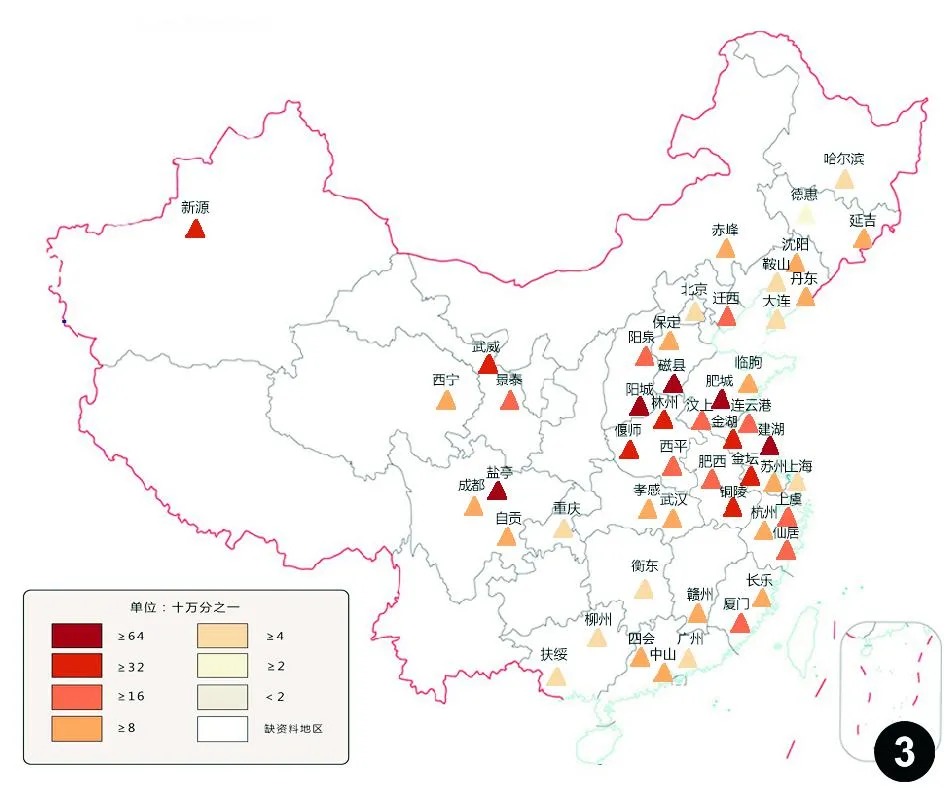
图3中国部分省市和地区男性食管癌死亡率分布图(2009年)

图4中国部分省市和地区女性食管癌死亡率分布图(2009年)
四、危险因素
食管癌的具体病因尚不明确,但有关其发病危险因素的研究已取得一定进展。目前认为食管癌的发生、发展是饮食和生活方式、人口学因素、环境与遗传因素、感染因素等若干因素协同作用的结果。
(一)食管癌的危险因素
1. 饮食和生活方式:食管癌的发病与饮食因素密切相关。吸烟、饮酒、口腔卫生差等不良生活方式也被认为与食管癌发病潜在相关。
(1)饮食因素:食物生产、加工和储存过程中均有可能受到真菌污染。研究[28]报道,我国食管癌高发区食物中存在严重的真菌污染,且多为不同菌株的混合污染。其作用机制包括产生促癌毒素[29-30]或促进食物中亚硝胺合成并与其协同致癌。腌制食品和红肉类与食管癌发生风险升高相关,高温食物、辛辣和油炸食品亦可增加食管癌发生风险[31-33]。
(2)吸烟和饮酒因素:吸烟、饮酒是食管鳞癌明确的危险因素。吸烟导致食管鳞癌的可能机制包括对食管细胞的基因毒性作用和长期吸烟所致的亚硝胺累积效应。戒烟可显著降低食管鳞癌的发生率[34]。重度饮酒者发生食管鳞癌的风险明显升高[35]。Meta分析显示,吸烟与饮酒可协同作用,进一步提高食管鳞癌的发生率[36]。
(3)口腔卫生因素:对我国食管癌高发区人群的调查发现,多数居民口腔卫生差,易发生龋齿或缺齿,口腔内细菌滋生,亚硝胺类物质含量较高,增加罹患食管鳞癌的风险[37]。此外,口腔卫生不良可与萎缩性胃炎协同作用,增加食管鳞癌的发生风险[38]。
2. 人口学因素:我国食管癌发病率随年龄增长而逐渐增加[39]。男性患者食管癌的诊断年龄早于女性患者[40]。2014年世界癌症报告数据提示,男性食管癌发病率和死亡率约为女性的2~4倍[1]。我国男性食管癌发病率和死亡率也高于女性[41],男女比例接近2∶1[24]。
3. 家族史和遗传易感性:我国食管癌高发区存在明显的家族聚集现象,可能与患者具有共同的遗传背景有关,也可能是由患者及其家属共同暴露于特定的环境因素所致[42]。国外研究尚未发现食管癌尤其是食管鳞癌有明显的家族聚集倾向[43]。食管鳞癌发生、发展的确切机制尚未阐明,可能与食管鳞癌患者部分染色体、基因异常有关。最新研究发现了多个食管鳞癌易感位点,这些位点的多态性与饮酒协同作用,直接影响食管鳞癌的发生[44]。
4. 感染因素:人类乳头瘤病毒(human papil-lomavirus, HPV)感染是一些食管癌高发区的重要致病因素,尤其是HPV-16与食管鳞癌发生呈正相关[45],HPV感染者罹患食管鳞癌的风险较普通人群升高近3倍[46]。
5. 其他因素:胃黏膜萎缩患者罹患食管鳞癌的风险较普通人群人高2倍[47]。头颈部和上呼吸道鳞癌与食管鳞癌同时或异时发生的概率分别为14%和3%[48],对头颈部癌患者常规行内镜筛查可提高食管癌早期诊断率[49]。贲门失弛缓症患者进展为食管鳞癌的风险是普通人群的16~33倍[50]。胼胝症患者食管鳞癌风险显著升高[51]。另外,1%~4%的食管癌患者有吞服酸、碱等导致的食管腐蚀性损伤病史[52]。
(二)食管癌的报警症状
食管癌可能的报警症状包括:胸骨后疼痛不适、进食通过缓慢并有滞留感或哽噎感、进行性吞咽困难、上腹部隐痛不适、消化道出血(呕血、黑便等)、消瘦等。我国台湾地区一项研究[53]显示,体质量减轻、消化道出血、吞咽困难和年龄>45岁与消化不良人群上消化道癌的发生密切相关。国内有学者对超过10万例的上消化道内镜数据进行分析,结果显示报警症状对该人群上消化道肿瘤的预测价值有限,仅吞咽困难症状有重要提示作用[54]。但出现吞咽困难症状时绝大多数肿瘤已进展至中晚期,因此在我国,报警症状并不能作为上消化道内镜检查必要性的决定因素。考虑我国内镜检查费用较低、普及率较高的国情,建议对有上消化道症状的患者及时行内镜检查以降低肿瘤漏诊率。
五、筛查
我国食管癌发病和死亡人数均居世界首位,二十世纪50年代以来,食管癌筛查和早诊早治一直受到国家卫生主管部门的重视。在食管癌高发区,食管癌筛查和早诊早治工作已初见成效。在非高发区,开展大规模人群普查并不符合我国国情,提高各级医疗机构肿瘤机会性筛查的检出率是现阶段较为可行的策略。
(一)筛查对象
根据我国国情、食管癌危险因素及其流行病学特征,符合下列①和②~⑥中任一项者应列为食管癌高危人群,建议作为筛查对象:①年龄>40岁;②来自食管癌高发区;③有上消化道症状;④有食管癌家族史;⑤患有食管癌前疾病或癌前病变;⑥具有其他食管癌高危因素(吸烟、重度饮酒、头颈部或呼吸道鳞癌等)。
(二)筛查方法
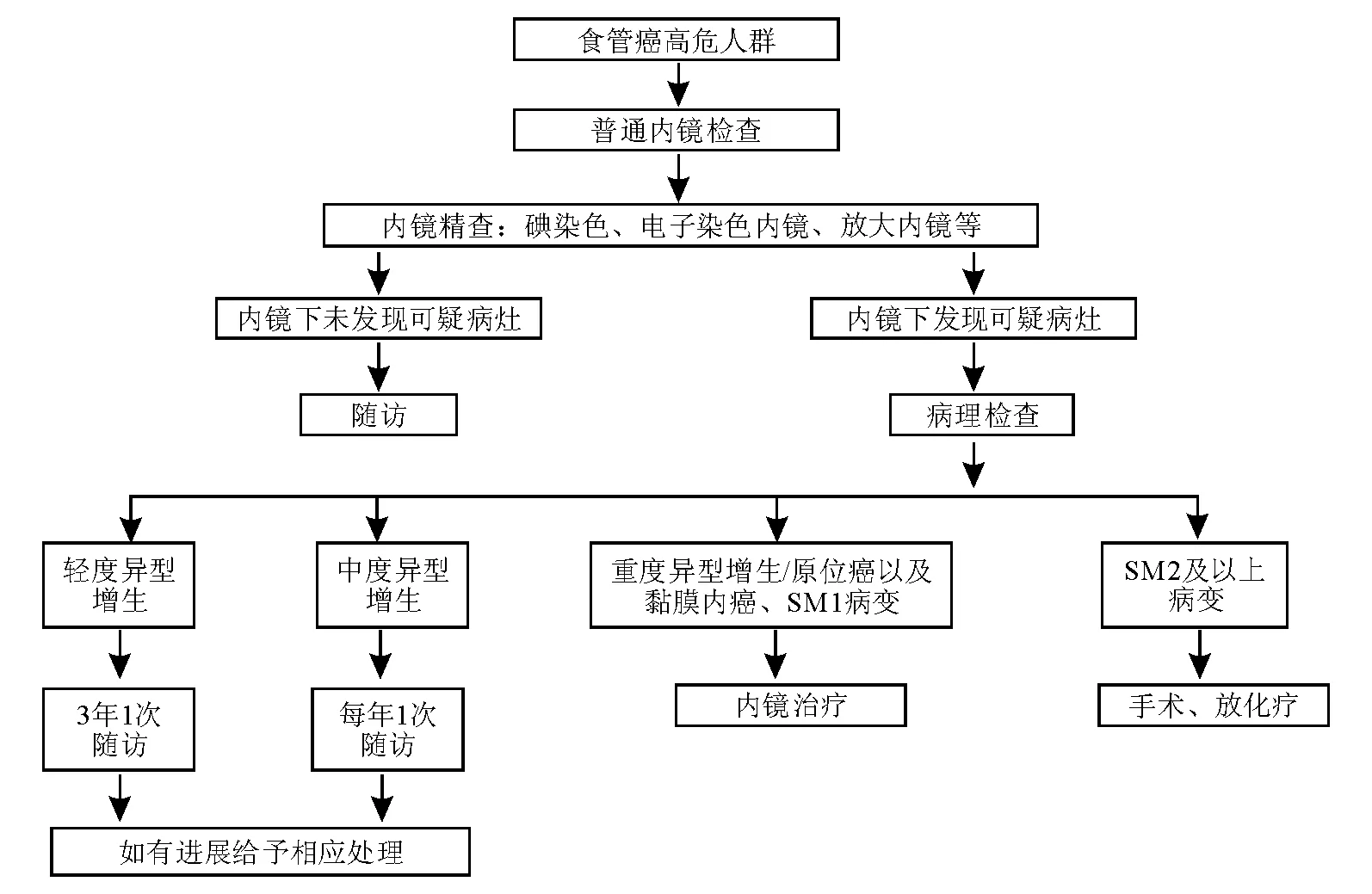
内镜和活检病理检查是目前诊断早期食管癌的金标准。内镜下可直观地观察食管黏膜改变,评估癌肿状态,拍摄或录制病变影像资料,并可通过染色、放大等方法评估病灶性质、部位、边界和范围,一步到位地完成筛查和早期诊断。内镜下食管黏膜碘染色加指示性活检的组合操作技术已成为我国现阶段最实用有效的筛查方法[55]。电子染色内镜等内镜新技术在早期食管癌筛查中的应用价值尚处于评估阶段,既往使用的食管拉网细胞学检查[56]、上消化道钡餐等筛查方法因诊断效能以及接受度等问题,已基本被淘汰,不作推荐。早期食管癌内镜筛查流程见图5。
六、内镜精查
(一)检查前准备
1. 检查前患者应禁食≥6 h,禁水>2 h,有梗阻或不完全梗阻症状者应延长禁食、禁水时间。
2. 检查前应取得知情同意,并向患者做好解释工作,消除患者的恐惧感,嘱其平静呼吸,不要吞咽唾液,避免不必要的恶心反应。
3. 检查前10~20 min可给予患者黏液祛除剂(如链酶蛋白酶)和祛泡剂(如西甲硅油)口服,以清除上消化道内黏液和气泡,改善视野,提高微小病变的检出率。
4. 检查前5 min给予1%盐酸达克罗宁胶浆或l%利多卡因胶浆5~10 mL含服,或咽部喷雾麻醉。有条件的单位可在麻醉师配合下使用静脉镇静或麻醉,可提高受检者对内镜检查的接受度。
(二)内镜检查过程
1. 患者取左侧卧位,头部略向前倾,双腿屈曲。检查者应注意安抚和鼓励受检者,以期配合检查。经口插镜后,内镜直视下从距门齿16 cm开始缓慢循腔进镜,仔细观察每一厘米的食管黏膜状态,注意黏膜色泽、光滑度、蠕动和内腔的形状,并完成后续对胃、十二指肠的检查。尽量在进镜时观察未被内镜摩擦的正常黏膜和黏膜病灶的原始状态。检查过程中,如腔内附有黏液、唾液或气泡,应用清水或黏液祛除剂和祛泡剂及时冲洗吸引后再继续观察。如发现病变则需确定病变的具体部位、范围和形态,并详细描述,同时拍照记录。
2. 如进镜时受检者咽反射强烈,观察颈段食管内腔较为困难,在退镜至此处时,嘱受检者屏气数秒,可使颈段食管良好扩张,便于观察。进入距门齿约40 cm的胃食管交界区时可嘱受检者深吸气后屏气数秒,胃食管交界区向食管侧移动,较易观察并可在直视下摄片。
3. 保证内镜图片数量和质量:为保证完全观察清楚整个上消化道,目前较为公认的摄影法推荐留图40张[57]。观察食管时每隔5 cm至少拍摄一幅图片。如发现病灶,需额外留图。同时,需保证每张图片的清晰度。
(三)内镜检查技术
1. 普通白光内镜:食管黏膜病灶有以下几种状态:①红区,即边界清楚的红色灶区,底部平坦;②糜烂灶,多为边界清楚、稍凹陷的红色糜烂状病灶;③斑块,多为类白色、边界清楚、稍隆起的斑块状病灶;④结节,直径在1 cm以内,隆起的表面黏膜粗糙或糜烂状的结节病灶;⑤黏膜粗糙,指局部黏膜粗糙不规则、无明确边界的状态;⑥局部黏膜上皮增厚的病灶,常遮盖其下的血管纹理,显示黏膜血管网紊乱、缺失或截断等特点。内镜医师应提高对上述特征的认识,在检查时注意观察黏膜的细微变化,锁定可疑区域是开展后续精查的基础。
2. 色素内镜:将各种染料散布或喷洒在食管黏膜表面,使病灶与正常黏膜在颜色上形成鲜明对比,能更清晰地显示病灶范围,便于进行指示性活检。色素内镜常用染料有碘液、甲苯胺蓝等,可单一染色,也可联合使用。
(1)碘染色:正常鳞状上皮细胞内富含糖原,遇碘可变成深棕色,而早期食管癌以及异型增生组织内糖原含量减少甚至消失,呈现不同程度的淡染或不染区[58]。根据病变着色深浅、范围以及边缘形态进行指示性活检,可提高高危人群早期鳞癌和异型增生的检出率[59-60]。该法不适用于碘过敏、甲亢患者。
(2)甲苯胺蓝染色:因肿瘤细胞增殖活跃,富含核酸类物质,易被碱性染料甲苯胺蓝染色,而正常细胞核内遗传物质相对较少,遇甲苯胺蓝着色不明显。与碘染色相比,甲苯胺蓝染色对操作技术要求更高,耗时长,假阳性率较高,在国内并不常用。
(3)联合染色:单一染色对早期食管癌及其癌前病变的检出效率受到染色原理、染色剂浓度等因素影响,而联合染色法可使各染色方法取长补短,如碘液-甲苯胺蓝染色法和碘液-亚甲蓝染色法检出早期食管鳞癌及其癌前病变的准确率高于单一碘染色,对病变浸润程度的评估也有一定价值[61]。
3. 电子染色内镜:通过特殊的光学处理实现对食管黏膜的电子染色,较白光内镜能更清楚地显示黏膜表面结构、微血管形态和病变范围,又可弥补色素内镜的染色剂不良反应、染色耗时长等不足。电子染色内镜与普通白光内镜之间可实现反复切换对比观察,操作更为简便。
窄带成像技术(narrow band imaging, NBI)已广泛应用于临床,其对早期食管癌的诊断价值已得到公认[62]。NBI在食管鳞癌筛查方面较普通白光内镜有明显优势[63],另有研究[64]报道,其诊断食管鳞癌的准确性和特异性优于碘染色,但尚需更多研究进一步证实。利用NBI结合放大内镜观察食管上皮乳头内毛细血管袢(intrapapillary capillary loops, IPCL)和黏膜微细结构有助于更好地区分病变与正常黏膜以及评估病变浸润深度,已成为早期食管癌内镜精查的重要手段。
智能分光比色技术(flexible spectral imaging color enhancement, FICE)将白光分解成不同波段,可进行多达50种光谱组合,从而获得不同黏膜病变的最佳图像,能较清晰地显示IPCL,可作为碘染色的重要补充[65]。高清智能电子染色内镜技术(I-Scan)增强了不同性质黏膜间颜色的对比,在表面增强、对比度、色调处理方面有了很大提升[66]。蓝激光成像技术(blue laser imaging, BLI)联合使用 410 nm、450 nm两种波长激光,可获得黏膜表浅和深部血管以及黏膜结构的高清图像,得到更大的景深并保证明亮度,改善早期食管鳞癌与周围正常黏膜的对比度,并可结合放大技术精细观察[67]。上述技术在食管癌筛查和精查中的应用有待深入研究。
4. 放大内镜(magnifying endoscopy):放大内镜是在普通内镜的前端配置有一个可调焦距的放大系统,可将食管黏膜放大几十甚至上百倍,有利于观察组织表面显微结构和黏膜微血管网形态特征的细微变化,尤其是在与电子染色内镜相结合时,对黏膜特征的显示更为清楚,可提高早期食管癌诊断的准确性,指导治疗方式的选择[62]。
5. 共聚焦激光显微内镜(confocal laser endo-microscopy, CLE):可将组织放大至1 000倍,从微观角度显示细胞和亚细胞结构,在无需活检的情况下即可从组织学层面区分病变与非病变区域,实现“光学活检”。CLE可实时提供早期食管癌的组织学图像,且精确度较高,省去了病理活检步骤,大大缩短了诊断时间[68]。利用CLE三维重建技术对食管鳞状上皮表面成熟度进行评分,可有效区分鳞状上皮内瘤变与非肿瘤上皮[69]。
6. 自发荧光内镜(autofluorescence imaging, AFI):可将正常组织与病变组织自发荧光光谱间的差异转换为成像颜色的差异而加以区分[70]。但其对设备要求较高,检出食管鳞状上皮异型增生的敏感性和阳性预测值较低,目前临床应用较少[71]。
早期食管癌的内镜精查应以普通白光内镜检查为基础,全面细致地观察食管的各个部分。根据各医院的设备状况和内镜医师经验,综合使用染色内镜、放大内镜、CLE等特殊技术,可进一步突显早期食管癌的内镜下表现,并有助于了解病变范围、浸润深度和病理类型,指导治疗方案的选择。早期食管癌内镜精查流程见图5。
(四)早期食管癌及其癌前病变的内镜下分型和病变层次分类
1. 病变内镜下分型:依照2002年巴黎分型标准和2005年巴黎分型标准更新版[72-73],表浅型食管癌及其癌前病变(Type 0)分为隆起型病变(0-Ⅰ)、平坦型病变(0-Ⅱ)和凹陷型病变(0-Ⅲ)。0-Ⅰ型又分为有蒂型(0-Ⅰp)和无蒂型(0-Ⅰs)。0-Ⅱ型根据病灶轻微隆起、平坦、轻微凹陷分为0-Ⅱa、0-Ⅱb和0-Ⅱc三个亚型。0-Ⅰ型与0-Ⅱa型病变的界限为隆起高度达到1.0 mm(与张开活检钳单个钳片厚度1.2 mm比较),0-Ⅲ型与0-Ⅱc型界限为凹陷深度达到0.5 mm(与张开活检钳单个钳片厚度的一半0.6 mm比较)。同时具有轻微隆起和轻微凹陷的病灶根据隆起/凹陷比例分为0-Ⅱc+Ⅱa和0-Ⅱa+Ⅱc型;凹陷和轻微凹陷结合的病灶根据凹陷/轻微凹陷比例分为0-Ⅱc+Ⅲ和0-Ⅲ+Ⅱc型(图6)。
SM1:病变浸润黏膜下层上1/3;SM2:病变浸润黏膜下层中1/3
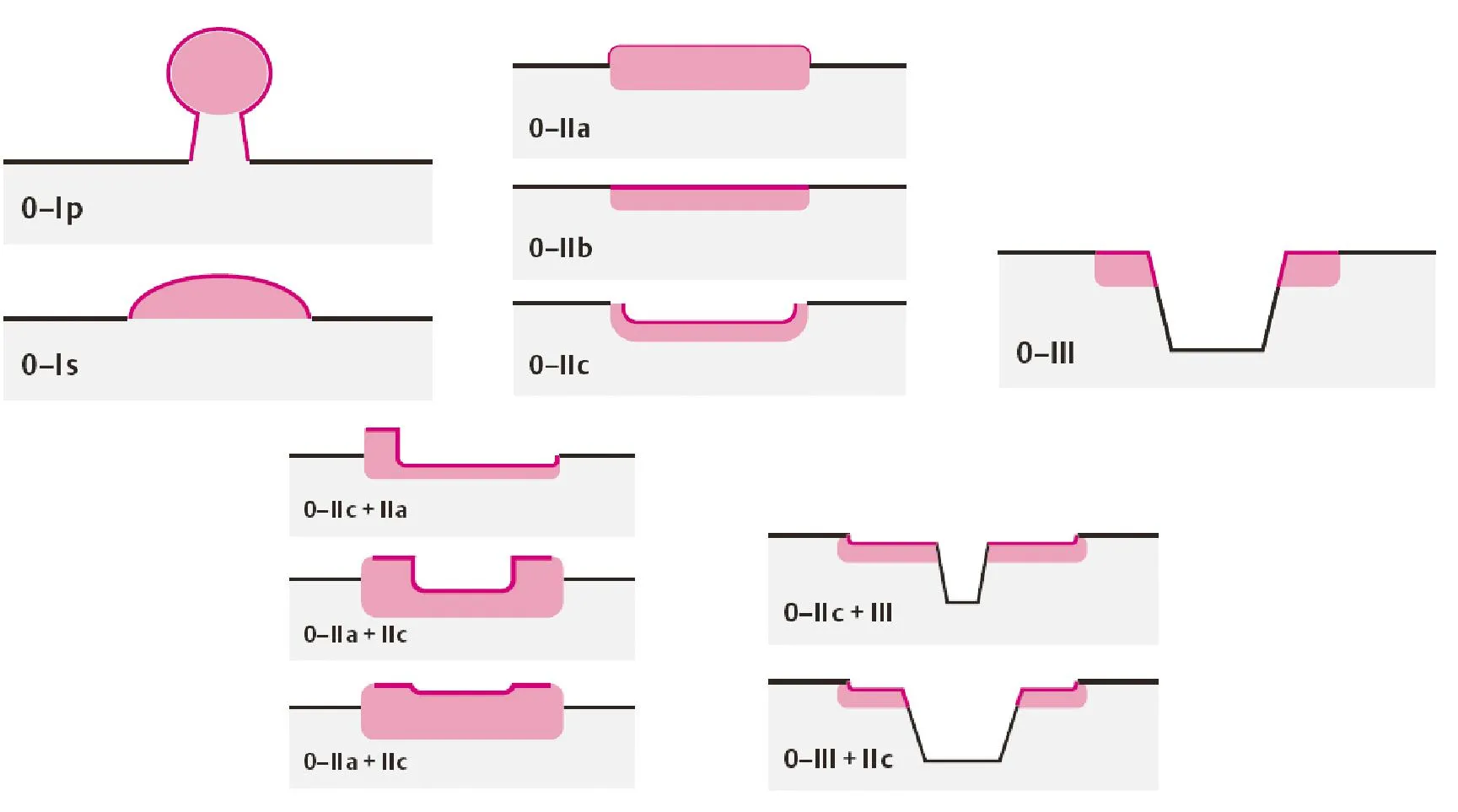
图6 早期食管癌内镜下分型(巴黎分型,2005年)
2. 病变层次分类:病变仅局限于上皮内(epithe-lium, EP),未突破基底膜者,为M1(原位癌/重度异型增生;Tis)。早期食管癌分为黏膜内癌和黏膜下癌:黏膜内癌分为M2和M3,M2指病变突破基底膜,浸润黏膜固有层(lamina propria mucosa, LPM),M3指病变浸润黏膜肌层(muscularis mucosa, MM);黏膜下癌分为SM1、SM2和SM3,SM1指病变浸润黏膜下层上1/3,SM2指病变浸润黏膜下层中1/3,SM3指病变浸润黏膜下层下1/3[11]。对于内镜下切除的食管鳞癌标本,以200 μm作为区分黏膜下浅层和深层浸润的临界值[72]。
3. 病变内镜下形态与病变层次的关系:黏膜内癌通常表现为0-Ⅱb型、0-Ⅱa型和0-Ⅱc型,病灶表面光滑或呈规则的小颗粒状;黏膜下癌通常为0-Ⅰ 型和0-Ⅲ型,病灶表面呈不规则粗颗粒状或凹凸不平小结节状[73]。应用上述标准,可初步预测病变所达层次。我国学者将早期食管癌病理形态分为隐伏型(充血型)、糜烂型、斑块型和乳头型:隐伏型多为原位癌;糜烂型大部分为原位癌,部分为早期浸润癌,癌细胞分化较差;斑块型最多见,大部分为早期浸润癌,癌细胞分化较好;乳头型主要为早期浸润癌,癌细胞分化一般较好。
(五)活组织病理检查
内镜下发现可疑病变应行活检,活检块数根据病变范围和大小确定。提倡应用色素内镜、新型内镜技术进行指示性活检。黏膜活检取材要求标本应足够大,深度尽可能达到黏膜肌层。与术后病理诊断相比,活检病理诊断存在一定比例的诊断误差(绝大部分为诊断不足),经仔细评估必要时可行内镜下诊断性切除。详情参见“中国消化内镜活组织检查与病理学检查规范专家共识(草案)”[74]。
七、术前评估
(一)病灶范围、病变层次和淋巴结转移评估
术前准确判断肿瘤浸润深度、范围以及有无淋巴结转移是选择合理治疗方式和评估预后的先决条件。目前,判断肿瘤范围主要借助色素内镜和电子染色内镜,对病变层次的评估则主要依靠内镜超声、IPCL分型、病变内镜下形态等信息[75],但目前缺乏统一的标准,操作者经验水平易对诊断结果产生影响,准确的评估仍依据切除标本的病理诊断。
1. 内镜超声(endoscopic ultrasound, EUS):EUS下早期食管癌的典型表现为局限于黏膜层且不超过黏膜下层的低回声病灶。EUS可清楚显示食管壁层次结构的改变、浸润深度和病变与邻近脏器的关系,T分期的准确率可达74%~86%[76-78],但对病变浸润深度的诊断准确性易受病变大小和部位的影响[77-78]。EUS诊断局部淋巴结转移的敏感性为80%,明显高于CT(50%)和PET(57%),但特异性(70%)略低于后两者(分别为83%和85%);对食管癌腹腔淋巴结转移的诊断敏感性和特异性均高 于CT[79]。内镜超声引导下细针抽吸术(EUS-guided fine-needle aspiration, EUS-FNA)可进一步提高对可疑淋巴结转移的诊断效能。由于超声波穿透力有限,EUS难以用于远处转移的评估,应结合CT、MRI或PET-CT等影像学检查进行评估。
2. 电子染色内镜联合放大内镜观察食管病变微血管等结构:NBI联合放大内镜可清楚显示食管上皮IPCL的形态变化[80-81]。最常用的IPCL分型为井上晴洋分型[82]:Ⅰ型,形态规则,代表正常鳞状上皮黏膜;Ⅱ型,出现扩张和(或)延长表现,多为炎症性改变和非肿瘤组织;Ⅲ型,血管形态有轻微改变;Ⅳ型,出现扩张、迂曲、管径粗细不均或形态不规则改变中的2种或3种;Ⅴ1型,同时出现扩张、迂曲、管径粗细不均和形态不规则四种改变;Ⅴ2型,在Ⅴ1型病变的基础上出现血管延长,原血管袢结构尚完整;Ⅴ3型,IPCL不规则并伴有血管袢结构的部分破坏;ⅤN型,出现增粗明显的新生肿瘤血管,原血管袢结构完全破坏。中、重度异型增生多表现为Ⅲ型、Ⅳ型,Ⅴ型则提示癌变。Ⅴ1、Ⅴ2型病变一般未浸润黏膜肌层,是内镜下切除的良好适应证;Ⅴ3型多浸润至M3和SM1,是内镜下切除的相对适应证;而ⅤN型病变不适合内镜下切除,推荐行外科手术治疗。其他分型如表浅型食管病变微细血管分型(microvascular patterns, MVP),除观察微血管形态外还考虑了乏血管区域(avascular area, AVA)的范围[83]。日本食道学会结合上述两种分型的优点提出了更为简洁的新分型,初步验证发现其评估表浅食管鳞癌浸润深度的平均准确率达90%[84]。
3. CT:是目前国内在进行食管癌临床分期时应用最为普遍的影像学手段。CT扫描对食管癌术前T分期和N分期的诊断准确率>70%[85],对局部淋巴结和腹腔淋巴结转移的诊断敏感性均不如EUS,诊断远处转移的敏感性和特异性则分别为52%和91%[79]。因此,临床上CT扫描常用于明确有无远处转移和转移部位,也可辅助EUS评估淋巴结转移状态。
4. MRI:MRI对食管癌T分期和N分期的诊断效能与CT相当[86],但扫描时间长,易受心脏、大血管搏动和呼吸运动影响产生伪影,可能影响肿瘤的T分期,且价格较CT昂贵,故一般不作为首选检查。
5. PET-CT:是PET和CT的同机融合,可同时评价病变的解剖结构异常和代谢功能异常。PET-CT在检测食管癌远处转移方面具有明显优势[79,87],但对早期食管癌的诊断价值有限[87],且检查费用高,国内不将其作为术前评估的常规手段。
考虑到成本-效益因素,本共识推荐应用EUS等内镜技术联合增强CT获得病变层次、淋巴结转移和远处转移的信息,完善食管癌的术前分期。电子染色内镜联合放大内镜的精细观察是较有前景的术前评估方式,建议有条件的医疗单位开展进一步研究。
(二)病理分型标准和临床处理原则
参照1998年维也纳胃肠道上皮性肿瘤病理分型标准及其修订版(2002年),根据内镜和病理诊断,选择不同的临床处理方式[88-89](表1)。

表1 胃肠道上皮性肿瘤维也纳分型(修订版)
注:a处理方式的选择应综合考虑病变大小、浸润深度(通过内镜、放射影像学或EUS等评估)以及患者年龄、伴随疾病等因素
八、内镜下切除治疗
(一)治疗原则
与传统外科手术相比,早期食管癌及其癌前病变的内镜下切除具有创伤小、并发症少、恢复快、费用低等优点,且两者疗效相当,5年生存率可达95%以上[4]。原则上,无淋巴结转移或淋巴结转移风险极低、残留和复发风险低的病变均适合行内镜下切除术。
(二)内镜下切除术
早期食管癌常用的内镜切除技术主要包括内镜下黏膜切除术(endoscopic mucosal resection, EMR)、内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)等。EMR技术从1989年开始在日本应用于早期食管癌的治疗[90-91],Oyama等[92]自2000年开始将ESD引入早期食管癌的治疗。经过多年的发展,早期食管癌的内镜下切除治疗已日趋成熟。
1.EMR
(1)定义:EMR指内镜下将黏膜病灶整块或分块切除,用于胃肠道表浅肿瘤诊断和治疗的方法。
(2)方法:常用的食管 EMR技术包括传统的黏膜下注射-抬举-切除法以及在其基础上演变而来的透明帽法(EMR with transparent cap, EMRC)、套扎法(EMR with ligation, EMRL)、内镜下分片黏膜切除术(endoscopic piecemeal mucosal resection, EPMR)等。各种EMR技术的基本原理相同,多是先通过黏膜下注射使黏膜下层与固有肌层分离,然后利用不同方法切除局部隆起的黏膜病灶。
EMRC是利用内镜前端安置的透明帽对病变进行吸引,再行圈套切除,对操作技术要求不高,并发症少,目前较为常用,但可切除的病变大小受透明帽的限制(图7)。EMRL是先对病变进行套扎以阻断血流并形成亚蒂,再行切除,视野清晰。EPMR用于传统EMR不能一次完整切除的较大病灶,将病灶分块切除,适用于直径>2 cm的巨大平坦病变,但标本体外拼接困难,难以评估根治效果,且易导致病变局部残留或复发[93]。
(3)疗效:国外文献报道,EMR可根除57.9%~78.3%的T1a期食管癌和癌前病变[94-96],整块切除率可达46%~78.6%[94-97]。国内报道,EMR治疗早期食管癌及其癌前病变,整块切除率为44.1%~84.5%[98-99],完全切除率为44.8%~100%[93,98-106](表2)。
2. 多环套扎黏膜切除术(multi-band mucosec-tomy, MBM):是使用改良食管曲张静脉套扎器进行多块黏膜切除的新技术,主要包括标记、套扎、圈套切除、处理创面等步骤(图8)。
MBM无需行黏膜下注射,可显著缩短操作时间。与EMR相比,MBM具有操作简单、成本低、治疗时间短、安全高效的优点,便于在基层推广[107],但应注意规范化操作,避免病变残留。
3. ESD
(1)定义:ESD是在进行黏膜下注射后使用特殊电刀逐渐分离黏膜层与固有肌层之间的组织,将病变黏膜和黏膜下层完整剥离的方法。
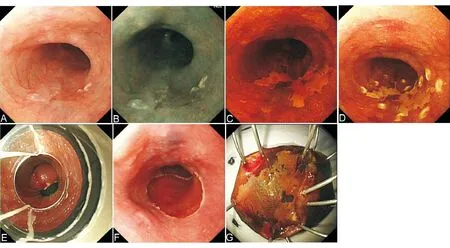
A:内镜下显示食管黏膜粗糙、糜烂,活检病理为重度异型增生;B:NBI下病变呈深棕色;C:碘染色阳性;D:病变周围标记后;E:黏膜下注射后;F:透明帽法行EMR;G:切除后创面;H:切除后重新碘染色,人工溃疡周围未见阳性病灶;I:切除标本
图7EMRC操作步骤
(2)操作步骤:①病变周围标记;②黏膜下注射,使病灶充分抬举;③环周切开黏膜;④黏膜下剥离,使黏膜与固有肌层完全分离,一次完整切除病灶;⑤创面处理:包括创面血管处理和病灶边缘检查(图9)。国内学者对经典ESD技术进行改进,发明了隧道式黏膜剥离技术(标记-注射-远端开口-近端切开-建立隧道-两边切开),是治疗大面积食管病变的理想方法,有效简化了操作步骤,使内镜手术更加安全快捷[108]。
(3)疗效:早期食管癌ESD治疗在美国应用较少,欧洲近几年逐步开始使用。日本开展较多,ESD治疗食管鳞癌的整块切除率可达93%~100%,完全切除率达88%以上[92,96,109]。国内ESD整块切除率为80%~100%,完全切除率为74%~100%,平均操作时间为40~95 min[99,110-115](表2)。
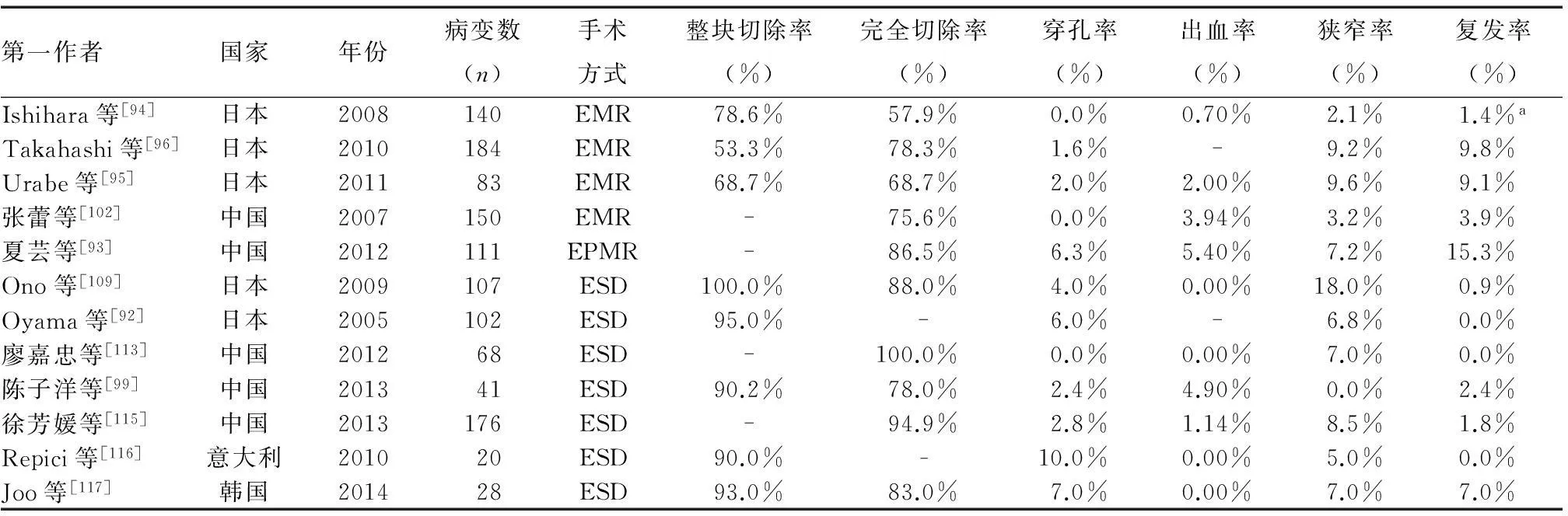
表2 各国早期食管鳞癌及其癌前病变EMR、ESD的疗效和并发症发生情况
注:-:未统计;a:含1例食管腺癌
A:白光内镜示食管黏膜糜烂;B:NBI下病变图像;C:碘染色阳性;D:病变周围标记后;E:套扎切除;F:切除后创面;G:切除标本
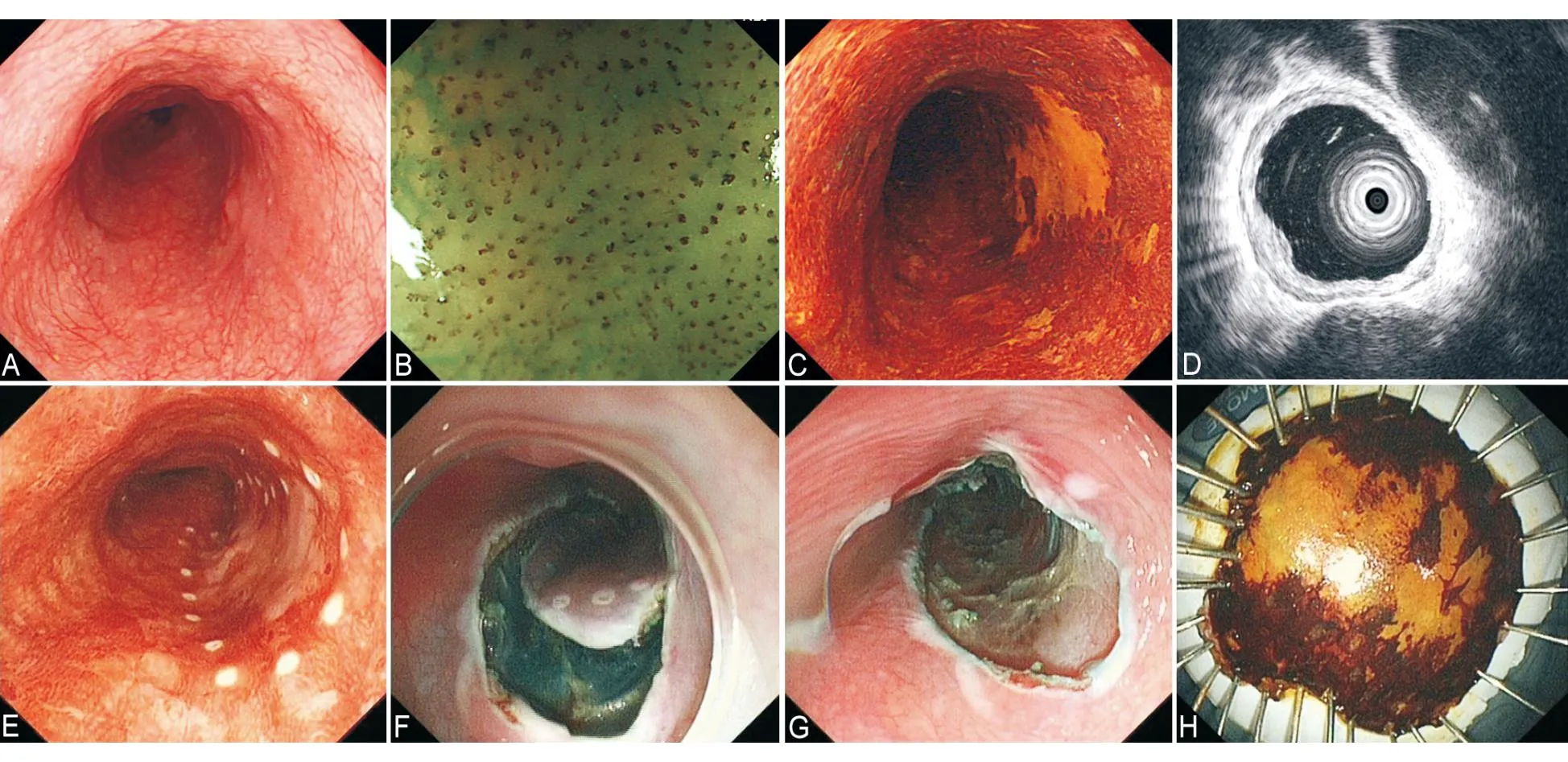
A:白光内镜示病变处食管黏膜粗糙,血管网消失;B:NBI下观察病变处IPCL分型为Ⅳ型(井上晴洋分型);C:碘染色阳性;D:EUS示病变位于黏膜层;E:病变周围标记后;F:黏膜下注射后切开黏膜;G:完整剥离病变并仔细检查创面;H:切除标本
图9ESD操作步骤
内镜下切除治疗主要用于淋巴结转移风险低且可能完整切除的食管癌病变。目前国内尚无统一规范的内镜下切除适应证,由于欧美食管癌发病率和鳞癌比例较低,加之内镜下切除技术的应用现状与我国差别较大,国内早期食管癌内镜下切除治疗多以参考日本指南为主。日本食道学会2012年颁布的“食管癌诊断和治疗指南”[8]推荐早期食管癌内镜下切除的绝对适应证:病变局限在上皮层或黏膜固有层的T1a期食管癌,淋巴结转移风险极低,内镜下切除可获得根治。内镜下切除的相对适应证:病变浸润黏膜肌层(M3)或黏膜下浅层(T1b-SM1,黏膜下浸润深度<200 μm)。黏膜下浸润深度超过200 μm的病变发生淋巴结转移的风险高,建议采取与进展期肿瘤相同的处理方式[118]。
(三)适应证和禁忌证
目前,国内较为公认的早期食管癌和癌前病变内镜下切除的绝对适应证:病变局限在上皮层或黏膜固有层(M1、M2);食管黏膜重度异型增生。内镜下切除的相对适应证:病变浸润黏膜肌层或黏膜下浅层(M3、SM1),未发现淋巴结转移的临床证据;范围大于3/4环周、切除后狭窄风险大的病变可视为内镜下切除的相对适应证,但应向患者充分告知术后狭窄等风险。内镜下切除的禁忌证:明确发生淋巴结转移的病变;若术前判断病变浸润至黏膜下深层,有相当比例患者内镜下切除无法根治,原则上应行外科手术治疗;一般情况差、无法耐受内镜手术者。内镜下切除的相对禁忌证:非抬举征阳性;伴发凝血功能障碍以及服用抗凝剂的患者,在凝血功能纠正前不宜手术;术前判断病变浸润至黏膜下深层,患者拒绝或不适合外科手术。
(四)围手术期处理
1. 术前准备:评估患者全身状况,排除麻醉和内镜下治疗禁忌证。术前必须行凝血功能检查,如有异常,应予以纠正后再行治疗。对服用抗凝药者,需根据患者原发病情况,酌情停药5~7 d,必要时请相关学科协助处理[119]。应向患者和家属详细讲述内镜下切除治疗的操作过程、预期结果、并发症、可能存在复发或转移的风险以及需追加外科手术或其他治疗的指征等,并签署知情同意书。所有患者行心电监护,术前15 min给予肌注地西泮和解痉药。如需要可应用静脉镇静或麻醉。
2. 术后处理:术后第1天禁食;监测血压、脉搏、呼吸等生命体征,观察头颈胸部有无皮下气肿,进行必要的实验室和影像学检查,如临床表现和相关检查无异常,术后第2天可进全流质,然后连续3 d 进软食,再逐渐恢复正常饮食。
(1)术后用药
抗菌药物的使用:对于术前评估切除范围大、操作时间长、反复黏膜下注射、穿孔风险高者,可考虑预防性使用抗菌药物。药物的选择参考卫生部抗菌药物使用原则,早期食管癌内镜下切除术后可选用第一代或第二代头孢菌素,可加用硝基咪唑类药物。术后用药总时间一般不超过72 h,但可酌情延长。
创面保护和止血:食管内镜下切除术后溃疡通常在4周左右愈合[120],可予质子泵抑制剂(PPI)或H2受体拮抗剂(H2RA) 4~6周抑酸治疗,有反酸病史或有胃食管反流病样症状的患者需足量、持续PPI治疗[121]。如有必要,可加用黏膜保护剂。评估认为出血风险较大者,可酌情使用止血药物。
(2)术后标本处理:术后将整块切除的标本展平,黏膜面朝上用不锈钢细针固定于平板上,区分远端和近端,观察、测量并记录新鲜标本的大小、形状、黏膜病变肉眼所见(大小、形状、颜色、硬度等),拍照后将标本浸没于4%中性甲醛溶液中固定并送检。分切标本前推荐进行碘染色以明确碘不染区,一般以垂直于病变长轴方向分切,若留取的水平切缘不足,应先确定距碘不染区最近的切缘,以此处切缘的切线为基准垂直分切[8]。分切标本应尽量按病灶原貌拼接。病理学取材、制片染色和规范化的病理学报告参见“中国消化内镜活组织检查与病理学检查规范专家共识(草案)”[74]。
(3)术后追加治疗(外科手术/放疗/化疗)指征:黏膜下浸润深度≥200 μm;淋巴管、血管浸润阳性;低分化或未分化癌;垂直切缘阳性。医师应结合患者一般情况和意愿综合考虑。
(五)操作相关并发症及其处理
内镜下切除虽属微创治疗,但受器械、方法、操作者经验、患者以及病变情况等因素的影响,仍存在一定的并发症发生率,主要有出血、穿孔、术后食管狭窄、感染等(表2)。
1. 出血:术中出血指术中需要止血治疗的局部创面出血;术后迟发性出血指术后30 d内出现呕血、黑便等征象,血红蛋白下降20 g/L以上[122]。
出血发生率和危险因素:国外文献报道,食管EMR相关出血发生率可达2%[94-95,123],ESD术中出血常见,术后迟发性出血发生率不足1%[109,124]。国内文献报道,食管EMR术中出血发生率为1.52%~11.7%[98,100,103,125],术后迟发性出血发生率为0%~7.04%[98,101,103];ESD术中出血发生率为22.9%~59.6%[111,113],术后迟发性出血发生率为0%~4.88%[99,111,113]。EMR出血与切除病变的大小有一定关系,病灶直径>2.0 cm者出血概率增加,混合电流切除者易发生术中出血,凝固电流切除者易发生延迟性出血[126]。食管ESD出血可能与病变部位、大小和类型、剥离层次、病变的黏连程度、血管分布、操作者的熟练程度等相关[18,115]。
出血治疗原则和处理方法:对于术中少量渗血,内镜下喷洒肾上腺素-0.9%NaCl溶液即可起效,而大量渗血则可酌情选用黏膜下注射肾上腺素-0.9% NaCl溶液、热活检钳钳夹止血、氩离子凝固术(argon plasma coagulation, APC)止血或止血夹夹闭止血。术中出血多因操作中损坏黏膜下血管所致,因此操作中可采取必要的预防措施,包括在黏膜下注射液中加入肾上腺素-0.9%NaCl溶液以收缩血管,术中应用热活检钳对可疑血管进行钳夹电凝处理等。病变切除后仔细处理创面,对可见血管进行预凝,有助于预防术后出血。术后出血相对少见,若患者血流动力学稳定,经保守治疗一般可恢复;而支持治疗后仍存在血流动力学不稳定,则需急诊内镜下确切止血,极少需要外科手术。术后酌情应用止血药和抗酸剂也可达到预防出血的效果。
2. 穿孔:术中穿孔可及时发现。术后患者出现前胸和颈部皮下气肿,胸部平片或CT发现纵隔气体或查体见穿孔征象等,应考虑术后穿孔。
穿孔发生率和危险因素:国外文献报道,食管EMR穿孔发生率不超过2%[4,94-96],ESD穿孔发生率为2%~10%[96,109,116]。国内文献报道,食管EMR穿孔发生率小于6.3%[93,102],ESD穿孔发生率为0%~11.5%[99,111,113]。ESD穿孔与操作者经验、病变部位和大小、病变处有无溃疡形成等相关[127-128]。创面处肌层暴露也是穿孔的危险因素,操作过程中使用CO2气体和预防性夹闭肌层破损处有助于预防穿孔[121,129-130]。胃肠道内积聚大量气体,容易使小的肌层裂伤形成穿孔,因此操作过程中应及时抽吸胃肠道内气体。严格掌握内镜切除适应证、充分的黏膜下注射和选用合适的器械也有利于预防穿孔发生。
穿孔治疗原则和处理方法:术中发现穿孔,后续操作应减少注气注水,切除结束后行内镜下夹闭,术后予禁食、胃肠减压、静脉使用广谱抗菌药物和支持治疗等保守治疗多可恢复。内镜下夹闭失败或穿孔较大、内镜无法夹闭时,可能需行外科手术,以防病情进展[131]。穿孔并发气胸时,应及时行负压引流。隐性穿孔保守治疗多可痊愈。
3. 食管狭窄:指内镜切除术后需要内镜下治疗的食管管腔狭窄,常伴有不同程度的吞咽困难,多在术后1个月出现。
狭窄发生率和危险因素:病变大小、浸润深度以及创面的环周比例和纵向长度对食管内镜切除术后狭窄发生率影响较大[132-133],其中切除范围大于 3/4环周和浸润深度超过M2是发生术后狭窄的独立危险因素[134]。大于3/4环周的病变内镜切除术后狭窄发生率可达88%~100%[134-136]。
狭窄治疗原则和处理方法:内镜下食管扩张术是最常规的治疗方法,多数狭窄经数次内镜下扩张可缓解,存在高危因素的病例术后行预防性食管扩张可降低狭窄发生率[137]。支架置入可作为难治性病例的选择,但存在疼痛、肉芽组织长入支架、食管溃疡形成以及部分支架不能取出等问题[138],近来研究报道预防性覆膜支架置入可安全有效地降低近环周食管ESD术后狭窄发生率[139]。生物可降解支架因降解致支架支撑力下降、移位等问题导致长期疗效不理想[140]。口服和局部注射糖皮质激素可有效预防术后狭窄发生,降低扩张需求,但最佳方案尚未达成共识[135,141-143]。细胞补片等再生医学技术尚处于研究阶段[144]。
(六)内镜切除术后随访
1. 术后残留和复发:有研究报道,表浅型食管鳞癌ESD后切缘阳性率为11.4%,肿瘤越大、浸润越深,切缘阳性风险越大,术前精细评估病灶大小和预测浸润深度对预防术后残留非常重要[145]。Meta分析发现,ESD(术后随访时间超过1年)局部复发率(0.55%,2/366)明显低于EMR(13.76%,83/603)[146]。国内文献报道,EMR术后局部复发率为0%~15.3%[93,98,103],ESD术后局部复发率为0%~9.4%[99,111,114]。肿瘤局部复发可能与EMR方式、EPMR分片块数、肿瘤浸润深度、操作是否规范、病变位于食管上段以及食管癌家族史有关[96,147]。
2. 残留和复发的预防和处理:病变切除后应仔细检查创面,必要时使用染色或电子染色内镜进行观察,发现病变残留应及时予再次处理,有利于降低复发率。局部残留和复发的病变多可通过内镜下治疗清除,内镜下治疗失败者可追加手术或放化疗。
3. 随访:内镜切除术后3、6、12个月各复查1次内镜,若无残留、复发,此后每年复查1次内镜。随访时应结合染色和(或)放大内镜检查,发现阳性或可疑病灶时行指示性活检和病理诊断。另外,肿瘤标志物和相关影像学检查亦不可忽视,同时应警惕异时性多原发食管鳞癌和第二原发癌(如头颈部鳞癌、胃癌等)[148]。
九、内镜下非切除治疗
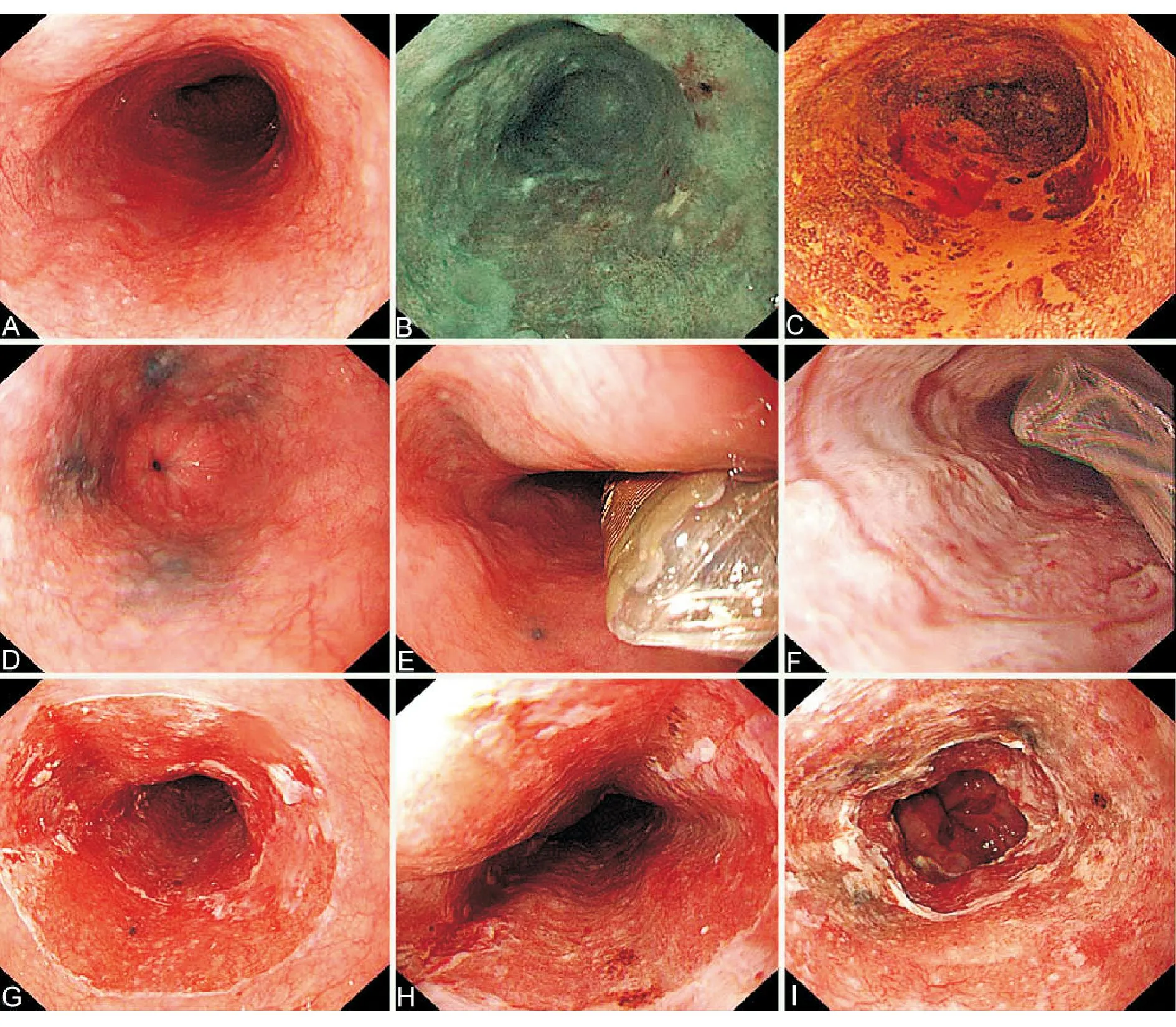
射频消融术(radiofrequency ablation, RFA)利用电磁波的热效应发挥治疗作用,使组织脱水、干燥和凝固坏死,从而达到治疗目的,在多发、病变较长或累及食管全周的早期食管癌及其癌前病变的治疗中具有明显优势,其作用均匀,且治疗深度控制在1 000 μm左右,降低了穿孔和术后狭窄的发生率。初步研究结果显示,RFA可用于Ⅱb型病变,且治疗前活检证实为食管鳞状上皮细胞中度和(或)重度异型增生以及局限于M2层的中-高分化鳞癌[149]。符合条件的早期食管鳞癌及其癌前病变RFA术后12个月完全缓解率可达97%[150-151]。但目前尚缺乏RFA对早期平坦型食管鳞癌疗效的大样本研究,长期疗效需进一步验证。环周型消融系统多应用于多发、延伸较长或环周病变的治疗,治疗过程包括记录消融位置、测量食管内径、置入消融导管进行消融等步骤,依据病变和第一次消融情况,可在清除已消融病变黏膜后行第二次消融(图10);局灶型消融系统则多应用于局灶性病变和术后残余灶的处理,无需经过测量步骤。
A:食管鳞状上皮重度异型增生,长约4 cm、近乎全周;B:NBI下病变图像;C:碘染色阳性;D、E:治疗范围近端和远端标记;E:射频消融球囊置于近端标记处(6点位);F:第一次消融后黏膜外观;G:清除已消融病变黏膜后外观;H:第二次消融后近端黏膜外观;I:第二次消融后远端黏膜外观
图10RFA操作步骤
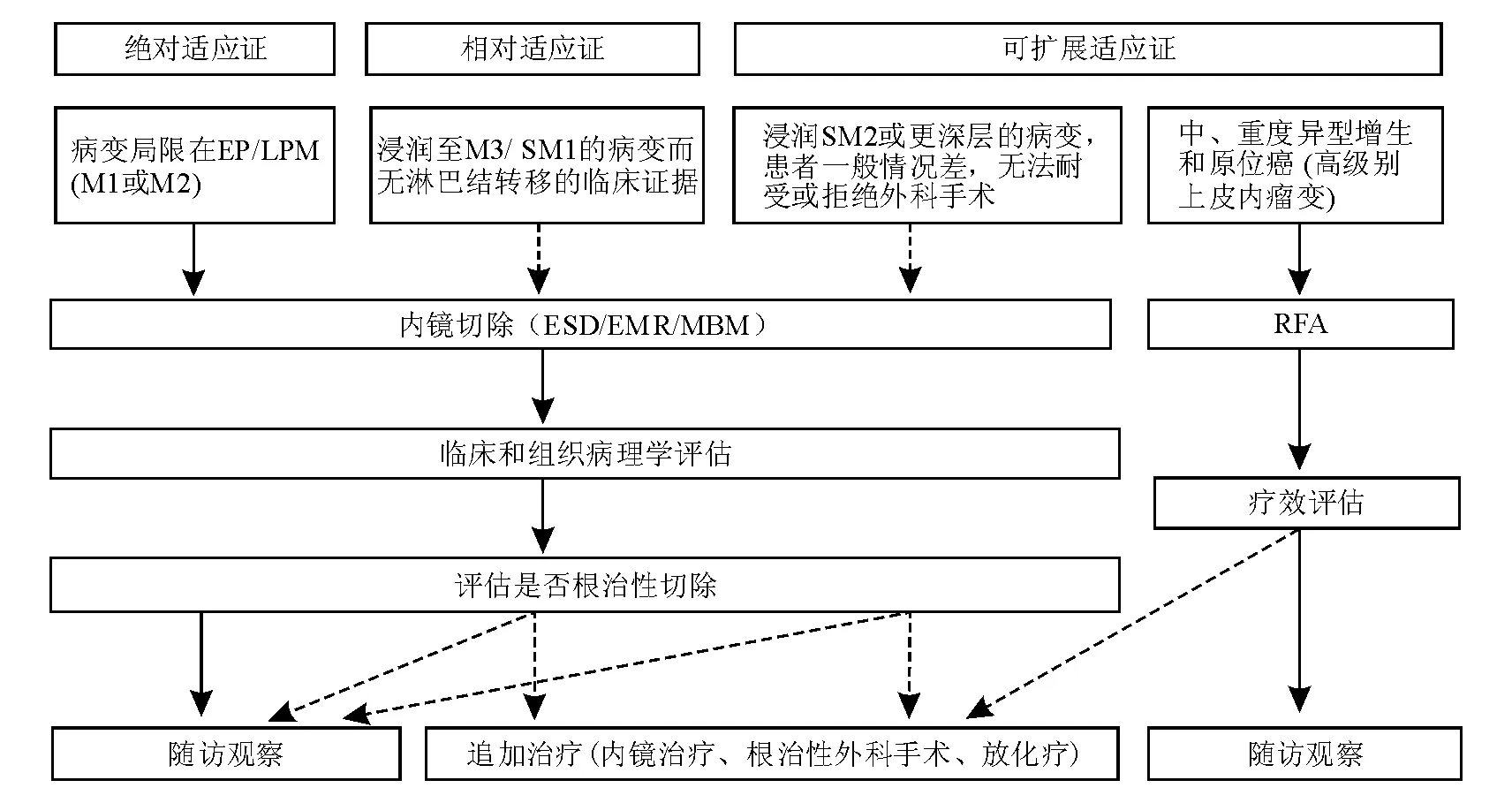
EP/LPM:上皮内/黏膜固有层;虚线箭头代表应权衡风险酌情选择
食管癌的内镜下非切除治疗方法还包括光动力疗法(photodynamic therapy, PDT)、APC、激光疗法、热探头治疗、冷冻疗法等,这些技术既可单独使用,也可与内镜切除术联合应用。PDT是利用特定激光激发选择性聚集于肿瘤组织的光敏剂产生单态氧,通过物理、化学、免疫等复杂机制导致肿瘤坏死的疗法,可用于处理大面积早期多灶病变[152],应注意光敏反应、术后穿孔、狭窄等不良事件。APC是一种非接触性热凝固方法,可有效处理食管癌前病变,应用于早期食管癌则需严格掌握适应证[153]。非切除治疗方法致肿瘤毁损,不能获得组织标本进行精确的病理学评估,无法明确肿瘤是否完整切除,更无法判定肿瘤的转移风险,因此治疗后需密切随访,长期疗效还有待进一步研究证实。
早期食管癌内镜治疗流程见图11。
十、早期食管腺癌
食管腺癌在我国食管癌中所占比例小,仅约1.2%~6.5%[154-155]。吸烟是食管腺癌的重要危险因素,而重度饮酒并非食管腺癌的危险因素。另外,有症状的胃食管反流病[156-157]、Barrett食管[158]、肥胖[159]等也与食管腺癌的发生密切相关。而口服抗氧化剂、食用新鲜水果蔬菜可能降低Barrett食管发病率,进而减少食管腺癌的发生风险[160]。幽门螺杆菌感染与食管腺癌发生呈负相关[161]。
内镜联合活检病理检查是早期食管腺癌的重要诊断方法。色素内镜、电子染色内镜、CLE、AFI等在提高Barrett食管和早期食管腺癌的检出率方面亦各有优势[162-166]。
早期食管腺癌的内镜下分型同鳞癌,但其0-Ⅰ 型与0-Ⅱa型病变的界限为隆起高度达2.5 mm(闭合活检钳厚度),0-Ⅲ 型与0-Ⅱc型病变的界限为凹陷深度达1.2 mm(张开活检钳单个钳片厚度)[72-73]。
早期食管腺癌的治疗可参考食管鳞癌的治疗,表浅型食管腺癌内镜切除可获良好预后[167]。与鳞癌相比,RFA技术在早期食管腺癌和Barrett食管伴异型增生的治疗中应用更为成熟,效果也更加确切[168-169]。在伴有异型增生的Barrett食管的治疗中,RFA疗效与EMR相当,且具有更低的术后狭窄发生率[169]。另外,EMR后辅助RFA治疗可在切除Barrett病灶后对周围可疑区域进行预防性处理,从而显著降低复发率和癌变率,长期完全缓解率可达95%[170]。
参与制订本共识意见的专家(按姓氏拼音排序):包郁(四川省肿瘤医院内镜科)、蔡全才(上海长海医院消化内科)、陈星(山西省人民医院消化科)、杜奕奇(上海长海医院消化内科)、高树庚(中国医学科学院肿瘤医院胸外科)、郭强(云南省第一人民医院消化内科)、郝建宇(首都医科大学附属北京朝阳医院消化科)、冀明(首都医科大学附属北京友谊医院消化科)、姜慧卿(河北医科大学第二医院消化内科)、金珠(北京大学第三医院消化科病理室)、李建生(郑州大学第一附属医院消化内科)、李延青(山东大学齐鲁医院消化科)、李兆申(上海长海医院消化内科)、廖专(上海长海医院消化内科)、令狐恩强(解放军总医院消化内科)、刘吉勇(山东省立医院消化科)、吕宁(中国医学科学院肿瘤医院病理科)、任旭(黑龙江省医院消化内科)、盛剑秋(北京军区总医院胃肠内科)、施宏(福建省肿瘤医院内镜科)、施瑞华(江苏省人民医院消化科)、唐涌进(《中华消化内镜杂志》编辑部)、王贵齐(中国医学科学院肿瘤医院内镜科)、王立东(郑州大学第一附属医院河南省食管癌重点开放实验室)、王洛伟(上海长海医院消化内科)、王实(浙江省肿瘤医院内镜中心)、吴齐(北京大学肿瘤医院内镜中心)、徐国良(中山大学附属肿瘤医院内镜科)、徐红(吉林大学第一医院胃肠内科)、杨爱明(北京协和医院消化内科)、游伟程(北京大学肿瘤医院)、袁媛(中国医科大学附属第一医院肿瘤研究所)、张立玮(河北医科大学第四医院内镜科)
执笔者:马丹(上海长海医院消化内科)、杨帆(上海长海医院消化内科)、廖专(上海长海医院消化内科)、王洛伟(上海长海医院消化内科)
参考文献
1 Montgomery EA. Oesophageal cancer//Stewart BW, Wild CP. World Cancer Report 2014 [M]. Lyon: IARC Press, 2014: 374-382.
2 Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61 (2): 69-90.
3 Merkow RP, Bilimoria KY, Keswani RN, et al. Treatment trends, risk of lymph node metastasis, and outcomes for localized esophageal cancer[J]. J Natl Cancer Inst, 2014, 106 (7): pii: dju133.
4 Ciocirlan M, Lapalus MG, Hervieu V, et al. Endoscopic mucosal resection for squamous premalignant and early malignant lesions of the esophagus[J]. Endoscopy, 2007, 39 (1): 24-29.
5 中国癌症预防与控制规划纲要(2004-2010) [J]. 中国肿瘤, 2004, 13 (2): 65-68.
6 Ajani JA, D’Amico TA, Almhanna K, et al. Esophageal and esophagogastric junction cancers, version 1. 2015[J]. J Natl Compr Canc Netw, 2015, 13 (2): 194-227.
7 Stahl M, Mariette C, Haustermans K, et al. Oesophageal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2013, 24 (Suppl 6): vi51- vi56.
8 Kuwano H, Nishimura Y, Oyama T, et al. Guidelines for Diagnosis and Treatment of Carcinoma of the Esophagus April 2012 edited by the Japan Esophageal Society[J]. Esophagus, 2015, 12: 1-30.
9 卫生部疾病预防控制局, 癌症早诊早治项目专家委员会. 癌症早诊早治项目技术方案(2011年版)[M]. 北京: 人民卫生出版社, 2011: 1-39; 74-76.
10 赫捷, 中国抗癌协会食管癌专业委员会. 食管癌规范化诊治指南[M]. 第2版. 北京: 中国协和医科大学出版社, 2013: 1-171.
11 Wang GQ, Abnet CC, Shen Q, et al. Histological precursors of oesophageal squamous cell carcinoma: results from a 13 year prospective follow up study in a high risk population[J]. Gut, 2005, 54 (2): 187-192.
12 Miros M, Kerlin P, Walker N. Only patients with dysplasia progress to adenocarcinoma in Barrett’s oesophagus[J]. Gut, 1991, 32 (12): 1441-1446.
13 Odze RD, Riddell RH, Bosman FT, et al. Premalignant lesions of the digestive system//Bosman FT, Carneiro F, Hruban RH, et al. WHO Classification of Tumours of the Digestive System[M]. 4th ed. Lyon: IARC Press, 2010: 10-12.
14 Diagnostic terms and definitions//Hamilton SR, Aaltonen LA. Pathology and genetics of tumours of the digestive system[M]. 3rd ed. Lyon: IARC Press, 2000: 1.
15 中华医学会消化病学分会. Barrett食管诊治共识(2011修订版,重庆)[J]. 中华消化内镜杂志, 2011, 28 (8): 421-422.
16 Japan Esophageal Society. Japanese Classification of Esophageal Cancer, tenth edition: part Ⅰ[J]. Esophagus, 2009, 6 (1): 1-25.
17 Tumours of the oesophagus//Bosman FT, Carneiro F, Hruban RH, et al. WHO Classification of Tumours of the Digestive System[M]. 4th ed. Lyon: IARC Press, 2010: 15-37.
18 侯晓佳, 李兆申, 施新岗, 等. 内镜黏膜下剥离术的疗效及出血危险因素分析[J]. 中华消化内镜杂志, 2012, 29 (10): 549-553.
19 Urabe Y, Hiyama T, Tanaka S, et al. Metachronous multiple esophageal squamous cell carcinomas and Lugol-voiding lesions after endoscopic mucosal resection[J]. Endoscopy, 2009, 41 (4): 304-309.
20 Soerjomataram I, Lortet-Tieulent J, Parkin DM, et al. Global burden of cancer in 2008: a systematic analysis of disability-adjusted life-years in 12 world regions[J]. Lancet, 2012, 380 (9856): 1840-1850.
21 赫捷, 赵平, 陈万青. 2012中国肿瘤登记年报[M]. 北京: 军事医学科学出版社, 2012: 48-51.
22 Arnold M, Soerjomataram I, Ferlay J, et al. Global incidence of oesophageal cancer by histological subtype in 2012[J]. Gut, 2015, 64 (3): 381-387.
23 周脉耕, 王晓风, 胡建平, 等. 2004-2005年中国主要恶性肿瘤死亡的地理分布特点[J]. 中华预防医学杂志, 2010, 44 (4): 303-308.
24 Lin Y, Totsuka Y, He Y, et al. Epidemiology of esophageal cancer in Japan and China[J]. J Epidemiol, 2013, 23 (4): 233-242.
25 曾红梅, 郑荣寿, 张思维, 等. 中国食管癌发病趋势分析和预测[J]. 中华预防医学杂志, 2012, 46 (7): 593-597.
26 全国肿瘤防治研究办公室, 全国肿瘤登记中心, 卫生部疾病预防控制局. 中国肿瘤死亡报告: 全国第三次死因回顾抽样调查[M]. 北京: 人民卫生出版社, 2010: 63-76.
27 Zeng H, Zheng R, Guo Y, et al. Cancer survival in China, 2003-2005: A population-based study[J]. Int J Cancer, 2015, 136 (8): 1921-1930.
28 王颖, 朱彤霞. 食管癌高发区林县井头村玉米样品的真菌区系分析[J]. 中国农业大学学报, 2002, 7 (1): 5-8.
29 王君, 刘秀梅. 食品中真菌毒素危险性分析的方法及现状[J]. 中华预防医学杂志, 2005, 39 (6): 430-433.
30 张帆, 吴志远, 吴健丽, 等. 食管癌高发区粮食中镰刀菌毒素的含量及其致突变作用[J]. 中华预防医学杂志, 2000, 34 (1): 53.
31 Islami F, Ren JS, Taylor PR, et al.Pickled vegetables and the risk of oesophageal cancer: a meta-analysis[J]. Br J Cancer, 2009, 101 (9): 1641-1647.
32 Cross AJ, Freedman ND, Ren J, et al. Meat consumption and risk of esophageal and gastric cancer in a large prospective study[J]. Am J Gastroenterol, 2011, 106 (3): 432-442.
33 Wu M, Liu AM, Kampman E, et al. Green tea drinking, high tea temperature and esophageal cancer in high- and low-risk areas of Jiangsu Province, China: a population-based case-control study[J]. Int J Cancer, 2009, 124 (8): 1907-1913.
34 Akhtar S, Sheikh AA, Qureshi HU. Chewing areca nut, betel quid, oral snuff, cigarette smoking and the risk of oesophageal squamous-cell carcinoma in South Asians: a multicentre case-control study[J]. Eur J Cancer, 2012, 48 (5): 655-661.
35 Pandeya N, Williams G, Green AC, et al. Alcohol consumption and the risks of adenocarcinoma and squamous cell carcinoma of the esophagus[J]. Gastroenterology, 2009, 136 (4): 1215-1224, e1-2.
36 Prabhu A, Obi KO, Rubenstein JH. The synergistic effects of alcohol and tobacco consumption on the risk of esophageal squamous cell carcinoma: a meta-analysis[J]. Am J Gastroenterol, 2014, 109 (6): 822-827.
37 Guha N, Boffetta P, Wünsch Filho V, et al. Oral health and risk of squamous cell carcinoma of the head and neck and esophagus: results of two multicentric case-control studies[J]. Am J Epidemiol, 2007, 166 (10): 1159-1173.
38 Nasrollahzadeh D, Malekzadeh R, Aghcheli K, et al. Gastric atrophy and oesophageal squamous cell carcinoma: possible interaction with dental health and oral hygiene habit[J]. Br J Cancer, 2012, 107 (5): 888-894.
39 刘曙正, 戴涤新, 连士勇, 等. 林州市1983~2002年食管癌发病率分析[J]. 中国肿瘤, 2008, 17 (4): 278-280.
40 李秀敏, 赵志敏, 常廷民, 等. 食管癌高发区1259例食管癌患者临床病理与遗传易感性[J].世界华人消化杂志, 2009, 17 (23): 2367-2373.
41 曾红梅, 郑荣寿, 张思维, 等. 1989-2008年中国恶性肿瘤死亡趋势分析[J]. 中华肿瘤杂志, 2012, 34 (7): 525-531.
42 Jia N, Wen X, Zhang N, et al. Younger age of onset and multiple primary lesions associated with esophageal squamous cell carcinoma cases with a positive family history of the cancer suggests genetic predisposition[J]. Chin Med J (Engl), 2014, 127 (15): 2779-2783.
43 Dhillon PK, Farrow DC, Vaughan TL, et al. Family history of cancer and risk of esophageal and gastric cancers in the United States[J]. Int J Cancer, 2001, 93 (1): 148-152.
44 Wu C, Kraft P, Zhai K, et al. Genome-wide association analyses of esophageal squamous cell carcinoma in Chinese identify multiple susceptibility loci and gene-environment interactions[J]. Nat Genet, 2012, 44 (10): 1090-1097.
45 Li X, Gao C, Yang Y, et al. Systematic review with meta-analysis: the association between human papilloma-virus infection and oesophageal cancer[J]. Aliment Pharmacol Ther, 2014, 39 (3): 270-281.
46 Hardefeldt HA, Cox MR, Eslick GD. Association between human papillomavirus (HPV) and oesophageal squamous cell carcinoma: a meta-analysis[J]. Epidemiol Infect, 2014, 142 (6): 1119-1137.
47 Islami F, Sheikhattari P, Ren JS, et al. Gastric atrophy and risk of oesophageal cancer and gastric cardia adenocarcinoma -- a systematic review and meta-analysis[J]. Ann Oncol, 2011, 22 (4): 754-760.
48 Muto M, Hironaka S, Nakane M, et al. Association of multiple Lugol-voiding lesions with synchronous and metachronous esophageal squamous cell carcinoma in patients with head and neck cancer[J]. Gastrointest Endosc, 2002, 56 (4): 517-521.
49 Su YY, Chen WC, Chuang HC, et al. Effect of routine esophageal screening in patients with head and neck cancer[J]. JAMA Otolaryngol Head Neck Surg, 2013, 139 (4): 350-354.
50 Evans JA, Early DS, Fukami N, et al. ASGE Standards of Practice Committee. The role of endoscopy in Barrett’s esophagus and other premalignant conditions of the esophagus[J]. Gastrointest Endosc, 2012, 76 (6): 1087-1094.
51 Hirota WK, Zuckerman MJ, Adler DG, et al. ASGE guideline: the role of endoscopy in the surveillance of premalignant conditions of the upper GI tract[J]. Gastrointest Endosc, 2006, 63 (4): 570-580.
52 Kochhar R, Sethy PK, Kochhar S, et al. Corrosive induced carcinoma of esophagus: report of three patients and review of literature[J]. J Gastroenterol Hepatol, 2006, 21 (4): 777-780.
53 Hsu YC, Yang TH, Liou JM, et al. Can clinical features stratify use of endoscopy for dyspeptic patients with high background prevalence of upper gastrointestinal cancer?[J]. Dig Liver Dis, 2012, 44 (3): 218-223.
54 Bai Y, Li ZS, Zou DW, et al. Alarm features and age for predicting upper gastrointestinal malignancy in Chinese patients with dyspepsia with high background prevalence ofHelicobacterpyloriinfection and upper gastrointestinal malignancy: an endoscopic database review of 102,665 patients from 1996 to 2006[J]. Gut, 2010, 59 (6): 722-728.
55 王国清, 魏文强, 乔友林. 食管癌筛查和早诊早治的实践与经验[J]. 中国肿瘤, 2010, 19 (1): 4-8.
56 Roth MJ, Liu SF, Dawsey SM, et al. Cytologic detection of esophageal squamous cell carcinoma and precursor lesions using balloon and sponge samplers in asymptomatic adults in Linxian, China[J]. Cancer, 1997, 80 (11): 2047-2059.
57 Hosokawa O, Tsuda S, Kidani E, et al. Diagnosis of gastric cancer up to three years after negative upper gastrointestinal endoscopy[J]. Endoscopy, 1998, 30 (8): 669-674.
58 王国清, 刘韵源, 郝长青, 等. 食管黏膜碘染色图像和浅表食管癌及癌前病变组织学的关系[J]. 中华肿瘤杂志, 2004, 26 (6): 342-344.
59 Carvalho R, Areia M, Brito D, et al. Diagnostic accuracy of lugol chromoendoscopy in the oesophagus in patients with head and neck cancer[J]. Rev Esp Enferm Dig, 2013, 105 (2): 79-83.
60 Dawsey SM, Fleischer DE, Wang GQ, et al. Mucosal iodine staining improves endoscopic visualization of squamous dysplasia and squamous cell carcinoma of the esophagus in Linxian, China[J]. Cancer, 1998, 83 (2): 220-231.
61 Peng G, Long Q, Wu Y, et al. Evaluation of double vital staining with lugol’s iodine and methylene blue in diagnosing superficial esophageal lesions[J]. Scand J Gastroenterol, 2011, 46 (4): 406-413.
62 Uedo N, Fujishiro M, Goda K, et al. Role of narrow band imaging for diagnosis of early-stage esophagogastric cancer: current consensus of experienced endoscopists in Asia-Pacific region[J]. Dig Endosc, 2011, 23 (Suppl 1): 58-71.
63 Muto M, Minashi K, Yano T, et al. Early detection of superficial squamous cell carcinoma in the head and neck region and esophagus by narrow band imaging: a multicenter randomized controlled trial[J]. J Clin Oncol, 2010, 28 (9): 1566-1572.
64 Nagami Y, Tominaga K, Machida H, et al. Usefulness of non-magnifying narrow-band imaging in screening of early esophageal squamous cell carcinoma: a prospective comparative study using propensity score matching[J]. Am J Gastroenterol, 2014, 109 (6): 845-854.
65 李艳霞, 余世界, 沈磊, 等. 内镜智能分光比色技术对早期食管癌及癌前病变的诊断价值[J]. 中华消化内镜杂志, 2012, 29 (12): 689-692.
66 Kodashima S, Fujishiro M. Novel image-enhanced endoscopy with i-scan technology[J]. World J Gastroenterol, 2010, 16 (9): 1043-1049.
67 Osawa H,Yamamoto H, Miura Y, et al. Blue Laser Imaging Provides Excellent Endoscopic Images of Upper Gastro-intestinal Lesions[J]. Video Journal and Encyclopedia of GI Endoscopy, 2014, 1 (3-4): 607-610.
68 Liu H, Li YQ, Yu T, et al. Confocal laser endomicroscopy for superficial esophageal squamous cell carcinoma[J]. Endoscopy, 2009, 41 (2): 99-106.
69 Li M, Zuo XL, Yu T, et al. Surface maturation scoring for oesophageal squamous intraepithelial neoplasia: a novel diagnostic approach inspired by first endomicro-scopic 3-dimensional reconstruction[J]. Gut, 2013, 62 (11): 1547-1555.
70 李淑德, 许国铭, 李兆申. 荧光内镜在上消化道疾病诊断中的应用[J]. 国外医学·消化系疾病分册, 2003, 23 (5): 282-284.
71 Ishihara R, Inoue T, Hanaoka N, et al.Autofluorescence imaging endoscopy for screening of esophageal squamous mucosal high-grade neoplasia: a phase Ⅱ study[J]. J Gastroenterol Hepatol, 2012, 27 (1): 86-90.
72 The Paris endoscopic classification of superficial neoplastic lesions: esophagus, stomach, and colon: November 30 to December 1, 2002[J]. Gastrointest Endosc, 2003, 58 (6 Suppl): S3- S43.
73 Endoscopic Classification Review Group. Update on the paris classification of superficial neoplastic lesions in the digestive tract[J]. Endoscopy, 2005, 37 (6): 570-578.
74 中华医学会消化内镜学分会病理学协作组. 中国消化内镜活组织检查与病理学检查规范专家共识(草案)[J]. 胃肠病学, 2014, 19 (9): 549-553.
75 Yoshida T, Inoue H, Usui S, et al. Narrow-band imaging system with magnifying endoscopy for superficial esophageal lesions[J]. Gastrointest Endosc, 2004, 59 (2): 288-295.
76 钟丽, 廖家智, 王颖, 等. 内镜超声在食管癌术前TN分期中的诊断价值[J]. 世界华人消化杂志, 2010, 18 (21): 2258-2261.
77 Thosani N, Singh H, Kapadia A, et al. Diagnostic accuracy of EUS in differentiating mucosal versus submucosal invasion of superficial esophageal cancers: a systematic review and meta-analysis[J]. Gastrointest Endosc, 2012, 75 (2): 242-253.
78 尔丽绵, 张立玮, 徐志彬, 等. 超声小探头对高发区早期食管癌及癌前病变术前治疗的评估及其影响因素[J]. 中国内镜杂志, 2013, 19 (3): 239-242.
79 van Vliet EP, Heijenbrok-Kal MH, Hunink MG, et al. Staging investigations for oesophageal cancer: a meta-analysis[J]. Br J Cancer, 2008, 98 (3): 547-557.
80 张月明, 贺舜, 郝长青, 等. 窄带成像技术诊断早期食管癌及其癌前病变的临床应用价值[J]. 中华消化内镜杂志, 2007, 24 (6): 410-414.
81 余强, 井上晴洋, 工藤進英. 上皮乳头内毛细血管袢形态在食管表浅型病变诊治中的应用[J]. 中华消化内镜杂志, 2013, 30 (3): 145-149.
82 Inoue H. Magnification endoscopy in the esophagus and stomach[J]. Digestive Endoscopy, 2001, 13 (Suppl 1): S40- S41.
83 Arima M, Tada M, Arima H. Evaluation of microvascular patterns of superficial esophageal cancers by magnifying endoscopy[J]. Esophagus, 2005, 2 (4): 191-197.
84 Oyama T, Ishihara R, Takeuchi M, et al. Tu1588 Usefulness of Japan Esophageal Society Classification of Magnified Endoscopy for the Diagnosis of Superficial Esophageal Squamous Cell Carcinoma[J]. Gastrointest Endosc, 2012, 75 (4): AB456.
85 李娟, 祝淑钗, 刘志坤, 等. 18F-FDG PET和CT对食管癌临床分期的价值[J].中国肿瘤临床, 2011, 38 (23): 1449-1452.
86 王旭广, 陈哲. CT和MRI检查对食管癌术前TN分期的价值[J]. 肿瘤, 2005, 25 (3): 281-283.
87 Gillies RS, Middleton MR, Maynard ND, et al. Additional benefit of18F-fluorodeoxyglucose integrated positron emission tomography/computed tomography in the staging of oesophageal cancer[J]. Eur Radiol, 2011, 21 (2): 274-280.
88 Schlemper RJ, Riddell RH, Kato Y, et al. The Vienna classification of gastrointestinal epithelial neoplasia[J]. Gut, 2000, 47 (2): 251-255.
89 Dixon MF. Gastrointestinal epithelial neoplasia: Vienna revisited[J]. Gut, 2002, 51 (1): 130-131.
90 Inoue H, Endo M. Endoscopic esophageal mucosal resection using a transparent tube[J]. Surg Endosc, 1990, 4 (4): 198-201.
91 Inoue H, Endo M, Takeshita K, et al. A new simplified technique of endoscopic esophageal mucosal resection using a cap-fitted panendoscope (EMRC)[J]. Surg Endosc, 1992, 6 (5): 264-265.
92 Oyama T, Tomori A, Hotta K, et al. Endoscopic submucosal dissection of early esophageal cancer[J]. Clin Gastroenterol Hepatol, 2005, 3 (7 Suppl 1): S67- S70.
93 夏芸, 邹晓平, 吕瑛, 等. 内镜下分片黏膜切除术治疗早期食管癌及癌前病变[J]. 中国微创外科杂志, 2012, 12 (3): 197-201.
94 Ishihara R, Iishi H, Uedo N, et al. Comparison of EMR and endoscopic submucosal dissection for en bloc resection of early esophageal cancers in Japan[J]. Gastrointest Endosc, 2008, 68 (6): 1066-1072.
95 Urabe Y, Hiyama T, Tanaka S, et al. Advantages of endoscopic submucosal dissection versus endoscopic oblique aspiration mucosectomy for superficial esophageal tumors[J]. J Gastroenterol Hepatol, 2011, 26 (2): 275-280.
96 Takahashi H, Arimura Y, Masao H, et al. Endoscopic submucosal dissection is superior to conventional endoscopic resection as a curative treatment for early squamous cell carcinoma of the esophagus (with video)[J]. Gastrointest Endosc, 2010, 72 (2): 255-264.
97 Heresbach D, Kornhauser R, Seyrig JA, et al. A national survey of endoscopic mucosal resection for superficial gastrointestinal neoplasia[J]. Endoscopy, 2010, 42 (10): 806-813.
98 周瑞雪, 李素华, 唐平, 等. 内镜下黏膜切除术联合氩离子血浆凝固术治疗早期食管癌及其癌前病变[J]. 中国肿瘤, 2009, 18 (9): 752-755.
99 陈子洋, 刘晓岗, 李易, 等. 内镜黏膜剥离术治疗早期食管癌的临床研究[J]. 华西医学, 2013, 28 (2): 184-186.
100王国清, 郝长青, 王贵齐, 等. 内镜粘膜切除治疗癌前病变和早期食管癌[J]. 中华消化内镜杂志, 2002, 19 (4): 218-220.
101王贵齐, 魏文强, 郝长青, 等. 早期食管癌及其癌前病变内窥镜透明帽法食管黏膜切除术[J]. 中华医学杂志, 2003, 83 (4): 306-308.
102张蕾, 郝长清, 赵德利, 等. 早期食管癌及其癌前病变食管黏膜切除术[J]. 中国消化内镜, 2007, 1 (1): 4-6.
103彭贵勇, 陈磊, 龙庆林, 等. 内镜皮圈套扎法黏膜切除术治疗早期食管癌的临床分析[J]. 第三军医大学学报, 2012, 34 (19): 2009-2011.
104徐子迅. 内镜黏膜切除术治疗早期食管癌和癌前病变的价值[J]. 中国实用医药, 2012, 7 (25): 12-13.
105郑晓玲, 何利平, 梁玮, 等. 内镜下黏膜剥切术联合氩离子血浆凝固术治疗食管早期癌及癌前病变的价值[J]. 中国医学创新, 2012, 9 (12): 23-25.
106洪卫康. 内镜下粘膜分片切除术治疗56例早期食管癌及癌前病变疗效观察[J]. 现代仪器与医疗, 2013, 19 (3): 77-79.
107Zhang YM, Boerwinkel DF, He S, et al. Prospective feasibility study on the use of multiband mucosectomy for endoscopic resection of early squamous neoplasia in the esophagus[J]. Endoscopy, 2013, 45 (3): 167-173.
108Linghu E, Feng X, Wang X, et al. Endoscopic submucosal tunnel dissection for large esophageal neoplastic lesions[J]. Endoscopy, 2013, 45 (1): 60-62.
109Ono S, Fujishiro M, Niimi K, et al. Long-term outcomes of endoscopic submucosal dissection for superficial esophageal squamous cell neoplasms[J]. Gastrointest Endosc, 2009, 70 (5): 860-866.
110周平红, 姚礼庆, 马丽黎, 等. 内镜黏膜下剥离术治疗食管早期癌及癌前病变[J]. 中华消化内镜杂志, 2008, 25 (11): 570-573.
111杜萍, 丁黎葭, 马丽黎, 等. 应用内镜黏膜下剥离术处理食管黏膜病变疗效评价[J]. 生物医学工程与临床, 2012, 16 (1): 29-32.
112李岩, 徐宏伟, 陆喜荣, 等. 内镜黏膜下剥离术治疗早期食管癌及癌前病变[J]. 胃肠病学和肝病学杂志, 2012, 21 (11): 1051-1053.
113廖嘉忠, 邓有辉, 黄培宁, 等. 内镜下黏膜剥离术治疗早期食管癌及癌前病变的临床应用[J]. 中国肿瘤临床与康复, 2012, 19 (5): 451-453.
114李红平, 唐波, 樊超强, 等. 内镜黏膜下剥离术治疗近环周早期食管癌及癌前病变的价值[J]. 第三军医大学学报, 2014, 36 (3): 278-282.
115徐芳媛, 尹成龙, 袁志萍, 等. 内镜黏膜下剥离术治疗早期食管癌及癌前病变的临床评价[J/CD]. 中华消化病与影像杂志(电子版), 2013, 3 (5): 9-14.
116Repici A, Hassan C, Carlino A, et al. Endoscopic submucosal dissection in patients with early esophageal squamous cell carcinoma: results from a prospective Western series[J]. Gastrointest Endosc, 2010, 71 (4): 715-721.
117Joo DC, Kim GH, Park do Y, et al. Long-term outcome after endoscopic submucosal dissection in patients with superficial esophageal squamous cell carcinoma: a single-center study[J]. Gut Liver, 2014, 8 (6): 612-618.
118Eguchi T, Nakanishi Y, Shimoda T, et al. Histopathological criteria for additional treatment after endoscopic mucosal resection for esophageal cancer: analysis of 464 surgically resected cases[J]. Mod Pathol, 2006, 19 (3): 475-480.
119Fujimoto K, Fujishiro M, Kato M, et al. Guidelines for gastroenterological endoscopy in patients undergoing antithrombotic treatment[J]. Dig Endosc, 2014, 26 (1): 1-14.
120Ota M, Ohki T, Nakamura T, et al. Investigation of ulcer healing after esophageal EMR/ESD[J]. Esophagus, 2010, 7 (2): 101-104.
121Hammad H, Kaltenbach T, Soetikno R. Endoscopic submucosal dissection for malignant esophageal lesions[J]. Curr Gastroenterol Rep, 2014, 16 (5): 386.
122Qumseya BJ, Wolfsen C, Wang Y, et al. Factors associated with increased bleeding post-endoscopic mucosal resection[J]. J Dig Dis, 2013, 14 (3): 140-146.
123Esaki M, Matsumoto T, Hirakawa K, et al. Risk factors for local recurrence of superficial esophageal cancer after treatment by endoscopic mucosal resection[J]. Endoscopy, 2007, 39 (1): 41-45.
124Isomoto H, Yamaguchi N, Minami H, et al. Management of complications associated with endoscopic submucosal dissection/endoscopic mucosal resection for esophageal cancer[J]. Dig Endosc, 2013, 25 (Suppl 1): 29-38.
125周瑞雪, 李素华, 唐平, 等. 内镜下黏膜切除术治疗食管早期癌及癌前病变[J]. 现代医药卫生, 2007, 23 (17): 2557-2559.
126张小茜, 朱萱. 早期食管癌癌前病变的EMR治疗研究进展[J]. 中国实用内科杂志, 2005, 25 (12): 1130-1132.
127刘鹏军, 张中平, 周平红. 食管早癌内镜黏膜下剥离术56例临床分析[J]. 中华消化内镜杂志, 2012, 29 (12): 699-701.
128王实, 刘永军, 吴伟, 等. 内镜下黏膜剥离术治疗早期食管癌及癌前病变[J]. 中华胸心血管外科杂志, 2012, 28 (9): 549-550.
129Tamiya Y, Nakahara K, Kominato K, et al. Pneumomedi-astinum is a frequent but minor complication during esophageal endoscopic submucosal dissection[J]. Endoscopy, 2010, 42 (1): 8-14.
130Maeda Y, Hirasawa D, Fujita N, et al. A pilot study to assess mediastinal emphysema after esophageal endoscopic submucosal dissection with carbon dioxide insufflations[J]. Endoscopy, 2012, 44 (6): 565-571.
131Larghi A, Waxman I. State of the art on endoscopic mucosal resection and endoscopic submucosal dissection[J]. Gastrointest Endosc Clin N Am, 2007, 17 (3): 441-469.
132Mizuta H, Nishimori I, Kuratani Y, et al. Predictive factors for esophageal stenosis after endoscopic submucosal dissection for superficial esophageal cancer[J]. Dis Esophagus, 2009, 22 (7): 626-631.
133Ono S, Fujishiro M, Niimi K, et al. Predictors of postoperative stricture after esophageal endoscopic submucosal dissection for superficial squamous cell neoplasms[J]. Endoscopy, 2009, 41 (8): 661-665.
134Shi Q, Ju H, Yao LQ, et al. Risk factors for postoperative stricture after endoscopic submucosal dissection for superficial esophageal carcinoma[J]. Endoscopy, 2014, 46 (8): 640-644.
135Yamaguchi N, Isomoto H, Nakayama T, et al. Usefulness of oral prednisolone in the treatment of esophageal stricture after endoscopic submucosal dissection for superficial esophageal squamous cell carcinoma[J]. Gastrointest Endosc, 2011, 73 (6): 1115-1121.
136Katada C, Muto M, Manabe T, et al. Esophageal stenosis after endoscopic mucosal resection of superficial esophageal lesions[J]. Gastrointest Endosc, 2003, 57 (2): 165-169.
137Ezoe Y, Muto M, Horimatsu T, et al. Efficacy of preventive endoscopic balloon dilation for esophageal stricture after endoscopic resection[J]. J Clin Gastroenterol, 2011, 45 (3): 222-227.
138马丹, 杨帆, 李兆申. 食管内镜黏膜下剥离术后狭窄的发生机制及临床防治的研究进展[J].中华消化内镜杂志, 2014, 31 (10): 606-609.
139Wen J, Lu Z, Yang Y, et al. Preventing stricture formation by covered esophageal stent placement after endoscopic submucosal dissection for early esophageal cancer[J]. Dig Dis Sci, 2014, 59 (3): 658-663.
140Hirdes MM, Siersema PD, van Boeckel PG, et al. Single and sequential biodegradable stent placement for refractory benign esophageal strictures: a prospective follow-up study[J]. Endoscopy, 2012, 44 (7): 649-654.
141Hashimoto S, Kobayashi M, Takeuchi M, et al. The efficacy of endoscopic triamcinolone injection for the prevention of esophageal stricture after endoscopic submucosal dissection[J]. Gastrointest Endosc, 2011, 74 (6): 1389-1393.
142Hanaoka N, Ishihara R, Takeuchi Y, et al. Intralesional steroid injection to prevent stricture after endoscopic submucosal dissection for esophageal cancer: a controlled prospective study[J]. Endoscopy, 2012, 44 (11): 1007-1011.
143Sato H, Inoue H, Kobayashi Y, et al. Control of severe strictures after circumferential endoscopic submucosal dissection for esophageal carcinoma: oral steroid therapy with balloon dilation or balloon dilation alone[J]. Gastrointest Endosc, 2013, 78 (2): 250-257.
144Ohki T, Yamato M, Ota M, et al. Prevention of esophageal stricture after endoscopic submucosal dissection using tissue-engineered cell sheets[J]. Gastroenterology, 2012, 143 (3): 582-588.
145Wen J, Linghu E, Yang Y, et al. Relevant risk factors and prognostic impact of positive resection margins after endoscopic submucosal dissection of superficial esophageal squamous cell neoplasia[J]. Surg Endosc, 2014, 28 (5): 1653-1659.
146郭大昕, 杨建民, 徐启顺, 等. 内镜黏膜下剥离术和内镜下黏膜切除术治疗早期食管癌安全有效性的Meta分析[J]. 中华消化内镜杂志, 2013, 30 (12): 685-689.
147Ishihara R, Iishi H, Takeuchi Y, et al. Local recurrence of large squamous-cell carcinoma of the esophagus after endoscopic resection[J]. Gastrointest Endosc, 2008, 67 (6): 799-804.
148Katada C, Muto M, Tanabe S, et al. Surveillance after endoscopic mucosal resection or endoscopic submucosal dissection for esophageal squamous cell carcinoma[J]. Dig Endosc, 2013, 25 (Suppl 1): 39-43.
149Zhang YM, Bergman JJ, Weusten B, et al. Radiofrequency ablation for early esophageal squamous cell neoplasia[J]. Endoscopy, 2010, 42 (4): 327-333.
150Bergman JJ, Zhang YM, He S, et al. Outcomes from a prospective trial of endoscopic radiofrequency ablation of early squamous cell neoplasia of the esophagus[J]. Gastrointest Endosc, 2011, 74 (6): 1181-1190.
151van Vilsteren FG, Alvarez Herrero L, Pouw RE, et al. Radiofrequency ablation for the endoscopic eradication of esophageal squamous high grade intraepithelial neoplasia and mucosal squamous cell carcinoma[J]. Endoscopy, 2011, 43 (4): 282-290.
152Tanaka T, Matono S, Nagano T, et al. Photodynamic therapy for large superficial squamous cell carcinoma of the esophagus[J]. Gastrointest Endosc, 2011, 73 (1): 1-6.
153王国清, 郝长青, 魏文强, 等. 氩离子热凝固术治疗癌前病变和早期食管癌的远期效果[J].中华肿瘤杂志, 2013, 35 (6): 456-458.
154朱文亮, 赵学科, 韩晶晶, 等. 食管癌高/低发区1981~2010年882例原发性食管腺癌临床病理特征和家族史变化初步分析[J]. 河南大学学报 (医学版), 2012, 31 (3): 213-218.
155郝晓雯, 黄晓俊. 甘肃省近30年间食管癌流行病学分析[J]. 现代预防医学, 2009, 36 (2): 215-216, 219.
156Zhai R, Chen F, Liu G, et al. Interactions among genetic variants in apoptosis pathway genes, reflux symptoms, body mass index, and smoking indicate two distinct etiologic patterns of esophageal adenocarcinoma[J]. J Clin Oncol, 2010, 28 (14): 2445-2451.
157Rubenstein JH, Taylor JB. Meta-analysis: the association of oesophageal adenocarcinoma with symptoms of gastro-oesophageal reflux[J]. Aliment Pharmacol Ther, 2010, 32 (10): 1222-1227.
158Pennathur A, Landreneau RJ, Luketich JD. Surgical aspects of the patient with high-grade dysplasia[J]. Semin Thorac Cardiovasc Surg, 2005, 17 (4): 326-332.
159Pennathur A, Gibson MK, Jobe BA, et al. Oesophageal carcinoma[J]. Lancet, 2013, 381 (9864): 400-412.
160Kubo A, Levin TR, Block G, et al. Dietary antioxidants, fruits, and vegetables and the risk of Barrett’s esophagus[J]. Am J Gastroenterol, 2008, 103 (7): 1614-1623.
161Whiteman DC, Parmar P, Fahey P, et al. Association ofHelicobacterpyloriinfection with reduced risk for esophageal cancer is independent of environmental and genetic modifiers[J]. Gastroenterology, 2010, 139 (1): 73-83.
162Kara MA, Peters FP, Fockens P, et al. Endoscopic video-autofluorescence imaging followed by narrow band imaging for detecting early neoplasia in Barrett’s esophagus[J]. Gastrointest Endosc, 2006, 64 (2): 176-185.
163Song J, Zhang J, Wang J, et al. Meta-analysis of the effects of endoscopy with narrow band imaging in detecting dysplasia in Barrett’s esophagus[J]. Dis Esophagus, 2014.[Epub ahead of print].
164Qumseya BJ, Wang H, Badie N, et al. Advanced imaging technologies increase detection of dysplasia and neoplasia in patients with Barrett’s esophagus: a meta-analysis and systematic review[J]. Clin Gastroenterol Hepatol, 2013, 11 (12): 1562-1570.
165Hoffman A, Korczynski O, Tresch A, et al. Acetic acid compared with i-scan imaging for detecting Barrett’s esophagus: a randomized, comparative trial[J]. Gastrointest Endosc, 2014, 79 (1): 46-54.
166Sharma P, Meining AR, Coron E, et al. Real-time increased detection of neoplastic tissue in Barrett’s esophagus with probe-based confocal laser endomicro-scopy: final results of an international multicenter, prospective, randomized, controlled trial[J]. Gastrointest Endosc, 2011, 74 (3): 465-472.
167Nakagawa K, Koike T, Iijima K, et al. Comparison of the long-term outcomes of endoscopic resection for superficial squamous cell carcinoma and adenocarcinoma of the esophagus in Japan[J]. Am J Gastroenterol, 2014, 109 (3): 348-356.
168Orman ES, Li N, Shaheen NJ. Efficacy and durability of radiofrequency ablation for Barrett’s Esophagus: systematic review and meta-analysis[J]. Clin Gastroenterol Hepatol, 2013, 11 (10): 1245-1255.
169Chadwick G, Groene O, Markar SR, et al. Systematic review comparing radiofrequency ablation and complete endoscopic resection in treating dysplastic Barrett’s esophagus: a critical assessment of histologic outcomes and adverse events[J]. Gastrointest Endosc, 2014, 79 (5): 718-731.
170Pech O. Nonneoplastic and neoplastic Barrett’s esophagus: the European perspective[J]. Dig Dis, 2013, 31 (1): 17-20.
(2015-03-02收稿)
·短篇论著·
通信作者:*本文李兆申,上海长海医院消化内科,Email: zhsli@81890.net;王贵齐,中国医学科学院肿瘤医院内镜科,Email: wangguiq@126.com
DOI:10.3969/j.issn.1008-7125.2015.04.006

