猪干扰素基因的克隆与原核表达载体的构建
牛伟涛
(邢台学院化学工程与生物技术学院,河北邢台 054001)
猪干扰素基因的克隆与原核表达载体的构建
牛伟涛
(邢台学院化学工程与生物技术学院,河北邢台 054001)
干扰素(Interferon)是一种广谱抗病毒剂,具有抗肿瘤、抗病毒和免疫调节等多种作用而被广泛应用于病毒性疾病的预防和治疗。本实验以猪肝脏组织为材料,提取猪肝脏组织DNA,根据GenBank收录的猪干扰素基因序列设计特异性引物,以猪肝脏DNA为模板进行高保真扩增得到IFN基因的ORF片段,然后进行了T载体克隆。再利用引入EcoRⅠ、SalⅠ酶切位点的特异性引物对IFN成熟肽段的基因进行亚克隆,经双酶切、连接、转化后,成功构建了pET28a-ifn原核表达重组质粒,为干扰素基因的原核表达奠定了基础。
猪干扰素基因;基因克隆;表达载体构建
干扰素是一种细胞因子,具备免疫调节、抗病毒和抗肿瘤等作用,它是科学家在1957年研究流感病毒干扰现象时发现的[1]。干扰素是一类分泌型糖蛋白,它主要通过与细胞表面受体相互作用从而使细胞、组织或器官产生一种或几种抗病毒的蛋白,这样便可以增强免疫应答[2]。干扰素主要由激活的胸腺细胞和自然杀伤细胞产生,病毒入侵时,干扰素在短时间内就能让机体处于抗病毒形态,并使机体在1~3周时间内抵制病毒反复感染[3]。生物体中广泛存在干扰素,人、猪、羊等哺乳动物都产生干扰素。我国猪场众多,大小猪病毒性传染病随季节变化危害较大,种类繁多,给很多养殖户造成巨大损失,干扰素就成为医药、兽药市场最具发展前景的一类生物制剂[4]。如果利用基因工程的方法将猪干扰素基因进行原核表达,可以为猪干扰素的应用研究提供坚实的基础。
1 实验器材、试剂
1.1 实验器材
TC-96/G/HLife Express基因扩增仪(杭州博日科技有限公司),BD-1000超微量核酸蛋白分析仪(北京五州东方科技发展有限公司),ZX-2020D凝胶成像分析系统等。
1.2 药品试剂
2×pfu高保真Taq Mix(上海捷瑞生物工程公司);T4 DNA连接酶、DNA Marker(TaKaRa大连公司);PCR产物回收试剂盒、DNA提取试剂盒(上海捷瑞生物工程公司);卡纳青霉素、氨苄青霉素(索莱宝生物科技有限公司)等药品。
2 实验方法
2.1 基因组DNA的提取
取20 mg猪肝脏组织,用冰冷生理盐水洗3次,置于液氮中充分研磨,然后参考DNA提取试剂盒说明书方法进行操作,然后置-20℃保存备用。
2.2 干扰素基因的PCR扩增
2.2.1 引物设计
根据Genbank中的猪干扰素基因序列,利用PrimerPremier5.0设计所需特异性引物。猪干扰素基因ORF序列扩增上游引物为5’ATGGCCCCAACCTCAGCCTTC3’;下游引物为5’TCACTCCTTCTTCCTGAGTCTGTC3’。猪干扰素基因成熟肽序列扩增上游引物为5’CGGAATTCTGCGACCTGCCTCAGAC3’,含EcoRⅠ酶切位点;下游引物为5’GCGTCGACTCACTCCTTCTTCCTGAGTC3’,含SalⅠ酶切位点。
2.2.2 PCR扩增
PCR反应体系为:2×PfuTaq Mix,25μl;上下游引物各2μl,模板为1μl,加dd H2O补齐至50μl;
PCR反应程序为:94℃ 5min;94℃ 30sec,52℃30sec,72℃45sec,30个循环;72℃10min;4℃保存。
2.3 PCR产物的纯化
PCR产物参照PCR产物回收试剂盒说明书进行回收,1%琼脂糖凝胶电泳检测。
2.4 连接与转化
连接反应体系:DNA片段3μl;载体1μl;T4 DNA连接酶0.5μl;10×Buffer 0.5μl;dd H2O,1 μl。16℃连接过夜。用CaCl2法制备DH5α感受态细胞,将连接产物进行转化。
2.5 酶切鉴定
反应体系:重组质粒12μl;重组质粒12μl;EcoRⅠ1μl;SalⅠ1μl;10×Buffer 2μl;dd H2O2μl。37℃,30min。
3 实验结果
3.1 干扰素基因的PCR扩增
利用设计的特异性引物,以猪肝脏基因组DNA为模板,对猪干扰素基因的ORF进行PCR扩增,产物经琼脂糖凝胶电泳检测并,如图1所示,在约570bp的位置出现了特异性扩增带。
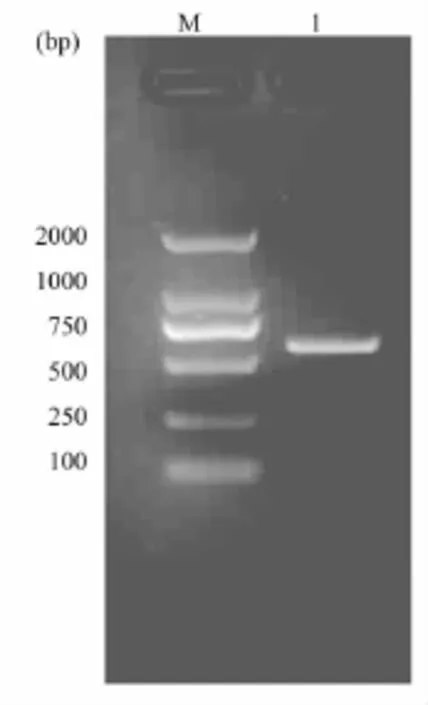
图1 干扰素基因ORF的PCR扩增M:DNA分子量标准;1:PCR产物
3.2 测序结果
将阳性T载克隆进行测序分析,结果显示,成功克隆得到长为570bp的猪干扰素基因的ORF片段,序列如下:
ATGGCCCCATCCTCAACTCTCCTCACGGTCCT GGTGCTGCTCAGCTGCAATGCCATCTGCTGTCTGG GCTGCAACCTGCCTCAGACCCACAGCCTGGCTCAT ACCAGGGCCCTGAGGCTCCTGGCACAAATGAGGA GAATCTCCCCCTTCTCCTGCCTGGACCACAGAAGG GACTTTGGATTCCCCCAAGAGGCCTTGGGGGGCA ACCAGGTCCAGAAGGCTCAAGCCATGGCTCTGGT GCATGAGATGCTCCAGCAGACCTTCCAGCTCTTCA GCACAGAGGGCTCGGCTGCTGCCTGGGATGAGAG CCTCCTGCACCAGTTCTGCACTGGACTGGATCAGC AGCTCAGGGACCTGGAAGCCTGTGTCATGCAGGA GGCGGGGCTGGAAGGGACCCCCCTGCTGGAGGAG GACTCCATCCTGGCTGTGAGGAAATACTTCCACAG ACTCACCCTCTATCTGCAAGAGAAGAGCTACAGC CCCTGTGCCTGGGAGATCGTCAGGGCAGAAGTCA TGAGAGTCTTCTCTTCCTCCACAAACCTGCAAGAC AGACTCAGGAAGAAGGAGTGA
3.3 干扰素成熟肽段基因序列的PCR扩增
利用特异性引物成功扩增到了干扰素成熟肽段基因序列片段,如图2所示。
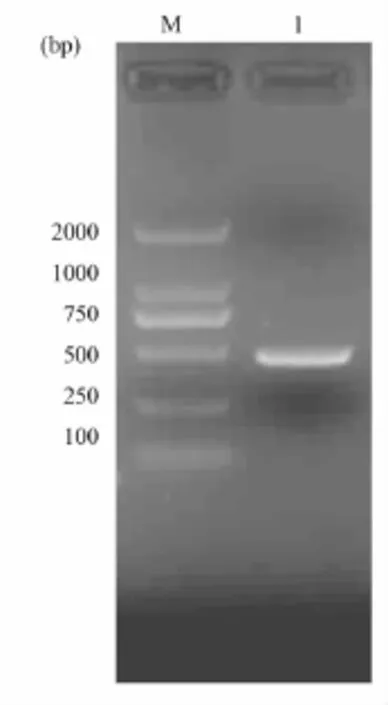
图2 干扰素成熟肽段基因序列的PCR扩增M:DNA分子量标准;1:PCR产物
3.4 重组质粒的鉴定
利用 EcoRⅠ与 SalⅠ限制性内切酶对pET28a-inf重组质粒进行双酶切实验,如图3电泳检测结果显示pET28a-inf重组质粒构建成功。

图3 pET28a-inf重组质粒的鉴定M:DNA分子量标准;1:pET28a-inf质粒的双酶切产物
4 讨论
实验成功克隆得到猪干扰素基因ORF片段,序列长度为570bp。猪干扰素基因ORF中含有信号肽序列,实验中利用特异性引物扩增得到成熟肽的编码序列,扩增产物长度为490bp。限制性双酶切鉴定表明猪干扰素基因已成功插入pET28a载体,成功构建了pET28a-inf表达载体,这为下一步猪干扰素基因能在原核表达系统进行高效表达打下了坚实的基础。
参考文献:
[1]Isaacs A, Lindenmann J. Virus interference I. The interferon [J].Proc R SocLond B BiolSci,1957,147(927):258-267.
[2]MinagawaT,Ishiwata K, Kajimoto T. Feline interferonomega treatment on canine parvovirus infection[J]. Vet Microbiol, 1999,69(122):51-53.
[3]刘运龙,程远国,刘学龙.干扰素研究进展[J].动物医学进展, 2008,29(2):85-89.
[4]梁斌.国内动物干扰素的研究进展[J].甘肃畜牧兽医,2005 , 35(2):39-42.
图4 CPU SFR Memory
图5 Internel Memory
[1]贺敬凯.单片机系统设计、仿真与应用——基于Keil和Proteus仿真平台 [M].西安:西安电子科技大学出版社, 2011.2
[2]李全利.单片机原理及接口技术[M].北京:高等教育出版社,2013.12
[3]余成波.传感器与自动检测技术[M].北京:高等教育出版社,2009.7
[4]丁向荣.C语言程序设计与Keil C [M].广东:广东高等教育出版社,2013.9
[5]徐爱钧.Keil C51单片机高级语言应用编程与实践[M].北京:电子工业出版社,2013.12
[6]耿肇英.C#应用程序设计教程[M].北京:人民邮电出版社, 2010.11
[7]张毅刚.单片机原理及应用——C51编程+Proteus仿真[M].北京:高等教育出版社,2012.11
[8]周润景,蔡雨恬.PROTEUS 入门使用教程[M].北京:机械工业出版社,2011.10
[9]杜树青.基于Proteus和Keil C51的单片机设计与仿真[M].北京:电子工业出版社,2012.2
[10]朱清慧.Proteus教程——电子线路设计、制板与仿真[M].北京:清华大学出版社,2011.6
Q78
A
1672-4658(2015)04-0175-03
2015-6-29
邢台市科学计划项目(2014ZC019);邢台学院科学研究项目(2014)
牛伟涛(1982-),男,讲师,博士在读,主要从事分子生物学与基因工程研究.

