细节决定成败—论新诊断2型糖尿病的短期胰岛素强化治疗策略
刘烈华 李延兵
中山大学附属第一医院内分泌科
细节决定成败—论新诊断2型糖尿病的短期胰岛素强化治疗策略
刘烈华 李延兵
中山大学附属第一医院内分泌科
Stretegies for Short-term Intensive Insulin Therapy in Patients with Newly Diagnosed Type 2 Diabetes : Focus on Pivotal Details

刘烈华 内分泌学博士,中山大学附属第一医院主治医师,主要研究方向为2型糖尿病的早期干预、DPP-4与糖尿病等,主持参与多项国家自然科学基金及省市科研项目,在多个SCI收录杂志发表论著10余篇。
随着经济飞速发展,我国新发糖尿病的人数也呈迅猛升高的态势,最新的流行病学调查结果显示,2型糖尿病的患病率已近十分之一[1]。与西方国家相比,我国2型糖尿病患者具有独特的特征:第一,在诊断时,我国2型糖尿病患者的平均BMI仅约25kg/m2左右,远较西方国家的>30kg/m2为低[1];第二,我国新诊断2型糖尿病患者存在突出的β细胞功能缺陷。据估计,空腹血糖<6.9mmol/L及空腹血糖<9.7mmol/L的中国新诊断2型糖尿病患者,其以早期时相胰岛素分泌评估的β细胞功能已经分别降至正常对照的1/4和1/20。这说明,针对胰岛β细胞功能缺陷的干预,应当作为新诊断2型糖尿病处理的关键进行考虑[2]。此外,我国的饮食结构以碳水化合物供给能量为主,而碳水化合物来源中又以高升糖指数的白米等精制的主食为首,这种饮食结构很容易造成餐后的高血糖,增加β细胞的负担;餐后血糖升高,也是我国2型糖尿病患者血糖谱的一项重要的特征[1]。对新诊断2型糖尿病患者人群的干预,也应该充分地考虑到这些特征。
在诊断伊始就进行短期的胰岛素强化干预治疗可显著改善胰岛β细胞的分泌功能,并在超过一半的患者中可诱导血糖缓解(不使用口服降糖药物血糖仍可达到满意控制)[3],因此这一疗法受到了广泛的重视,并已被我国最新的2型糖尿病防治指南列为新诊断患者的可选治疗手段之一[4]。然而,这一疗法在推广应用方面,还不能让人满意。究其根源,除了医师及患者的旧有观念—胰岛素必须在病程晚期才能应用—需要更新外,很重要的原因是医师对于如何在新诊断患者中进行强化治疗,还缺乏整体的认识;对于强化治疗的技术细节,还没有把握。本文将结合最新的文献以及本单位在此方向多年实践所积累的经验,对新诊断2型糖尿病的胰岛素强化治疗策略作一综述,为这一疗法的临床应用提供参考。
选择合适的人群
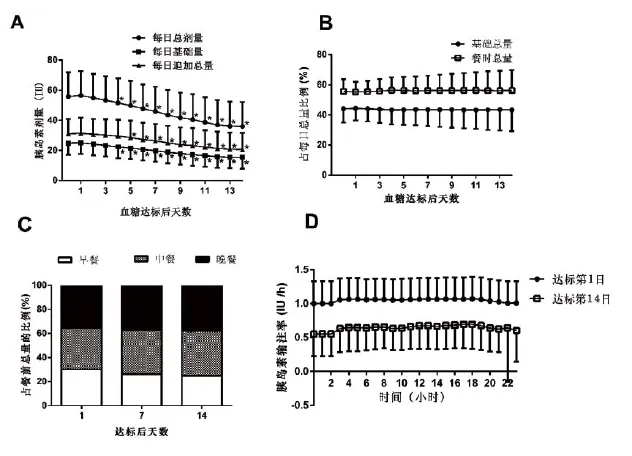
图1 强化治疗过程中的胰岛素输注谱
近年来,2型糖尿病的个体化治疗在各大指南和共识意见中均受到了强调。如ACCORD研究、VADT研究等大型临床研究显示,强化血糖控制并非在所有患者中均能获益,在病程较长、基线情况较复杂、心血管疾病风险较高的患者中,过低的血糖控制甚至可能是有害的[5,6]。采用强化治疗,必须充分权衡利弊和风险。长期强化血糖控制的并发症获益,通常需要长达十年方可显现(心血管事件的获益甚至可能需要20年)[7];而强化治疗需要患者具备较强的自我管理能力、学习能力,并可能在短期内存在一定的低血糖风险,在作出强化治疗的决策之前,必须对患者的病情程度、胰岛功能及胰岛素抵抗情况、并发症情况进行全面的了解和评估,以期作出最有利的选择。在强化前所需进行的评估,本刊有专文论述,此处不予赘言。
目前对于早期胰岛素强化的适应证和禁忌证,还没有完全的定论。一般认为,年龄较轻、基线肥胖或胰岛素抵抗程度较重、一般情况好、低血糖风险及心血管风险较小、预期寿命较长的患者,更可能从强化治疗中获益。对于年龄较大(如>70岁)、既往有心脑血管疾病史(或有明确的辅助检查证据)、严重的慢性并发症或伴发疾病者,应慎用或不采用胰岛素强化降糖治疗,这些患者的降糖目标本就应适当放宽,以避免低血糖等不良事件的发生。
在我国2013版2型糖尿病防治指南中建议,在诊断时空腹血糖>11.1mmol/L,或糖化血红蛋白>9%的患者中可进行胰岛素强化治疗[4]。诚然,这一建议的根据是该部分患者的胰岛功能较差、糖毒性作用明显,强化治疗对胰岛β细胞功能的恢复具有更重大的意义。然而这并不意味着血糖稍低的患者不能进行胰岛素强化治疗。事实上,我们在一项亚组分析中,发现基线空腹血糖在7~11.1mmol/L的患者与空腹血糖>11.1mmol/ L者相比,胰岛素强化治疗后1年缓解率更高,1年随访时胰岛素第一时相分泌也更佳。这说明空腹血糖在7~11mmol/L的患者也可从早期强化治疗中获益[8]。在实际操作中,应结合患者的具体情况进行分析,不必过于拘泥。
制定合理的方案
强化治疗期间的生活方式干预
饮食结构的调整和运动,是所有糖尿病患者治疗的基石。在胰岛素强化治疗期间,饮食和运动调整显得尤为重要。生活方式的改变是和胰岛素的使用相互适应的,进餐和活动量的大幅变异,往往造成胰岛素调整的困难和血糖的波动,最终导致治疗的失败。初诊的患者对于糖尿病管理的知识相对缺乏,这要求治疗团队在治疗前和治疗过程中对患者进行系统的指导教育,教育的内容应包括饮食及营养知识、如何进行合适的运动,以及出现低血糖后的处理。
对于新诊断2型糖尿病的饮食、运动干预细节,本刊已有专文论述。在治疗过程中有几点成败攸关的注意事项:(1)在治疗团队中应有营养师的参与,对医师开具的营养处方进行把控,以确保患者的膳食符合要求。(2)医师在治疗期间除了关注血糖与胰岛素之间的关系、作出迅速的调整外,应当对患者的饮食及运动情况进行详细的观察和记录,并及时作出指导。(3)由于治疗期间的饮食及运动习惯可能与患者的院外生活大相径庭,尤其是治疗初期因热量控制可能产生显著的饥饿感,医师应注意加强沟通和知识传授,避免患者不适当的加餐,加快其对治疗的适应。
初始剂量的设置
既往对糖尿病胰岛素治疗的经验多来源于1型糖尿病和长病程的2型糖尿病。作为一般性的原则,在我国2014年的胰岛素泵治疗指南中建议,2型糖尿病患者(不论病程)起始的全日胰岛素总量可按照0.5~1.0 U/kg体重给予,其中基础胰岛素和餐时胰岛素大致按照1:1进行分配。当然,将这一建议应用于新诊断2型糖尿病患者的胰岛素泵强化治疗中也是可行的。但是如前文所述,我国的2型糖尿病患者具有较鲜明的特色;而作为新诊断的2型糖尿病患者而言,其胰岛功能紊乱及胰岛素抵抗的程度也与长病程患者有显著的不同,故其胰岛素剂量的设定和调整,也应当有其独特之处。
为了探索新诊断2型糖尿病患者胰岛素的用量规律,我们总结了2007-2013年在我中心104例接受短程胰岛素泵强化治疗的新诊断2型糖尿病患者的数据(图1,A-D)[9]。这些患者的基线BMI为25.3±3.0kg/ m2,基线糖化血红蛋白为10.9%±2.1%。我们发现,在血糖达标(定义详见下文)当日,胰岛素的总用量为56.6±16.1U(0.82±0.20U/kg),其中基础胰岛素总量25.2±7.7U(0.37±0.11U/kg),三餐追加总量30.0±10.3U(0.46±0.17U/kg)。采用多元回归模型,我们得到了一个用以估算达标所需胰岛素总量的的公式:
每日总量(U)=0.35×体重(kg)+2.05×空腹血糖(mmol/L)+4.24×甘油三酯(mmol/L)+0.55×腰围(cm)-49.1
采用这一公式所估算得到的总量与实际的用量吻合度良好。为了避免低血糖,可以将此剂量的70%~80%设定为初始胰岛素用量。由图1可见,基础胰岛素可设为24小时均匀分配,三餐前胰岛素的比例也大致为1∶1∶1。此外,如果患者在上泵即刻的血糖显著升高(≥13.9mmol/L),可额外给予2~4U的负荷剂量,以使血糖较快接近所需的目标。
血糖在治疗过程中的迅速、安全及持续的达标对于早期胰岛素强化疗效是至关重要的。治疗的目标是血糖的“正常化”,即空腹血糖4.4~6.1mmol/L,餐后2小时血糖4.4~7.8mmol/L。血糖正常化的目的,是使内源性胰岛素被外源性胰岛素输注完全替代或接近完全替代,从而减少β细胞的分泌负担,减轻糖毒性、β细胞的内质网应激及氧化应激等损伤因素的作用,促使β细胞的自我修复,甚至使一部分发生退化的β细胞(退分化)重新恢复正常的胰岛分泌功能(再分化)[10]。达到这一目的的关键,是治疗期间的密切的血糖监测及积极的胰岛素剂量调整。
在强化治疗期间,应当如何进行指尖微量血糖监测,目前还没有定论。一般而言,胰岛素注射次数越多,就需要越频繁的血糖监测,以应对血糖的高低波动。我们建议,每日至少监测4次以上的血糖,监测时点应该包含空腹血糖和三餐餐后2小时血糖。对住院强化治疗患者常规做法是强化期间每日监测7点血糖:空腹血糖,三餐前及三餐后2小时血糖,睡前血糖。如患者存在低血糖倾向或空腹高血糖,还应加测凌晨3am血糖。患者出现低血糖的临床表现时,应当随时进行血糖监测。如果有条件,可进行动态血糖监测,可对胰岛素剂量进行实时的调整。

表1 胰岛素调整的一般原则,修改自中国胰岛素泵治疗指南2014版
强化治疗期间的胰岛素方案并不是固定不变的。在治疗的早期,常需增加胰岛素的用量以使血糖达标。在达标后,由于高血糖对胰岛素敏感性的影响被解除,大部分患者的胰岛素用量可出现持续下降的趋势,下降的速度大致为1.4±1.0U/天(0.02U/kg/天),基础胰岛素和餐时胰岛素的下降幅度大致是平行的(图1A)。因此,在治疗过程中,胰岛素的剂量应该依照此规律,在密切的血糖观察下每日进行调整。胰岛素调整的一般性原则如表1所示。
坚持长久的干预(饮食、运动和随访)
短期强化治疗的疗程目前也还没有定论,2周至3个月均有报道[11]。长期胰岛素可能带来体重增加等副作用,因而并不推荐超过3个月的方案。目前较为广泛接受的意见是,血糖达标后,维持接近正常的血糖2周后停用胰岛素。在强化后若仅仅采用饮食运动控制,绝大部分患者(约80%)能维持血糖在理想的水平内。(空腹血糖<7mmol/L,餐后2小时血糖<10mmol/ L,A1C<7%),称为血糖缓解。然而,必须指出的是,短期胰岛素强化治疗并不能治愈2型糖尿病。强化治疗后约有80%左右的患者能获得即时的血糖缓解,然而缓解率随着时间的推移逐渐下降,在治疗后1年,缓解率约为50%;维持2年缓解者约占40%,极少患者能维持8年以上的缓解[12,13]。因此,在治疗后仍应要求患者坚持良好的生活方式,同时密切的随访和及时的处理都是必须的。
既然强化治疗后,缓解率随着时间的推移逐渐下降,为了增加血糖的长期控制率,巩固强化治疗的效果,是否需要联用口服降糖药物、联用何种药物、何时进行药物联用,是一系列崭新的话题,这方面的文献报道不多。在一项随机对照研究中[14],我们将160例新诊断2型糖尿病患者随机分为单纯胰岛素泵组、胰岛素泵联用α硫辛酸组、胰岛素泵联用二甲双胍组和胰岛素泵联用罗格列酮组,α硫辛酸2周,二甲双胍及罗格列酮疗程持续至停泵后3个月。初步的结果发现,联用二甲双胍治疗可更显著地改善停药后的胰岛功能指标(AIR及HOMA-B),而联用罗格列酮则可更显著地改善胰岛素抵抗的指标,如HOMA IR和骨骼肌内的脂肪含量。联用二甲双胍或罗格列酮治疗的患者,在停泵3月时维持满意血糖控制的比例与停泵后单纯进行生活方式调整的患者相比有升高的趋势,然而这一趋势没有达到统计学差异。我们还尝试了GLP-1类似物利拉鲁肽的短期联用方案。但是,结果让人略感失望:使用GLP-1类似物尽管在治疗期间能更好地改善β细胞功能,然而在停药后,这一获益迅速丧失,血糖水平也显著反弹[14]。就现有的数据来看,使用胰岛素增敏剂作为胰岛素泵强化治疗的联合或序贯治疗,或是较好的选择。
总结与展望
在2型糖尿病的早期进行的短程胰岛素强化治疗诞生至今已有接近20年的历史。尽管在许多方面仍有待阐明及改进,这一疗法给患者带来的获益是实实在在的,具有推广的价值。其中成败关键,在于医疗团队对于这一疗法的深刻理解,以及对治疗过程中细节的把控。强化治疗是2型糖尿病治疗的良好开端,血糖的长治久安,则需要医患双方的密切配合和共同努力。
1 Yang W, Lu J, Weng J, et al. Prevalence of diabetes among men and women in China. N Engl J Med,2010,362(12):1090-1101.
2 中国胰岛素分泌研究组. 中国新诊断2型糖尿病胰岛素分泌和胰岛素抵抗特点调查. 中华内分泌代谢杂志,2008,24(3):256-260.
3 Weng J, Li Y, Xu W, et al. Effect of intensive insulin therapy on beta-cell function and glycaemic control in patients with newly diagnosed type 2 diabetes: a multicentre randomised parallel-group trial. Lancet,2008,371(9626):1753-1760.
4 中国2型糖尿病防治指南(2 0 1 3年版). 中华糖尿病杂志,2014,6(7):447-498.
5 Duckworth W, Abraira C, Moritz T,et al. Glucose control and vascular complications in veterans with type 2 diabetes. N Engl J Med, 2009,360(2):129-139.
6 Gerstein HC, Miller ME, Byington RP, et al. Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med, 2008,358(24):2545-2559.
7 Holman RR, Paul SK, Bethel MA, et al. 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med, 2008,359(15):1577-1589.
8 李延兵, 曾龙 , 时立新, 等. 早期强化治疗对不同血糖水平新诊断2型糖尿病患者胰岛β细胞功能和预后的影响. 中华内科杂志, 2010,49(1):9-13.
9 Liu L, Ke W, Wan X, et al. Insulin requirement profiles of short-term intensive insulin therapy in patients with newly diagnosed type 2 diabetes and its association with long-term glycemic remission. Diabetes Res Clin Pract,2015,108(2):250-257.
10 Wang Z, York NW, Nichols CG, et al. Pancreatic beta cell dedifferentiation in diabetes and redifferentiation following insulin therapy. Cell Metab,2014,19(5):872-882.
11 Weng J, Retnakaran R, Ariachery CA, et al. Short-term intensive insulin therapy at diagnosis in type 2 diabetes: plan for filling the gaps. Diabetes Metab Res Rev, 2014 Sep 8 [Epub ahead of print]
12 Kramer CK, Zinman B, Retnakaran R. Short-term intensive insulin therapy in type 2 diabetes mellitus: a systematic review and meta-analysis. Lancet Diabetes Endocrinol,2013,1(1):28-34.
13 Li Y, Xu W, Liao Z, et al. Induction of long-term glycemic control in newly diagnosed type 2 diabetic patients is associated with improvement of beta-cell function. Diabetes Care, 2004,27(11):2597-2602.
14 Huang Z, Wan X, Liu J, et al. Short-term continuous subcutaneous insulin infusion combined with insulin sensitizers rosiglitazone, metformin, or antioxidant alpha-lipoic acid in patients with newly diagnosed type 2 diabetes mellitus. Diabetes Technol Ther, 2013,15(10):859-869.
10.3969/j.issn.1672-7851.2015.06.008

