中华绒螯蟹卵巢发育期间两种雌激素受体在卵巢和肝胰腺的分布及变化
柳梅梅吴旭干刘智俊陈 浩成永旭, 2
(1. 上海海洋大学省部共建水产种质资源发掘与利用教育部重点实验室, 上海 201306; 2. 上海海洋大学上海高校知识服务平台, 上海 201306)
中华绒螯蟹卵巢发育期间两种雌激素受体在卵巢和肝胰腺的分布及变化
柳梅梅1吴旭干1刘智俊1陈 浩1成永旭1, 2
(1. 上海海洋大学省部共建水产种质资源发掘与利用教育部重点实验室, 上海 201306; 2. 上海海洋大学上海高校知识服务平台, 上海 201306)
大量脊椎动物的研究结果表明, 雌激素是通过和靶器官中的雌激素受体(ER)结合来直接和间接调控卵巢发育[10]。有研究表明, 甲壳动物卵巢、肝胰腺、神经系统和内分泌系统等多种组织中存在ER或ER类似物, 且免疫活性与卵巢发育阶段具有相关性, 推测认为甲壳动物的雌激素可能也是通过与 ER结合来调控卵巢发育[11—14]。中华绒螯蟹简称河蟹, 是我国重要的养殖蟹类, 具有较高的经济价值, 其养殖过程中存在一龄蟹性早熟和二龄成蟹卵巢发育不良等问题, 这严重影响着河蟹养殖的经济效益[15, 16], 而河蟹性早熟和卵巢发育不良可能与雌二醇分泌有关[6, 17]。尽管雌二醇存在于河蟹雌体的卵巢和肝胰腺等多种组织中, 且其含量与卵巢发育阶段有关[4, 17],但是有关其对卵巢发育的作用机制不详。鉴于此, 本实验采用免疫印迹和免疫组织化学的方法对河蟹的 ER进行了识别与定位, 较系统研究了河蟹卵巢发育周期内ER在卵巢和肝胰腺内的分布与变化, 旨在为进一步探讨雌激素及其受体在河蟹卵巢发育中的调控机制提供基础资料。
1 材料与方法
1.1 实验动物与暂养
实验用蟹均取自于上海海洋大学崇明河蟹实验基地。采样时间为2013年7月—2014年1月, 每月挑选5—10只肢体健全的雌蟹用于实验, 体重为 47—135 g, 甲壳长为4.3—6.1 cm。实验用蟹均活体运输至上海海洋大学甲壳动物营养繁殖实验室, 在室内循环水养殖系统中暂养两周后用于实验, 暂养水族箱体积为178 L (长×宽×高为75 cm×53 cm×45 cm), 水体体积为120 L左右, 箱底部铺5 cm厚的细沙供蟹潜伏, 同时放置2段无毒PVC管(直径18 cm, 长25 cm) 作为隐蔽物, 每箱放2—3只蟹, 暂养期间每日下午 19:00按照蟹体重的 3%—5%投喂配合饲料,次日上午10点清理残饵和粪便, 水源为曝气后的自来水,自然光照, 实验期间水温为14—24℃, pH 7.0—9.0, 溶氧>5 mg/L; 氨氮<0.5 mg/L, 亚硝酸盐<0.10 mg/L。
1.2 实验取样与卵巢分期
实验用蟹暂养后进行活体解剖。解剖前先用电子天平称重, 然后测量其甲壳长、甲壳宽。解剖后取出所有的卵巢组织, 准确称重并记录卵巢颜色, 据此计算卵巢指数(GSI/%=100×卵巢质量/蟹质量) 。同时取小块卵巢、肝胰腺和肌肉, PBS漂洗后固定在Bouin氏液中。根据文献[18, 19]的分期方法将河蟹的卵巢发育分为 5期, 每个卵巢分期发育阶段均重复固定 3—5只蟹的相关组织, 以用于后续免疫组化实验。
1.3 主要试剂
1938年4月3日,熊式辉曾向蒋介石提出:“本党成立将近三十年,由革命党改为政党,现在却一不像美之共和民主等政党,二不像苏俄之共产革命专政党,三不像德意之纳粹党及法西斯党,实际并以上三种性质兼有而不俱全,以此来与民社等政党及凭借武力革命之共产党相周旋,一切政治施为,固难求其适应。”㉞蒋介石侍从室的高级幕僚唐纵在1944年4月28日的日记中也提到,“目今党何以不能在政治上起领导作用?党的上层干部,对于主义政策的认识,并不彻底。由革命到取得政权,思想和观念已为之大变,现在大家的观念是现实问题。上级干部在追求权位,下级同志在追求生活。主义、政治、革命,都已忘却了! 消失了!”㉟
免疫印迹试剂 一抗分别为兔抗人的雌激素 α受体(ERα, 抗C端20个氨基酸,编号:sc-543)和雌激素β受体(ERβ, 抗N端1—150氨基酸,编号sc-8974),两种多克隆抗体均购于美国Santa Cruz生物公司; 二抗为HRP标记的羊抗兔IgG抗体(编号HSA0004)、彩色预染的标准蛋白(编号PRT0670)购于上海麦约尔生物技术有限公司; 凝胶配置试剂盒(编号 WB0130)购于维奥(上海)生物科技有限公司; 全蛋白提取试剂盒(编号AR0101-30)、RIPA裂解液(编号 WB0103)、SDS-PAGE蛋白上样缓冲液(编号AR1112)、TBS (编号AR0193)、TBST (编号AR0195)、PBS (10 mmol/L, pH 7.2—7.6, 编号AR0030)、DAB试剂盒(编号AR1021)购自武汉博士德生物工程有限公司。免疫印迹缓冲液包括SDS-PAGE蛋白上样缓冲液、TBS及TBST。
免疫组化试剂 一抗同免疫印迹, 二抗 HRP标记的羊抗兔IgG抗体工作液(编号PV-9001)和一抗稀释液(编号 ZLI-9028) 购于北京中杉金桥生物技术公司, 3%双氧水(编号 AR1108)、DAB显色试剂盒(编号 AR1022)、0.01 mol/L枸橼酸盐缓冲液(pH6.0, 编号 AR0024)和0.01 mol/L的PBS缓冲液(pH7.2—7.6, 编号AR0030)购于武汉博士德生物工程有限公司。免疫组化缓冲液包括PBS与枸橼酸盐缓冲液。
1.4 免疫印迹
分别取卵巢处于Ⅱ期的雌蟹卵巢和肌肉(约 0.1 g左右)加入1 mL蛋白提取液(编号 AR0101-30)提取蛋白, 提取方法按照试剂盒说明书进行, 蛋白提取液离心后采用微量紫外分光光度计(型号 Q5000, 美国 Quawell公司生产)测定蛋白浓度, 然后用于免疫印迹或保存于–70℃冰箱中备用。
将蛋白提取物与上样缓冲液按4︰1 (体积比)混合后沸水变性10min, 分别取样品和标准蛋白20 μL及5 μL进行SDS-PAGE电泳, 浓缩胶浓度为5%, 电压为90V; 分离胶浓度为10%, 电压为110 V, 电泳后分离胶用转膜仪(型号: BG-VER-Mini, 北京百晶生物技术有限公司生产) 在150 mA电流下转膜70—100min, 然后将膜用TBS浸洗后置于 5%的脱脂奶粉溶液中, 室温下用摇床摇动封闭 1h, TBST浸洗后, 加入一抗(稀释体积比1︰200) 4℃下摇动孵育 12h; TBST浸洗后, 加二抗(稀释体积比 1︰800), 在37℃下孵育2h; TBST浸洗后用DAB显色, 数码相机拍照后采用BioRad imagelab V3.0软件计算ER分子量。
1.5 免疫组化
取 Bouin氏液固定 24h后的组织进行酒精梯度脱水,二甲苯透明, 石蜡包埋后采用 Leica切片机(型号 Leica RM2125RTS, 德国Leica公司生产)进行连续切片, 切片厚度为 5—7 μm。切片常规脱蜡至水后, 浸入枸橼酸盐缓冲液中在94℃条件下保持15min进行抗原热修复, 自然冷却至室温后取出切片用PBS洗涤3次(2—5 min/次)。再用3%的双氧水室温处理 20min 以抑制内源性过氧化物酶的活性, PBS洗涤3次(2—5 min/次)后滴加ER抗体(稀释体积比1︰50), 4℃孵育过夜(18h)。PBS漂洗3次后(2—5 min/次)滴加二抗工作液一, 在37℃条件下孵育20min; PBS漂洗3次后(2—5 min/次), 滴加二抗工作液二, 37℃条件下孵育20min; DAB显色15min后于显微镜下观察显色效果。显色后的切片用蒸馏水洗涤后采用酒精梯度脱水, 二甲苯透明,中性树胶封片后在Leica DM2500显微镜下观察和拍照。根据染色的深浅, 将阳性强弱分为强阳性、中等阳性、弱阳性和阴性, 分别记为“+++”、“++”、 “+”和“–”。
2 结果
2.1 ER的免疫印迹
为了防止ERα和ERβ的交叉反应, 本研究分别采用基于ERα蛋白C端(对应于其基因的E/F区) 氨基酸残基设计的兔抗人ERα多克隆抗体和基于ERβ蛋白N端(对应于其基因的A/B区)氨基酸残基设计的ERβ多克隆抗体, ERα和 ERβ这两段氨基酸残基的序列差异较大, 因此这两者发生交叉反应的概率较低。免疫印迹实验结果表明,河蟹卵巢中分别存在 ERα和ERβ的免疫阳性条带各一条,其分子量约为70和80 kD左右(图1)。分别采用牛血清蛋白和河蟹肌肉作为同步对照, 结果均为阴性。
2.2 ER在卵巢中的分布和变化
在卵巢发育过程中, ERα主要分布于卵巢中的滤泡细胞、中期卵母细胞胞质(Ⅱ-Ⅳ期)和后期卵母细胞核(Ⅲ-Ⅴ期), 不同卵巢发育阶段卵巢中ERα的分布和阳性强度也有所不同(表 1)。Ⅰ期卵巢中以卵原细胞为主, 卵原细胞中未发现 ERα阳性, 此期生发区间可见滤泡细胞, 滤泡细胞呈ERα中等阳性(图版Ⅰ-1); Ⅱ期卵巢中以内源性卵黄合成期卵母细胞(EN)和卵黄合成前卵母细胞(PRO)为主, 生发区间的滤泡细胞已开始向生发区内迁移, 部分已分布于卵母细胞周围, 此期卵母细胞的胞质呈 ERα强阳性反应,滤泡细胞仍为 ERα中等阳性(图版Ⅰ-2, 3);Ⅲ期卵巢中以外源性卵母细胞(EX)为主, 此时滤泡细胞已完成对卵母细胞的包裹, 此阶段 ERα阳性物质主要分布于滤泡细胞和EX的细胞质, EX的细胞核为ERα弱阳性反应(图版Ⅰ-4, 4a); Ⅳ期卵巢中以近成熟期卵母细胞(NO)为主, 滤泡细胞紧贴在NO周围, 此时EX细胞质的ERα免疫阳性减弱至弱阳性, 而细胞核中增强至中等阳性(图版Ⅰ-5, 5b); Ⅴ期卵巢中主要为成熟的卵母细胞(MO), 此期卵母细胞仅核中呈 ERα弱阳性, 此期由于Ⅴ期卵巢中的滤泡细胞和细胞膜融合, 故切片中很难发现(图版Ⅰ-6)。
在卵巢发育过程中, ERβ免疫阳性的变化规律和ERα有所不同, 其免疫阳性强度明显低于ERα (表2)。Ⅰ期卵巢中滤泡细胞呈ERβ弱阳性(图版Ⅰ-7); Ⅱ期卵巢中卵母细胞胞质中呈 ERβ的中等阳性反应(图版Ⅰ-8, 9), 滤泡细胞仍为ERβ弱阳性; Ⅲ期卵巢中的ERβ阳性物质主要分布于EX的细胞核和EN的细胞质(图版Ⅰ-10); Ⅳ期卵巢中的滤泡细胞和卵母细胞质均呈ERβ弱阳性, 卵母细胞核则为ERβ中等阳性(图版Ⅰ-11, 11c); Ⅴ期成熟卵母细胞(MO)质中基本无ERβ阳性, 卵母细胞核中为ERβ弱阳性(图版Ⅰ-12)。

图1 中华绒螯蟹卵巢和肌肉中ER的免疫印迹分析Fig.1 Western blotting results of two ERs in the ovary and muscle of the ovarian stage Ⅱ Chinese mitten crab Eriocheir sinensis
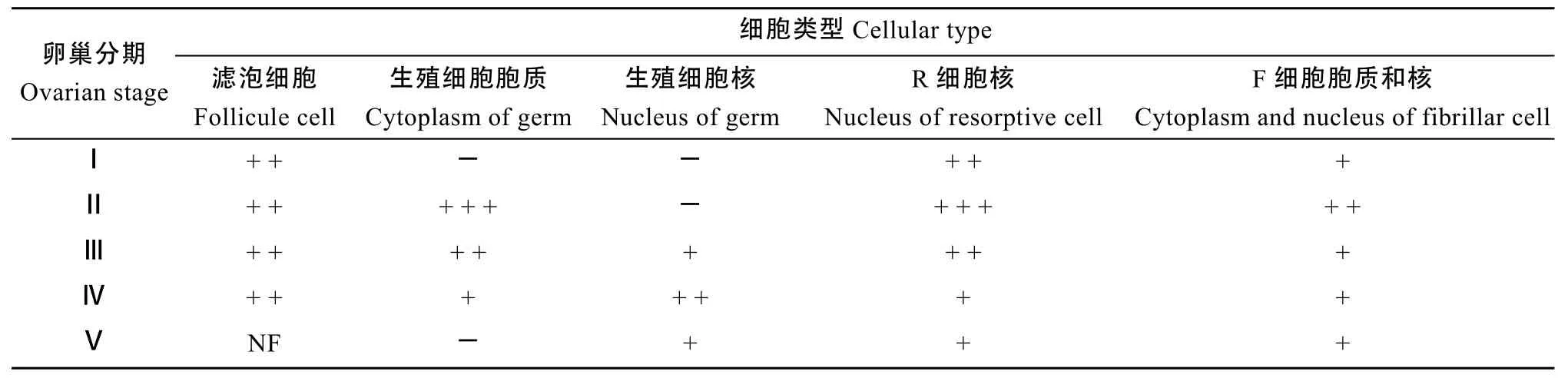
表1 中华绒螯蟹卵巢发育期间卵巢和肝胰腺细胞中的ERα分布和变化Tab. 1 The distribution and change of ERα on the ovary and hepatopancreas during the ovarian development of Eriocheir sinensis
2.3 ER在肝胰腺中的分布和变化
在卵巢发育过程中, ERα免疫阳性反应主要分布于F细胞和R细胞核(表1, 图版Ⅱ-1-6)。Ⅰ期肝胰腺中R细胞核呈 ERα中等阳性, F细胞为弱阳性(图版Ⅱ-1); Ⅱ期肝胰腺R细胞核为ERα强阳性, F细胞呈ERα中等阳性(图版Ⅱ-2); Ⅲ期肝胰腺R细胞核为ERα中等阳性, F细胞为ERα弱阳性(图版Ⅱ-3); Ⅳ期和Ⅴ期肝胰腺F细胞及R细胞核均呈ERα弱阳性(图版Ⅱ-4-6)。
在卵巢发育过程中, 肝胰腺中 ERβ免疫阳性的变化规律和ERα略有相似, 但又有所不同(表2, 图版Ⅱ-7-12)。Ⅰ期肝胰腺中R细胞核为弱阳性, F细胞为中等阳性(图版Ⅱ-7), 这与ERα在Ⅰ期肝胰腺的阳性强度不同;Ⅱ期肝胰腺的R细胞核和F细胞均为ERβ中等阳性(图版Ⅱ-8); Ⅲ期肝胰腺R细胞核和F细胞均为ERβ强阳性(图版Ⅱ-9); Ⅳ期肝胰腺F细胞及R细胞核中的ERβ免疫活性减为中等阳性(图版Ⅱ-10); Ⅴ期肝胰腺中 F细胞和 R细胞核中 ERβ阳性进一步降低, 为弱阳性(图版Ⅱ-11,12)。
3 讨论
3.1 ER的种类及分子量
脊椎动物的雌激素核受体包含ERα、ERβ和ERγ三种亚型, 它们可能都是由原始的ER基因通过复制进化而来的, 其中ERγ为硬骨鱼类特有, ERα和ERβ在鱼类、两栖类、爬行类、鸟类和哺乳类中广泛存在, 对其生殖调控具有极其重要的作用[20]。大量研究表明, 哺乳动物的ERα 和 ERβ的组织分布和生理功能有所不同[21, 22], 小鼠的ERα主要影响乳腺发育和泌乳, 而 ERβ主要调控排卵效率[23]。而有关甲壳动物 ER的研究较少, 且主要集中于ERα的免疫组化[11—14]。本实验采用兔抗人的ERα和ERβ多克隆抗体分别进行免疫印迹分析, 结果发现在河蟹卵巢组织中分别存在一个ERα和ERβ免疫条带, 其分子量分别为70和80 kD左右, 这与三疣梭子蟹(Portunus trituberculatus) Erα (53 kD)和Erβ (120 kD) 的分子量有一定的差异[24], 河蟹 ERα的分子量与欧洲淡水螯虾(Cherax albidus)和钩虾(Gammaridae fossarum)的较为接近, 后两者ERα的分子量分别为67和62 kD分子量[11, 25]。不同物种同一 ER亚型的分子量差异可能是由于其基因进化过程中的剪切和变异造成的[23]。尽管ERα和ERβ在某些结构域上高度相似, 如DNA结合区(C/D区), 但是其转录激活区(A/B区)和配体结合区(E/F区)差异较大, 小鼠 ERα
和ERβ在这两个结构域的相似度仅为53%和30%[26]。本实验所选用的兔抗人ERα和ERβ抗体, ER抗原分别是依据C端20个氨基酸残基(E/F区)和N端1—150氨基酸残基(A/B区)设计而成, 由于ERα和ERβ的这两段氨基酸残基差异较大, 因此在本实验中ERα和ERβ的特异性相对较强, 可以避免两者免疫印迹的交叉反应。
3.2 ER在卵巢和肝胰腺中的分布变化与卵巢发育的关系本研究结果表明河蟹卵巢发育过程中卵巢和肝胰腺中存在ERα和ERβ, 且免疫阳性与卵巢发育阶段有关, 但是两者免疫活性的变化规律略有不同。在整个河蟹卵巢发育过程中, 生殖细胞中的ERα和ERβ均由胞质向胞核迁移, 两者在胞核中的最大免疫阳性均出现在Ⅳ期(卵黄发生旺期)。造成以上现象的可能原因为, 雌激素与ER结合后必需与细胞核中的雌激素反应元件(Estrogen response element, ERE)结合才能启动卵黄蛋白原(Vg)等基因的转录调控[25], 因此ER需要从细胞质向细胞核迁移从而启动基因组调控模式, 因此其细胞核中的最高免疫阳性出现在卵黄发生旺期(Ⅳ期卵巢)。先前的研究表明, 河蟹卵巢中雌激素的最高含量通常出现在Ⅲ-Ⅳ期[6], 且外源雌二醇活体注射实验也证实雌二醇主要促进河蟹Ⅲ期卵巢发育, 而河蟹ERα和ERβ的最高免疫阳性主要出现在Ⅳ期,
这与雌二醇的含量峰值出现时间相比具有一定滞后性。这可能因为卵巢中雌二醇诱导ER基因转录及蛋白表达需要一个过程, 此外雌二醇除了通过ER调控卵黄发生外, 还具有其他多种生理功能[1], 因此河蟹卵巢中的雌激素含量峰值与其受体的最大免疫阳性出现时间并不完全一致。
卵巢组织的滤泡细胞中始终存在 ERα免疫阳性, 且免疫活性与卵巢发育阶段关系不大, 推测其原因为: (1)滤泡细胞可能是甲壳动物雌二醇和卵黄蛋白原的合成位点或中转位点之一[27—29], 肝胰腺合成的卵黄蛋白原通过血淋巴运输至滤泡细胞并进行加工, 然后通过滤泡细胞将卵黄物质间接传递给卵母细胞[6, 30]; (2)由于卵巢发育过程中滤泡细胞中始终存在雌二醇, 因此雌二醇诱导滤泡细胞中ER的合成, ER可能进一步通过与滤泡细胞中的雌激素反应元件(Estrogen response element, ERE)结合从而实现调控卵黄蛋白原合成等功能[31]。此外, 整体上河蟹卵巢组织中的 ERα的免疫阳性强于 ERβ, 这与哺乳动物中的结果一致, 这可能是由于ERα和ERβ在卵巢发育过程中承担的生理功能不同造成的[32]。

表2 中华绒螯蟹卵巢发育期间卵巢和肝胰腺细胞中的ERβ分布和变化Tab. 2 The distribution and change of ERβ on the ovary and hepatopancreas during the ovarian development of Eriocheir sinensis
甲壳动物的肝胰腺不仅是营养物质的消化、吸收和储存器官, 且在生殖内分泌方面也扮演着重要的作用[33, 34]。有研究表明河蟹肝胰腺是外源性卵黄发生期(Ⅲ-Ⅳ期)卵黄蛋白原的主要合成场所, 但尚不清楚肝胰腺中何种细胞可以合成Vg[30, 35]。本研究结果表明, ER阳性物质分布在肝胰腺的F细胞和R细胞中, 这可能是因为F细胞和R细胞均是河蟹外源Vg的合成位点, 类似的现象已经在三疣梭子蟹中被基本证实[24]。尽管ERα和ERβ在肝胰腺两种细胞中的免疫阳性均呈先上升后下降趋势, 但是两者的免疫阳性峰值发生阶段有所不同, ERβ最高峰值出现在Ⅲ期(外源性卵黄合成期, 肝胰腺中大量合成 Vg), 这暗示ERβ在肝胰腺中的免疫阳性增强可能与 Vg合成有关[35]; ERα最高免疫阳性出现在Ⅱ期, 此时肝胰腺处于Vg合成前的准备阶段, 但此阶段肝胰腺中无 Vg合成, 其功能由此前的消化吸收和营养代谢过渡到增加了卵巢发育的调控功能[19], 因此ERα在肝胰腺中可能不直接参与Vg的合成调控, 而是通过其他途径调控卵巢发育。另外, 在卵巢发育过程中, 各期肝胰腺的F细胞和R细胞中均存在ERα 和ERβ, 这也暗示着这两种ER在河蟹卵巢发育过程中起着广泛的生理作用。
3.3 雌激素及ER对卵巢发育的作用机制
众所周知, 在脊椎动物中, 雌激素只有与ER结合才能行使一系列的生理功能[25]。经典的雌激素生殖调控机制为ER基因组调控模式, 它包括配体依赖途径和非配体依赖途径两种[36, 37]。配体依赖途径(Ligand-dependent) 是指核内的ER与配体结合后, 形成活化的同源二聚体, 该二聚体与核内的雌激素反应元件(Estrogen response element, ERE)结合, 由于ERE通常是靶基因调节区的增强子,因此ER可以通过与配体结合参与靶基因的转录调控[38]; 非配体依赖途径(Ligand-independent) 是指动物体内一些多肽激素也能激活ER而促进靶基因表达, 如: 表皮生长因子(EGF)、胰岛素样生长因子-1(IGF-1)和胞内信使类似物等[36]。近年来, 非基因组调控模式在鱼类和哺乳动物中也被报道, 非基因组调控模式也称为膜受体作用模式, 是指雌激素通过与细胞膜上的ER结合后, 在几分种甚至几秒内直接激活细胞内的信号通路, 如改变细胞内的cAMP、MAKP和Ca2+等第二信使的浓度, 从而改变细胞内蛋白功能和调控基因表达, 最终影响卵巢发育, 这种雌激素受体称之为膜受体(mER)[37]。迄今为止, 有关雌激素对甲壳动物卵巢发育的研究主要集中在外源雌激素对卵巢发育和卵黄发生的影响,
有关其作用机制尚停留在推测和探讨阶段[4, 9, 31]。近 10
年来, 通过采用哺乳动物的ER核受体进行免疫组化定位,
已经在多种甲壳动物的卵巢、肝胰腺、神经组织和内分泌器官等多种组织中发现 ERα广泛存在, 且免疫阳性强度和卵巢发育阶段有关[11, 13, 14, 24], 这暗示甲壳动物体内可能存在 ERα, 且参与了卵巢发育的调控[12, 31]。本研究结果表明, 在河蟹卵巢发育过程中, 卵巢和肝胰腺中始终存在ERα和ERβ的免疫阳性, 且肝胰腺中两者阳性强度的变化模式有所不同。这暗示ERα和ERβ可能都参与了河蟹的卵巢发育调控, 它们除了促进 Vg合成外, 可能还具有其他作用, 但ERα和ERβ在河蟹卵巢发育过程中的生理功能可能存在差异。根据河蟹卵巢发育过程中, 卵巢中的ERα和ERβ的免疫阳性由细胞质向细胞核迁移, 且免疫阳性和卵巢发育阶段密切相关的事实, 作者推测河蟹ER对其卵巢发育的调控可能属于ER核受体的基因组调控模式。
[1] Nagaraju G P. Reproductive regulators in decapod crustaceans: an overview [J]. The Journal of Experimental Biology, 2011, 214(1): 3—16
[2] Lu J F, Zhao W X. Effect and regulation of reproductive hormones on ovary in decapod crustacean [J]. Journal of Shanghai Fisheries University, 2001, 10(2): 166—171 [陆剑锋, 赵维信. 十足目甲壳动物生殖激素对卵巢的作用及其调控. 上海水产大学学报, 2001, 10(2): 166—171]
[3] Janer G, Porte C. Sex steroids and potential mechanisms of non-genomic endocrine disruption in invertebrates [J]. Ecotoxicology, 2007, 16(1): 145—160
[4] Shen B J, Yang X Z, Wu X G, et al. The effects of exogenous 17β-estradiol on ovary development and on the level of endogenous 17β-estradiol in Eriocheir sinensis [J]. Journal of Shanghai Ocean University, 2010, 19(3): 289—295 [沈蓓杰,杨筱珍, 吴旭干, 等. 外源17β-雌二醇对中华绒螯蟹Ⅲ-Ⅳ期卵巢发育以及内源雌激素水平的影响. 上海海洋大学学报, 2010, 19(3): 289—295]
[5] Quinitio E, Hara A, Yamauchi K, et al. Changes in the steroid hormone and vitellogenin levels during the gametogenic cycle of the giant tiger shrimp, Penaeus monodon [J]. Comparative Biochemistry and Physiology Part C: Pharmacology, Toxicology and Endocrinology, 1994, 109(1): 21—26
[6] Lu J F, Chang G L, Wu X G, et al. Hormonal regulations of ovarian development and vitellogenesis in Chinese mitten crab (Eriocheir sinensis) feed on two different diets [J]. Oceanologia et Limnologia Sinica, 2010, 41(4): 505—512[陆剑锋, 常国亮, 吴旭干, 等. 两组不同饲料对中华绒螯蟹(Eriocheir sinensis)卵巢发育及卵黄发生的激素调控.海洋与湖沼, 2010, 41(4): 505—512]
[7] Zhao W X, An M. In vitro induction effects of exogenous hormones and eyestalk extracts on the oocytes of Macrobrachium rosenbergii [J]. Journal of Shanghai Fisheries University, 1996, 5(4): 221—225 [赵维信, 安苗. 外源激素和眼柄提取物对罗氏沼虾卵母细胞的离体诱导作用. 上海水产大学学报, 1996, 5(4): 221—225]
[8] Rodríguez E, Medesani D, Greco L, et al. Effects of some steroids and other compounds on ovarian growth of the red swamp crayfish, Procambarus clarkii, during early vitellogenesis [J]. The Journal of Expermental Zoology, 2002, 292(1): 82—87
[9] Yano I, Hoshino R. Effects of 17 ß-estradiol on the vitellogenin synthesis and oocyte development in the ovary of kuruma prawn (Marsupenaeus japonicus) [J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2006, 144(1): 18—23
[10] Zhan X Q, Wang X Z, Zhang J H. Progress on estrogen receptor and female reproduction [J]. Progress in Veterinary Medicine, 2005, 26(12): 35—39 [詹晓庆, 王鲜忠, 张家骅.雌激素受体和雌性生殖研究进展. 动物医学进展, 2005, 26(12): 35—39]
[11] Paolucci M, Cristo C D, Cosmo A D. Immunological evidence for progesterone and estradiol receptors in the freshwater crayfish Austropotamobius pallipes [J]. Molecular Reproduction and Development, 2002, 63(1): 55—62
[12] Han S Z, Chen X L, Ye H H, et al. Immunorecognition of estrogen receptor in the optic ganglion of Scylla serrata [J]. Journal of Xiamen University (Natural Science), 2006, 45(6): 741—742 [韩师昭, 陈学雷, 叶海辉, 等. 雌激素受体在锯缘青蟹视神经节的免疫识别. 厦门大学学报(自然科学版), 2006, 45(6): 741—742]
[13] Ye H H, Huang H Y, Li S J, et al Immunorecognition of estrogen and androgen receptors in the brain and thoracic ganglion mass of mud crab, Scylla paramamosain [J]. Progress in Natural Science, 2008, 18(6): 691–695
[14] Yang X Z, Zhao L L, Cheng Y X, et al. Immunolocalization of estrogen receptor α in Neomysis japonica oocytes and follicle cells during ovarian development [J]. Tissue and Cell, 2012, 44(2): 95—100
[15] Wu X G, Cheng Y X, Sui L Y, et al. Biochemical composition of pond-reared and lake-stocked Chinese mitten crab Eriocheir sinensis (H.Milne-Edwards) broodstock [J]. Aquaculture Research, 2007, 38(14): 1459—1467
[16] Wu X G, Wang Z K, Cheng Y X, et al. Effect of dietary phospholipid and highly unsaturated fatty acids on the precocity, survival and growth of juvenile Chinese mitten crab (Eriocheir sinensis) [J]. Aquaculture Research, 2011, 42(3): 457—468
[17] Wei W, Wei H, Liu Q. Effect of estradiol in hemolymph and gonad on precociousness of Eriocheir sinensis [J]. Journal of Fisheries of China, 2005, 29(6): 862—865 [魏薇, 魏华, 刘青. 中华绒螯蟹体内的雌二醇对性早熟的影响. 水产学报, 2005, 29(6): 862—865]
[18] Xue L Z, Du N S, Lai W. Histology of female reproductive system in Chinese mitten-handed crab, Eriocheir sinensis [J]. Journal of East China Normal University (Natural Science), 1987, (3): 88—97 [薛鲁征, 堵南山, 赖伟. 中华绒螯蟹(Eriocheir sinensis) 雌性生殖系统的组织学研究. 华东师范大学学报(自然科学版), 1987, (3): 88—97]
[19] Wu X G, Chen H, Liu Z J, et al. Immunorecognition and distribution of progesterone receptors in the Chinese mitten crab (Eriocheir sinensis) during ovarian development [J]. Journal of Shellfish Research, 2014, 33(1): 1—9
[20] Thornton J W. Evolution of vertebrate steroid receptors from an ancestral estrogen receptor by ligand exploitation and serial genome expansions [J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(10): 5671—5676
[21] Rong S X. Research Advances on estrogen receptor [J]. Occupational Health & Emergency Rescue, 2005, 23(1): 11—14 [荣顺兴. 雌激素受体的研究进展. 职业卫生与应急救援, 2005, 23(1): 11—14]
[22] Wang P, Yang Z J. The related research advances on estrogen receptor [J]. Journal of Chengde Medical College, 2009, 26(1): 68—70 [王陪, 杨振军. 雌激素的相关研究进展. 承德医学院学报, 2009, 26(1): 68—70]
[23] Zhang J Q, Cai W Q. Research Advances on β-estrogen receptor [J]. Progress In Physiological Sciences, 2001, 32(1): 68—70 [张吉强, 蔡文琴. 雌激素β受体的研究进展. 生理科学进展, 2001, 32(1): 68—70]
[24] Liu Z J. The study on the distribution and change of estrogen receptor during the ovarian development and estrogen modulation in vitro ovarian tissue culture of female swimming crab, Portunus trituberculatus [D]. Thesis for the Doctor degree of Shanghai Ocean University, Shanghai. 2013 [刘智俊. 三疣梭子蟹卵巢发育期间雌激素受体分布变化及雌激素离体调控的研究. 上海海洋大学博士论文,上海. 2013]
[25] Köhler H R, Kloas W, Schirling M, et al. Sex steroid receptor evolution and signalling in aquatic invertebrates [J]. Ecotoxicology, 2007, 16(1): 131—143
[26] Dechering K, Boersma C, Mosselman S. Estrogen Receptors alpha and beta Two Receptors of a Kind [J]. Current Medicinal Chemistry, 2000, 7(5): 561—576
[27] Summavielle T, Monteiro P R R, Reis-Henriques M A, et al. In vitro metabolism of steroid hormones by ovary and hepatopancreas of the crustacean Penaeid shrimp Marsupenaeus japonicus [J]. Scientia Marina, 2003, 67(3): 299—306
[28] Cheng Y X, Li S Q, Wang G Z, et al. Structural modulation of the area between oocytes and follicular cells during vitellogensis of the mud crab (Scylla serrata) [J]. Acta Zoologica Sinica, 2002, 48(1): 80—92 [成永旭, 李少菁, 王桂忠, 等. 锯缘青蟹卵黄发生期卵母细胞和卵泡细胞之间的结构变化. 动物学报, 2002, 48(1): 80—92]
[29] Yang X Z, Wu X G, Yao G G, et al. Ultrastructure of oocytes and follicular cells of Portunus trit uberculatus during the first reproductive cycle [J]. Journal of Fudan University (Natural Sxience), 2007, 6(46): 963—967 [杨筱珍, 吴旭干,姚桂桂, 等. 三疣梭子蟹第一次卵巢发育过程中卵母细胞和卵泡细胞超微结构的观察. 复旦学报(自然科学版), 2007, 6(46): 963—967]
[30] Du N S, Lai W, Chen P C, et al. Studies on vitellogenesis of Eriocheir sinesis [J]. Acta Zoologica Sinica, 1999, 45(1): 88—92 [堵南山, 赖伟, 陈鹏程, 等. 中华绒螯蟹卵黄形成的研究. 动物学报, 1999, 45(1): 88—92]
[31] Coccia E, Lisa E, Cristo C, et al. Effects of estradiol and progesterone on the reproduction of the freshwater crayfish Cherax albidus [J]. The Biological Bulletin, 2010, 218(1): 36—47
[32] Bai H, Tao Y. Distribution of estrogen receptors in mammalian fetal gonads [J]. Animal Husbandry and Veterinary Medicine, 2010, 42(2): 88—91 [白海, 陶勇. 雌激素受体在哺乳动物胎儿性腺中的分布. 畜牧与兽医, 2010, 42(2): 88—91]
[33] Rosa R, Nunes M. Biochemical changes during the reproductive cycle of the deep-sea decapod Nephrops norvegicus on the south coast of Portugal [J]. Marine Biology, 2002, 141(6): 1001—1009
[34] Wang W, Wu X, Liu Z J, et al. Insights into hepatopancreantic functions of nutrition metabolism and ovarian development in the swimming crab Portunus trituberculatus: gene discovery in the comparative transcriptome of different stage hepatopancreas [J]. PloS ONE, 2014, 9(1): e84921
[35] Li K, Chen L Q, Zhou Z L, et al. The site of vitellogenin synthesis in Chinese mitten-handed crab Eriocheir sinensis [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2006, 143(4): 453—458
[36] Ueda S, Tsuda H, Sato K, et al. Alternative tyrosine phospho-rylation of signaling kinases according to hormone receptor status in breast cancer overexpressing the insulin-like growth factor receptor type 1 [J]. Cancer Science, 2006, 97(7): 597—604
[37] Thomas P C, Tubbs H, Berg G. Sex steroid hormone receptors in fish ovaries [A]. In: Babin P J, Cerdà D J, Lubzens E (Eds.), The Fish Oocyte: From Basic Studies to Biotechnological Applications [C]. Springer Netherlands: Berlin. 2007, 203—233
[38] Klein-Hitpass L, Ryffel G U, Heitlinger E, et al. A 13 bp palindrome is a functional estrogen responsive element and interacts specifically with estrogen receptor [J]. Nucleic Acids Research, 1988, 16(2): 647—663
DISTRIBUTION AND CHANGES OF TWO ESTROGEN RECEPTORS IN THE OVARIES AND HEPATOPANCREAS DURING THE OVARIAN DEVELOPMENT OF CHINESE MITTEN CRAB ERIOCHEIR SINENSIS
LIU Mei-Mei1, WU Xu-Gan1, LIU Zhi-Jun1, CHEN Hao1and CHENG Yong-Xu1, 2
(1. Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources, Ministry of Education, Shanghai Ocean University, Shanghai 201306, China; 2. Shanghai Universities Knowledge Service Platform, Shanghai Ocean University, Shanghai 201306, China)
中华绒螯蟹; 雌激素受体; 免疫定位; 卵巢发育; 肝胰腺
Eriocheir sinensis; Estrogen receptor; Immunolocalization; Ovarian development; Hepatopancreas
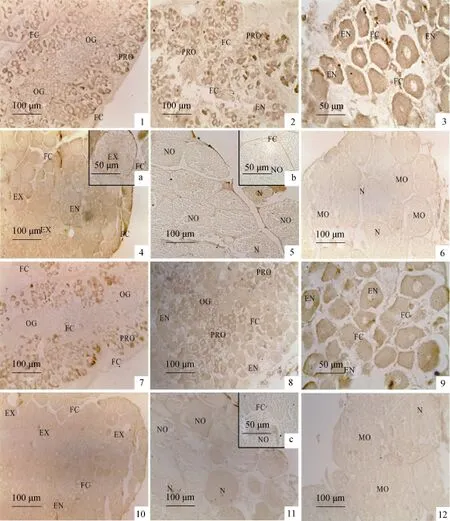
图版Ⅰ 中华绒螯蟹卵巢发育过程中各期卵巢中ER的阳性分布PlateⅠ The distribution of positive ER in the ovary during the ovarian development of E. sinensis

图版Ⅱ 中华绒螯蟹卵巢发育过程中各期肝胰腺中ER的阳性分布PlateⅡ The distribution of positive ER in the hepatopancreas during the ovarian development of E. sinensis
Q958.8
A
1000-3207(2015)04-0822-09
10.7541/2015.108
2014-09-29;
2015-02-05
863高技术发展计划项目(2012AA10A409-5); 上海市科学技术委员会项目(13231203504, 13DZ2280500); 上海高校水产学一流学科建设项目(2012-62-0908)江苏省科技厅苏北科技发展计划项目(BN2013007)资助
柳梅梅(1990—), 女, 安徽人; 硕士研究生; 主要从事甲壳动物繁殖生物学的研究。E-mail: 15105517287@163.com
成永旭(1964—), Tel: 021-61900417, E-mail: yxcheng@shou.edu.cn

