NaCl胁迫对罂粟幼苗生长及生理特性的影响
赵 旭, 杨振华, 赵 静, 魏玉杰*
(1.甘肃省农垦农业研究院,甘肃武威 733006;2.文县二中,甘肃陇南 746412)
NaCl胁迫对罂粟幼苗生长及生理特性的影响
赵 旭1, 杨振华1, 赵 静2, 魏玉杰1*
(1.甘肃省农垦农业研究院,甘肃武威 733006;2.文县二中,甘肃陇南 746412)
[目的] 研究不同浓度NaCl 胁迫下罂粟幼苗的生长及生理生化特性的变化,为罂粟抗盐性综合研究提供理论基础。[方法] 利用不同浓度的NaCl溶液对罂粟种子进行处理并模拟盐胁迫环境,测定相关的生长及生理指标。[结果] NaCl浓度的增加促使罂粟幼苗的苗高、根长、根冠比、根系含水量、茎叶含水量均明显下降。幼苗叶片中脯氨酸、丙二醛含量也随NaCl浓度的增加而上升,且高浓度下上升幅度大于低浓度。[结论] 60~90 mmol/L是罂粟的耐盐临界点。当盐浓度增加到180 mmol/L时,幼苗基本枯死。
罂粟;NaCl胁迫;生理特性
罂粟(PapaversomniferumL.)是罂粟科罂粟属的一种重要的一年生或多年生药源植物,可用于治疗咳嗽、疼痛、腹泻等症状[1]。罂粟主要用来提取吗啡和可待因,制成镇痛药而应用于临床,但这类麻醉性药物存在严重的毒副作用,并且易导致耐受和成瘾,特别是由吗啡乙酰化而成的海洛因(Heroin),其成瘾性和耐受性发展更快,副作用更大,已成为滥用最广、毒性最强、危害最大的违禁麻醉品之一。因此,国际上对罂粟种植和研发有着严格的限制,影响着这一重要药源植物的开发和利用[2]。
盐害是影响作物生长的最主要的非生物逆境之一[3]。各类盐渍土的共同特征是土壤中含有显著的盐碱成分,具有不良的物理化学性质,致使大多数植物的生长受到不同程度的抑制,甚至不能生长成活。中国西部盐渍化以内蒙古、陕西、宁夏、甘肃、青海、新疆等六省最突出。其中,甘肃省的盐渍土为10 379 km2,六省区次生盐渍化(耕地盐渍化)比例也较大。在我国0.67亿hm2的耕地中,10%为盐渍化土壤。干旱、不合理耕作等因素导致耕地的次生盐渍化的日益加重。土壤盐渍化已成为限制农作物产量进一步提高的重要环境因子之一[4]。目前为止,关于作物的盐害机理[5-7]、培育抗盐性品种及抗盐性研究[8-11]等,前人已进行了艰苦的探索,并且取得突破性进展。由于罂粟的特殊性而受到严格监管,关于盐害对罂粟种子发芽及幼苗生长影响的报道还较少。笔者研究了不同浓度NaCl 胁迫下罂粟幼苗的生长、生理生化特性的变化,为罂粟抗盐性综合研究提供理论基础。
1 材料与方法
1.1 试验材料试验材料为白花野罂粟,由甘肃省农垦农业研究院提供。
1.2 试验方法
1.2.1罂粟幼苗的培养及胁迫处理。用清水将白花罂粟种子进行多次洗涤,再用浓度75%乙醇溶液或浓度1%稀释次氯酸钠消毒10 min,去离子水洗净,并且用滤纸拭干表面水分。取若干培养皿放入两层滤纸消毒,将处理好的罂粟种子放入消毒后培养皿,每个培养皿置50粒处理后罂粟种子,每个处理设置3个重复,然后分别等量加入配置好的6个不同浓度NaCl溶液(0、30、60、90、120、150、180 mmol/L),将培养皿置于人工气候箱中,光照800 lx下培养,温度设置为(18±1)℃,湿度为50%。在第8天测定发芽势,在第14天测定发芽率,最后调查存活率,计算相对盐害率。
种子发芽势=发芽达到高峰期时发芽种子数/供试种子数×100%
种子发芽率=发芽种子数/供试种子数×100%
相对盐害率=(对照发芽率-处理发芽率)/ 对照发芽率×100%[12]
1.2.2测定指标与方法。在发芽试验结束后,从各培养皿中随机抽取5株罂粟幼苗,用ddH2O清洗后,测定并统计不同盐浓度处理下各重复的平均株高、平均根长。罂粟幼苗期耐盐指数值计算公式为:
耐盐指数=处理性状表现值/对照性状表现值×100%[13]
吸干取出的罂粟幼苗表面水分,分别称量并统计不同盐浓度处理下各重复的根系鲜重(R)及地上部分(茎叶部分)鲜重(T)
根/冠(R/T)= 根系鲜重(R)/地上部分鲜重(T)
将称量过的不同浓度下各重复的部分罂粟幼苗根系及茎叶置于80 ℃的干燥箱中烘干5 h后,再分别称量,并统计各部分干重[14]。
根系含水量=(根系鲜重-根系干重)/根系鲜重×100%
茎叶含水量=(茎叶鲜重-茎叶干重)/茎叶鲜重×100%
采用茚三酮法,测定脯氨酸含量;采用TBA法,测定丙二醛(MDA)含量[15]。
2 结果与分析
2.1 不同浓度NaCl胁迫对罂粟种子萌发的影响由图1可知,随着NaCl浓度的增加,罂粟种子的萌发受到明显的影响,发芽势和发芽率均表现下降趋势。相比对照,在30、60、90、120、150、180 mmol/L浓度下,各处理的发芽势分别下降10.07%、15.05%、62.44%、70.05%、81.40%、88.51%,发芽率分别下降4.01%、12.21%、35.42%、39.18%、47.56%、91.15%。当NaCl浓度为60~90 mmol/L时,试验结束后罂粟种子的发芽率在该浓度范围内有明显的下降趋势,因此该浓度范围内盐胁迫对罂粟种子萌发的影响显著。当NaCl浓度达到180 mmol/L时,罂粟种子发芽势与发芽率都下降到极低的水平,高浓度的盐胁迫使多数罂粟种子死亡,因此在该盐浓度下可认为罂粟不能正常生长。
2.2 不同浓度NaCl胁迫对白花罂粟幼苗生长的影响由表1可知,NaCl浓度在0~60 mmol/L范围内,各处理的平均苗高变化不大,与对照相比,当NaCl浓度为60 mmol/L时,与对照相比减少了4.52%,而平均根长在NaCl浓度为30 mmol/L时,与对照相比减少了41.72%。当NaCl浓度大于60 mmol/L时,苗高和根长都大幅下降。当浓度小于60 mmol/L时苗高差异不显著,当浓度达60~90 mmol/L时差异达0.01显著水平。当浓度为30~60 mmol/L时,各处理根长都达到0.01显著水平。这充分说明在低浓度盐胁迫下对罂粟根系生长的影响大于茎叶的生长。综上所述,盐浓度在60~90 mmol/L之间,对白花罂粟幼苗生长产生显著影响。
2.3 不同浓度NaCl胁迫对白花罂粟幼苗苗期植株苗高及根长耐盐指数的影响由表2可知,在低盐浓度≤60 mmol/L NaCl条件下,白花罂粟苗高耐盐指数基本接近1,且对照间不显著,说明低于此浓度的盐胁迫对植株的地上部分的生长影响不大,当NaCl浓度达到90 mmol/L时,耐盐指数远小于1,与对照间差异达0.05显著水平,NaCl浓度≥90 mmol/L时各处理间在0.01水平显著,说明60~90 mmol/L NaCl是白花罂粟苗期的耐盐临界区间。与苗高耐盐指数相比,根长的耐盐指数在低盐浓度30 mmol/L下已远小于1,且各处理与对照相比在0.01水平显著,说明白花罂粟苗期根系的耐盐性相比地上部分较弱。
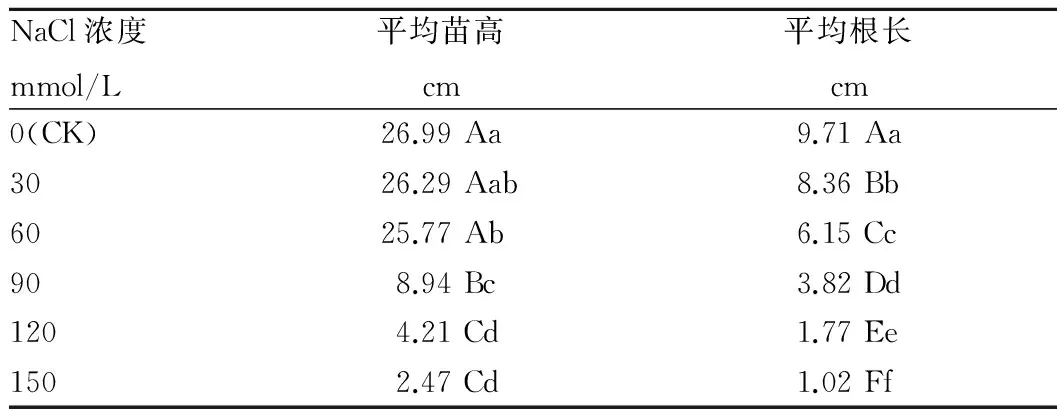
表1 不同浓度NaCl胁迫对罂粟幼苗生长的影响
注:表中不同小写、大写字母分别表示在0.05、0.01水平上差异显著。
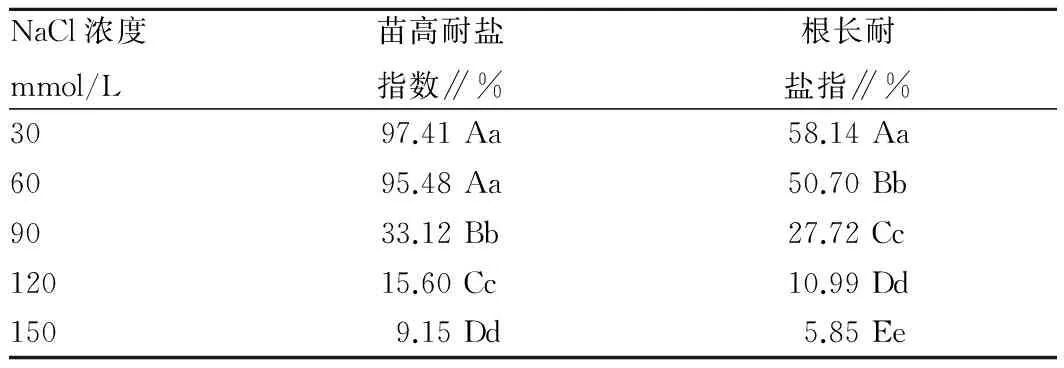
表2 不同浓度NaCl胁迫对罂粟幼苗期苗高及根长耐盐指数的影响
注:表中不同小写、大写字母分别表示在0.05、0.01水平上差异显著。
2.4 不同浓度NaCl胁迫对白花罂粟幼苗根/冠的影响根冠比是植物根系鲜重/干重与地上部分(茎叶部分)鲜重/干重的比值,反映地下部分和地上部分的相关性。由表3可知,当盐浓度小于60 mmol/L时,根冠比值下降缓慢,而浓度在60 ~120 mmol/L时比值大幅下降,与对照相比,各处理根冠比分别下降6.72%、9.09%、21.54%、43.08%、46.84%;当NaCl浓度≤60 mmol/L时,各处理间差异不显著,当浓度达90 mmol/L时与对照间差异达0.01显著水平。
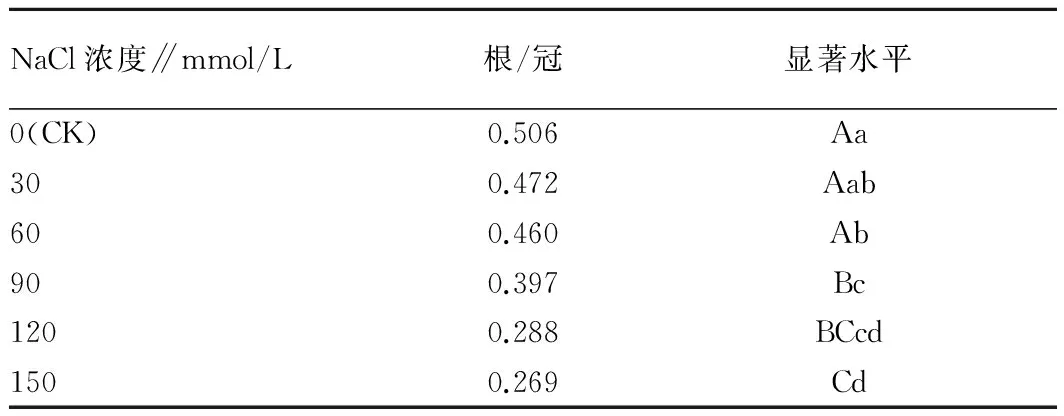
表3 不同浓度NaCl胁迫对罂粟幼苗根/冠的影响
注:表中不同小写、大写字母分别表示在0.05、0.01水平上差异显著。
2.5 不同浓度NaCl胁迫对白花罂粟幼苗根系及茎叶含水量的影响不同浓度NaCl胁迫对白花罂粟的生长产生不同程度的抑制,导致幼苗的根系及地上部茎叶的鲜重、干重及其含水量都有明显的下降趋势。由表4可知,当NaCl浓度在0~60 mmol/L之间时地上茎叶部分的含水量下降缓慢,而根系的含水量下降幅度要大于茎叶部分,与对照相比,60 mmol/L时茎叶和根系含水量分别下降了1.29%、2.82%。当NaCl浓度大于60 mmol/L时根系、地上部分的含水量都开始急剧下将。当浓度达到90 mmol/L时,与对照相比,地面茎叶及根系含水量分别下降4.01%和5.13%。在高NaCl浓度范围(90~150 mmol/L)下,地上部分的含水量变化平缓,而根系的含水量下降趋势仍然明显。当NaCl浓度≥90 mmol/L时,地上茎叶部分含水量与对照间差异达0.01显著水平,而根系含水量在NaCl浓度≥60 mmol/L时,与对照间已达0.01显著水平,说明低盐浓度对根系的抑制大于对地上部分,在高盐浓度下根系与地上部分相比对盐胁迫仍有较强的响应。
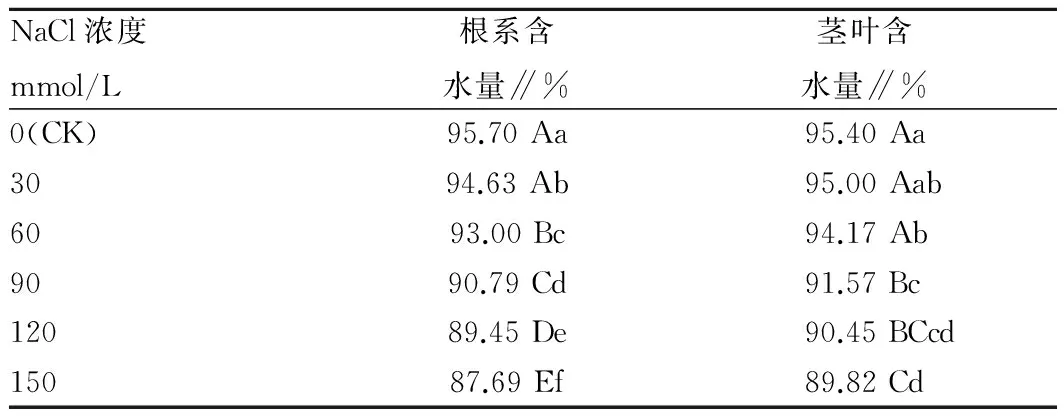
表4 不同浓度NaCl胁迫对罂粟根系及茎叶部分含水量的影响
注:表中不同小写、大写字母分别表示在0.05、0.01水平上差异显著。
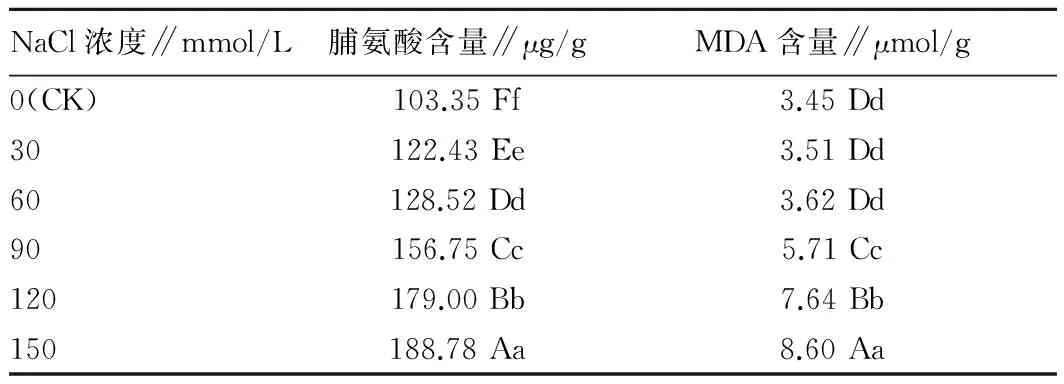
2.6 不同浓度NaCl胁迫对白花罂粟幼苗叶片脯氨酸含量的影响脯氨酸是植物逆境条件下重要的渗透调节分子,可以被盐诱导大量合成,以维持细胞渗透势和细胞保护酶活性[16-18]。由表5可知,在低盐浓度≤60 mmol/L NaCl条件下,罂粟幼苗叶片中的脯氨酸含量增加缓慢,NaCl浓度为30 mmol/L和60 mmol/L时,与对照相比,分别增加18.46%和25.17%,当浓度≥90 mmol/L时脯氨酸含量开始骤增,浓度在90、120、150 mmol/L下,与对照相比,分别增加了51.67%、73.20%、82.67%,各处理间差异均达到0.01显著水平。
表5 不同浓度NaCl胁迫对罂粟幼苗叶片脯氨酸含量和MDA含量的影响
NaCl浓度∥mmol/L脯氨酸含量∥μg/gMDA含量∥μmol/g0(CK)103.35Ff3.45Dd30122.43Ee3.51Dd60128.52Dd3.62Dd90156.75Cc5.71Cc120179.00Bb7.64Bb150188.78Aa8.60Aa
注:表中不同小写、大写字母分别表示在0.05、0.01水平上差异显著。
2.7 不同浓度NaCl胁迫对白花罂粟幼苗叶片MDA含量的影响植物器官衰老或在逆境下遭受伤害,往往发生膜脂过氧化作用。MDA是膜脂过氧化的最终分解产物,其含量可以反映植物遭受逆境伤害的程度。由表5可知,当NaCl浓度在60 mmol/L以下时,MDA含量基本保持不变,当NaCl浓度大于此浓度时,MDA含量急剧上升,与对照相比各处理分别增加了1.74%、4.93%、6.55%、121.45%、149.28%。当NaCl浓度在0~60 mmol/L之间,各处理与对照间差异不显著,当浓度≥90 mmol/L时,与对照相比差异达0.01显著水平。
3 讨论
罂粟苗期是对盐胁迫反映的敏感时期。发芽率、发芽势是种子活力高低的指标[19]。白花罂粟幼苗受到NaCl胁迫后,低NaCl浓度≤60 mmol/L对种子萌发、幼苗生长的抑制效应随NaCl浓度的上升而缓慢增加,与对照相比变化不大。这表明白花罂粟种子萌发对低盐胁迫有一定的适应性和调节能力。这与多数耐盐植物的研究[9-10]相符。当NaCl浓度在60~90 mmol/L之间,白花罂粟的发芽势、发芽率大幅下降;当浓度达到180 mmol/L时,白花罂粟种子由于高浓度的盐胁迫而枯死。高浓度盐胁迫造成白花罂粟发芽率低的原因可能是外界溶液渗透压过高导致种子吸水不足,致使植株不能进行正常的生长。60 mmol/L NaCl可能是影响白花罂粟种子发芽的临界浓度。
在盐胁迫下,不同处理白花罂粟幼苗的根长、株高都有所不同。随着浓度的升高,株高、根长都呈下降趋势,当NaCl浓度为30 mmol/L时根长与对照相比已达0.05显著水平,而株高在NaCl浓度达到60 mmol/L时,与对照间差异达0.05显著水平。这说明低盐浓度对根的抑制作用大于对苗长的抑制。在NaCl高浓度(≥90 mmol/L)下,白花罂粟幼苗的根长和株高都严重受阻。这与叶海荣等[11,20-21]对盐胁迫下小麦、水稻幼苗生长变化的研究结论基本一致。
白花罂粟幼苗不同部位对盐胁迫的响应不同。在NaCl浓度≤60 mmol/L下,幼苗地上部的耐盐指数较高,而根系的耐盐指数较低,即根系对盐胁迫的响应更敏感。当NaCl浓度达到90 mmol/L时,地上部分耐盐指数骤降,说明在此盐浓度下,植株的各项生理机能都受到影响,使植物的耐盐机能也减弱。可以推测,60 ~90 mmol/L NaCl浓度是该品种的耐盐临界区间。
根冠比是衡量苗期根系发育好坏的一个重要指标。根冠比较大的幼苗表明其根系发育良好,从而有较强的吸收水分和矿质的能力。良好的根系对植物苗期抗盐有利[17]。研究表明,当NaCl浓度≤60 mmol/L时,对白花罂粟幼苗根冠比的影响不大,各处理与对照间不显著,超过此浓度,根冠比随NaCl浓度的增加而显著下降,即中等浓度以上盐胁迫首先伤害根部,抑制根的生长,影响根吸收水分和养分的能力,使植株含水量下降,于是抑制地上部分的生长。这与高英等[22]对盐胁迫下玉米发芽、幼苗生长变化的研究结论基本一致。
植株干重、根干重和水分含量是反映作物苗期生理状态的重要指标,能直接反映作物受盐害的程度。试验结果表明,在中等NaCl浓度(30~90 mmol/L)下,茎叶、根系含水量与对照相比差异都达显著水平,但影响根系含水量的盐浓度要低于茎叶。当NaCl浓度达到120 mmol/L时,与对照相比,根系、茎叶含水量分别下降6.53%、5.19%,即高浓度盐胁迫对茎叶含水量的影响大于根系。
脯氨酸是植物细胞质中一种游离脯氨酸。根据脯氨酸的含量,可以从生理的角度了解逆境对植物的危害度和植物对逆境的抵抗能力[22]。脯氨酸被认为是植物在渗透胁迫下易积累的一种相容渗透剂。它可以提高细胞内渗透势,保护细胞蛋白质结构,防止酶变性。另外,它还是植物在去除盐胁迫恢复正常过程中有效的氮源、碳源和还原剂。研究结果表明,当NaCl浓度≤60 mmol/L时,在盐胁迫下由于白花罂粟植株游离脯氨酸含量的累积,罂粟幼苗生长受到抑制不大,当浓度超过60 mmol/L时,虽然罂粟植株体内的游离脯氨酸含量仍在持续累积,但罂粟的生长活动已受到明显抑制。这说明植物通过代谢变化进行自我调节是有一定限度的。当NaCl浓度超过90 mmol/L时,脯氨酸含量大幅增加的现象可能与蛋白质的快速分解有关。这是因为此时细胞的呼吸作用、光合作用等生理活性均已急剧下降[23]。脯氨酸含量变化可能是对逆境的一种适应性反应,通过对脯氨酸的积累能部分地缓解因盐胁迫引起的自由基和过氧化物对幼苗的伤害,维持膜的稳定性,增强罂粟对盐胁迫的适应性。但当盐浓度大于一定的值后,罂粟的适应性遭到破坏,盐胁迫会显著影响罂粟的正常生长,从而影响产量。从脯氨酸的合成来看,脯氨酸的谷氨酸合成途径的关键酶对NaCl具有一定的抗性[24]。在高盐浓度下,脯氨酸的鸟氨酸合成途径的激活对脯氨酸的积累起更重要的作用[18]。从脯氨酸的分解来看,脯氨酸氧化酶、脯氨酸水解酶对NaCl十分敏感,且盐胁迫将导致线粒体膜透性发生变化,使细胞中的脯氨酸不能进入线粒体内,造成降解受阻[25-26]。
盐对植物的毒害首先表现为对细胞膜的破坏作用引起质膜过氧化。MDA是植物器官受到逆境胁迫后膜脂过氧化的最终分解物,其值越大,说明植株遭受逆境伤害的程度越大。MDA从膜上产生的位置释放出后可以与蛋白质、核酸反应,改变这些大分子的构型,或使之产生交联反应,从而丧失功能,还可以使纤维素分子间的矫健松弛,抑制蛋白质的合成,细胞膜透性增大。MDA含量是反映植物抗逆能力的较好指标[27-28]。浓度在60 mmol/L以下时MDA含量的变化不大,即盐胁迫对罂粟正常生长的影响不大,当盐浓度大于60 mmol/L时MDA含量的骤增,盐胁迫对罂粟的生长产生0.01显著水平影响,表明中等以上盐胁迫(60~90 mmol/L NaCl)会对罂粟植株各器官膜结构产生破坏,且随着盐胁迫的加剧,MDA含量逐渐增加。
综上所述,白花罂粟品种生长的适宜NaCl浓度为≤60 mmol/L,此时罂粟生长、生存受影响不大,当浓度≥90 mmol/L时白花罂粟萌发、生长受到明显影响;发芽势、发芽率、根冠比、根系及地上部分含水量都明显下降;耐盐指数在60~90 mmol/L NaCl时出现骤降;脯氨酸、MDA含量都大幅上升。所以,可以推测60~90 mmol/LNaCl是白花罂粟实验室进行耐盐性研究的耐盐临界区间。常红军等[23]对盐胁迫下鲁单981号玉米品种生长及生理特性变化的研究结论出现类似结果。
[1] FACCHINI P J,PENZES C,JOHNSON A G,et al. Molecular characterization of berberine bridge enzyme genes from opium poppy[J]. Plant Physiol,1996,112(4): 1669-1677.
[2] YADAV H K,SHUKLA S,SINGH S P.Genetic variability and interrelationship among opium and its alkaloids in opium poppy (PapaversomniferumL.)[J]. Euphytica, 2006,150(1): 207-214.
[3] BOYER J S.Plant productivity and envieonment [J].Science,1982,218:443-448.
[4] 张永峰,殷波.玉米耐盐性研究进展[J].玉米科学,2008,16(6):83-85.
[5] 秦忠彬,赵守仁,张月平.作物抗逆性的原理与技术[M].北京:北京农业大学出版社,1989:279-281.
[6] 乔秉钧,孙启忠.植物对盐分吸收和累积[J].四川草原,1993(1):15-19.
[7] 刘祖祺,张石城.植物抗性生理学[M].北京:中国农业出版社,1994:250-251.
[8] 任建华,高平平,乔燕祥.绿豆幼苗期耐盐性研究[J].山西农业科学,1994,22(2):20-24.
[9] 张国英,谈建中,刘美娟.盐胁迫对桑种子发芽及幼苗生理生化的影响[J].蚕业科学,2004,30(2):190-194.
[10] 李树华,米海莉,惠红霞.NaCl胁迫对小麦发芽的影响试验研究[J].宁夏农林科技,2000(6):11-13.
[11] 叶梅荣,刘玉霞.NaCl对吸胀后小麦种子发芽和幼苗生长的影响[J].安徽农业技术师范学院学报,2000,14(2):35-36.
[12] 杨双友.水稻不同栽培方式试验研究[J].北方水稻,2008(4):45-46.
[13] 申玉香,乔海龙,陈和,等.几个大麦品种(系)的耐盐性评价[J].核农学报,2009,23(5):752-757.
[14] 胡宝忱,艾军,郭守东,等.盐胁迫对玉米幼苗生长的影响[J].杂粮作物,2008,28(3):166-168.
[15] 邹琦.植物生理学试验指导[M].北京:中国农业出版社,2000:161-175.
[16] 韩朝红,孙谷畴,林植芳.NaCl对吸胀后水稻的种子发芽和幼苗生长的影响[J].植物生理学通讯,1998,34(5):339-342.
[17] 高英,同延安,赵营,等.盐胁迫对玉米发芽和苗期生长的影响[J].中国土壤与肥料,2007(2):30-34.
[18] 赵福庚,刘友良.盐胁迫激活大麦幼苗脯氨酸合成的鸟氨酸途径(英文)[J].植物生理学报,2001,43(1):36-40.
[19] 赵锁劳,窦延玲.小麦耐盐性鉴定指标及其分析评价[J].西北农业大学学报,1988,26(6):80-85.
[20] 赵旭,王林权,尚浩博,等.盐胁迫对不同基因型冬小麦发芽和出苗的影响[J].干旱地区农业研究,2005,23(4):108-112.
[21] 韩朝红,孙谷畴,林植芳.NaCl对吸胀后水稻的种子发芽和幼苗生长的影响[J].植物生理学通讯,1998,34(5):339-342.
[22] 马秀芳,沈秀英.不同耐旱性玉米品种对干旱的生理生化反应[J].沈阳农业大学学报,2002,33(3):167-170.
[23] 常红军,陈元盛.盐胁迫对鲁单981号玉米品种生长及生理特性的影响[J].安徽农业科学,2006,34(16):3950,4178.
[24] 赵福庚,刘友良,张文华.大麦幼苗叶片脯氨酸代谢及其与耐盐性的关系[J].南京农业大学学报,2002,25(2):7-10.
[25] TING I PDRAKE M.沙漠植物的生理生态[M].日本:日本九州大学出版会,1993:30-31.
[26] MARTINEZ C A,MAESTRI M,LANI E G.Invitro salt tolerance and proline accumulation in Andean potate (Solanumspp.) different in frost resistance[J]. Plant Science,1996,116:177-184.
[27] 梅俊学.逆温下发菜脯氨酸含量及质膜透性的变化与含水量的关系[J].山东师范大学学报,2000,15(2):178-181.
[28] 赵可夫.植物抗盐生理[M].北京:中国科学技术出版社,1993:165-176.
Effects of NaCl Stress on Growth and Physiological Characteristic ofPapaverSomniferumL.
ZHAO Xu1, YANG Zhen-hua1, ZHAO Jing2, WEI Yu-jie1*
(1.Gansu State Farm Academy of Agricultural Research, Wuwei, Gansu 733006;2.Wenxian Second Middle School,Longnan, Gansu 746412)
[Objective] Changes of growth and physiological and biochemical characteristics ofPapaversomniferumL. seedlings with different concentrations of NaCl were studied to provide a theoretical basis for the comprehensive study ofPapaversomniferumL. salt resistance. [Method]PapaversomniferumL. seedling was treated with different concentration of NaCl solution and salt stress environment was simulated. Its growth and physiological indexes variation were determined. Using different concentrations of NaCl solution to simulate the poppy seed processing and salt stress environment, its growth and physiological indicators were measured. [Result] The plant height, root length, root shoot ratio, root water content, and stem leaf water content were all decreased with the increase of the concentration of NaCl. The proline content and MDA content were all increased with the increase of the concentration of NaCl.[Conclusion] When salt concentration was increased to 180 mmol/L,PapaversomniferumL. seedling basically died. The critical point of salt tolerance ofPapaversomniferumL.seedling was 60 mmol/L NaCl.
PapaversomniferumL.; NaCl stress; Physiological characteristics
国家自然科学基金(31160303)。
赵旭(1985-),男,甘肃白银人,助理研究员,硕士,从事特药遗传育种方面的研究。*通讯作者,研究员,博士,从事特用植物生物技术育种方面的研究。
2014-11-21
S 567
A
0517-6611(2015)01-003-04

