OCT无创检测技术的人体血糖平衡延迟时间研究
苏 亚,孟 卓,2,于海民,王龙志,刘铁根,姚晓天*
(1. 天津大学 精密仪器与光电子工程学院 光电信息技术科学教育部重点实验室,天津 300072;2. 苏州光环科技有限公司,苏州 215123;3. 江南大学 理学院,无锡 214122)
OCT无创检测技术的人体血糖平衡延迟时间研究
苏亚1,孟卓1,2,于海民2,3,王龙志1,刘铁根1,姚晓天1*
(1. 天津大学 精密仪器与光电子工程学院 光电信息技术科学教育部重点实验室,天津 300072;2. 苏州光环科技有限公司,苏州 215123;3. 江南大学 理学院,无锡 214122)
摘要:为了研究在人体血糖快速变化情况下,皮肤组织液糖浓度与血液(指血、静脉血)中血糖变化的延迟关系,采用光学相干层析技术,通过人体口服葡萄糖耐量测试和血糖钳夹实验,测量了随血糖变化的皮肤光衰减系数,并对人体血糖平衡延迟时间问题做了研究。为了避免由于延迟因素造成预测血糖值误差过大,选择700μm ~800μm以下皮肤深度的真皮网状层作为分析计算区域。结果表明,延迟时间一般随着皮肤区域深度的增加而缩短;在不同的皮肤深度区域,血糖平衡延迟时间存在一定的差异性。此研究有助于提高光学无创血糖检测的准确性和可靠性。
关键词:医用光学;光学相干层析;无创血糖检测;血糖平衡延迟时间
*通讯联系人。E-mail:steveyao888@yahoo.com
引言
糖尿病是一种以持续高血糖为基本生化特征的全身性疾病,它以糖代谢紊乱为主要表现,并可以引起多种并发症。如果糖尿病没有得到足够的控制,容易引起一些急性并发症,如低血糖症、酮症酸中毒、非酮高渗性昏迷。血糖检测是糖尿病的重要检测指标之一,为了避免并发症的发生,病人需要实时自我监测血糖。目前光学无创血糖检测技术主要包括近红外光谱、中(远)红外光谱、光学相干层析、拉曼光谱、光声光谱和偏振光旋光等[1-6]。其优点是不使用生物有害物,不用刺伤肌体比如采集血液、体液等,可以进行长期的连续检测。因此, 具有很大的研究和实用价值,是今后血糖测量研究发展的趋势。
光学相干层析技术(optical coherence tomography,OCT)是一种基于弱相干原理的非接触、无损伤成像技术,分辨率能够达到微米量级。通过测量皮肤组织内部因葡萄糖值不同所引起的光衰减系数变化,可以计算其葡萄糖浓度。人体皮肤主要由表皮层、真皮层和皮下组织构成。由于各层的组织成分不同,其光学特性参量随血糖变化的相关性、变化量亦有不同。因此需要根据皮肤组织在深度方向的结构分布做具体分析。而OCT的优势在于,可以对皮肤组织不同深度区域的光学特性参量变化进行精确测量,从而找到与血糖变化最相关的组织深度区域,来进行标定、预测。
在光学无创血糖检测中,通常选用皮肤作为测量人体血糖的目标组织,通过检测真皮层内组织光学特性参量变化来计算血糖值,即测量的是真皮层组织的血糖变化情况。但一般采用血液(指血、静脉血)中的血糖作为标定参考值。当人体血糖在快速变化时,由于生理因素原因,皮肤组织中的血糖变化会滞后于指血(末梢血)或静脉血中的血糖变化[7],即此二者血糖浓度达到相对平衡存在一段生理延迟时间。这种延迟会造成光学无创血糖测量结果的不准确。对于高血糖症或低血糖症患者来说,这种由于生理延迟所造成的检测结果不准确是非常危险的[8]。所以,在实际应用中需要考虑到延迟时间对于血糖测量结果造成的影响。此外,由于人体组织本身就是一个精密的自我调节系统,对于其组织内部由血糖变化引起的反应,离体组织血糖实验并不能精确反映其光学特性参量随血糖变化规律。
本文中通过人体口服葡萄糖耐量测试和血糖钳夹实验,主要研究了在人体血糖快速改变的情况下,组织液糖浓度所引起的皮肤光衰减系数变化与指血(末梢血)、静脉血血糖之间的延迟关系。并根据实验数据对其延迟时间做了定量分析。此研究对于提高无创血糖检测结果的准确性具有一定的指导作用。
1实验设计、仪器及数据处理
1.1 实验仪器及参量
本实验中所用仪器为美国Thorlabs公司的OCS1300S高速频域OCT系统。光源中心波长1325nm,带宽100nm,最大成像深度3mm,纵向分辨率12μm,横向分辨率25μm。实验中所采集的OCT 3维图像大小为3.75mm×3.75mm×3mm(x×y×z),每幅3维图像的采集时间为8s。为了抑制散斑噪声,每个轴向扫描重复采集4次取平均值。
1.2 实验方法
实验分为2组,第1组采用口服葡萄糖耐量实验(oral glucose tolerance test,OGTT),被测试者为5位健康成人。口服溶于250mL水中的75g葡萄糖,5min内服用完毕。使用罗氏便携式血糖仪测量采集的指血作为血糖标定参考值。
第2组为血糖钳夹实验(glucose clamp),被测试者为3位Ⅱ型糖尿病患者。分别在被测试者双前臂实施静脉穿刺,一侧手臂用于输入胰岛素和葡萄糖溶液,另一侧采血的手臂用加热型护手袋包裹,用以采集动脉化静脉血样。使用生化分析仪测量采集的血样作为血糖标定参考值。在上述两组实验过程中,OCT仪器同步采集手前臂内侧皮肤图像,每幅3维图像采集间隔20s。
1.3 数据处理
由于人体皮肤表面并不平整,因此对于采集到的皮肤3维图像,首先需要使用图像处理算法将皮肤表面进行对齐,之后对图像进行3维重建。将重建后的3维图像中所有轴向扫描进行平均,以减小实验过程中散斑噪声和被测物位移对测量结果造成的影响。最后得到归一化的沿深度z方向的1维信号光强图(如图1所示)。
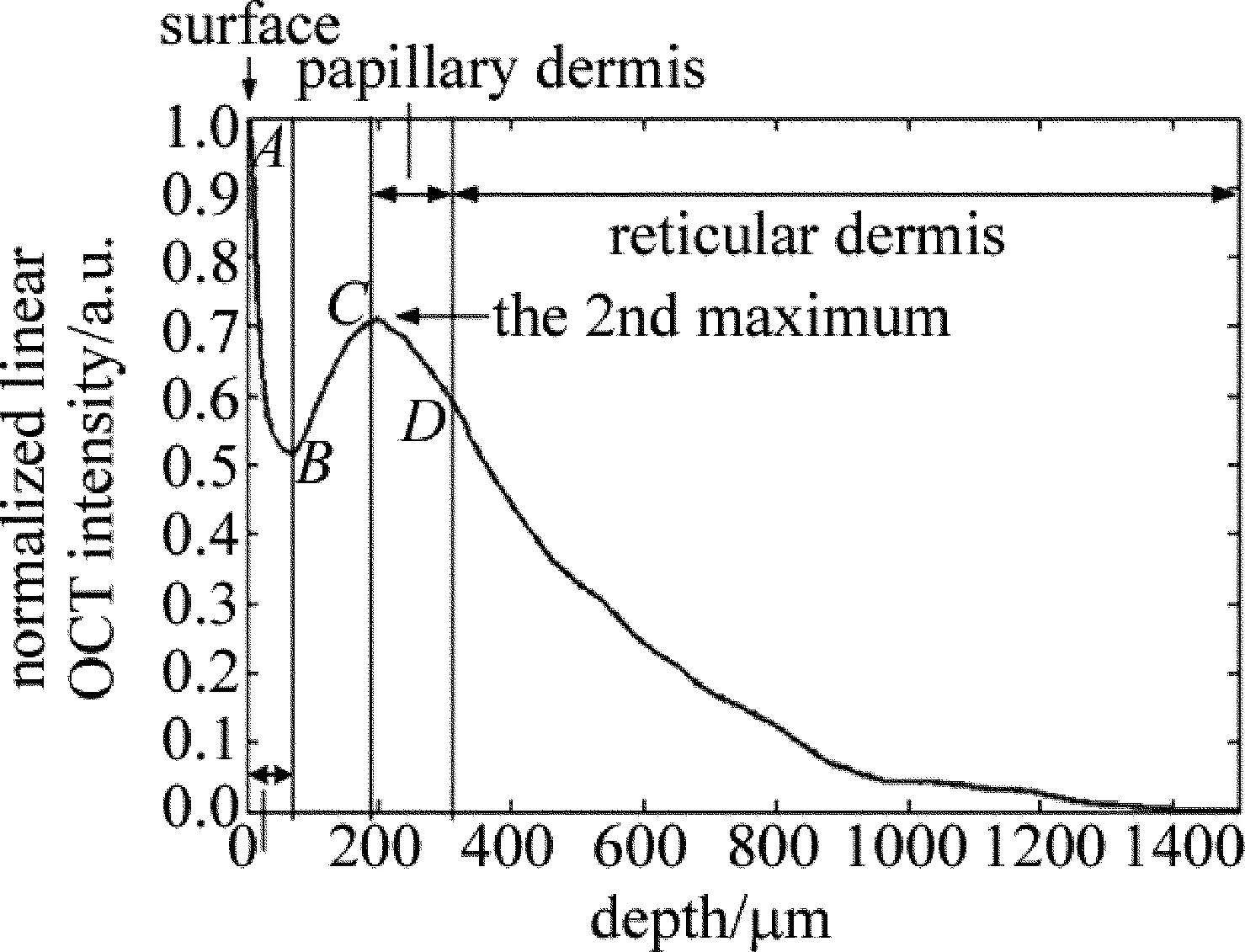
Fig.1 Normalized 1-D distribution of light intensity in depth
如图1所示为沿深度z方向的手臂皮肤归一化1维光强图,1维光强曲线由3维重建图中所有轴向扫描平均而得。皮肤表面为归一化最大值1,表面以下90μm左右深度范围内为表皮层(AB段)[9];BC段为表皮层和真皮层的交界区域,由于散射逐渐增强,光强也逐渐增大;C点为第2个极值点,C点以下为真皮层;CD段为真皮浅层乳头层,厚度约为120μm;D点以下区域为网状层[10]。
皮肤沿深度方向分布的不同组织层可近似为分段均匀介质,根据比尔-朗伯定律:

式中,μt为光衰减系数,I表示通过样品后的光强,I0表示入射光强。干涉信号到达光电探测器的光强可表示为:

式中,Is表示从样品臂返回的光强,Ir表示从参考臂返回的光强。因此,沿深度z方向的OCT信号强度可表示为:

式中,A0表示皮肤表面入射光强。(2)式在对数范围内可表示为:
g(z)=20lgA(z)=20lgA0-

式中,b为OCT信号在对应z深度范围内的拟合直线斜率值,且b=-20μt/ln10(μm-1)。因为,OCT测量分辨率在微米量级,所以:

或:

在光学无创血糖检测中,一般选用真皮层作为测量人体血糖浓度的目标组织。即光衰减系数反映的是皮肤真皮层组织中的血糖变化,这种变化趋势会滞后于末梢血或静脉血中的血糖变化。因此,对于采集血样时刻所对应的由OCT图像计算出的皮肤光衰减系数,由于延迟的原因此二者之间不会达到最大相关性。作者所采用的计算延迟时间的方法为,从采集血样时刻起,以1min为间隔,逐渐向后计算光衰减系数与血糖值的相关系数,直到计算出最大相关系数。此时对应的时间间隔,即认为是二者之间的延迟时间。
2结果与讨论
由于皮肤结构及组成物质的不同,在不同深度区域其光衰减系数与血糖(bloodglucoseconcentration,BGC)之间的正负相关性并不相同,因此相关系数大小也不一致,一般取值范围在±1之间[11]。图2所示为OGTT实验中,某位被测试者皮肤光衰减系数随血糖变化的趋势图。光衰减系数计算的深度区域为200μm~325μm,此区域位于真皮层上半部的乳头层,且与血糖变化呈负相关性。
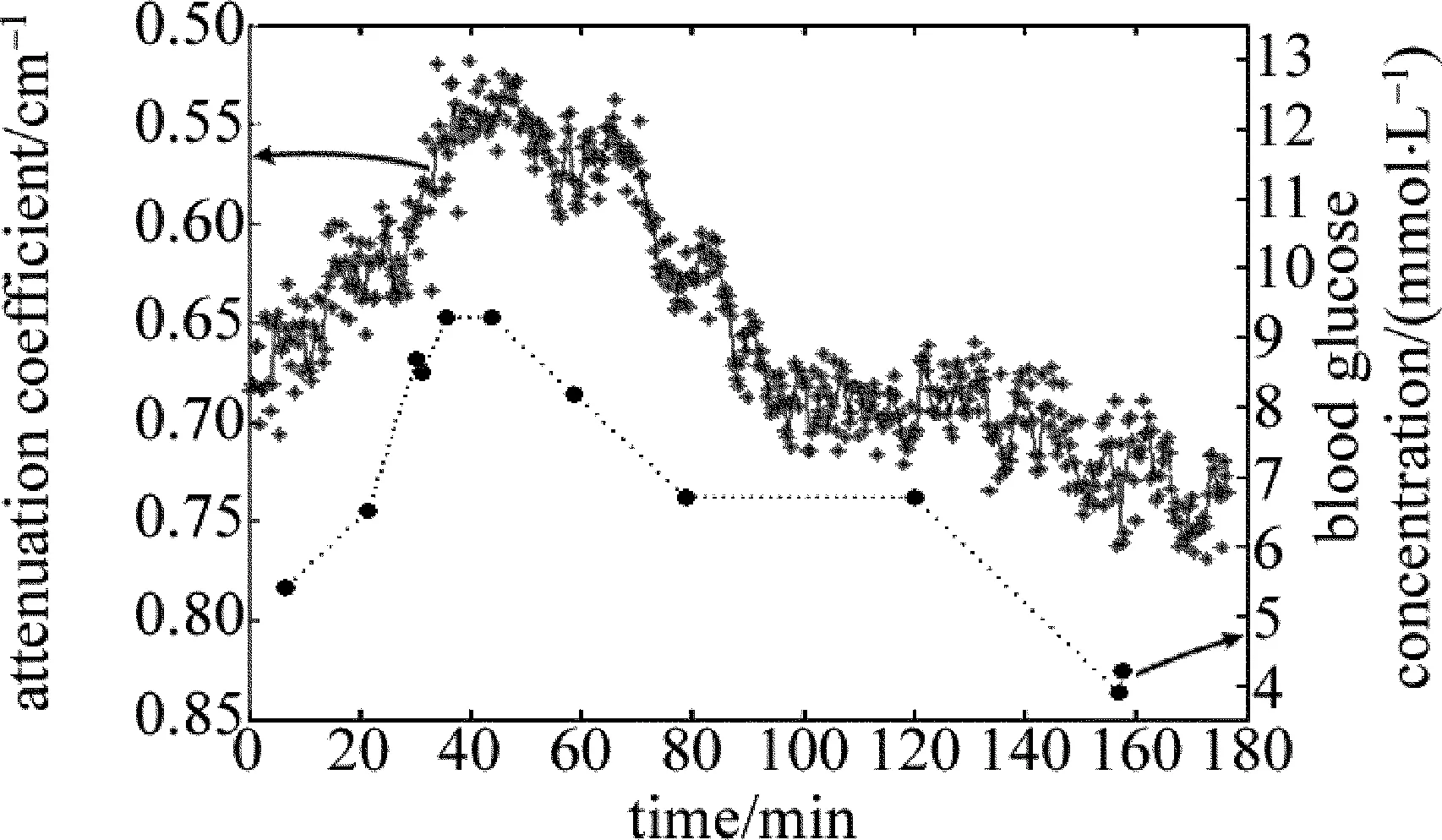
Fig.2Attenuationcoefficient(plottedintheinvertedscale)andBGCversustimeforoneofthefivesubjectsinOGTTexperiments
血糖钳夹实验和口服葡萄糖耐量测试,共8名被测试者的实验结果如表1所示。其中,血糖钳夹实验对象为3名Ⅱ型糖尿病患者,口服葡萄糖耐量实验对象为5名健康成人。每位被测试者计算血糖平衡延迟时间所选择的深度区域分为两部分,第1块区域靠近真皮层与表皮层交界处,其位置位于真皮层上半部分的乳头层。第2块区域位于真皮层下半部分的网状层,靠近皮下组织。乳头层胶原纤维束较网状层纤细,但此二层基本组成物质相同,均由胶原纤维、基质、组织间隙液组成。由于真皮层的物质分布不同,光衰减系数与血糖的正负相关性随深度变化也不同。本文中计算所得的二者之间最大相关系数按绝对值表示(如表1所示),即为计算到延迟时间点的最大相关系数。
从表1中数据可以看出,对于8位被测试者,其血糖平衡延迟时间各不相同。这主要是由于人的个体及生理因素差异所导致。对于3名Ⅱ型糖尿病患者,其靠近表皮层区域的血糖平衡延迟时间为24min~33min,靠近皮下组织的区域延迟时间为11min~17min。而对于5名OGTT测试的健康成人,对应区域的延迟时间分别为12min~41min和2min~34min。虽然两组被测试人员血液样品采集的部位不一致(动脉化静脉血和指血),但血糖平衡延迟时间并无明显区别。
对于同一个人,选择计算的深度区域不同,其对应的延迟时间也不同。一般越靠近皮肤表层,其血糖平衡延迟时间越长。区域越靠近皮下组织,延迟时间越短。在靠近皮肤表皮层的乳头层区域,平均延迟时间为28min。而靠近皮下组织的网状层区域,平均延迟时间为13min。其原因可能是由于人体将摄入的食物经过消化系统转化为单糖(如葡萄糖等)进入血液,通过血管运送到全身细胞,作为能量的来源。因此,皮肤真皮层区域越深,其组织间隙液与皮下组织血液中的血糖交换速度越快,即其血糖改变速度越接近于血管内的血糖变化。故血糖平衡延迟时间随着皮肤区域深度的增加而缩短。从以上分析可以看出,在不同的皮肤深度区域,血糖平衡延迟时间具有一定的差异性。对于OCT无创血糖检测,为了避免由于延迟因素造成预测血糖值误差过大,需要结合皮肤不同深度的相关区域对血糖平衡延迟时间做具体定量分析计算。且选择计算的皮肤区域越深,延迟时间对于预测值的影响越小。

Table 1 Experimental results of OGTT and glucose clamp
3结论
通过口服葡萄糖耐量测试和血糖钳夹实验,主要研究了在人体血糖快速改变的情况下,组织液糖浓度所引起的皮肤光衰减系数变化与指血(末梢血)、静脉血血糖之间的延迟关系。结果表明,二者血糖平衡延迟时间与皮肤区域的深度有关。皮下区域选择越深,延迟时间也越短。因此,对于延迟时间的计算,需要针对个人及特定深度区域做具体分析。光学无创血糖检测过程中需要将延迟因素考虑在内,以减少对预测血糖值的影响。而关于预测血糖值的计算,应尽量选择700μm~800μm深度以下,靠近皮下组织的真皮网状层区域,以减少延迟时间的影响。此外,对比末梢血血糖和静脉血血糖,此二者与皮肤真皮层组织血糖值延迟时间并无明显区别。
参考文献
[1]LI Q B,LIU J Q,LI X. Development of human blood glucose noninvasive measurement system based on near infrared spectral technology [J]. Spectroscopy and Spectral Analysis, 2012, 32(3):642-646(in Chinese).
[2]LI X,ZHANG G J,LI Q B. An improved wavelet analysis preprocessing method applied to Mid-IR blood glucose non-invasive measurement [J]. Acta Optica Sinica, 2010, 30(2): 579-584(in Chinese).
[3]ENEJDER A M, SCECINA T G, OH J,etal. Raman spectroscopy for noninvasive glucose measurements [J]. Journal of Biome-dical Optics, 2005, 10(3): 031114.
[4]ANSARI R R, BÖCLDE S, ROVATI L. New optical scheme for a polarimetric-based glucose sensor [J]. Journal of Biomedical Optics, 2004, 9(1): 103-115.
[5]PLEITEZ M A, LIEBLEIN T, BAUER A,etal. In vivo noninvasive monitoring of glucose concentration in human epidermis by mid-infrared pulsed photoacoustic spectroscopy [J]. Analytical Chemistry, 2013, 85(2): 1013-1020.
[6]KINNUNEN M, MYLLYLä R, JOKELA T,etal. In vitro studies toward noninvasive glucose monitoring with optical coherence tomography [J]. Applied Optics, 2006, 45(10):2251-2260.
[7]KURANOV R V, SAPOZHNIKOVA V V, PROUGH D S,etal. In vivo study of glucose-induced changes in skin properties assessed with optical coherence tomography [J]. Physics in Medicine and Biology, 2006, 51(16): 3885-3900.
[8]KOSCHINSKY T, HEINEMANN L. Sensors for glucose monitoring: technical and clinical aspects [J]. Diabetes/Metabolism Research and Reviews, 2001, 17(2): 113-123.
[9]HORI Y, YASUNO Y. Automatic characterization and segmentation of human skin using three-dimensional optical coherence tomography [J]. Optics Express, 2006, 14(5): 1862-1877.
[10]BHANDARI A, HAMRE B, FRETTE O,etal. Modeling optical properties of human skin using Mie theory for particles with different size distributions and refractive indices [J]. Optics Express,2011, 19(15): 14549-14567.
[11]SAPOZHNIKOVA V V, KURANOY R V, CICENAITE I,etal. Effect on blood glucose monitoring of skin pressure exerted by an optical coherence tomography probe [J]. Journal of Biomedical Optics, 2008, 13(2):021112.
Study on blood glucose lag time in noninvasive measurement
using optical coherence tomography
SUYa1,MENGZhuo1,2,YUHaimin2,3,WANGLongzhi1,LIUTiegen1,YAOXiaotian1
(1. Key Laboratory of Opto-electronics Information and Technical Science of Ministry of Education, College of Precision Instrument and Opto-electronics Engineering, Tianjin University, Tianjin 300072, China; 2. Suzhou Optoring Ltd. Co., Suzhou 215123, China; 3. School of Science, Jiangnan University, Wuxi 214122, China)
Abstract:To investigate the lag of glucose concentration between interstitial fluid of human skin and blood (peripheral blood and venous blood) during rapid change of blood glucose, optical coherence tomography (OCT) was used to measure attenuation coefficient of human skin with the change of blood glucose in oral glucose tolerance test and glucose clamp in vivo. To reduce error in prediction result, the correlation region used to calculate predicted glucose concentration should be selected below 700μm~800μm in dermis layer. The results show that lag time decreases with the increases of depth of human skin. It is demonstrated experimentally that the lag time changes at different depths in human skin. The study can improve the accuracy and reliability of measurement value in noninvasive blood glucose sensing.
Key words:medical optics; optical coherence tomography; noninvasive blood glucose measurement; blood glucose lag time
收稿日期:2014-02-14;收到修改稿日期:2014-04-15
作者简介:苏亚(1980-),男,博士研究生,主要从事光学相干层析技术和生物组织光学方面的研究。
基金项目:国家九七三重点基础研究发展计划资助项目(2010CB327806);国际科技合作专项基金资助项目(2010DFB13180);江苏省基础研究计划资助项目(BK20130374);苏州市医疗器械与新医药科技计划资助项目(ZXY2012026)
中图分类号:O657.3
文献标志码:A
doi:10.7510/jgjs.issn.1001-3806.2015.01.004

