多芳基吡咯衍生物的发光性质及其应用
刘 派,陈笛笛,冯 霄,石建兵,佟 斌,董宇平*
(1.北京理工大学 生命科学学院,北京 100081;2.北京理工大学 材料科学与工程学院,北京 100081;3.北京理工大学 化学学院,北京 100081)
引言
有机发光材料在发光二极管、有机激光、光电池、光传感器等多个领域都有重要应用[1-5]。在极稀的溶液中,荧光分子之间可以适当的分离,从而避免了荧光发色团间相互作用所产生的干扰,故荧光寿命、衰减速率和发光效率等光物理参数均在极稀的溶液中测定。然而传统的荧光生色团多为具有大π共轭体系的刚性平面分子,虽然在稀溶液中具有很高的荧光量子产率,但在聚集状态下荧光减弱甚至不发光,这是因为平面性很好的芳香基团在混合溶剂聚集时更倾向于基于π-π相互作用的面-面堆积,这就会使激发态通过非辐射跃迁途径衰减,使得荧光分子的发光强度大幅减弱甚至完全不发光,这一猝灭过程与聚集体的形成有关,即聚集导致荧光猝灭(Aggregation caused quenching,ACQ)[6](图1)。由于 ACQ 效应大大限制了发光材料的应用,因此,人们通过化学反应、物理方法,或者其他工程来抑制发光聚集体的生成[7-9]。然而,这些方法对于 ACQ 效应的抑制并不明显。因为在某种程度上制备薄膜的过程中一定会发生聚集,因而最理想的是得到一种在聚集态下发强光的分子。
2001年,唐本忠课题组发现1-甲基-1,2,3,4,5-五苯基硅杂环戊二烯(silole)衍生物在稀溶液中几乎不发光,但在浓溶液及固体状态下发光大大增强,即 “聚 集 诱 导 发 光 (Aggregation-induced emission,AIE)”现象[10]。产生这一现象的主要原因是分子聚集使分子构象扭转被限制或分子间形成J-聚集体,抑制了非辐射能量转移,从而促进了聚集态下发光或发光增强[11,12]。
科研工作者基于“螺旋桨”式的分子设计,成功地合成出多种具有AIE性质的分子体系,并在荧光传感器、智能材料、有机发光二极管和细胞成像等领域发挥了巨大的作用。其中主要的几类AIE体系,包括:六苯基噻咯(hexaphenylsilole)体系[13](图 1)、四 苯 基 乙 烯 体 系 (tetraphenylethene)[14-18]、苯乙烯 基 蒽 体 系 (distyrylanthracene)[19,20]、二苯基芴或咔唑体系(diphenylmethylene fluorene or carbazole)[21-23]、二苯基丁二腈体系(diphenylfumaronitrile)[24]、多苯基丁二烯体系(multiphenylbutadiene)[25-27]、三苯基苯体系(triphenylbenzene)[28]、三苯基吡喃体系(triphenylpyrone)[29],三苯基磷杂吲哚体系(triphenylphosphole)[30,31]、BODIPY 体系[32]、吡嗪体系(pyrazine)[33,34]等。
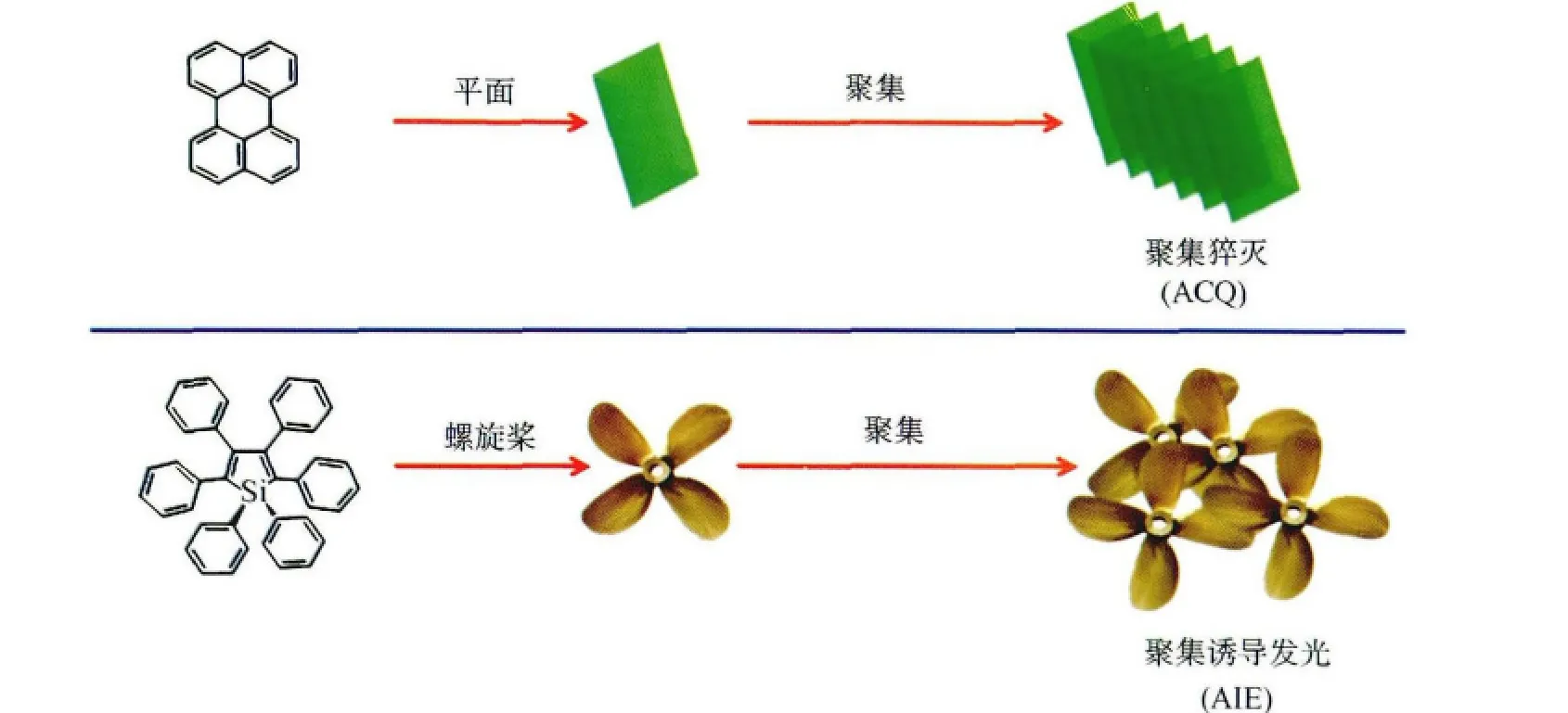
图1 Perylene的平面分子构型、聚集示意图,以及六苯基噻咯的“螺旋桨”式分子构型、聚集示意图plane configurationsand aggregation of perylene,“propeller”of molecular configuration and aggregation of hexaphenylsilole
由于silole具有非常显著的AIE特性,即使将silole分子中的Si原子换成其它元素,如Ge、Sn等,所制备的系列化合物在聚集状态下或者处于蔗糖八醋酸纤维素凝胶态中,荧光量子产率仍然高于溶液状态下的2倍,表现出AIE性质[35]。对于以噻吩为核的四芳基取代噻吩(tetraphenythiophene),因为具有与Silole非常相似的构型,也表现为具有AIE性质[36,37],这些结果都证实了分子的振动和转动受限是荧光增强的主要原因。
论述
近年来,吡咯衍生物或聚合物因其特殊的光电性质使其在有机发光器件方面受到越来越广泛的关注[38,39]。如果以吡咯为核,通过单键连接的多芳基吡咯将会与silole具有相似的结构特点,从而具备了扭曲的“螺旋桨”式构型,这样就避免了聚集态下的面-面紧密堆积,极大降低了非辐射能量损耗,使荧光分子有望从根本上避免了“聚集猝灭”的缺陷,使发光强度得到很大提升。正是基于这一考虑,本课题组率先对具备AIE特性的多芳基吡咯进行了深入研究。通过化学合成反应引入不同数量及不同取代位置的基团,研究结构与AIE性质之间的关系,并深入探究其应用,这将有助于帮助我们更好地理解AIE的机理。
目前合成的含芳环取代基吡咯类化合物的方法比较单一,主要通过 Knorr反应[40]或 Paal-Knorr反应[41,42]进行合成,但由于受到原料1,4-二酮化合物及重金属类催化剂来源的影响,限制了更深入的研究。我们选择并改进了Schulte-Reisch方法[43,44],利用1,4-二苯基丁二炔与苯胺在氯化亚铜的催化下合成了1,2,5-三苯基吡咯,并通过采用本体合成的方法提高了收率,缩短了反应时间,降低了反应温度。继而我们又通过NBS溴化以及Suzuki反应,合成了四苯基吡咯与五苯基吡咯及其衍生物(图2)[45]。
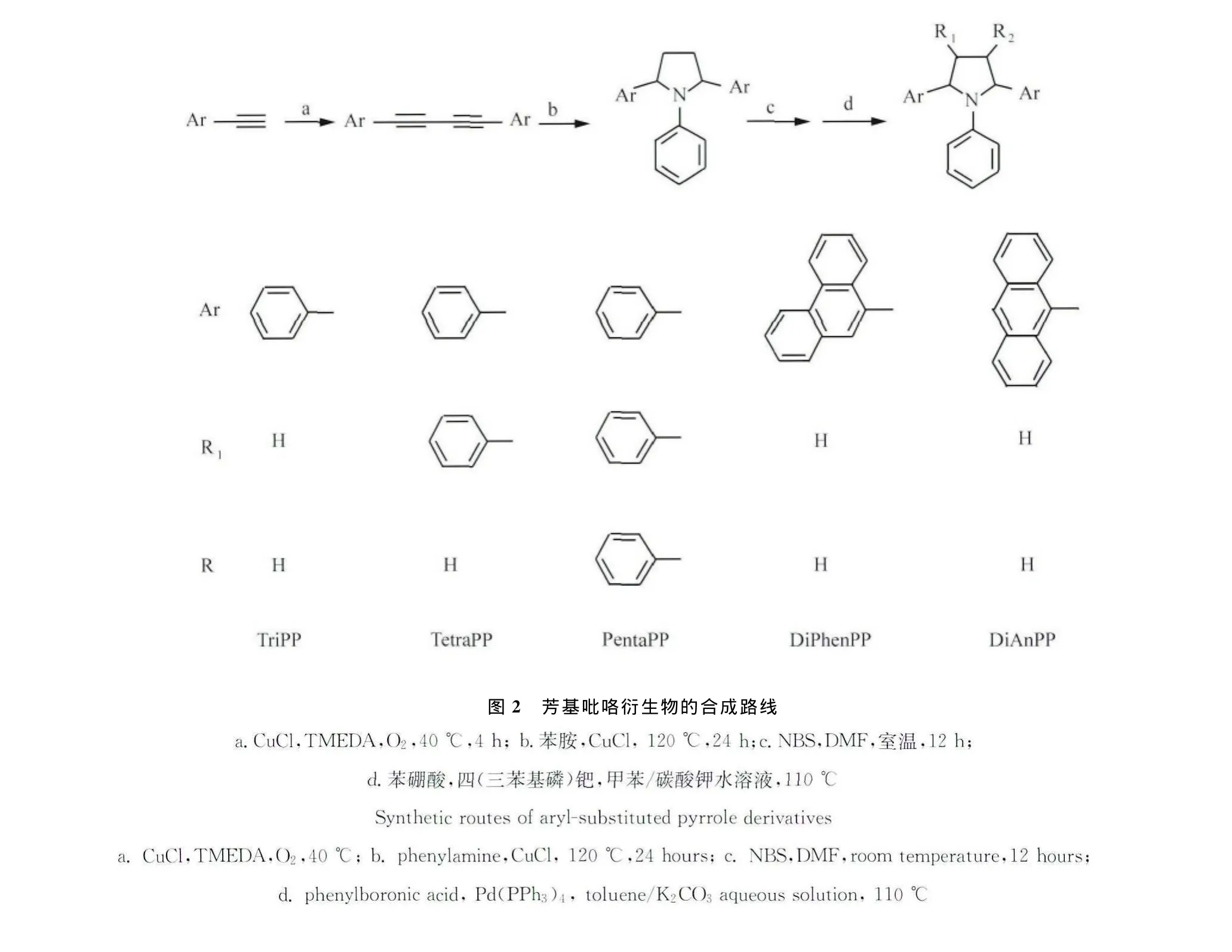
图3为制备的多种多芳基取代吡咯的晶体在365nm的紫外光照下的照片,可以看出:Tripp、TetraPP、PentaPP在固态时均可在紫外光照下发射一定程度的蓝色荧光,只有3,4-二溴-1,2,5-三苯基吡咯几乎看不到荧光,这是由于溴对荧光具有一定程度的猝灭作用所造成的。
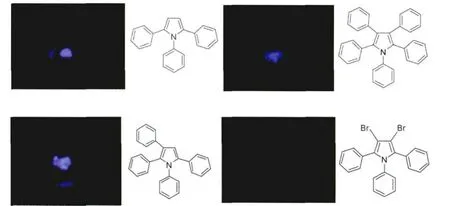
图3 4种苯基取代吡咯在紫外光照下化合物的照片(365nm)The photographs of four kinds of aryl-substituted pyrrole derivatives under UV light(365nm)
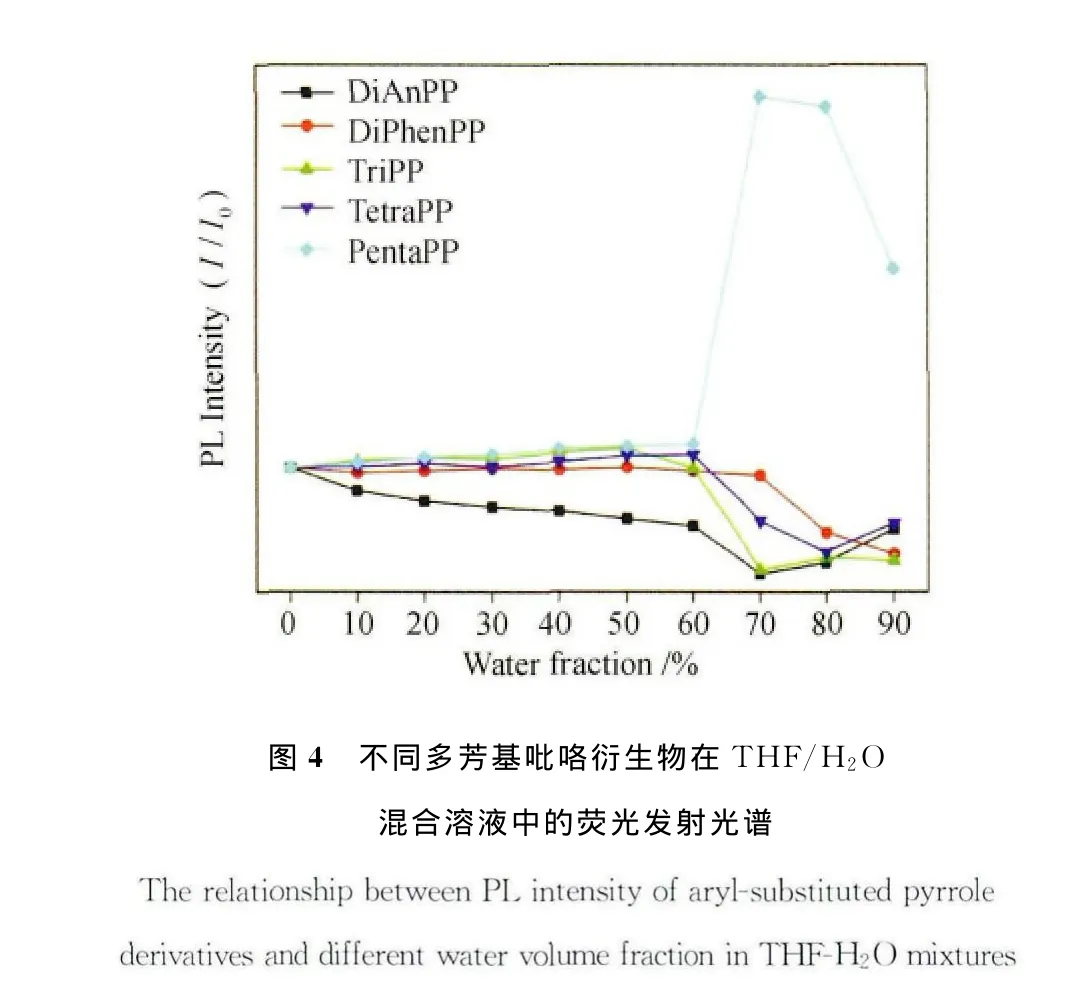
通过向5种化合物的THF溶液中加入其不良溶剂H2O诱导其发生聚集,由荧光发射光谱(图4)可以看出,当含水量达到70%以后,只有PentaPP的荧光呈增加趋势,而其它4种化合物均发生了一定程度荧光猝灭现象,即只有PentaPP具有比较明显的 AEE(Aggregationenhanced emission)性质。当水含量达到60%~70%以后,其它4种化合物由于分子间较强的π-π键相互作用引起分子发生堆积,由于其分子共平面化程度较大,分子间在聚集过程中发生了面对面的H-聚集,导致了激发态电子的能量随着这种激发态缔合体的生成发生非辐射去活能量的损耗,荧光发生猝灭。而PentaPP由于分子内空间位阻较大,其π-π共轭结构发生扭曲,分子的平面化程度相对其它两种化合物而言较差,分子间发生聚集的时候不能以面对面的形式发生H-聚集,而是发生了头尾相接的J-聚集,这种非辐射能量的通道受到了抑制,从而其在聚集态时仍然具有较高的荧光量子产率。
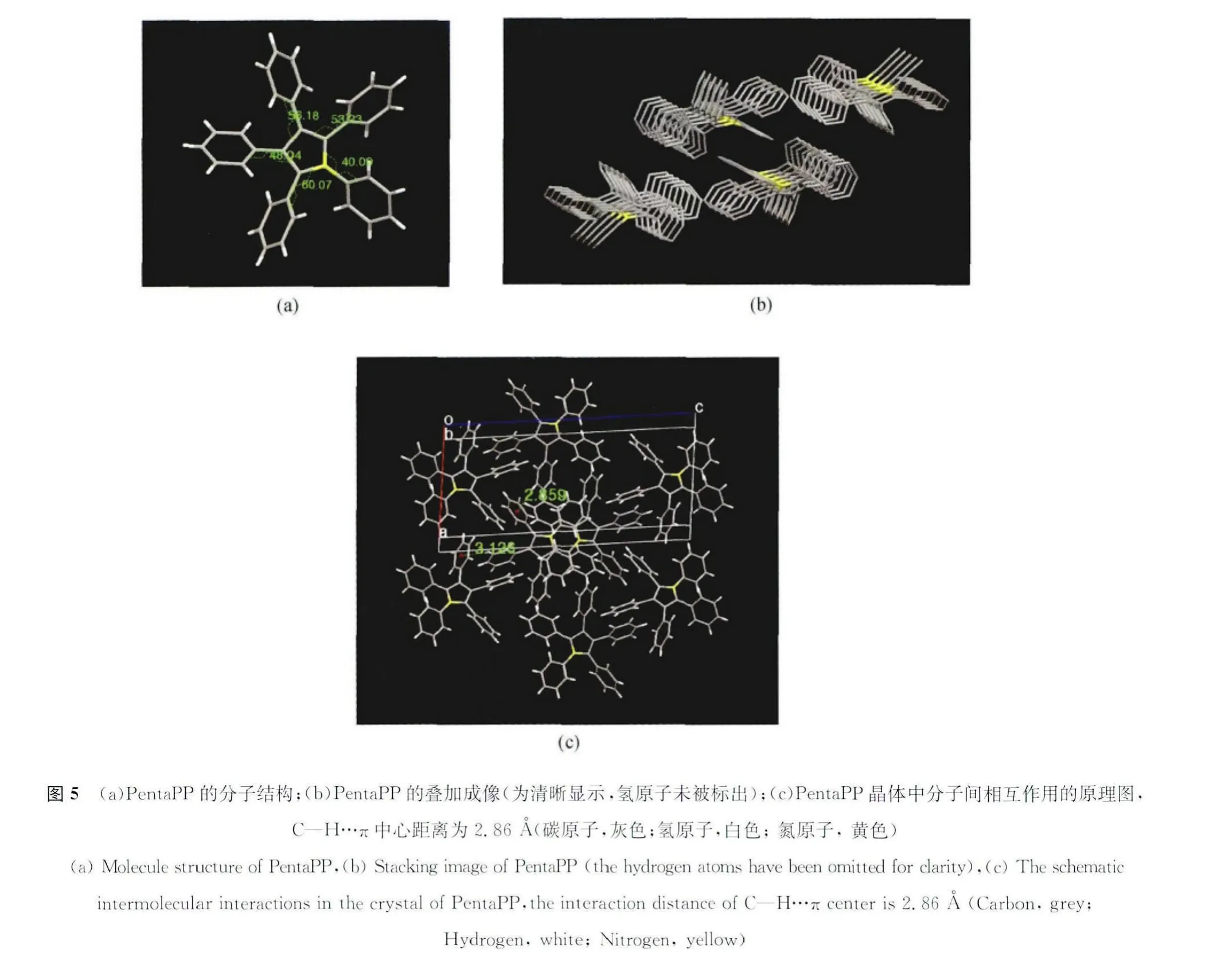
为证明上述分析的可行性,我们对PentaPP的单晶结构进行了解析。结果显示PentaPP具有高度扭曲的构象,吡咯环和临近苯环之间的扭转角分别是40.09°、53.23°、56.18°、48.04°和60.07°(图5(a)),而且分子间逐列排列并且垂直于吡咯平面,每个分子间的距离是5.14Å,他们之间的ππ键并不是“face to face”的形式而是edge-to-face的形式,形成了芳香基间的CH…π的氢键连接,阻碍了苯环和吡咯环的σ键的旋转,使晶体可以更好的产生AEE的现象。
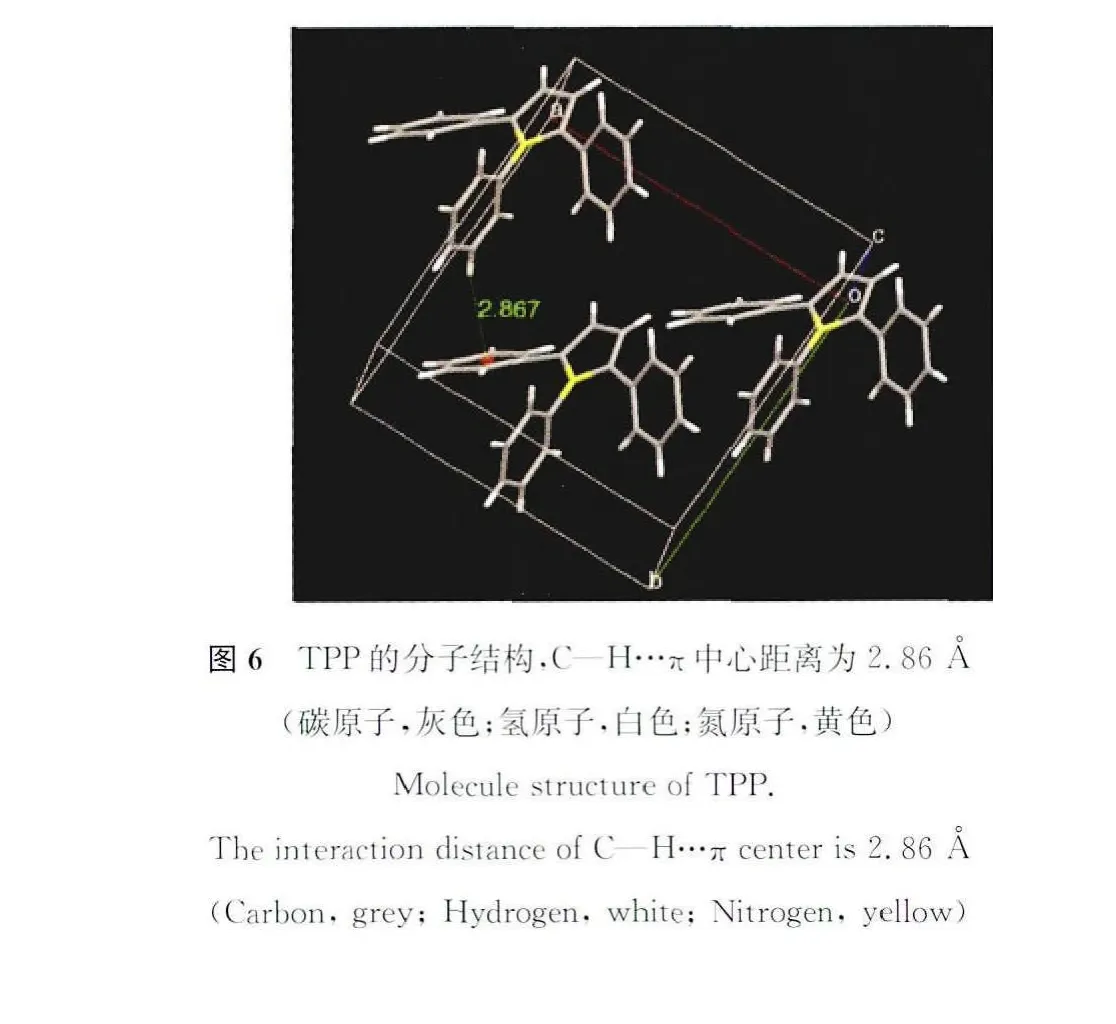
为了更好地解释三苯基吡咯在相同条件下没有表现为AIE特性的原因,我们对其单晶结构进行了分析(见图6)。结果表明其单晶体结构属C2空间群类型的单斜晶系。在稳定晶体结构过程中,C—H…π相互作用代替了π-π相互作用,使得苯环之间的距离较大,不利于限制分子内旋转,难以有效抑制非辐射能量转移,从而表现为ACQ性质。
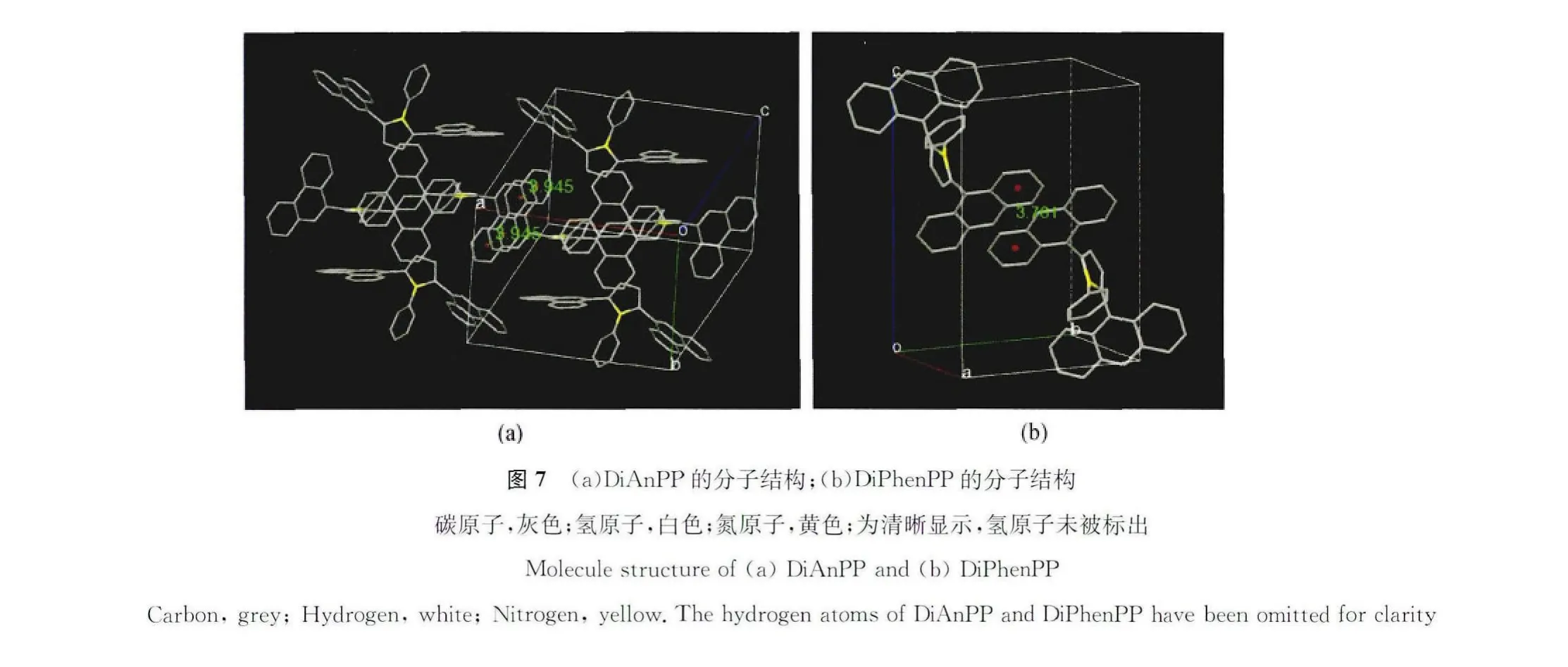
对于具有更大的共轭结构和空间位阻的蒽和菲取代基,虽然芳基吡咯分子内的单键旋转受到了限制。然而分子内吡咯基团和相联芳基之间的的扭转角达到80°使得分子间蒽基团和菲基团在单晶中π-π堆积分别达到了3.76Å和3.94Å(图7(a)和(b)),即蒽基团或菲基团在聚集态结构中是以彼此面-面堆积,这就为去激发能量耗散提供了无辐射能量转移途径[45]。
为了拓展新型的AIE体系,更好地推广AIE理念,以及开发AIE在传感器领域的实际应用,在保持“螺旋桨”式分子构型的前提下,我们通过简单的化学修饰,赋予多芳基吡咯AIE体系以功能化,拓展了多芳基吡咯作为发光材料的应用范围。多芳基取代吡咯类衍生物,根据小分子的取代基类型及位置不同,分子表现出不同的荧光特性,并实现了多样化的应用。
我们向1,2,5-三苯基吡咯上引入单酯基、双酯基和三酯基,分别记为 TPP-COOCH3、TPP-2COOCH3、TPP-3COOCH3。由图8可知,引入酯基后,可以将基于TPP的分子从ACQ现象变为AIE现象,造成这样的原因可能是限制了分子内旋转。实验结果表明了只有TPP-COOCH3具备AIE现象。
为了增强其水溶性,我们将酯基转化为羧酸盐,合成了一系列化合物,分别为TPP-COONa、TPP-2COONa和TPP-3COONa。对这类化合物而言,水是他们的良溶剂,四氢呋喃是不良溶剂。TPP-COONa的稀溶液几乎不发出任何荧光,当不断加入的四氢呋喃溶液使其含量超过80%时,体系的荧光急剧增强,这说明聚集诱导了TPPCOONa的发光现象,证实了TPP-COONa是一个活跃的 AIE分子(图9)。而 TPP-3COONa在328nm激发下光致发光明显增强,并且在THF浓度在75%的时候达到最大值,这是因为TPP-3COONa分子的无序快速聚集。因为TPP-3COONa的3个带电子基团在四氢呋喃溶液中的溶解度比TPP-COONa要低,更容易形成聚集体,为在低四氢呋喃浓度下检测金属离子提供更多的可能性[46,47]。
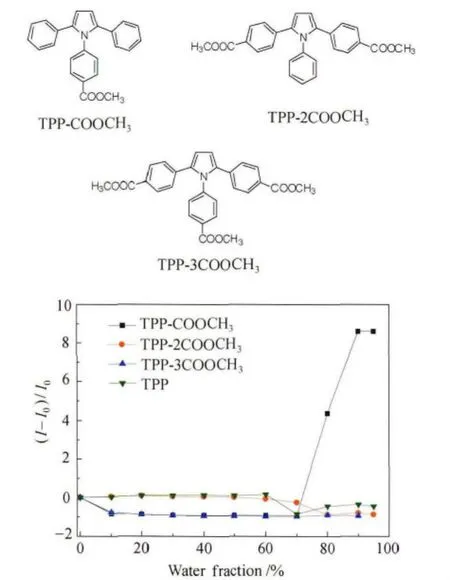
图8 TPP、TPP-COOCH3、TPP-2COOCH3、TPP-3COOCH3的结构式及在THF/H2O中的荧光发射光谱Plot of fluorescence intensities of TPP、TPP-COOCH3、TPP-2COOCH3、TPP-3COOCH3(10μmol/L)versus solvent composition of THF/H2O mixture and molecule structure
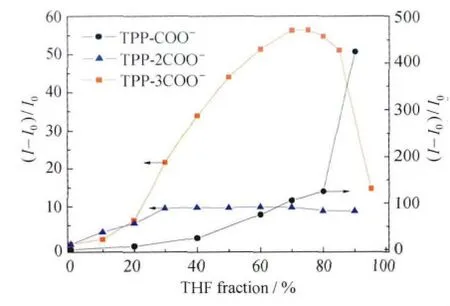
图9 TPP-COONa、TPP-2COONa和TPP-3COONa在THF/H2O中的荧光发射光谱Plot of fluorescence intensities of TPP-COONa,TPP-2COONa and TPP-3COONa(10μmol/L)versus solvent composition of THF/H2O mixture
铝离子(Al3+)是一种广泛应用于食品添加剂、厨房用具、包装材料的金属离子,人们已经证实Al3+的过多摄入会对神经造成不可恢复的损害。目前已经存在的检测Al3+的方法有原子吸收光谱法、原子发射光谱法、电感耦合等等,这些方法都存在预处理复杂,检测成本高等等问题,需要建立简单、准确分析方法来对Al3+进行高精度的检测[48,49]。
如图10所示,我们可以用TPP-COONa来对铝离子进行检测,在75/25的H2O/THF的混合溶液中,Al3+浓度从0增加到20μmol/L,荧光强度增加得很快;当 Al3+浓度在20μmol/L到28μmol/L时光致发光强度增加比较缓慢;当Al3+浓度超过28μmol/L时,体系的荧光强度不再增加。
若以荧光增长比(I-I0)/I0对铝离子浓度作图,将会得到一个很好的线性关系,线性拟合方程如下:
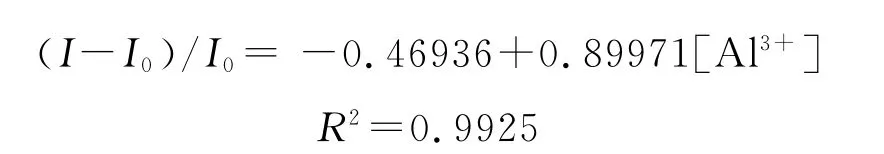
当铝离子浓度达到20μmol/L后,体系的荧光强度趋于平缓,并在铝离子浓度到达25μmol/L时达到饱和,这说明每个Al3+可以与3个TPP-COONa利用静电相互作用来结合[46]。
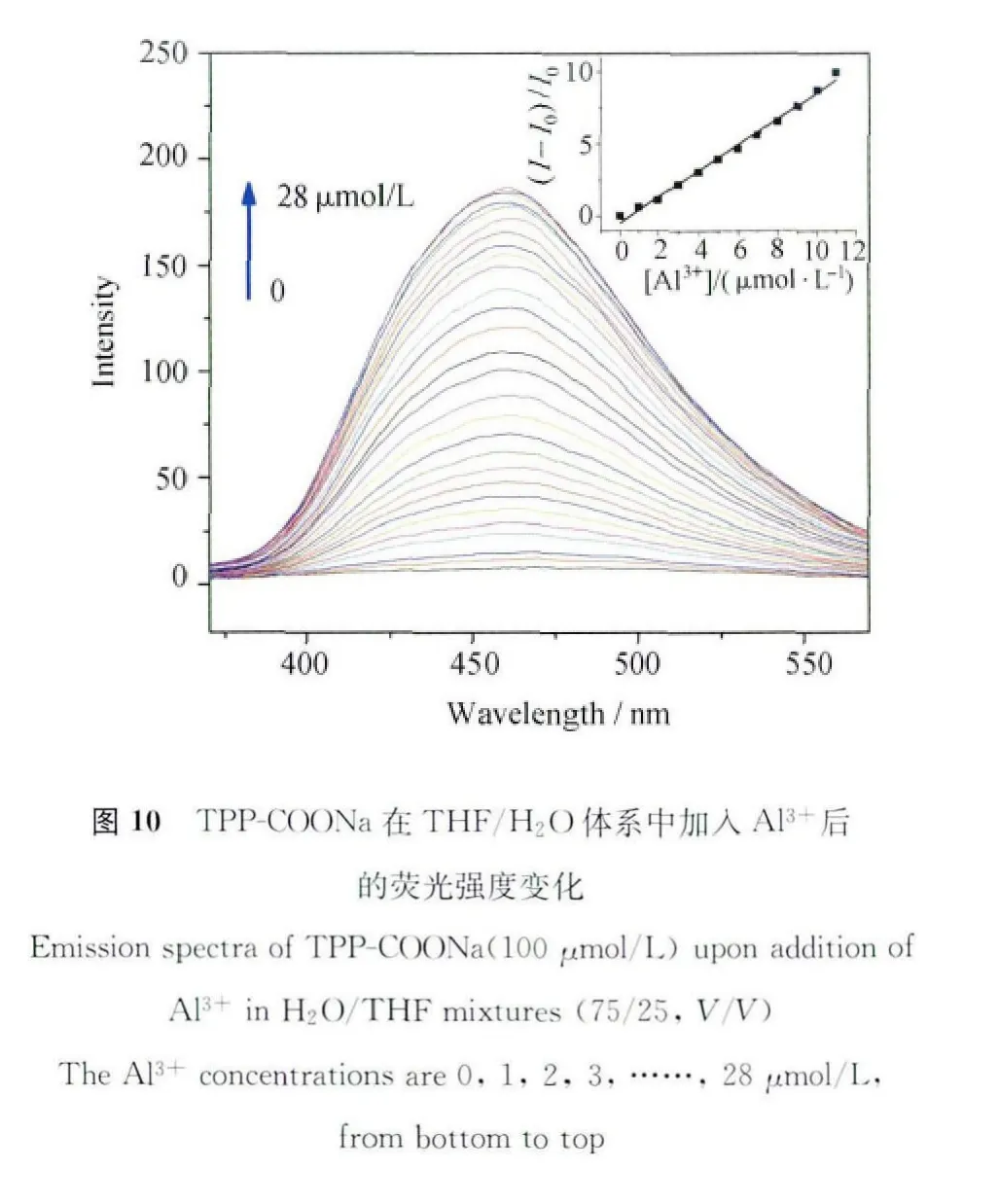
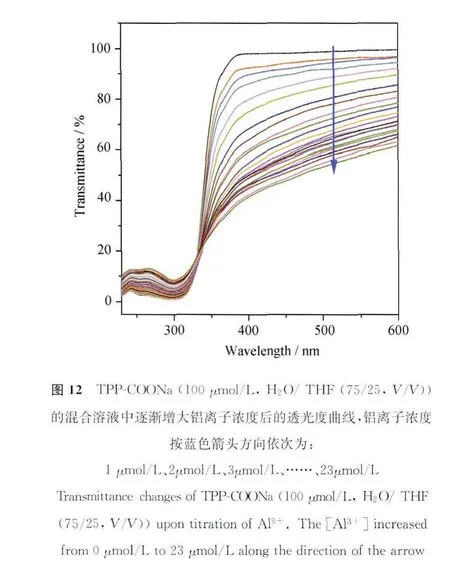
TPP-COONa的紫外光谱出现两个π-π跃迁吸收带,峰值分别为298nm和253nm,前者可归属为2,5-二苯基吡咯部分,后者则归属于苯甲酸钠部分,而在400nm之后的长波区间内则无明显吸收。在逐渐增大铝离子浓度的同时,298nm和253nm的峰值逐渐降低,这表明,TPP-COONa和Al3+结合后由于溶解性变差而逐渐析出,因此紫外吸收会呈现线性的降低(图11)。而长波长区域内吸收谱图由于光散射逐渐抬升,这说明羧酸盐与铝离子相互作用的同时引起了体系中聚集体的生成。在体系中加入铝离子的同时,可见光范围内的透光度(T%)也在逐渐下降(图12),这也同样说明了体系中聚集体的生成。其紫外光谱3个峰值的变化趋势均呈现出良好的线性关系,这对于铝离子的定量检测打下坚实基础,具有非常重要的应用价值[46]。
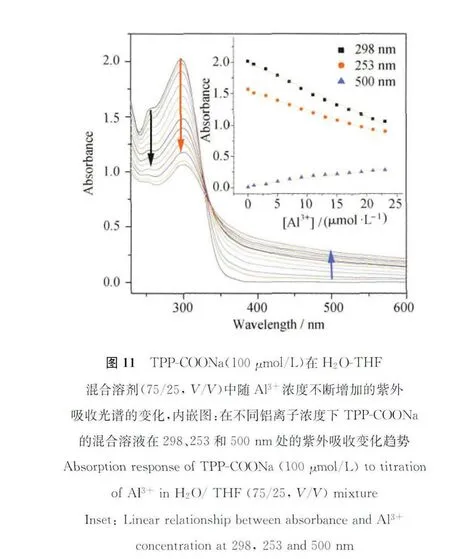
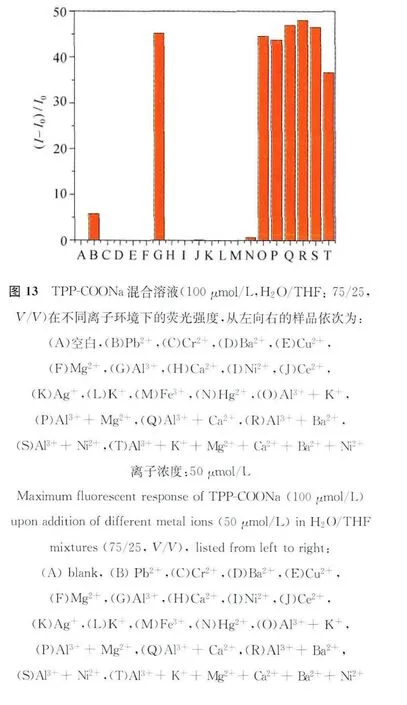
为了证实TPP-COONa对于铝离子的特异选择性,我们测试了TPP-COONa对于多种离子的荧光响应,其结果如图1 3所示,5 0μmol/L的Cr2+、Ba2+、Cu2+、Mg2+、Ca2+、Ni2+、Ce2+、Ag+、K+、Fe3+和Hg2+加入后,体系的荧光强度并无明显变化,TPP-COONa仅对Pb2+有着较弱的荧光增强响应,但是与铝离子的荧光响应相差甚远。从荧光响应数据上来看,该荧光探针对Al3+荧光增强程度大概是Pb2+的近10倍,即对于铝离子具有更好的选择性。除了选择性之外,我们还测试了该化合物在复杂离子环境下的抗干扰能力。因为 K+、Mg2+、Ca2+、Ba2+和Ni2+这5种离子在生物组织中所占比例较大,因此我们选择这5种离子作为干扰源,测试了TPP-COONa在单一干扰离子存在和5种离子共存的复杂离子环境下荧光响应,从图13可以发现,在单一干扰离子存在的情况下,体系对于铝离子均具有较强的荧光响应,与单一铝离子存在条件下的最大荧光响应相差无几。在5种干扰离子共存的复杂离子环境下,由于体系的离子强度过高,该荧光探针对于铝离子的最大荧光响应略有损失,但仍表现出明显的荧光“点亮”效应,此项数据表明该传感器的抗干扰能力较强,具有很好的实际应用前景[46]。
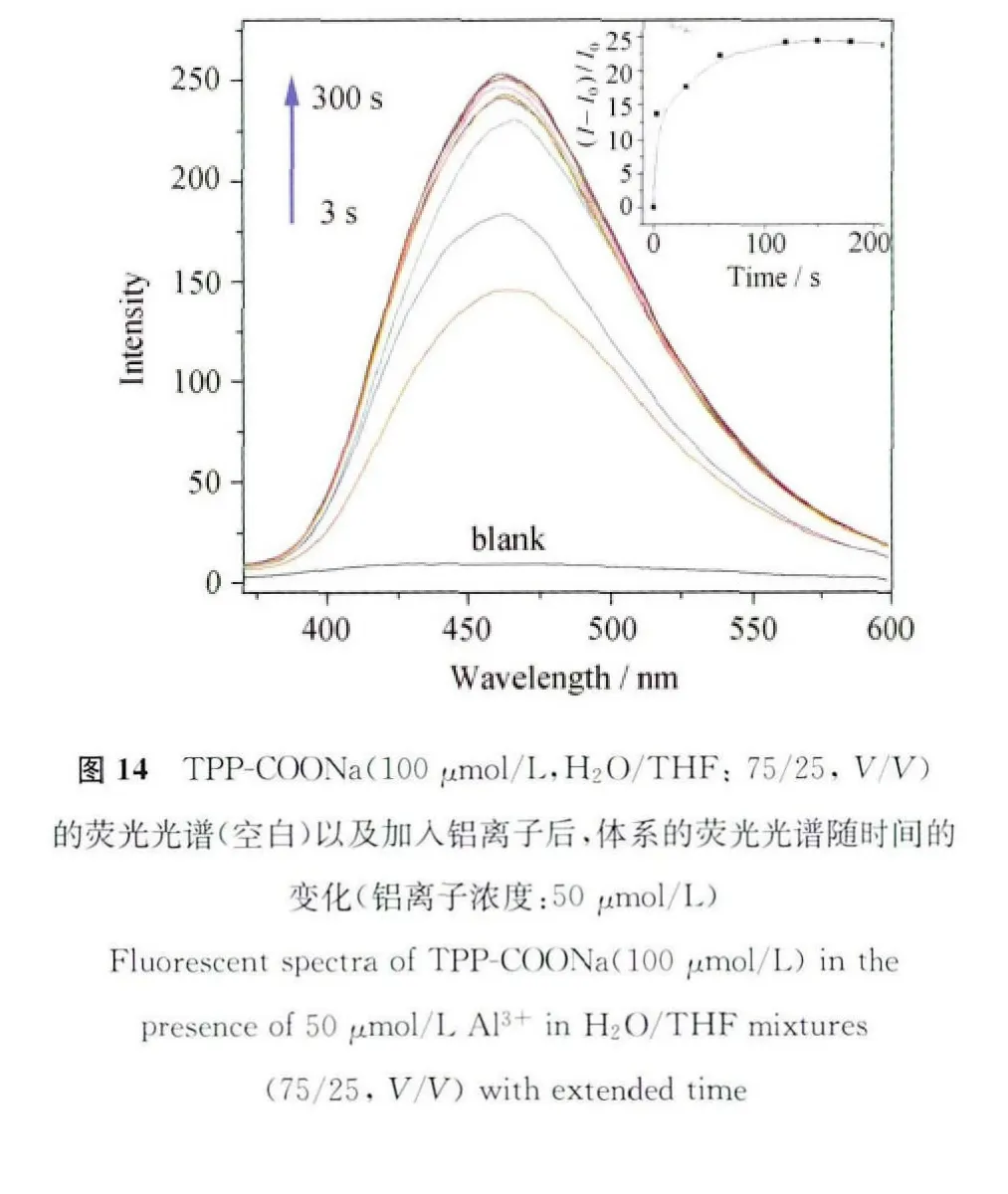
响应速度一直都是化学传感器的重要参数,响应速度越快意味着等待时间越短,就越有利于检测分析,特别是对于一些危险品、爆炸物、有害气体的实时在线检测工作尤为重要。我们测试了该荧光传感材料对于Al3+的响应速度。图14的空白曲线是TPP-COONa混合溶液(100μmol/L,THF/H2O:25/75,V/V)加入 Al3+之前的空白荧光曲线,我们可以看到该溶液的背景噪音很低,荧光曲线基本与基线平行。然而在加入50μmol/L铝离子后,荧光信号迅速增强,3s后,荧光强度就提高了14倍,肉眼可以清晰的看到蓝色荧光。2min后荧光强度达到最大值并趋于平缓。此项实验表明,TPP-COONa荧光传感器对于Al3+的响应速度非常快,已完全满足实际应用的需求[46]。
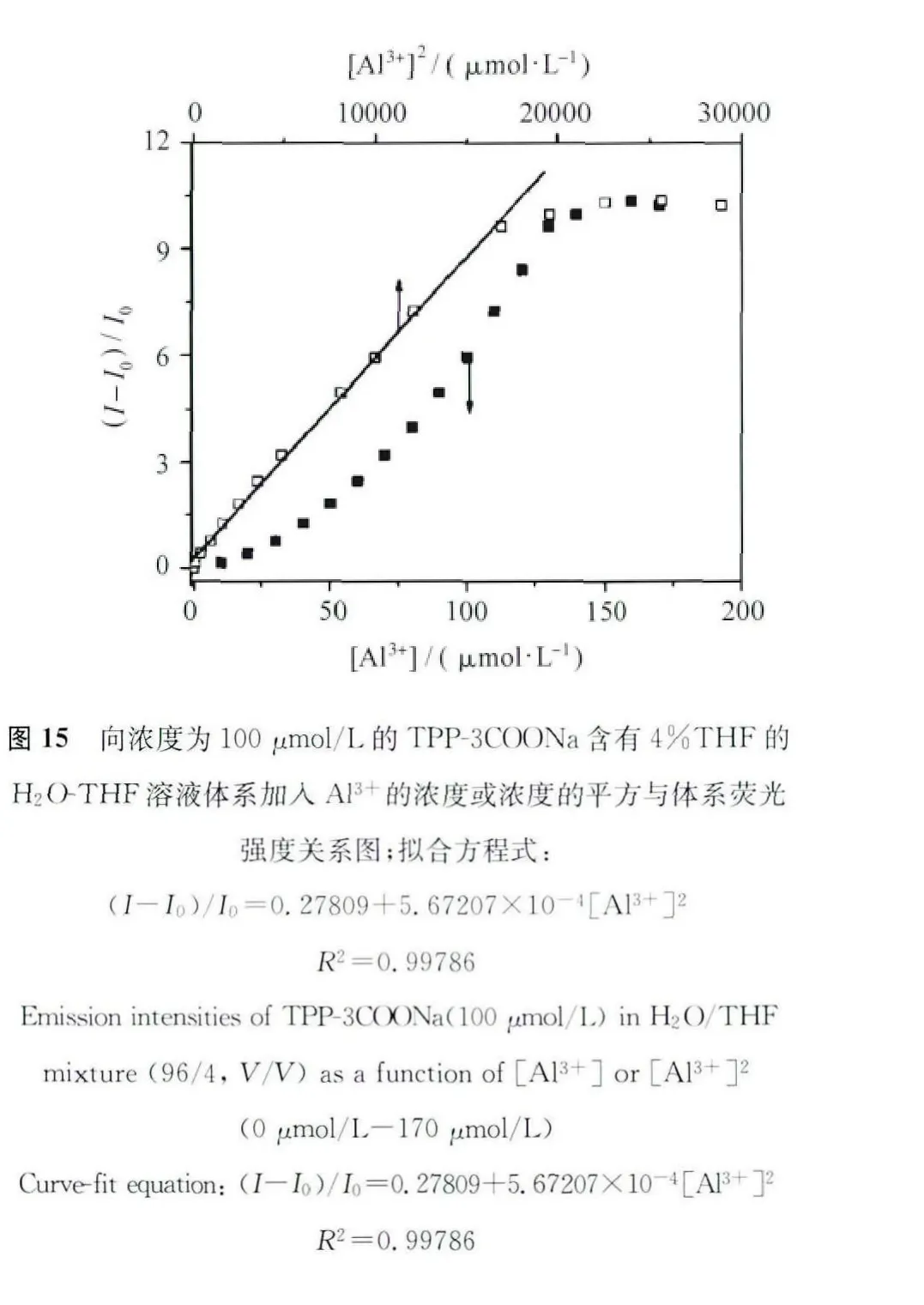
虽然TPP-COONa实现了对Al3+的点亮型特异性检测,但需要在THF/H2O体积比为25/75的溶剂中进行,这种较大比例THF的存在不能应用于生物体系,需要进一步改进TPP-COONa结构与检测能力。根据前面对TPP-3COONa的AIE行为的研究表明,TPP-3COONa是具有AIE活性的。因此我们想利用其具有很好水溶性的优点将其应用于离子检测。结果发现,浓度为100 μmol/L的TPP-3COONa在含有4%THF的 H2OTHF体系中对Al3+具有很好的点亮响应(如图15)。随着Al3+浓度的增加,体系的荧光强度也随之均匀的增加,并且所加Al3+铝离子浓度的平方与荧光强度的增加具有很好的线性关系,荧光强度增大高达10倍。为进一步证明体系对于检测Al3+的灵敏度,我们对其进行了检测限的研究,结果证明其检测限非常低,只有5.3μmol/L,这一结果说明该体系具有很好的实际应用前景[47]。
为了进一步研究TPP-3COONa对Al3+的选择性,我们利用上面所提到的浓度为100μmol/L的 TPP-3COONa,在含有4%THF的 H2O-THF体系中,对其他离子进行了最大响应性测试。比较结果可以看出(如图16),该化合物对Al3+具有很好的选择性。同时我们也做出了纯水体系对不同离子的最大响应图,可以看出在浓度为4%THF的H2O-THF体系中,TPP-3COONa具有更好的选择性以及灵敏度。如图16所示,TPP-3COONa虽然对 Au3+、Cr2+、Pb2+以及Cu2+显示出不同的点亮响应,对Hg2+、Fe3+以及Ag+也有一定的猝灭响应,但是其响应程度远不及对响应明显。为了进一步检验其实际应用前景,我们向含有Al3+的上述体系中加入干扰离子,如Al3+、Ba2+、Mg2+、Ca2+和K+。如图16所示,这些干扰离子的存在并没有影响到体系对Al3+响应性,这进一步说明了该体系在实际应用以及实现生物体系应用的一大优势[47]。
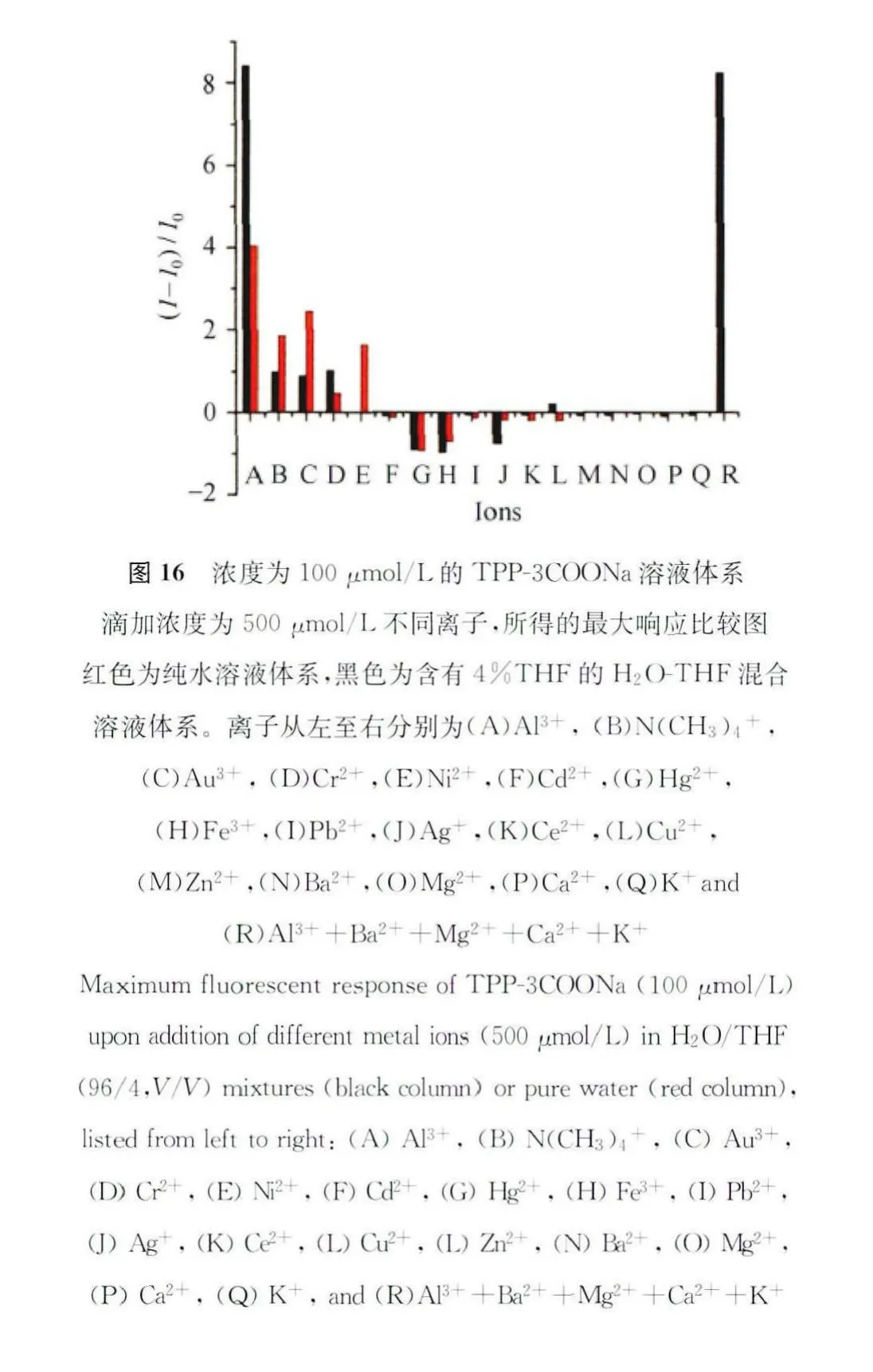
为了考察对Al3+的响应速度的快慢,我们通过荧光光谱对其进行了响应时间的研究。实验结果如图17所示。可以看出,当加入Al3+之后10s便可以达到荧光最大值,并且保持不变。值得提出的是,由于操作时间的限制,10s是我们所能测试到的最短时间。因此,我们认为该化合物对于Al3+的响应可以达到实时检测的效果。为了进一步证明该结论为正确性,我们又对加入不同浓度的Al3+进行了响应时间的研究。由图17可以看出,浓度的高低并不影响实时响应的效果。响应时间如此之快的原因是TPP-3COONa分子本身可以与Al3+结合的羧酸根基团数目多,且当体系含有一定量的THF时,体系有一定的松散聚集体,Al3+加入后,能够更快地诱导更大或者更多的聚集体生成,从而很快达到最大响应效果,即实时响应[47]。
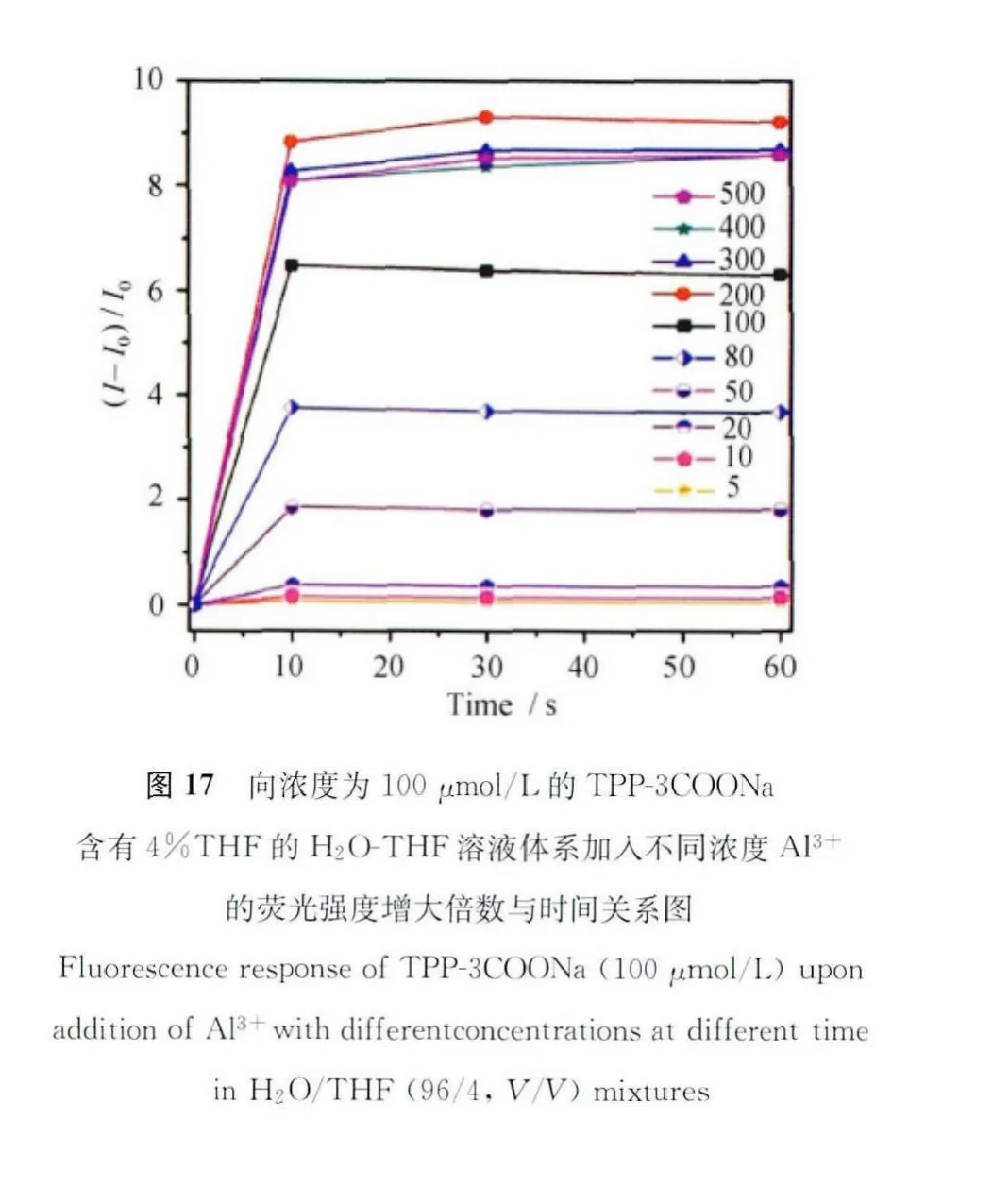
我们认为该化合物对Al3+的点亮响应是基于AIE机理的。为此,我们进行了以下实验。首先,我们对浓度为100μmol/L的TPP-3COONa在含有4%THF的H2O-THF体系进行了UV-Vis吸收光谱实验。并在此基础上对该化合物进行Al3+的滴定实验。如图18所示,图中329nm处的吸收峰我们归结于为整体共轭的结果。另外,随着Al3+浓度的增加,329nm处吸收峰下降,我们认为是由于出现聚集体,溶液当中分子浓度下降,导致UV吸收下降。而在391nm处,出现了Low Energy(LE)吸收,同时,在346nm处出现一个等电点,这些现象均说明,Al3+的加入与 TPP-3COONa之间发生了静电或者配位作用。同时,这一作用也使分子间发生聚集,聚集程度增大。
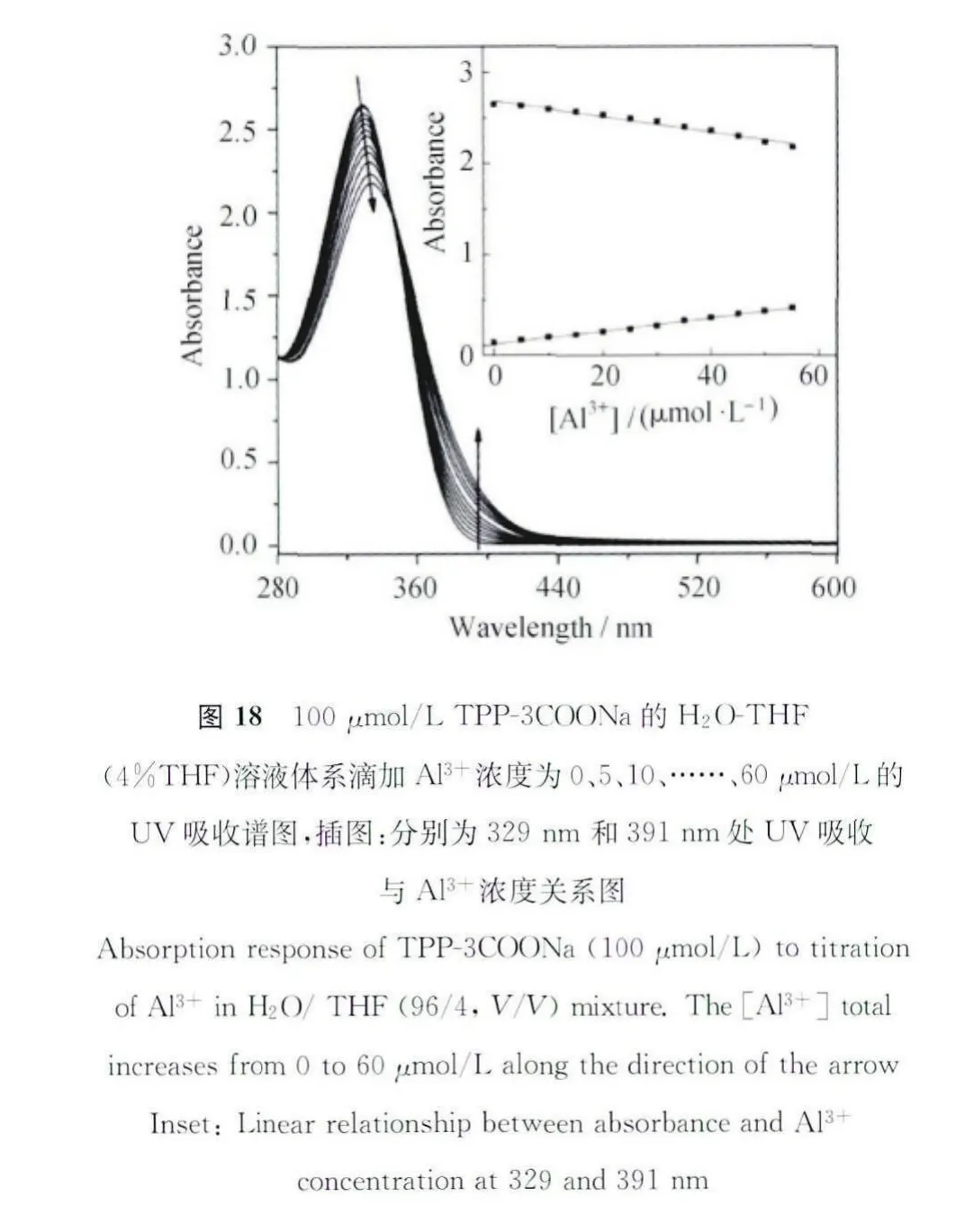
为了进一步证明点亮检测过程是基于聚集诱导发光机理,我们进行了动态光散射的研究。实验结果如图19所示,再加入Al3+之前,化合物的平均粒径尺寸为50nm,而加入500μmol/L的之后,平均粒径尺寸长到了130nm,增加了60nm。这充分说明加入Al3+可以诱导聚集体生成这一说法。除此之外,我们还利用TEM观察了加入前后微观形貌的变化。
如图20所示,加入Al3+之前,聚集体呈现为球状及带状的松散聚集体,平均粒径在23nm左右。加入之后,聚集体呈现为胶囊状的紧密聚集体,平均粒径为71nm左右。这更进一步直观的证明了聚集体的生成。因此,我们认为浓度为100 μmol/L的TPP-3COONa在含有4%THF的 H2O-THF体系对于Al3+的响应是基于AIE机理的[47]。
关于响应机理见图21。我们认为该体系加入Al3+之后的荧光增强是基于AIE机理的协同作用。首先,根据文献报道,当羧酸根离子与Al3+作用时,相比于单齿螯合物而言,倾向于生成相对更稳定的二齿螯合物。而当TPP-3COONa中的至少一个羧酸根离子与Al3+作用后,有助于提高分子中的苯环与吡咯环的共平面性,因此利于分子间堆积,抑制分子内旋转,降低非辐射能量消耗,即基于AIE的机理,体系荧光增强。另一方面,TPPNa在加入Al3+之前,已经存在松弛的聚集体(如图20(a))。这些聚集体尺寸小、电荷密度高而且亲核性强。故加入的Al3+很快能够通过静电吸引作用靠近处于聚集体表面的羧酸根离子,形成螯合物之后降低其水溶性。这一过程不仅能够使聚集体尺寸增大,同时还能够使聚集体更加紧密,使分子内旋转受限,TPPNa荧光增强。
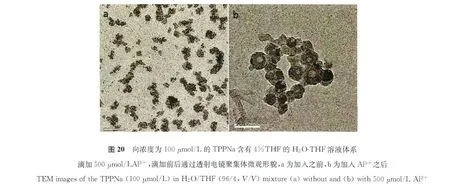
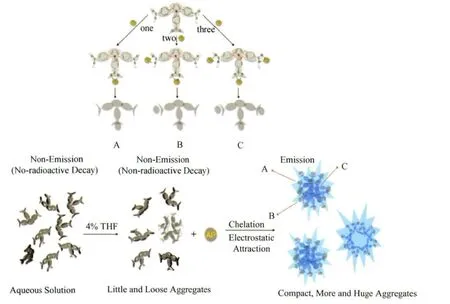
图21 TPP-3COONa对Al 3+响应机理示意图Sensing process based on AIE mechanism
温度是一项非常重要的物理参数,在生活和科研等领域广泛使用,尤其在科技生产领域,工作温度的概念十分重要,例如手机、电脑等电子产品在的运行过程中会产生热量,电器元件的温度就会随之上升,在大于85℃的工作温度下,绝大部分电器元件会被烧坏,甚至产生漏电,火灾等事故,因此温度的测定或预警在电子工业领域中十分重要。我们利用三苯基吡咯羧酸衍生物(TPPA)的发光特点制备了一种温度敏感材料TPPADMF,它在70~100℃范围内具有明显的荧光响应[50]。
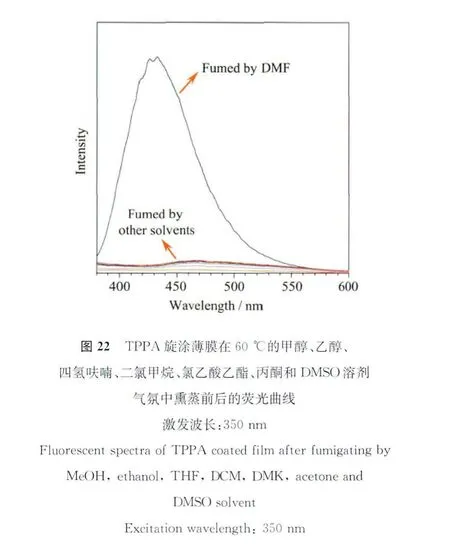
大量的实验证实TPPA的羧酸基团对于自身发光起了关键性的作用,改变或者破坏TPPA羧酸基团之间的相互作用,会使聚集态下被猝灭的TPPA发出强烈荧光。我们发现,TPPA在N,N-二甲基甲酰胺(DMF)中重结晶,将会得到具有明亮蓝色荧光的晶体,普通的TPPA固体原本是不发光的,TPPA的固体荧光量子产率仅为4%,而由DMF诱导形成的结晶荧光强度得到极大的增长,是DMF诱导结晶前的80多倍,这一显著差异肉眼清晰可辨。它最大发射波长为428nm,荧光寿命(η)为9.96ns,荧光量子产率为30.8%。将TPPA旋涂制备成薄膜后放置在60℃的DMF蒸汽中熏蒸3min,TPPA会在DMF溶剂的刻蚀-挥发过程中重结晶,其薄膜也会慢慢发出荧光,有趣的是,我们尝试在甲醇、乙醇、四氢呋喃、二氯甲烷、氯乙酸乙酯、丙酮和DMSO溶剂中熏蒸诱导结晶,所得固体薄膜均不发光(图22)[50]。
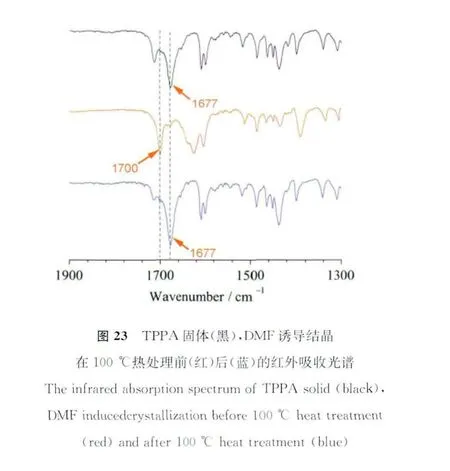
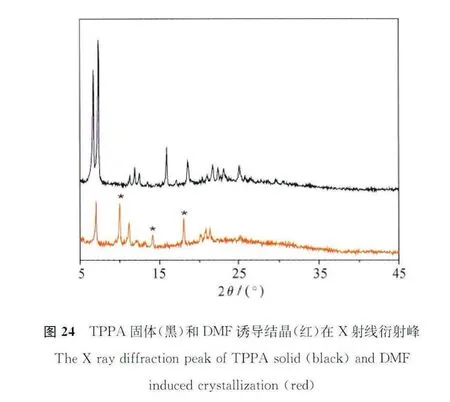
红外吸收谱图说明DMF诱导结晶前后的氢键作用变化。从图23可以看出,TPPA固体的红外吸收光谱(黑色)中可以清晰地在1677cm-1处看到羧酸二聚体的羰基伸缩振动峰,这说明在TPPA固体中,分子是以羧酸间氢键相互作用形成二聚体的形式存在的。而在DMF诱导结晶过程中,DMF比羧酸具有更强的氢键结合能力,羧酸基团自身结合能力不如羧酸与DMF分子结合能力强,因此DMF诱导结晶中并没有出现二聚体形式。DMF诱导结晶的红外吸收在1700cm-1处出现新的吸收峰(图23),归属于独立羰基的伸缩振动峰。与此同时,DMF诱导结晶的X射线衍射谱也发生变化,10.0°、14.25°、18.0°等位置出现了TPPA所没有的新结晶峰(图24)。这表明由于DMF溶剂分子的嵌入,使TPPA分子发生氢键诱导重排,进一步导致晶型的转变。
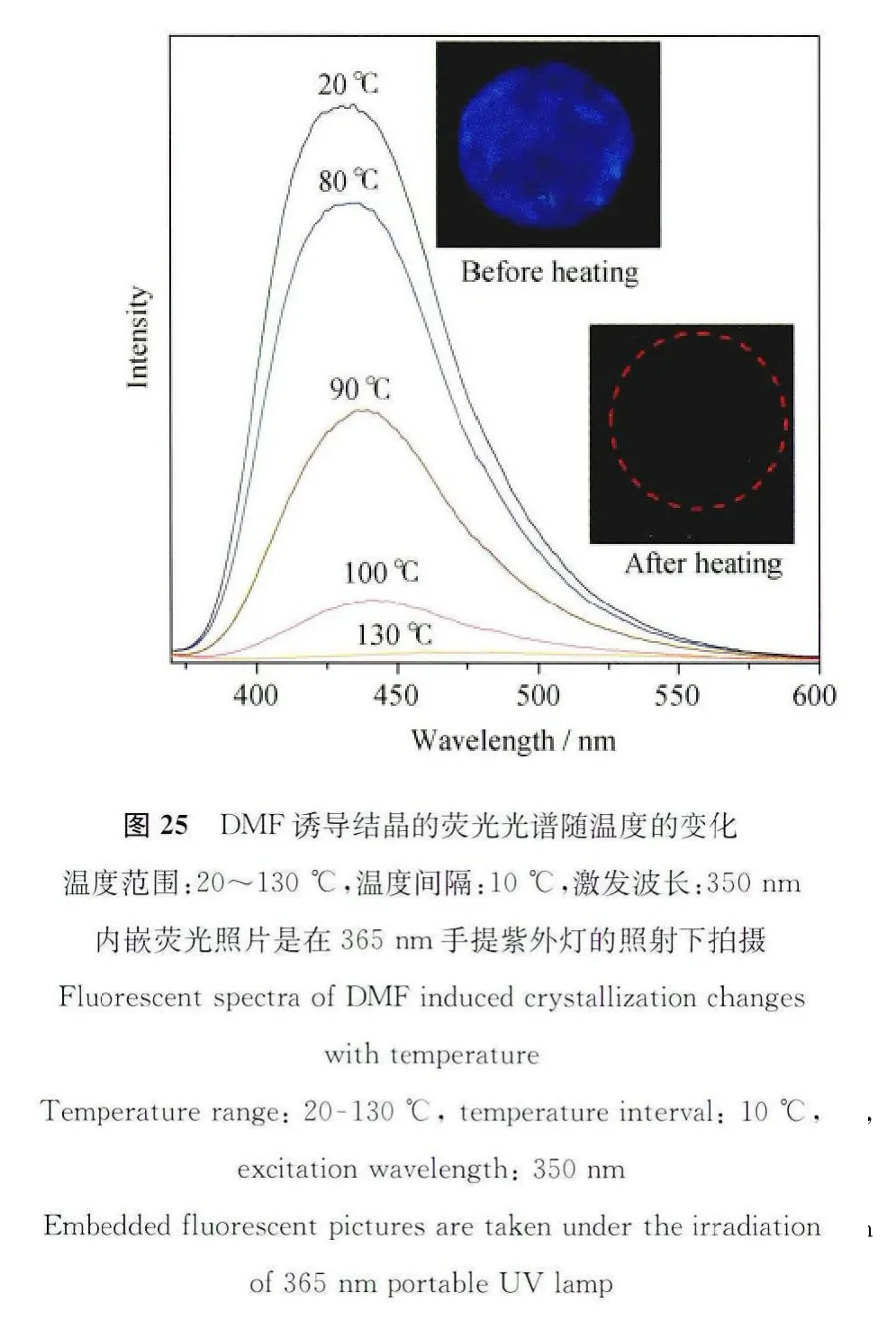
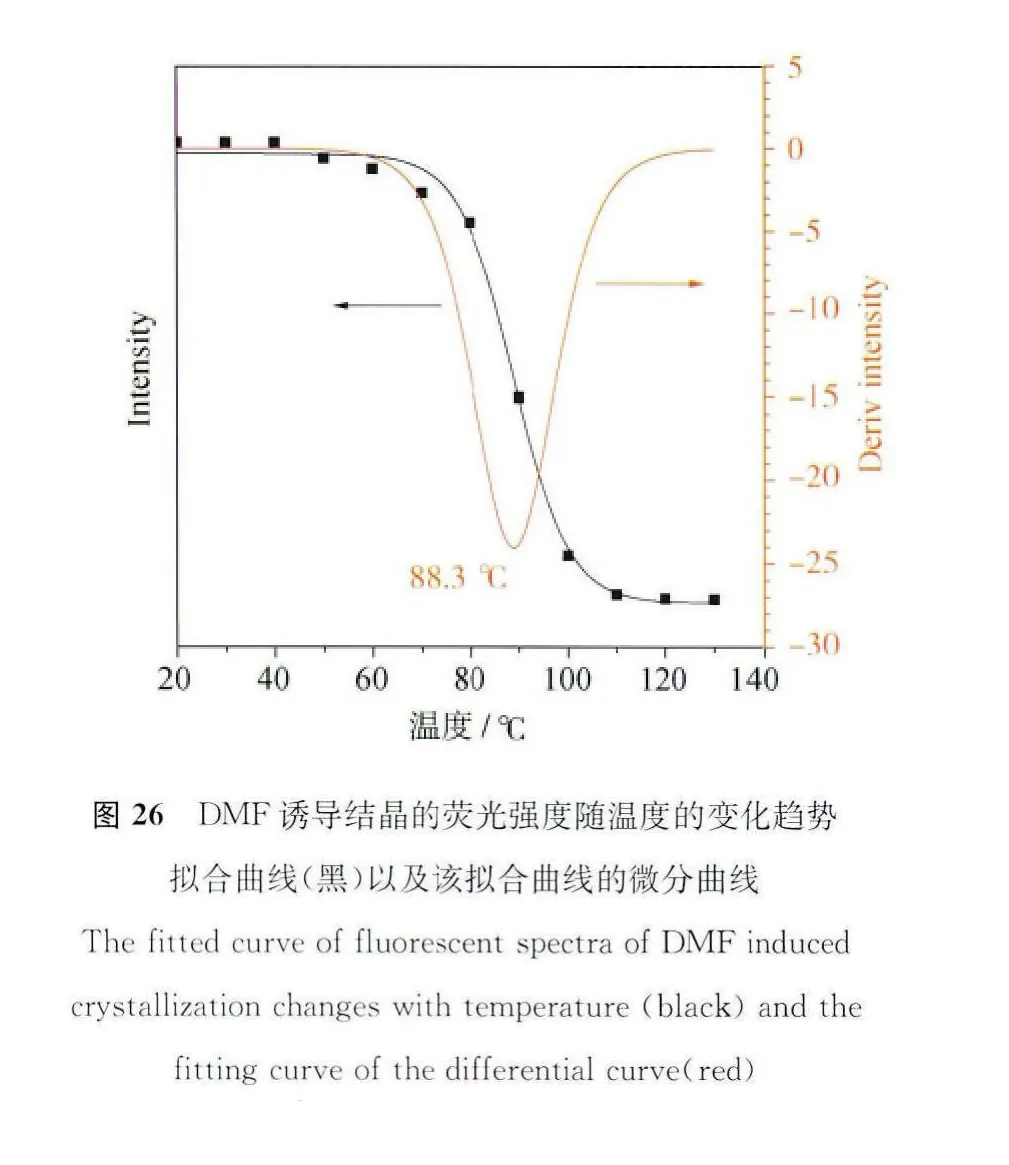
既然DMF溶剂分子的插入会改变TPPA分子原有晶型,使之成为具有优异发光性能的DMF诱导结晶,那么如果我们从相反的角度上考虑,将DMF诱导结晶加热处理,使晶格中的DMF溶剂分子挥发掉,那么它的荧光是否可以恢复?在什么温度下恢复?带着这些问题我们做了一项DMF诱导结晶随温度变化的荧光光谱。如图25所示,我们将DMF诱导结晶固定在石英片上形成一个晶体薄膜,该薄膜在350nm紫外光的照射下发出明亮的蓝色荧光,随着温度的上升,石英薄膜的荧光逐渐下降。从图25的荧光随温度变化趋势图中可以看出,在20~70℃的温度变化范围内,荧光强度的下降趋势小于10%。这表明低于70℃的温度不足以使晶格内的DMF溶剂分子从结晶中逸出,荧光的小幅度下降则归因于荧光分子的温度效应,即:提高荧光分子的温度会加剧荧光分子的热运动,使分子激发态的能量耗散,从而导致荧光强度的降低。当温度升高至70℃以上时,荧光强度急剧降低,到130℃时,荧光几乎完全猝灭,图26拟合曲线的微分线给出88.3℃的拐点值,说明在88.3℃的时候,荧光变化速度达到最大值,也就是DMF逸出晶格的速度达到最大。这一段温度范围的检测对于电子元件的温度预警系统十分重要。
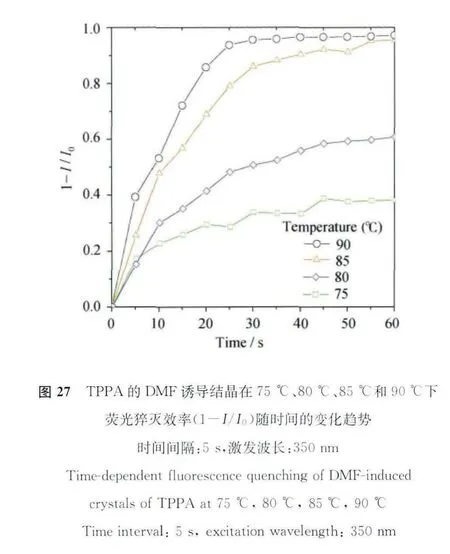
从以上荧光数据可以看出,DMF诱导结晶对特定温度范围有较高的敏感性,重复试验了几次我们发现,荧光下降显著的温度范围每次均在85℃左右,一旦高于这个温度,DMF诱导结晶的荧光就会完全猝灭,这说明DMF从晶格中逸出的温度是一个固定不变的数值,因此可以说该结晶是一类极具潜力的温敏材料。为了测试该温敏材料的温度选择性和响应速度,我们在不同温度下测得了该结晶的荧光曲线随时间变化。如图27所示,所选的温度值分别为75、80、85和90℃,不难发现:在75℃和80℃的时候,随着热处理时间延长,荧光虽有些下降,但是离完全猝灭还有很长一段距离,猝灭效率(1-I/I0)仅为38%,而85℃和90℃的热处理则会导致该结晶的完全猝灭,猝灭效率高达95%以上,而且温度越高,荧光响应就越快。在90°C对材料进行热处理时,其荧光在30s内就完全猝灭。由此可见该温敏材料不仅对温度的选择性非常好,并且拥有一个特定的控制荧光“开关”的温度值,还可以做到迅速响应,这些性质对于其在温控器件和温度预警系统领域的应用十分重要。
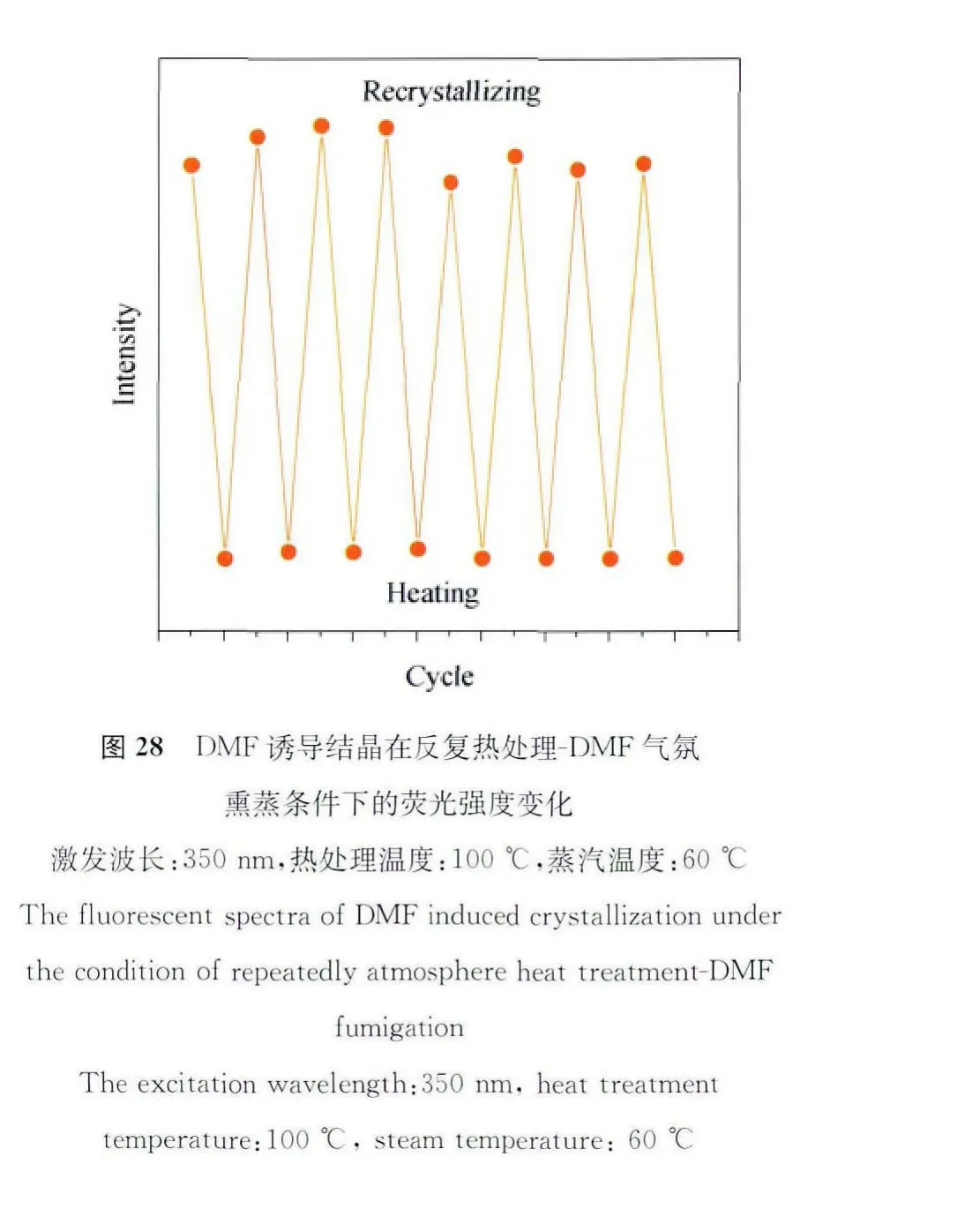
良好的可逆性是温敏材料的一个必备品质,然而该材料在经历升温猝灭,又下降到室温的过程后,荧光却无法得以恢复,因为DMF从晶格中逸出是不可逆的过程。若要使猝灭后的材料重新发光,则需要将其放置在热的DMF蒸汽熏蒸条件下,重新诱导结晶方可使其荧光恢复原状。该温敏材料虽然不能够像传统温度计一样随温度可逆变化,然而它在精准温控器件或温度预警系统等方面的应用极具潜力。图28中的实验测试了该材料循环利用的性质,100℃热处理40s后,晶体的荧光完全猝灭,猝灭后的晶体在60℃的DMF气氛下重新诱导结晶结晶,2min后荧光又可恢复。这一加热-重结晶过程重复多次后,该温敏材料依然保持较高的荧光开关比[50]。这一过程并不会破坏分子结构,因此不难理解该温敏材料在反复使用过程中性能不会下降,从商业角度上来看,循环使用还可以大大降低成本。
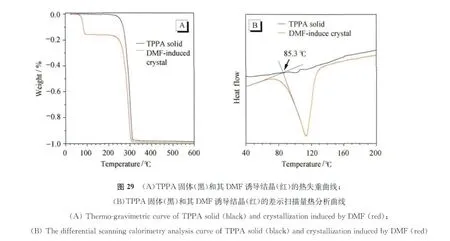
为了更进一步地证明DMF对于荧光控制的关键作用。我们对TPPA的DMF诱导结晶进行了热重分析(TGA)和差示扫描量热分析(DSC)。
图29(A)的热失重曲线显示,在大概260℃左右,TPPA出现5%的失重。由于TPPA基本是由刚性苯环结构组成的,其自身的热稳定性较好,分解温度在300.6℃。另一方面,DMF诱导结晶的热失重曲线与TPPA固体粉末完全不同,在升温至95℃的时候,自身重量损失了16%之多,这个重量损失极有可能是DMF的热挥发导致的,按照DMF和TPPA的分子量之比,16%的重量损失预示着晶格中DMF与TPPA的比例约为1∶1。另外,DMF诱导结晶的热失重曲线的微分曲线在84.3℃出现极大值,表明在该温度下,DMF的逸出速度最快,这和上述图26的荧光曲线的拐点(88.3℃)相近。DSC曲线更加说明了这一点,如图29B所示,TPPA固体粉末的DSC曲线基本是条直线,在40~200℃的温度范围内,并无明显的吸收/放热峰;而DMF诱导结晶由于DMF热挥发的缘故,在113℃出现一个明显的吸热峰,其初始分解温度大概在85.3℃,这与TGA和荧光曲线给出的拐点相一致,均代表着DMF的挥发温度。
综上所述,TPPA由于羧酸取代基的缘故,固态的荧光效率很低,但是由DMF诱导重结晶后,却得到了强烈蓝色荧光的晶体—TPPA-DMF诱导结晶。我们发现该结晶在70~100℃的温度范围内,荧光会随着温度的增加急剧下降,85℃以上热处理时,其荧光会完全猝灭。在DMF溶剂气氛熏蒸条件下,其荧光又会很快恢复,通过热分析和电镜观察,我们认为荧光猝灭可解释如下:DMF溶剂分子在热处理条件下从晶格中逃逸,一方面,分子由原来的紧密堆积变为松散堆积,造成大量空穴的形成,给TPPA分子的单键内旋转提供了广阔自由的空间,进一步导致非辐射能量转移;另一方面DMF的逸出使羧酸基团的拉电子能力大大加强,这就与推电子能力较强的吡咯形成了电子推-拉体系(D-A),TPPA分子在受到紫外激发时会发生电荷转移而消耗掉部分能量,这两方面都会导致荧光的降低甚至猝灭(图30)。DMF诱导结晶的温敏性能不仅具有较好的温度选择性,而且响应迅速,并可以循环利用,这些特性使其在温度控制器件或温度预警体系等方面具有较高的应用价值。
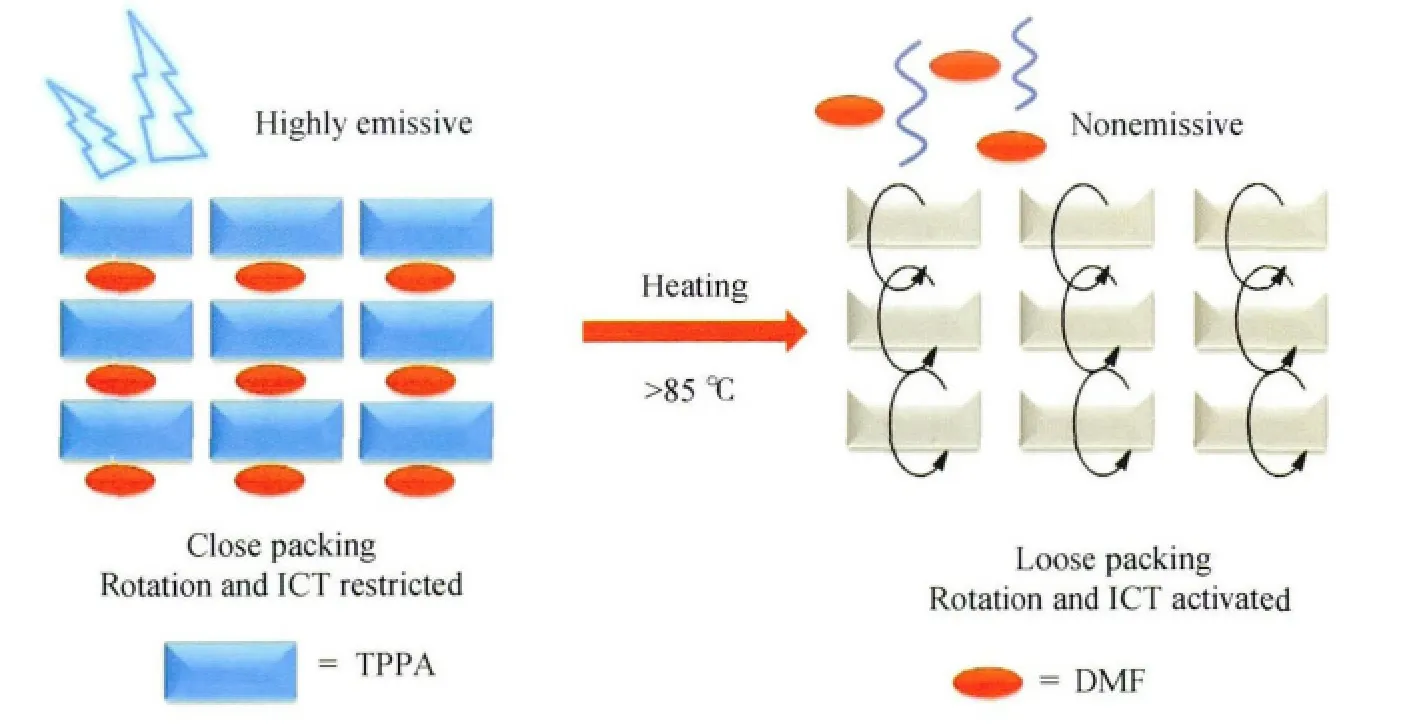
图30 TPPA的DMF诱导结晶温敏机理示意图Thermosensitivity mechanism of TPPA crystallization induced by DMF
结论
本文主要综述了本课题组在多芳基取代吡咯AIE性质与应用研究成果。通过考察取代芳基的数目与类型与聚集态时的发光性能之间关系,从单晶结构解析出发,阐明了AIE的产生机制;通过官能团的引入,合成了TPP-COONa、TPP-2COONa、TPP-3COONa3种化合物,证明了 TPPCOONa是一种活跃的AIE分子,而且这种结构能够作为金属离子检测器来检测铝离子,TPP-3COO-比TPP-COO-的检测效果更快,响应时间更短,而且对其他离子并没有特异性的响应,利用AIE机理检测Al3+可以作为一种潜在的“零等待”的检测方法。由DMF诱导含羧酸基TPPA重结晶,得到了强烈蓝色荧光的晶体-DMF诱导结晶。该结晶在70~100℃的温度范围内,其温敏性能不仅具有较好的温度选择性,而且响应迅速,并可以循环利用。
[1] Thomas III S W,Joly G D,Swger T M.Chemical sensors based on amplifying fluorescent conjugated polymers[J].Chemical Reviews,2007,107:1339-1386.
[2] Hoeben F J M,Jonkheijm P,Meijer E W,Schenning A P H J.About supramolecular assemblies ofπ-conjugated systems[J].Chemical Reviews,2005,105:1491-1546.
[3] Bunz Uwe H F.Poly(aryleneethynylene)s:syntheses,properties,structures,and applications[J].Chemical Reviews,2000,100:1605-1644.
[4] Hide F,Díaz-García M A,Schwartz B J,Heeger A J.New developments in the photonic applications of conjugated polymers[J].Accounts of Chemical Research,1997,30:430-436.
[5] Borisov S M,Wolfbeis O S.Optical Biosensors[J].Chemical Reviews,2008,108:426-461.
[6] Birks J B.Photophysics of Aromatic Molecules[M].London:John Wiley &Sons Ltd,1970.
[7] Wang J,Zhao Y F,Dou C D,Sun H,Xu P,Ye K Q,Zhang J Y,Jiang S J,Li F,Wang Y.Alkyl and dendronsubstituted quinacridones:synthesis,structures,and luminescent properties[J].The Journal of Physical Chemistry B,2007,111:5082-5089.
[8] Hecht S,Fréchet M J.Dendritic Encapsulation of Function:Applying nature′s site isolation principle from biomimetics to materials science[J].Angewandte Chemie International Edition,2001,40:74-91.
[9] Chen L H,Xu S,McBranch D,Whitten D.Tuning the properties of conjugated polyelectrolytes through surfactant complexation[J].Journal of the American Chemical Society,2000,122:9302-9303.
[10] Luo J D,Xie Z L,Lam J W Y,Cheng L,Chen H Y,Qiu C F,Kwok H S,ZhanX W,Liu Y Q,Zhu D B,Tang B Z.Aggregation-induced emission of 1-methyl-1,2,3,4,5-pentaphenylsilole[J].Chemical Communications,2001,18:1740-1741.
[11] Mei J,Hong Y N,Lam J W Y,Qin A J,Tang Y H,Tang B Z.Aggregation-induced emission:The whole is more brilliant than the parts[J].Advanced Materials,2014,26:5429-5479.
[12] Hong Y N,Lam J W Y,Tang B Z.Aggregation-induced emission[J].Chemical Society Reviews,2011,40:5361-5388.
[13] Li Z,Dong Y Q,Mi B X,Tang Y H,Haussler M,Tong H,Dong Y P,Lam J W Y,Ren Y,Sung H H Y,Wong K S,Gao P,Williams I D,Kwok H S,Tang B Z.Structural control of the photoluminescence of silole regioisomers and their utility as sensitive regiodiscriminating chemosensors and efficient electroluminescent materials[J].The Journal of Physical Chemistry B,2005,109:10061-10066.
[14] Zhao Z J,Lam J W Y,Tang B Z.Aggregation-induced emission of luminogens[J].Current Organic Chemistry,2010,14:2109-2132.
[15] Li K,Ding D,Zhao Q L,Sun J Z,Tang B Z,Liu B.Biocompatible organic dots with aggregation-induced emission for in vitro and in vivo fluorescence imaging[J].Science China Chemistry,2013,56:1228-1233.
[16] 夏 晶,吴燕梅,张亚玲,佟 斌,石建兵,支俊格,董宇平.具有聚集诱导发光特性的四苯基乙烯研究进展[J].影像科学与光化学,2012,30(1):9-25.
Xia J,Wu Y M,Zhang Y L,Tong B,Shi J b,Zhi J G,Dong Y P.Recent progress of tetraphenylethenes with aggregation induced emission[J].Imaging Science and Photochemistry,2012,30(1):9-25.
[17] 曾 毅,李 鹏,李 嫕.四苯基乙烯衍生物光物理和光化学研究[J].影像科学与光化学,2014,32(5):463-470.
Zeng Y,Li P,Li Y.Photophysical and photochemical studies on a tetraphenylethene derivative [J].Imaging Science and Photochemistry,2014,32(5):463-470.
[18] 金佳科,陈秀娟,刘一,秦安军,孙景志,唐本忠.用水溶性四苯基乙烯基荧光探针检测ctDNA[J].高分子学报,2011,9:1079-1085.
Jin J K,Chen X J,Liu Y,Qin A J,Sun J Z,Tang B Z.Detection of ctDNA with water soluble tetraphenylene-based fluorescence probe[J].Acta Polymerica Sinica,2011,9:1079-1085.
[19] He J T,Xu B,Chen F P,Xia H J,Li K P,Ye L,Tian W J.Aggregation-induced emission in the crystals of 9,10-distyrylanthracene derivatives:the essential role of restricted intramolecular torsion[J].Journal of Physical Chemistry C,2009,113:9892-9899.
[20] Song N,Chen D X,Xia M C,Qiu X L,Ma K,Xu B,Tian W J,Yang Y W.Supramolecular assembly-induced yellow emission of 9,10-distyrylanthracene bridged bis(pillararene)s[J].Chemical Communications,2015,51:5526-5529.
[21] Dong Y Q,Lam J W Y,Qin A J.Switching the light emission of(4-biphenylyl)fulvene by morphological modulation:crystallization-induced emission enhancement [J].Chemical Communications,2007,1:40-42.
[22] Dong S C,Li Z,Qin Z G.New Carbazole-based fluorophores:synthesis, characterization, and aggregationinduced emission enhancement[J].The Journal of Physical Chemistry B,2009,113:434-441.
[23] 杨志涌,于 涛,陈美娜,张锡奇,王程程,许炳佳,周勰,刘四委,张 艺,池振国,许家瑞.具有聚集诱导发光效应的咔唑基三苯乙烯衍生物单体及聚合物 [J].高分子学报,2009,6:560-565.
Yang Z Y,Yu T,Chen M N,Zhang X Q,Wang C C,Xu B J,Zhou X,Liu S W,Zhang Y,Chi Z G,Xu J R.A monomer and its polymer derived from carbazolyl triphenylene with aggregation induced emission effect characteristics[J].Acta Polymerica Sinica,2009,6:560-565.
[24] An B K,Gierschner J,Park S Y.Pi-conjugated cyanostilbene derivatives:aunique self-assembly motif for molecular manostructures with enhanced emission and transport[J].Accounts of Chemical Research,2012,45:544-554.
[25] Han T,Zhang Y J,Feng X,Lin Z,Tong B,Shi J B,Zhi J G,Dong Y P.Reversible and hydrogen bonding-assisted piezochromic luminescence for solid-state tetraaryl-buta-1,3-diene[J].Chemical Communications,2013,49:7049-7051.
[26] Zhang Y J,Han T,Gu,S Z,Zhou T Y,Zhao C Z,Guo Y X,Feng X,Tong B,Bing J.;Shi J B,Zhi J G,Dong Y P.Mechanochromic behavior of aryl-substituted buta-1,3-diene derivatives with aggregation enhanced emission[J].Chemistry-A European Journal,2014,20:8856-8861.
[27] Zhang Y H,Kong L W,Shi J B,Tong B,Zhi J G,Feng X,Dong Y P.Aggregation-induced emission of hexaphenyl-1,3-butadiene[J].Chinese Journal of Chemistry,2015,33:701-704.
[28] Zeng Q,Li Z,Dong Y,Di C,Qin A,Hong Y,Ji L,Zhu Z,Jim C K W,Yu G,Li Q,Li Z,LiuY,Qin J,Tang B Z.Fluorescenceenhancements of benzene-cored luminophorsby restricted intramolecular rotations:AIE and AIEE effects[J].Chemical Communication,2007,1:70-72.
[29] Hirano K,Minakata S,Komatsu M,Mizuguchi J.Intense blue luminescence of 3,4,6-triphenyl-alpha-pyrone in the solid stateand its electronic characterization[J].The Journal of Physical Chemistry A,2002,106:4868-4871.
[30] Shiraishi K,Kashiwabara T,Sanji T,Tanaka M.Aggregation-induced emission ofdendritic phosphole oxides [J].New Journal of Chemistry,2009,33:1680-1684.
[31] 钱立军,佟 斌,支俊格,杨帆,申进波,石建兵,董宇平.含磷酰杂菲苯甲酸对苯二酯的聚集诱导发光增强性能及其在检测过渡金属离子中的应用[J].化学学报,2006,66:1134-1138.
Qian L J,Tong B,Zhi J G,Yang F,Shen J B,Shi J B,Dong Y P.Aggregation-induced emission enhancement of phosphaphenan threne-containing p-phenylene dibenzoate and its application to detecting transition metal ions[J].Acta Chimica Sinica,2006,66:1134-1138.
[32] Hu R,Lager E,Aguilar-Aguilar A,Liu J,Lam J W Y,Sung H H Y,Williams I D,ZhonY,Wong K S,Pena-Cabrera E,Tang B Z.Twisted intramolecular charge transfer andaggregation-induced emission of BODIPY derivatives[J].The Journal of Physical Chemistry C,2009,113:15845-15853.
[33] Qin A J,Lam J W Y,Mahtab F,Jim C K W,Tang L,Sun J Z,Sung H H Y,Williams I D,Tang B Z.Pyrazine Luminogens with“free”and“locked”phenyl rings:understanding of restriction of intramolecular rotation as a cause for aggregation-induced emission [J].Applied Physics Letter,2009,94:253308
[34] Chen M,Li L Z,Nie H,Tong J Q,Yan L L,Xu B,Sun J Z,Tian W J,Zhao Z J,Qin A J and Tang B Z.Tetraphenylpyrazine-based AIE gens:facilepreparation and tunable lightemission[J].Chemical Science,2015,6:1932-1937.
[35] Tracy H J,Mullin J L,Klooster W T.Enhanced photoluminescence from group 14metalloles in aggregatedand solid solutions[J].Inorganic Chemistry,2005,44:2003-2011.
[36] Xing Y J,Xu X Y,Wang F,Lu P.Optical properties of a series of tetraarylthiophenes[J].Optical Materials,2006,29:407-409.
[37] Deng S L,Chen T L,Chien W L,Hong J L.Aggregationenhanced emission in fluorophores containing pyridine andtriphenylamine terminals:restricted molecular rotation andhydrogen-bond interaction [J].Journal of Materials Chemistry C,2014,2:651-659.
[38] Zhu Y,Rabindranath A R,Beyerlein T,Tieke B.Highly luminescent 1,4-diketo-3,6-diphenylpyrrolo[3,4-c]pyrrole-(DPP-)based conjugated polymers prepared upon suzuki coupling[J].Macromolecules,2007,40:6981-6989.
[39] Morales-Saavedra O G,Huerta G,Ortega-Martinez R,Fomina L.Linear and non-linear optical properties of 2,5-disubstituted pyrroles supported by a catalyst-free SiO2sonogel network[J].Journal of Non-Crystalline Solids,2007,353:2557-2566.
[40] Alberola A,Ortega A G,Sádaba M L,Sañudo C.Versatility of weinreb amides in the knorr pyrrole synthesis[J].Tetrahedron,1999,55:6555-6566.
[41] Jones R A,Been G P.The Chemistry of Pyrroles[M].New York:Academic Press,1977.50-54.
[42] Chiu P K,Lui K H,Maini P N,Sammes M P.Novel synthesis of 3H-pyrroles,and novel intermediates in the Paal-Knorr 1H-pyrrole synthesis:2-hydroxy-3,4-dihydro-2H-pyrrolesfrom 1,4-diketones and liquid ammonia [J].Journal of the Chemical Society,Chemical Communications,1987:109-110.
[43] Reisch J,Schulte K E.Pyrrol-derivate aus diacetylenen[J].Angewandte Chemie,1961,73:241-247.
[44] Huerta G,Fomina L,Rumsh L,Zolotukhin M G.New polymers with N-phenyl pyrrole fragments obtained by chemical modifications of diacetylene containing-polymers[J].Polymer Bulletin,2006,57:433-443.
[45] Feng X,Tong B,Shen J B,Shi J B,Han T Y,Chen L,Zhi J G,Lu P,Ma Y G,Dong Y P.Aggregation-induced emission enhancement of aryl-substituted pyrrole derivatives[J].Journal of Physical Chemistry B,2010,114:16731-16736.
[46] Han T Y,Feng X,Tong B,Shi J B,Chen L,Zhi J G,Dong Y P.A novel“'turn-on”fluorescent chemosensor for the selective detection of Al3+based on aggregation-induced emission[J].Chemical Communications,2012,48:416-418.
[47] Shi X Y,Wang H,Han T Y,Feng X,Tong B,Shi J B,Zhi J G,Dong Y P.A highly sensitive,single selective,real-time and “turn-on”fluorescent sensor for Al3+detection in aqueous media[J].Journal of Materials Chemistry,2012,22:19296-19302.
[48] Hau F K,He X M,Lam W H,Yam V W W,Highly selective ion probe for Al3+based on Au(Ⅰ)…Au(Ⅰ)interactions in a bis-alkynyl calixarene Au(Ⅰ)isocyanide scaffold[J].Chemical Communications,2011,47:8778-8780.
[49] Xie X J,Qin Y.A dual functional near infrared fluorescent probe based on the bodipy fluorophores for selective detection of copper and aluminum ions[J].Sensors and Actuators B:Chemical,2011,156:213-217.
[50] Han T Y,Feng X,Shi J B,Tong B,Dong Y F,Lam J W Y,Dong Y P,Tang B Z.DMF-induced emission of an arylsubstituted pyrrole derivative:a solid thermo-responsive material to detect temperature in a specific range [J].Journal of Materials Chemistry C,2013,1:7534-7539.

