早期放射性骨髓损伤微血管渗透性变化的MRI研究
王克军,查云飞,刘昌盛,邢栋,闫力永,龚威,胡磊,王娇
早期放射性骨髓损伤微血管渗透性变化的MRI研究
王克军,查云飞,刘昌盛,邢栋,闫力永,龚威,胡磊,王娇
【摘要】目的:采用动态增强MRI(DCE-MRI)定量渗透性参数探索X线照射后大鼠股骨骨髓微血管渗透性变化。方法:36只6-8周龄SD大鼠随机分为辐射组(n=18)和对照组(n=18),辐射组大鼠接受6.0Gy高能量X线全身照射,对照组大鼠不进行照射处理。分别在X线照射前后各时间点行股骨DCE-MRI灌注成像检查,测量股骨兴趣区微血管转运常数(Ktrans)、反流速率常数(Kep)、血浆容积分数(Vp)和血管外细胞外容积分数(Ve);大鼠股骨行组织病理学检查并测定微血管密度(MVD)。结果:辐射组在辐射前后各时间点DCE-MRI灌注参数Ktrans、Kep、Vp、Ve值差异均具有统计学意义(F=59.097,P<0.01;F=21.349,P<0.01;F=27.059,P<0.01;F=32.061,P<0.01)。Ktrans值逐渐增加,在辐射后第7天达到峰值;Vp值逐渐减小;Kep值照射后第4天减小(P<0.01),第7天较第4天增大(P<0.01);Ve值照射后第4天增大(P<0.01),第7天与第4天无明显变化(P>0.05)。相应时间节点对照组各渗透性参数之间差异无统计学意义(P值均>0.05)。辐射组大鼠MVD与Ktrans、Kep值呈负相关(r值分别为-0.5936、-0.8055,P值均<0.05)、与Vp呈正相关(r=0.6451,P<0.05)、与Ve值无相关性(r=0.1426,P>0.05)。结论:DCE-MRI定量参数可评价早期放射性骨髓损伤的微血管渗透性变化。
【关键词】辐射;骨髓;微血管密度;磁共振成像
作者单位:430060 武汉,武汉大学人民医院放射科
电离辐射导致骨髓造血细胞数量显著减少以及造血细胞基质成分变化,进而使骨髓造血微环境受到破坏[1,2]。动态增强MRI(dynamic contrast enhanced MRI,DCE-MRI)可以反映对比剂在骨髓微血管的灌注、渗透和廓清等整个过程,具有对骨髓微血管结构及血管渗透性进行非侵袭性定量分析的能力[3-7]。但是
DCE-MRI尚未应用于探索早期骨髓微血管辐射损伤的病理生理机制研究中。本研究动态观察X线照射后股骨骨髓DCE-MRI各定量渗透性参数变化,并与免疫组织化学行相关性分析,旨在探讨DCE-MRI各定量渗透性参数在评价早期放射性骨髓微循环损伤中的应用价值。
材料与方法
1.动物模型制备与分组
36只6~8周龄雌性SD大鼠(武汉大学医学院动物中心提供)适应性喂养1周后,随机分为正常对照组(n=18)和辐射组(n=18),对照组与辐射组大鼠均给予标准饲料喂养。辐射组大鼠持续吸入异氟烷气体麻醉剂并俯卧于床板上,直线加速器(23-EX Vrian)6MeV X射线单次全身照射,照射剂量为6.0Gy,剂量率3Gy/min。实验期间对照组大鼠不施加X线照射。辐射组照射前、照射后第4天、7天分别行DCE-MRI检查。检查结束后立即将大鼠处死,取相应大鼠完整股骨行组织病理学检查。对照组在相同时间节点分别行DCE-MRI及病理学检查。
2.检查方法
采用3.0T超导MR扫描仪(Discovery MR750 Plus,USA)行MRI检查,小动物专用4通道线圈,内经5cm。实验大鼠麻醉后俯卧于自制动物固定模型上,将已连在导管(PE60,Becton Dickinson and Company)上的1mL注射器针头(25GA,Becton Dickinson and Company)置于大鼠尾静脉内,大鼠股骨位于线圈中心,行常规斜冠状面SE T1WI和质子密度加权成像(proton density weighted imaging,PDWI)扫描,T1WI扫描参数:TR 400ms,TE 16.7ms;PDWI扫描参数:TR 2500ms,TE 36.2ms。扫描层厚3mm,视野8mm×8mm,矩阵512×512,激励次数为2。
DCE-MRI检查采用2D-FSPGR序列,扫描参数: TR 6.5ms,TE 2.0ms,层厚3mm,视野8mm× 8mm,矩阵256×192,翻转角80°,连续无间隔同层扫描100帧动态图像,扫描持续时间为4min 20s。对比剂为欧乃影,剂量0.1mmol/kg,DCE-MRI基线扫描15个动态时相之后由同一实验员在不少于10s时间内通过导管匀速推注对比剂。在DCE-MRI检查之前行2D-FSPGR序列(TR 6.5ms,TE 2.0ms,层厚3mm,视野8mm×8mm,矩阵256×192,翻转角为3°、6°、9°、12°和15°)扫描,用于T1mapping的计算,结合对比剂弛豫率进行从DCE-MRI图像信号强度到浓度的转换[8]。
3.图像分析
在大鼠腹主动脉勾画感兴趣区R1,通过Omni kinetics软件(GE Healthcare)获得R1的时间-浓度曲线,确定动脉输入函数[9](arterial input function,AIF),利用药代动力学Extended Tofts双室模型[10,11]得到股骨干中心R2(图1)血管渗透性的各项定量参数,即血浆空间容积分数(Vp)、对比剂从血浆空间渗漏到血管外细胞外间隙(extravascular extracellular space,EES)的体积转运常数(Ktrans)、对比剂从EES返回到血浆空间的速率常数(Kep),并根据公式计算出血管外细胞外容积分数(Ve),Ve=Ktrans/Kep。R1取圆形,选取腹主动脉层面,置于腹主动脉中心;R2取椭圆形(大小为15~20个像素,平均值为18个像素),置于股骨干骨髓腔内,重复测量3次,取平均值作为各个参数的最终测量值。R2应尽量避开骨皮质。
4.组织病理学检查
DCE-MRI检查完成后将大鼠脱臼处死,切开皮肤,分离显露出股骨,离断两端筋膜及周围软组织,完整取出股骨,用10%甲醛固定,脱钙、脱水后石蜡包埋,股骨近端用脱钙切片机沿冠状面切成4μm厚薄片,行HE染色以及免疫组化染色,经CD31抗体标记微血管后,每一个标本先在低倍镜(×100)下选取3个微血管最丰富的不相连区域,在每一个区域中计数高倍镜(×200)下的微血管数,取其平均值为微血管密度(microvessel density,MVD)值[12]。
5.统计学处理
采用SPSS16.0统计分析软件进行统计学分析,各组计量数据用均数±标准差(x±s)表示,MVD与DCE-MRI各定量参数的相关性采用Pearson相关分析;辐射组和对照组间渗透性参数的比较采用独立样本t检验,辐射前后不同时间节点渗透性参数的比较采用ANOVA分析,以P<0.05为差异有统计学意义。
结 果
辐射组在X线照射前后各时间节点大鼠股骨骨髓的DCE-MRI定量参数Ktrans、Kep、Vp、Ve值差异均有统计学意义(F=59.097,P<0.01;F=21.349,P<0.01;F=27.059,P<0.01;F=32.061,P<0.01)。照射后骨髓Ktrans值逐渐增加,在照射后第7天达到峰值;Kep值照射后4天减小(P<0.01),第7天较第4天增大(P<0.01);Vp值照射后逐渐减小,照射后第7天达到最低;Ve值照射后4天增大(P<0.01),第7天与第4天无明显变化(P>0.05,表1,图2)。相应时间节点对照组大鼠骨髓各渗透性参数差异无统计学意义(P>0.05)。
常规HE染色显示辐射组大鼠照射后第4天骨小梁稀疏,骨髓造血细胞显著减少,其中嗜碱性有核细胞
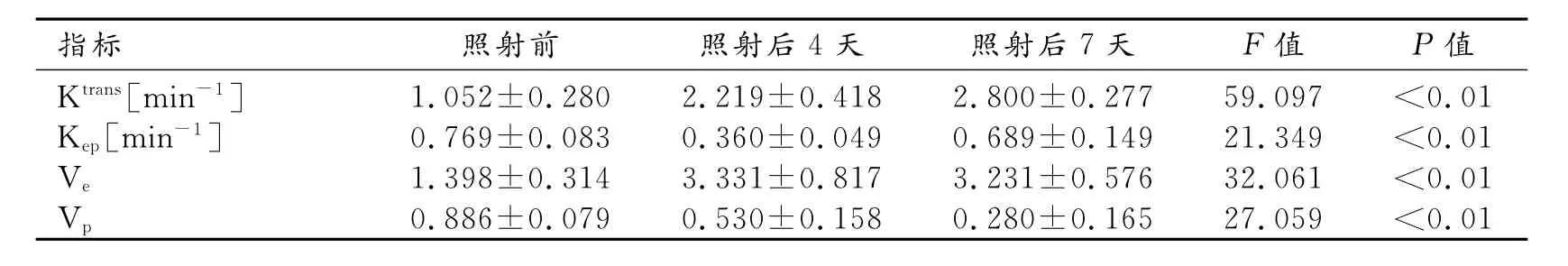
表1 辐射组照射前后各时间节点DCE-MRI参数比较
大量减少,骨髓基质可见大量红细胞渗出;辐射组大鼠照射后第7天出现大量脂肪细胞,嗜碱性有核细胞明显减少(图3)。
辐射组大鼠照射4天后骨髓微血管减少,MVD值为2.7333±0.25820,照射7天后骨髓微血管显著减少,MVD值为0.8333±0.3444(图4),差异有统计学意义(P<0.05)。
以Pearson相关分析显示,辐射组大鼠骨髓照射后各时间节点MVD与Ktrans呈负相关(r=-0.5936, P<0.05),与Vp呈正相关(r=0.6451,P<0.05),与Kep呈负相关(r=-0.8055,P<0.01),与Ve无相关性(r=0.1426,P>0.05,图5)。
讨 论

图1 斜冠状面PDWI大鼠股骨ROI选取示例图。 图2 a)照射前后各时间节点大鼠骨髓Ktrans伪彩图;b)照射前后各时间节点大鼠骨髓Kep伪彩图;c)照射前后各时间节点大鼠骨髓Vp伪彩图;d)照射前后各时间节点大鼠骨髓Ve伪彩图。图3 a)照射后4天大鼠股骨HE染色(×200);b)照射后7天大鼠股骨HE染色(×200)。 图4 a)照射后4天CD31免疫组织化学染色(×200);b)照射后4天CD31免疫组织化学染色(×200)。

图5 辐射组照射后各时间节点骨髓MVD与DCE-MRI各定量参数Ktrans、Kep、Vp、Ve的散点图。a)MVD与Ktrans呈负相关;b)MVD与Kep呈负相关;c)MVD与Vp呈正相关;d)MVD与Ve无相关性。
本研究采用活体DCE-MRI定量渗透性参数研究大鼠受X线照射后早期长管状骨髓微循环的变化,结果显示辐射后第4天、第7天骨髓Ktrans逐渐增大,在辐射后第7天达到最大;Vp逐渐减小;Kep辐射后第4天减小,第7天较第4天增大;Ve辐射后第4天增大,第7天与第4天无明显变化。同时大鼠骨髓照射后各时间节点MVD与Ktrans、Kep、Vp存在高度的相关性,表明DCE-MRI定量渗透性参数能够准确、客观地反映辐射后早期骨髓微循环灌注和血管渗透性变化,其中Ktran、Vp可以定量、无创地评价辐射后早期骨髓微血管通透性及微血管密度改变。
由药代动力学Extended Tofts双室模型计算得出的DCE-MRI定量参数Ktrans值主要反映血管渗透性[13,14],受辐射后第4天、第7天骨髓Ktrans值逐渐增大,Vp值逐渐减小,与病理结果显示辐射后骨髓微循环渗透性增大,微血管密度减少相符合,可能的病理机制是辐射早期骨髓毛细血管和静脉窦内皮受损,骨髓微血管网破坏并伴有髓内微出血灶[2,15]。辐射组大鼠骨髓照射后各时间节点MVD与Vp呈正相关,提示Vp能反映骨髓平均微血管密度,尤其对辐射后骨髓未被破坏具有灌注功能微血管的显示较敏感[16]。MVD 与Ktrans呈负相关,辐射早期毛细血管渗透性增加,还可出现严重的细胞内水肿,内皮细胞肿胀,从而导致血管闭塞。辐射后第4天骨髓Kep减小,可能由于辐射后骨髓造血细胞显著减少,致使血管外细胞外容积分数Ve增大,渗出对比剂分散在细胞外间隙,从而导致对比剂从EES返回到血浆空间减少,但是随着辐射损伤进展,病理结果显示脂肪细胞大量增加,逐渐替代造血细胞占据整个骨髓组织,在第7天脂肪细胞增加与造血细胞减少达到平衡,从而出现Ve在第7天与第4天保持不变的情况,Kep与Ktrans呈现一致的变化趋势[17,18]。
电离辐射导致骨髓造血细胞数量显著减少以及造血细胞基质成分变化,随着造血微循环的进一步破坏,骨髓造血功能发展成不可逆性损伤。有研究显示辐射损伤后早期应用川弓嗪等活血化瘀中药能促进和改善骨髓血流供应,从而有助于骨髓造血功能恢复[19]。因此,辐射后早期微循环损伤诊断对造血功能恢复至关重要。然而骨髓微血管检查主要依靠有创病理学,且无法做到动态、重复观察;从而限制了辐射后骨髓微循环损伤早期诊断。本研究采用无创DCE-MRI定量渗透性参数准确客观反映辐射后早期骨髓微循环灌注和血管渗透性变化,从而能为骨髓微循环辐射损伤早期治疗及疗效观察提供依据。本研究还发现辐射后Ve并没有随着骨髓造血细胞大量减少而逐渐增大,而是在照射后第7天与第4天保持一致,结合病理提示大量增加的骨髓脂肪细胞可能逐渐替代造血细胞占据整个骨髓。以往研究表明骨髓脂肪含量增加总是与灌注减低联系在一起[20,21]。随着骨髓脂肪细胞堆积将压迫封闭的骨髓腔内窦状隙,可能是导致MVD、血浆容积分数Vp逐渐减小的重要原因。辐射后骨髓脂肪细胞数量增加是单纯占据骨髓造血微环境空间,还是积极参与辐射后骨髓微血管循环的损伤有待进一步的研究。
本研究存在以下不足:①本研究仅显示辐射后早期(7天)骨髓微循环变化,对于DCE-MRI渗透性参数与骨髓微循环中远期病理的相关性仍需进一步研究;②本研究实验动物全身照射的单次剂量与临床放疗患者分次剂量存在差异,实验动物与临床患者的放射性骨髓损伤病理变化并不完全一致。
总之,DCE-MRI定量渗透性参数可作为评价骨髓微循环辐射损伤的生物标志物,可用于骨髓微循环辐射损伤的疗效评价和预后评估。
参考文献:
[1] Cao X,Wu X,Frassica D,et al.Irradiation induces bone injury by damaging bone marrow microenvironment for stem cells[J].Proc Natl Acad Sci USA,2011,108(4):1609-1614.
[2] 杨冬,刘伟.电离辐射引起血管损伤的研究[J].中华肿瘤防治杂志,2007,14(8):638-641.
[3] Biffar A,Dietrich O,Sourbron S,et al.Diffusion and perfusion imaging of bone marrow[J].Eur J Radiol,2010,76(3):323-328.
[4] Nosas-Garcia S,Moehler T,Wasser K,et al.Dynamic contrast-enhanced MRI for assessing the disease activity of multiple myeloma:a comparative study with histology and clinical markers[J].J Magn Reson Imaging,2005,22(1):154-162.
[5] 邢栋,查云飞,李勤祥,等.动脉自旋标记与动态对比增强MRI脊柱骨髓灌注成像对照研究[J].放射学实践,2014,29(03):318-322.
[6] Liu Y,Cao L,Ray S,et al.Osteoporosis influences osteogenic but not angiogenic response during bone defect healing in a rat model [J].Injury,2013,44(7):923-929.
[7] Liu Y,Cao L,Hillengass J,et al.Quantitative assessment of microcirculation and diffusion in the bone marrow of osteoporotic rats using VCT,DCE-MRI,DW-MRI,and histology[J].Acta Radiol,2013,54(2):205-213.
[8] Trzasko JD,Mostardi PM,Riederer SJ,et al.Estimating T1from multichannel variable flip angle SPGR sequences[J].Magn Reson Med,2013,69(6):1787-1794.
[9] Barnes SL,Whisenant JG,Loveless ME,et al.Practical dynamic contrast enhanced MRI in small animal models of cancer:data acquisition,data analysis,and interpretation[J].Pharmaceutics,2012,4(3):442-478.
[10] Tofts PS,Brix G,Buckley DL,et al.Estimating kinetic parameters from dynamic contrast-enhanced T1-weighted MRI of a diffusable tracer:standardized quantities and symbols[J].J Magn Reson Imaging,1999,10(3):223-232.
[11] Sourbron SP,Buckley DL.On the scope and interpretation of the Tofts models for DCE-MRI[J].Magn Reson Med,2011,66(3): 735-745.
[12] Padro T,Ruiz S,Bieker R,et al.Increased angiogenesis in the bone marrow of patients with acute myeloid leukemia[J].Blood, 2000,95(8):2637-2644.
[13] Ingrisch M,Sourbron S.Tracer-kinetic modeling of dynamic contrast-enhanced MRI and CT:aprimer[J].J Pharmacokinet Pharmacodyn,2013,40(3):281-300.
[14] Ewing JR,Brown SL,Lu M,et al.Model selection in magnetic resonance imaging measurements of vascular permeability:gadomer in a 9L model of rat cerebral tumor[J].J Cereb Blood Flow Metab,2006,26(3):310-320.
[15] Koroleva LV,Kruslinskaja RS,Suskevic LN,et al.Characteristics of bone marrow blood circulation exposed to ionizing radiation [J].Radiobiol Radiother(Berl),1982,23(5):583-589.
[16] Jackson A,O'Connor JP,Parker GJ,et al.Imaging tumor vascular heterogeneity and angiogenesis using dynamic contrast-enhanced magnetic resonance imaging[J].Clin Cancer Res,2007,13(12): 3449-3459.
[17] Delrue LJ,Casneuf V,Van Damme N,et al.Assessment of neovascular permeability in a pancreatic tumor model using dynamic contrast-enhanced(DCE)MRI with contrast agents of different molecular weights[J].MAGMA,2011,24(4):225-232.
[18] Tofts PS,Berkowitz B,Schnall MD.Quantitative analysis of dynamic Gd-DTPA enhancement in breast tumors using apermeability model[J].Magn Reson Med,1995,33(4):564-568.
[19] Xiao K,Liu W,Lu W,et al.Effects of ligustrazine on bone marrow microvessel system in the early period of acute radiation injury in mice[J].J Tongji Med Univ,1997,17(1):9-12.
[20] Griffith JF,Yeung DK,Antonio GE,et al.Vertebral bone mineral density,marrow perfusion,and fat content in healthy men and men with osteoporosis:dynamic contrast-enhanced MR imaging and MR spectroscopy[J].Radiology,2005,236(3):945-951.
[21] Griffith JF,Yeung DK,Antonio GE,et al.Vertebral marrow fat content and diffusion and perfusion indexes in women with varying bone density:MR evaluation[J].Radiology,2006,241(3):831-838.
•中枢神经影像学•
MRI study of the changes of microvascular permeability in early radiation-induced bone marrow injury in rats
WANG Kejun,ZHA Yun-fei,LIU Chang-sheng,et al.Department of Radiology,Renmin Hospital of Wuhan University,Wuhan 430060,P.R.China
【Abstract】Objective:To investigate the microvascular permeability status in bone marrow of rats femur after irradiation by X-ray via quantitative perfusion parameters of dynamic contrast-enhanced MRI(DCE-MRI).Methods:Thirty-six SD rats at the age of 6~8weeks were randomly divided into irradiation group and normal control group(n=18per group). The irradiation group received whole body high-energy X-ray irradiation with the dosage as 6.0Gy,while the control group did not receive irradiation.Perfusion imaging using DCE-MRI was performed at different time points before and after the irradiation.The following parameters were measured including the volume transfer constant(Ktrans),efflux rate constant (Kep),blood plasma volume fraction(Vp)and extracellular extravascular volume fraction(Ve).Then rats were sacrificed and the bone marrow of each rat's femur was immediately removed for measuring microvessel density(MVD)by histopathologic examination.Results:The irradiation group had statistically significant differences in Ktrans,Vp,Kepand Vevalues at different time points before and after the irradiation(F=59.097,P<0.01;F=27.059,P<0.01;F=21.349,P<0.01;F=32.061,P<0.01).The Ktransvalues gradually reached a peak on the 7th day after irradiation.The Vpvalues gradually decreased.The Kepvalues decreased on the 4th day after irradiation(P<0.01),but increased on the 7th day as compared with the 4th day(P<0.01).Although the Vevalues increased on the 4th day(P<0.01),there was no statistically significant difference in ve between the 7th day and the 4th day(P>0.05).The control group had no statistically significant differences in permeability parameters of DCE-MRI at different time points before and after irradiation(P>0.05,respectively).After irradiation,the bone marrow microvessel density(MVD)showed negative correlation with Ktrans(r= -0.5936,P<0.05)and Kep(r= -0.8055,P<0.05),respectively,and positive correlation with Vp(r=0.6451,P<0.05),yet with no correlation with Ve(r=0.1426,P>0.05).Conclusion:Quantitative perfusion prameters of DCE-MRI can be used for evaluation of the changes of microvascular permeability in early radiation-induced bone marrow injury.
【Key words】Radiation;Bone marrow;Microvascular density;Magnetic resonance imaging
收稿日期:(2014-11-19 修回日期:2015-01-27)
基金项目:湖北省自然科学基金资助项目(2013CFB242);湖北省卫生厅科研资助项目(JX6B68)
通讯作者:查云飞,E-mail:zhayunfei999@126.com
作者简介:王克军(1986-),男,湖北十堰人,硕士研究生,主要从事骨骼肌与血管系统影像诊断工作。
DOI:10.13609/j.cnki.1000-0313.2015.05.010
【中图分类号】R818.74;R445.2
【文献标识码】A
【文章编号】1000-0313(2015)05-0545-05

