肾康注射液对高血压肾损害大鼠血压及相关指标的影响
周 楠,吕延英,王红英,王俊平,王光建,赵 兴,杨 健,贺建宇
(1.西安交通大学药学院,陕西西安 710061;2. 西安世纪盛康药业有限公司,陕西西安 710300; 3. 武警总部机关门诊部防疫科,北京 100089)
◇中医药研究◇
肾康注射液对高血压肾损害大鼠血压及相关指标的影响
周 楠1,吕延英2,王红英1,王俊平2,王光建2,赵 兴2,杨 健3,贺建宇1
(1.西安交通大学药学院,陕西西安 710061;2. 西安世纪盛康药业有限公司,陕西西安 710300; 3. 武警总部机关门诊部防疫科,北京 100089)
目的 探讨肾康注射液对高血压肾损伤大鼠血压及相关指标的影响。方法 将32只高血压肾损伤模型大鼠随机分为4组:模型对照组(即SHR组)、阳性对照组、肾康注射液大剂量组、肾康注射液小剂量组;WKY大鼠作为阴性对照组。阳性对照组腹腔注射给予福辛普利钠1.6 mg/kg,肾康注射液大小剂量组分别腹腔注射肾康注射液,相当于生药剂量为4.8、2.4 g/kg,阴性对照组和模型组腹腔分别注射等体积生理盐水,每天1次,连续给药30 d。末次给药后检测高血压肾损伤大鼠的血压、心脏病变以及NO、Ang-Ⅱ、C反应蛋白、TGF-β1等指标。结果 给药前后各组间大鼠体质量无明显差异(P>0.05);给药后肾康注射液组的血压值明显低于模型对照组,差异具有统计学意义(P<0.05或P<0.01);与模型对照组比较,肾康注射液组的NO活性明显增高,肾脏皮质中的Ang-Ⅱ明显降低,C反应蛋白明显降低,差异有统计学意义(P<0.05);但血清中的Ang-Ⅱ、血清转化因子TGF-β1无显著性差异(P>0.05)。结论 肾康注射液能降低高血压肾损伤大鼠血压、提高肾组织的NO活性、降低Ang-Ⅱ及C反应蛋白的含量。
肾康注射液;高血压肾损害;血压;NO;Ang-Ⅱ;C反应蛋白;TGF-β1
高血压病的发病与肾脏的关系是十分密切的。肾脏既是血压调节的重要器官,同时又是高血压损害的主要靶器官之一。一方面,肾脏通过改变对水钠代谢的调节以及分泌加压和降压物质,从多方面影响血压,另一方面,高血压又可造成肾脏功能受损,若高血压一旦对肾脏造成损害,又可以因肾脏对体液平衡调节以及血管活性物质等代谢障碍,加剧了高血压的严重程度,并最终导致肾功能不全[1]。
肾康注射液是具有降逆泄浊、益气活血作用的中药复方制剂,目前的药理实验研究表明,肾康注射液具有显著降低5/6肾切除大鼠的血压、尿蛋白的排泄、改善高血脂及肾功能的作用[2],肾康注射液可通过抑制糖尿病肾病大鼠肾组织炎症因子NF-κB表达,从而减轻肾脏损伤的程度[3]。临床研究表明,肾康注射液可以化瘀祛浊,使肾单位、肾小管更新,慢性肾功能衰竭进程得以逆转,达到改善临床症状的疗效[4]。基于以上研究背景和临床应用情况,本研究旨在探明肾康注射液治疗高血压肾病的作用机制。探讨其对高血压肾病大鼠血压及其相关指标的影响。
1 材料与方法
1.1 试剂及仪器 肾康注射液(西安世纪盛康药业有限公司,批号:201107043、201108022);福辛普利钠片(中美上海施贵宝制药有限公司,规格:10 mg/片,批号:1007090);一氧化氮试剂盒(南京建成生物工程研究所,批号:20120115);BCA试剂盒(北京普利莱基因技术有限公司);血管紧张素-Ⅱ酶联免疫试剂盒、C反应蛋白酶联免疫试剂盒、血清转化因子TGF-β1酶联免疫试剂盒(北京科盈美科技有限公司);美国肯特CODA多动物多通道尾袖套法无创血压系统;低速离心机(GENIUS 5K-R,长沙鑫奥仪器仪表有限公司);高速匀浆器(IKA-T10,德国IKA集团);电子天平(AY120,日本岛津SHIMADZU)。
1.2 实验动物 30周龄,体质量340~400 g,清洁级雄性SHR大鼠32只,同龄WKY大鼠10只,均购于上海斯莱克实验动物有限公司,动物生产许可证号:SCXK(沪)2007~0005。动物常规饲养,保持室温20~25 ℃,12 h光照与黑暗交替(光照8∶00~20∶00),自由饮水和摄食。饲养1周后,测定SHR大鼠尿微量白蛋白的含量,达到肾损伤标准20~200 mg/L[5]即为高血压肾病模型大鼠,用于本实验。
1.3 分组与给药 将32只高血压肾病模型大鼠随机分为4组:模型对照组(即SHR组)、阳性对照组、肾康注射液大剂量组、肾康注射液小剂量组;WKY大鼠作为阴性对照组。阳性对照组腹腔注射给予福辛普利钠1.6 mg/kg,肾康注射液大小剂量组腹腔分别注射给予肾康注射液,相当于生药剂量为4.8、2.4 g/kg(分别相当于人用量的8倍、4倍),阴性对照组和模型组腹腔分别注射等体积生理盐水10 mL/kg,每天1次,连续给药30 d后,10 g/L水合氯醛麻醉大鼠,腹主动脉取血,取心脏、肾脏。
1.4 尾动脉血压的测量 给药第0、1、2、3、4周测定大鼠的血压值,采用尾动脉测压法用肯特无创测压系统测定大鼠的收缩压及舒张压,预热温度37 ℃,预热15 min,每周测定1~2次,并根据结果调整测量次数[6]。
1.5 心脏脏器系数及左心室指数的计算 称量体质量后打开胸腔取出心脏,以预冷的Hanks液充分灌洗,滤纸吸干,称量心脏及左心室质量。
1.6 一氧化氮(NO)的检测 取0.5 g肾脏皮质组织,用冰冷的生理盐水冲洗,除去血液,擦干,称取0.2 g放入烧杯中,剪碎,制成10%匀浆后,在3 000~4 000 r/min离心10~15 min,上清液即为组织匀浆液,取组织匀浆液用NO含量测定试剂盒测定肾组织中NO活性。
1.7 血管紧张素-Ⅱ(Ang-Ⅱ)的检测 实验结束后,取静脉血1 mL及肾脏皮质匀浆,离心后取上清,用Ang-Ⅱ试剂盒(免疫酶联法)测定血浆及肾脏Ang-Ⅱ含量。
1.8 C反应蛋白的检测 实验结束后,取静脉血1 mL,离心后取上清用C反应蛋白检测试剂盒(免疫酶联法)测定C反应蛋白活力。
1.9 血清转化因子TGF-β1的检测 实验结束后,取静脉血1 mL,离心后取上清,用TGF-β1试剂盒(免疫酶联法)测定血浆TGF-β1含量。
1.10 肾脏的Masson染色 实验结束后,取大鼠肾脏,进行Masson三色染色,观察肾脏的纤维化水平。
2 结 果
2.1 给药期间大鼠体质量的变化 给药前各组大鼠体质量无明显差异,给药后各组大鼠体质量呈现先增加后又略微下降的趋势,各组之间差异无统计学意义(P>0.05,表1)。
表1 肾康注射液对大鼠体质量的影响
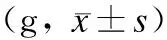

组别例数给药前给药1周给药2周给药3周给药4周阴性对照组10386.10±32.74401.60±30.94392.60±35.82395.40±27.23398.50±30.20模型对照组8402.25±11.07420.38±12.81426.25±12.35415.25±14.29414.75±13.31福辛普利对照组8379.88±21.44400.75±28.11398.25±25.08397.75±24.18392.25±34.70肾康注射液小剂量组8382.75±29.85398.88±34.29397.88±34.39399.12±35.75399.38±32.20肾康注射液大剂量组8384.88±13.06406.88±14.34397.75±16.07399.00±22.49400.75±12.52
各组间比较,显示无统计学意义。
2.2 给药期间大鼠收缩压的变化 给药前测定各组大鼠的基础血压,模型对照组及其他各组的血压值明显高于阴性对照组,且差异有统计学意义(P<0.01);随着给药的进行,阳性药对照组、肾康注射液小及大剂量组的血压值开始明显低于模型对照组,差异具有统计学意义(P<0.05或P<0.01),而阴性对照组的血压值恒定,且显著低于其他各实验组(表2、3)。
2.3 对心脏及左心室指数的影响 给药后,各组的心脏质量、心脏脏器系数、左心室质量、左心室指数等指标均无显著性差异(P>0.05,表4)。
表2 肾康注射液对大鼠收缩压的影响


组别例数0周1周2周3周4周阴性对照组10145.85±12.98**147.12±8.46**142.5±19.40**134.4±16.11**136.22±16.91**模型对照组8215.75±20.33220.12±19.20219.88±14.60224.5±17.19221.62±23.12福辛普利对照组8210.52±24.44206.62±17.70*192.57±12.08*195.33±17.75*198.38±22.95*肾康注射液小剂量组8216.55±20.33182.5±25.58*210.62±16.20*198.62±15.68*209.28±19.39*肾康注射液大剂量组8213.34±12.15156.22±25.10**194.62±25.11*207.12±10.66*195.33±13.17*
与模型对照组比较,*P<0.05,**P<0.01。
表3 肾康注射液对大鼠舒张压的影响


组别例数0周1周2周3周4周阴性对照组1091.10±13.13**107.00±14.21**87.00±17.02**79.80±14.33**83.55±20.50**模型对照组8173.12±19.59164.00±14.57163.00±12.60170.37±20.61165.34±19.80福辛普利对照组8162.75±20.20151.75±17.89*159.00±19.83164.12±16.71158.38±20.35*肾康注射液小剂量组8162.89±21.89145.34±17.84*142.01±16.64*134.57±27.73*158.57±17.83*肾康注射液大剂量组8165.12±15.49130.12±21.94**140.25±19.28*147.75±12.76*147.16±11.54*
与模型对照组比较,*P<0.05,**P<0.01。
表4 肾康注射液对心脏及左心室指数的影响
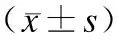

组别例数心脏质量(g)心脏脏器系数(g/kg)左心室质量(g)左心室指数(g/g)阴性对照组101.26±0.343.7±0.0420.85±0.180.68±0.03模型对照组81.55±0.173.8±0.0281.08±0.080.70±0.04福辛普利对照组81.46±0.083.6±0.0281.06±0.070.72±0.04肾康注射液小剂量组81.40±0.143.6±0.0201.01±0.100.72±0.02肾康注射液大剂量组81.38±0.083.2±0.0751.00±0.070.72±0.04
各组间比较,显示无统计学意义。
2.4 对肾脏组织中NO活性的影响 与阴性对照组比较,模型对照组NO活性明显降低,差异有统计学意义(P<0.01);与模型对照组比较,肾康注射液小、大剂量组的NO活性明显增高,并差异有统计学意义(P<0.05),而阳性对照组的NO活性有增高的趋势,但差异无统计学意义(P>0.05,表5)。
2.5 对各组Ang-Ⅱ的影响 肾脏皮质中Ang-Ⅱ含量,与模型对照组比较,阴性对照组、肾康注射液小、大剂量组及阳性对照组的Ang-Ⅱ明显降低,并差异有统计学意义(P<0.05)。血清中的Ang-Ⅱ,与模型对照组比较,也只有阳性对照组的Ang-Ⅱ明显增高,差异有统计学意义(P<0.05,表6)。
表5 肾康注射液对NO活性的影响
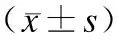

组别例数NO(μmol/gprot)阴性对照组107.14±1.18**模型对照组85.58±1.84福辛普利对照组86.42±2.12肾康注射液小剂量组87.74±2.50**肾康注射液大剂量组87.51±1.75**
与模型对照组比较,**P<0.01。
表6 肾康注射液对肾脏及血清Ang-Ⅱ的影响


组别例数肾脏血清阴性对照组10118.80±11.08*71.64±11.29模型对照组8124.73±19.2867.50±12.38福辛普利对照组8116.03±9.27*84.63±30.67*肾康注射液小剂量组8119.04±13.48*62.80±7.21肾康注射液大剂量组8104.53±19.76*77.05±8.40
与模型对照组比较,*P<0.05。
2.6 对各组C反应蛋白及血清转化因子TGF-β1的影响 与阴性对照组比较,模型对照组的C反应蛋白明显增高,并有统计差异(P<0.05);与模型对照组比较,肾康注射液小、大剂量组及阳性对照组的C反应蛋白明显降低,并且差异有统计学意义(P<0.05)。各组的血清转化因子TGF-β1的值比较差异无统计学意义(表7)。
2.7 对各组肾脏的纤维化的影响 对各组的肾脏进行Masson染色的结果可以看出,模型组的肾间质存在严重纤维化,福辛普利及肾康小剂量组的纤维化程度较为缓解,肾康注射液大剂量组能够很好地抑制肾脏的纤维化,与阴性对照组没有明显差别(图1)。
表7 肾康注射液对血浆炎症因子C反应蛋白及血清转化因子TGF-β1的影响
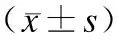

组别例数C反应蛋白(μg/L)TGF-β1(ng/L)阴性对照组10402.25±36.12*97.75±9.27模型对照组8449.29±27.6994.91±16.15福辛普利对照组8385.65±27.04*97.45±19.43肾康注射液小剂量组8394.25±35.46*96.59±16.17肾康注射液大剂量组8412.81±24.76*92.05±9.82
与模型对照组比较,*P<0.05。

图1 各组肾脏内纤维化程度的比较
Fig.1 Comparison of renal fibrosis in the five groups
A:阴性对照组;B:模型对照组;C:福辛普利组;D:肾康注射液小剂量组;E:肾康注射液大剂量组。
3 讨 论
肾康注射液是一种中药注射液,主要药材为大黄、丹参、红花和黄芪,文献表明大黄具有促进尿素及肌酐排泄的作用,并具有抑制系膜细胞增殖的作用[7-8],红花为菊科植物,具有活血化瘀、抗血凝、调经等功效[9]。近代中药药理学研究表明:红花具有使紧张度增高的动物离体血管扩张的作用,对于延缓肾脏病损伤具有明显的作用[10]。丹参是心血管疾病的常用中药,可以缓解大鼠的肾衰竭,具有防止肾小球的硬化和保护肾功能的作用[11]。本研究对肾康注射液的降压作用做了进一步地探讨。给予受试药物后,高血压大鼠的血压虽然仍存在继续上升的趋势,但阳性对照药及肾康注射液组的大鼠血压上升值远小于模型对照组,说明肾康注射液可降低高血压肾病大鼠的血压,对肾脏起到了一定的保护作用。研究表明,内源性NO合成不足可以导致肾小球灌注压下降,介导肾小管坏死,提高NO浓度可降低肾血管阻力,抑制肾小球内血小板聚集和粘附,因而任何导致NO合成减少的因素均可诱发或加剧急性肾功能不全的发生和发展[12]。在本实验中,给药结束后,测定各组大鼠肾脏皮质中NO活性,阳性对照药及肾康注射液组的NO活性远高于模型对照组,说明肾康注射液可以一定程度上阻止肾损伤,降压作用也可能通过了NO途径[13]。
RAS是机体内调节血压和体液容积的重要因素之一。Ang-Ⅱ是RAS最主要的生物活性物质。肾脏是Ang-Ⅱ重要的分泌器官和靶器官[14],并且Ang-Ⅱ参与调控高血压引起的左心室肥大及慢性肾脏疾病[15-17]。TGF-β1是一种多功能生长因子,参与了原发性高血压的血管肥厚、肾脏纤维化等过程。WILLIAMS等[18]认为,Ang-Ⅱ诱发高血压肾脏纤维化加重高血压肾病的作用可能是通过TGF-β1实现的。本研究用ELISA法测定肾脏及血清中的Ang-Ⅱ的水平,结果表明给予肾康注射液后,肾脏的Ang-Ⅱ水平明显低于模型对照组,而对血清中的Ang-Ⅱ作用不明显。此外,本研究结果还显示,给予肾康注射液后,C反应蛋白明显下降,说明肾康注射液起到了一定的作用,降低了相关的炎症因子,而各组的血清转化因子TGF-β1的值有一定的差异,但不能完全说明给药起到了明显的作用。另外,肾脏的MASSON病理切片结果说明了肾康注射液对高血压大鼠肾脏纤维化有抑制作用。
本实验还对高血压的另一个重要靶器官——心脏的质量及心脏指数进行了研究,结果各给药组间无显著性差异,各组大鼠的心脏脏器系数及左心室指数也无明显差异,可能由于初期高血压肾病大鼠心脏尚未出现显著病变。
肾损害是原发性高血压的严重并发症之一,两者关系密切,互为因果,常形成恶性循环。本课题进一步研究了肾康注射液对高血压肾病的降压作用,以期用现代分析技术及药理学方法阐释其作用功效及可能的机制,为高血压肾病的治疗探寻新的治疗药物。
[1] 林善锬. 肾脏与高血压[J]. 中华内科杂志, 1996, 35(2):139-141.
[2] 赵宗江,张新雪,师锁柱,等. 肾康注射液延缓5/6肾切除大鼠慢性肾功能衰竭进展的机理探讨[J]. 中国中医基础医学杂志, 2000, 6(10):16-19.
[3] 吴应龙,应素萍. 肾康注射液对糖尿病肾病大鼠肾组织NF-κB的实验研究[J]. 中国中西医结合肾病杂志, 2008, 9(9):827-829.
[4] 范文延. 肾康注射液治疗慢性肾功能衰竭临床对照研究[J]. 医药论坛杂志, 2008, 29(7):33-35.
[5] 徐叔云,卞如濂,陈修. 药理实验方法学[M]. 北京: 人民卫生出版社, 2002:1134-1136.
[6] 李春梅,钱艳芳. 间接法与直接法测定大鼠动脉血压的比较研究[J]. 山西医科大学学报, 2002, 33(3):278-279.
[7] 肖炜,邓虹珠,马云. 大黄治疗慢性肾功能衰竭的临床与实验研究概述[J]. 中国中药杂志, 2002, 27(4):241-244.
[8] 肖炜,马云,魏连波,等. 黄芪、大黄复方制剂对培养大鼠系膜细胞增殖和细胞外基质分泌的影响[J]. 中国临床康复, 2006, 10(11):173-176.
[9] 许庆友,丁英钧,韩琳,等. 梗阻性肾病大鼠肾脏肾上腺髓质素的表达及缬沙坦、红花对其的影响[J]. 中国药理学通报, 2007, 23(2):158-161.
[10] 陈蓁,王锐平,贺浪冲. 细胞膜色谱法筛选红花中的有效成分[J]. 陕西中医, 2004, 25(7):643-644.
[11] 刘久波,吕军,张珍,等. 银杏叶制剂和丹参对急性肾衰兔肾皮质局部血流量的影响[J]. 中国微循环, 2004, 8(3):149-151.
[12] 唐锦辉,徐钦儒. 一氧化氮与肾脏疾病研究进展[J]. 国外医学, 1996, 16(5):216-219.
[13] 吴延庆,邹斌,程晓曙,等. 肾内血管紧张素系统在NO缺乏性高血压肾损害的作用[J]. 岭南心血管病杂志, 2003, 9(6):434-436.
[14] 刘胜,郑秋甫,张晓英,等. 苯那普利与科素亚联合应用对高血压肾病的保护作用[J] 中国中西医结合肾病杂志, 2005, 6(2):83-85.
[15] FUKUDA A, WICKMAN LT, VENKATAREDDY MP, et al. Angiotensin II-dependent persistent podocyte loss from destabilized glomeruli causes progression of end stage kidney disease[J]. Kidney Int, 2012, 81(1):40-55.
[16] RAIZADA V, HILLERSON D, AMARAM JS, et al. Angiotensin Ⅱ-mediated left ventricular abnormalities in chronic kidney disease[J]. J Investig Med, 2012, 60(5):785-791.
[17] FERRARIO CM. Role of angiotensin Ⅱ in cardiovascular disease therapeutic implications of more than a century of research[J]. J Renin Angiotensin Aldosterone Syst, 2006, 7(1):3-14.
[18] WILLIAMS B. Angiotensin-Ⅱ and the pathophysiology of cardiovascular remodeling[J]. Am J Cardiol, 2001, 87(8A):10-17.
(编辑 韩维栋)
Effects of Shen-kang injection on blood pressure and related factors of hypertensive renal disease rats
ZHOU Nan1, LÜ Yan-ying2, WANG Hong-ying1, WANG Jun-ping2, WANG Guang-jian2, ZHAO Xing2, YANG Jian3, HE Jian-yu1
(1. School of Pharmacy, Xi’an Jiaotong University, Xi’an 710061; 2. Xi’an Shiji Shengkang Pharmaceutical Industry Co. Ltd., Xi’an, 710300; 3. Department of Clinical Epidemic Prevention, Police Headquarters of Armed Forces, Beijing 100089, China)
Objective To observe the effects of Shen-kang injection on blood pressure and related factors in hypertension nephropathy rats. Methods Thirty-two male rats with hypertension nephropathy were randomly divided into 4 groups: model group, positive control group, and Shen-kang low- and high-dose injection groups. WKY rats served as the negative control group. The positive control group was treated with fosinopril sodium (1.6 mg/kg) by intraperitoneal injection. Shen-kang injection groups were treated with intraperitoneal Shen-kang injection containing 4.8 and 2.4 g/kg of crude drug respectively. Negative control group and model group were injected with normal saline of the same volume. Drugs were administered once a day for 30 consecutive days. The blood pressure, cardiac abnormalities and related inflammatory factors such as NO, Ang-Ⅱ, C-reactive protein and TGF-β1were determined after the last administration. Results Rat body weight of each group did not significantly differ during the administration (P>0.05). Compared with that in model control group, blood pressure was significantly lowered in Shen-kang injection groups after administration (P<0.05 orP<0.01). NO activity was increased while renal cortex Ang-Ⅱ was reduced and C-reactive protein was decreased obviously (P<0.05). However, serum Ang-Ⅱ and TGF-β1levels were not significantly different in Shen-kang injection groups (P>0.05). Conclusion Shen-kang injection can lower blood pressure, improve NO activity, and decrease Ang-Ⅱ and C-reactive protein levels in rats with hypertension nephropathy.
Shen-kang injection; hypertension nephropathy; blood pressure; NO; Ang-Ⅱ;C-reactive protein;TGF-β1
2014-02-26
2014-06-05
贺建宇. E-mail: hejianyu@xjtu.edu.cn
R285.5
A
10.7652/jdyxb201501023
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20141119.0902.008.html(2014-11-19)

